Clostridium difficile – vyvolavatel toxického megakolon
Infekce vyvolané bakterií Clostridium difficile (CDI) jsou v posledních letech nejčastějšími infekčními onemocněními souvisejícími s nemocniční péčí. Onemocnění se prezentuje jako prostý průjem, pseudomembranózní kolitida a vzácně jako toxické megakolon. Pro CDI jsou typické rekurence. V následující kazuistice je popsán případ padesátiletého muže, který byl dva týdny před projevy prvních příznaků CDI ambulantně léčen širokospektrým antibiotikem. Zprvu hemoragická kolitida postupně progredovala až do rozvoje toxického megakolon a sepse a pacientovi musela být z vitální indikace provedena subtotální kolektomie, po níž se zotavil. Vlastní průběh léčby je diskutován v článku.
Úvod
Clostridium difficile (Cd) je anaerobní sporulující bakterie prvně izolovaná v roce 1938 ze stolice zdravých novorozenců [1]. V současnosti je Cd nejčastějším původcem nemocničních střevních infekcí, v mezinárodní terminologii označovaných zkratkou CDI (Clostridium difficile Infection). Ty se manifestují od průjmů, kolitid až po pseudomembranózní kolitidy. Výjimkou nejsou těžké, mnohdy smrtelné komplikace, mezi něž patří toxické megakolon a sepse. Vysoké procento často opakovaných rekurencí je dalším nepříznivým aspektem této infekce. Z rizikových faktorů disponujících k rozvoji infekce je nejvýznamnější antibiotická léčba navozující střevní dysmikrobii [2], ale užívání antibiotik v anamnéze není nutnou podmínkou pro vznik CDI. Dalším z rizikových faktorů je pokročilejší věk a užívání inhibitorů protonové pumpy.
Hlavním faktorem virulence Cd je produkce toxinů; jedná se o toxin A (Tcd A), toxin B (Tcd B) a u některých, často epidemických kmenů, také o tzv. binární toxin. Velmi rychlý nárůst počtu CDI charakterizovaný často těžkým průběhem, vysokou mortalitou a častějším selháním léčby byl zprvu zaznamenán na počátku třetího tisíciletí v Kanadě a USA; následně pak došlo k dalšímu globálnímu rozšíření těchto problémů, Evropu nevyjímaje [3].
V České republice jsou prozatím k dispozici pouze omezená data o reálné incidenci, nicméně podle předběžných výsledků evropského projektu EUCLID představuje aktuální incidence u nás 4,4 CDI na 10 000 „lůžkodnů“, což je čtyřnásobek oproti roku 2008, kdy se uskutečnila obdobná studie [4]. Výsledky studie EUCLID také upozorňují na skutečnost, která zřejmě není ani v našich podmínkách výjimečná, že totiž tato infekce je obecně ne vždy správně diagnostikována. Příčinou je jednak chybějící klinické podezření (podle závěrů EUCLID není denně v Evropě diagnostikováno 82 případů CDI právě z tohoto důvodu), jednak zatím ne zcela optimální laboratorní diagnostika [4].
Laboratorní diagnostika podle současných doporučení zahrnuje dvoustupňové nebo třístupňové algoritmy kombinující imunochemické, molekulární a kultivační metody [5]. Tyto přístupy společně dosahují vysoké spolehlivosti, ale také výrazně zvyšují náklady na vyšetření, a nejsou proto v rutinní diagnostice vždy aplikovány. Nejčastěji používaný průkaz klostridiových toxinů A a B ve stolici pomocí testů ELISA dosahuje zhruba pouze 70–80% senzitivity, je-li použit jako izolovaná metoda [5]. Klasifikace izolátů Cd důležitá jak z epidemiologických důvodů, tak i z hlediska určité predikce závažnosti onemocnění, vychází z molekulární typizace, v současné praxi nejčastěji PCR (polymerase chain reaction) ribotypizace.
Globální nárůst výskytu CDI je spojován s výskytem hypervirulentních kmenů, charakteristických kromě jiného vysokou produkcí toxinů A i B. K nejobávanějším se řadí PCR ribotyp 027. Rozsáhlá surveillance uskutečněná v roce 2008 v rámci Evropy ukázala poměrně heterogenní zastoupení toxigenních ribotypů s prevalencí ribotypu 027 necelých 5 %; v ČR nebyl tento ribotyp doposud izolován [2]. V ČR aktuálně převládá ribotyp 176, prvně u nás popsaný v roce 2009, který je svými molekulárními charakteristikami velmi blízký ribotypu 027 a někdy je v odborné literatuře označován jako „027 like“ [6].
Léčba CDI se odvíjí od tíže onemocnění. Pro lehčí formy či první rekurence CDI je doporučeno podávání metronidazolu v dávce 3krát denně 500 mg per os nebo i.v., u těžších forem nebo při špatné terapeutické odpovědi na metronidazol je možné přidat vankomycin per os v dávce 4krát 125 mg. Celková doba léčby je 10–14 dní. Druhá a další rekurence onemocnění se léčí vankomycinem podávaným v dávce 4krát 125 mg per os; lze jej také kombinovat s metronidazolem i.v. po dobu 10–14 dní, poté je možné pokračovat v podávání vankomycinu v sestupném dávkování. Léčba nejtěžší formy CDI, toxického megakolon, je obtížná; vankomycin se může podat i ve formě klyzmatu v kombinaci s intravenózním metronidazolem, ale v těchto případech bývá z vitální indikace doporučována kolektomie. Za této situace dosahuje smrtnost obzvláště vysokého procenta (více než 50 %). U pacientů s častými rekurencemi bývá doporučena tzv. fekální transplantace, to je podání filtrátu stolice od zdravých příbuzných enterální sondou.
V posledních dvou letech se na trh dostal fidaxomicin, což je nové syntetizované makrocyklické antibiotikum, jehož účinnost je udávána in vitro 8krát vyšší než u vankomycinu, a navíc je po jeho podání pozorován významně nižší počet rekurencí. Jeho nevýhodou je vysoká cena. V doporučených postupech (www.infekce.cz) jsou uvedena ještě další antibiotika, nicméně jejich účinnost není zcela zaručena nebo je nižší.
Kazuistika
Muž, 50 let, sledován pro arteriální hypertenzi, dnu, jaterní steatózu, před 25 lety vyšetřován pro levostrannou parézu lícního nervu. Operace žádné, úrazy žádné. Kouří 20 cigaret denně, pije 2–3 piva denně. Rodinná anamnéza: matka zemřela na karcinom prsu, otec na cévní mozkovou příhodu. Sociální anamnéza: pracuje jako automechanik, žije s rodinou, alergii neudává. Farmakologická anamnéza: Anopyrin 100 mg 0–1–0, Lozap 50 mg 1–0–0, Milurit 100 mg 1–0–0, Essentiale Forte N 1–1–1.
Epidemiologická anamnéza: kontakt s infekčním onemocněním neguje.Nynější onemocnění: v lednu 2009 byl nemocný léčen 14 dní antibiotiky pro „chřipku“ u praktického lékaře, na konci února se objevily první příznaky průjmového onemocnění se stolicemi 8krát denně; byl afebrilní. Dne 9. 3. 2009 se u pacienta poprvé objevila krev ve stolici a bolesti břicha, týž den byl vyšetřen na chirurgické ambulanci pražské nemocnice. Zde stav uzavřen jako protrahovaná abdominální kolika v.s. gastroenteritis subacuta nejasné etiologie. Zjištěné laboratorní hodnoty: leukocytóza 13 200, CRP 122,9 mg/l. Ultrazvuk (UZ) břicha vykazuje zesílenou stěnu celého tračníku s maximem na colon descendens. Doporučen Amoksiklav 2 × 1 g, Ercefuryl, Imodium, doporučena kontrol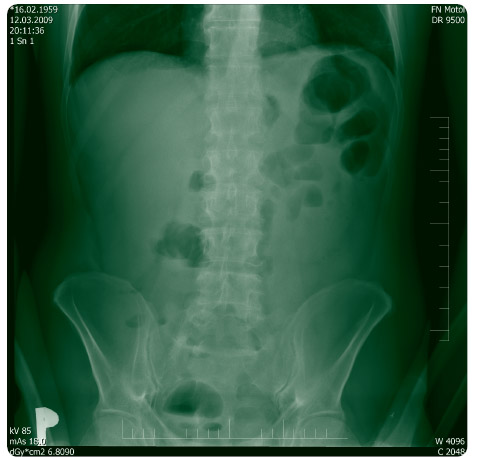 a u praktického lékaře a při progresi obtíží kontrola na infekčním oddělení. Po užití této léčby přiznává pacient ústup potíží na jeden den, poté se ale u něj opět objevily průjmy s příměsí krve.
a u praktického lékaře a při progresi obtíží kontrola na infekčním oddělení. Po užití této léčby přiznává pacient ústup potíží na jeden den, poté se ale u něj opět objevily průjmy s příměsí krve.
Dne 12. 3. 2009 proběhlo další vyšetření na urologii pro poruchu mikce, stupňující se bolesti v podbřišku, teploty do 38,0 °C. Pacient udával nauzeu a stolici 5–6krát denně. Po vyloučení urologické příčiny byl nemocný odeslán k chirur-
gickému vyšetření, kde se potvrdil stav beze známek náhlé příhody břišní. Na UZ břicha byl zaznamenán subileózní
stav na tenkých kličkách, v.s. zánětlivé změny na sigmatu a colon descendens, na nativu břicha subileózní stav na tenkých kličkách (obr. 1).
Laboratorní hodnoty: leukocytóza 14 500, trombocyty 674 000, CRP 226,8 mg/l. Pacient byl odeslán k hospitalizaci na tehdy ještě infekční oddělení. Úbytek hmotnosti u něj dosáhl během 14 dnů více než 10 kg a stěžoval si na bolest břicha s maximem v obou podbřišcích s propagací do skrota.
Stav při přijetí k hospitalizaci: hmotnost – 72 kg, výška – 182 cm, krevní tlak – 144/95 mm Hg, puls – 120 tepů/min, tělesná teplota – 38,5 °C, dechová frekvence – 22 vdechů/min, saturace O2 – 96 % na vzduchu.
Celkový stav: pacient při vědomí, orientován časem i místem; schvácený, ležící, spolupracuje; výživa dobrá; hydratace snížená (jazyk); eupnoický, prokrvení dobré, cyanóza 0; kůže čistá, bez exantému, anikterická. Hlava, krk, hrudník: bez patologického nálezu. Břicho: v niveau, dechová vlna volně postupuje, poklep diferencovaně bubínkový; palpačně měkké, ale s difuzní bolestivostí s maximem v obou hypogastriích a v levé jámě kyčelní, peristaltika slyšitelná, játra +2 cm v inspiriu, slezina nenaráží, jiné rezistence nehmatné, TPT bilaterálně negativní. Na končetinách normální nález. Neurologicky pouze frustní paréza n. VII vlevo. Meningeální příznaky negativní. Po vyšetření per rectum na rukavici hnědá stolice s nepatrnou příměsí krve, indagace bolestivá. Nejsou přítomny zevní známky poranění ani maligního onemocnění.
V laboratoři zjištěna hyponatremie, hypokalemie, hypoproteinemie, hypalbuminemie, ve stolici detekovány oba toxiny Cd, běžná kultivace negativní, kultivace Cd neúspěšná. Moč a sediment bez patologického nálezu, renální funkce v normě, hemokultury negativní.Zahájena léčba metronidazolem v dávce 500 mg každých 6 hodin, eubiotikem Enterol, analgetiky a byla podána parenterální výživa.
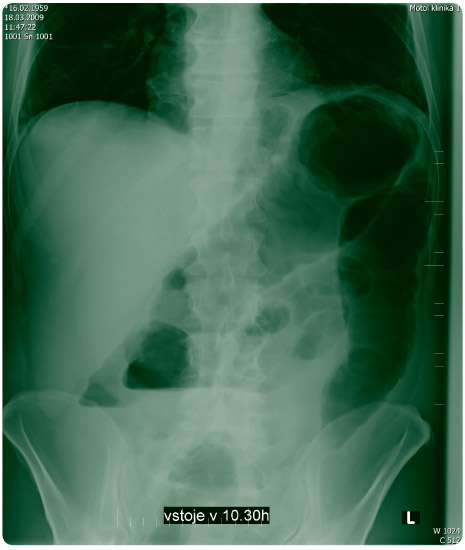 Dne 18. 3. 2009 byl pro nelepšící se stav, silné bolesti břicha a trvající průjmové stolice pacientovi proveden kontrolní UZ a nativní snímek břicha (obr. 2), který doložil progresi pasáže a obraz až ileózního stavu. Laboratorní hodnoty: leukocytóza 13 400 s posunem doleva, trombocytóza 748 000, CRP 246,7 mg/l. Závěr chirurgického vyšetření ze dne 18. 3. 2009: pseudomembranózní kolitida, distenční bolesti levého mezogastria, bez jasného nálezu peritoneálního dráždění a beze známek pneumoperitonea. Doporučena kolonoskopie a gastroenterologické vyšetření k návrhu další léčby.Zahájena léčba vankomycinem v dávce 4krát 125 mg per os, metronidazol ponechán do kombinace.
Dne 18. 3. 2009 byl pro nelepšící se stav, silné bolesti břicha a trvající průjmové stolice pacientovi proveden kontrolní UZ a nativní snímek břicha (obr. 2), který doložil progresi pasáže a obraz až ileózního stavu. Laboratorní hodnoty: leukocytóza 13 400 s posunem doleva, trombocytóza 748 000, CRP 246,7 mg/l. Závěr chirurgického vyšetření ze dne 18. 3. 2009: pseudomembranózní kolitida, distenční bolesti levého mezogastria, bez jasného nálezu peritoneálního dráždění a beze známek pneumoperitonea. Doporučena kolonoskopie a gastroenterologické vyšetření k návrhu další léčby.Zahájena léčba vankomycinem v dávce 4krát 125 mg per os, metronidazol ponechán do kombinace.
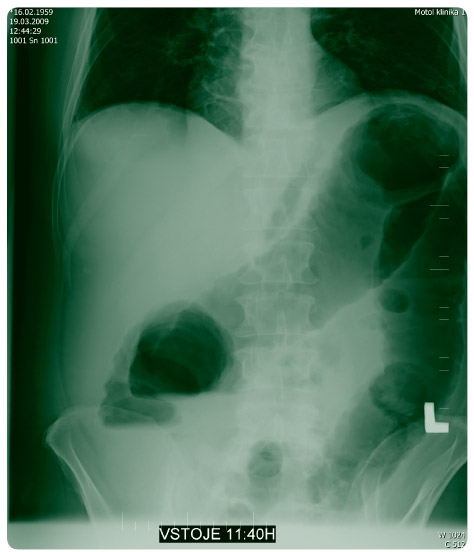
Dne 19. 3. 2009 byl pro silné bolesti břicha, palpační citlivost v levé jámě kyčelní a celkově nelepšící se stav u nemocného proveden kontrolní nativní rtg břicha (obr. 3) – zjištěna další mírná progrese distenze tračníku a nemocný byl přeložen na chirurgickou kliniku k urgentní hemikolektomii. Původně zamýšlená kolonoskopie byla již v této chvíli kontraindikována a gastroenterologové ji odmítli uskutečnit pro nebezpečí perforace střeva. V den překladu provedena subtotální kolektomie s terminální ileostomií. Peroperačně byla prokázána
 těžká pseudomembranózní kolitida, histologicky byla na zastižených preparátech zcela rozrušená struktura sliznice, edém submukózy, rozsáhlé vředy kryté pablánami (obr. 4). Pooperační průběh komplikoval rozvoj A
těžká pseudomembranózní kolitida, histologicky byla na zastižených preparátech zcela rozrušená struktura sliznice, edém submukózy, rozsáhlé vředy kryté pablánami (obr. 4). Pooperační průběh komplikoval rozvoj A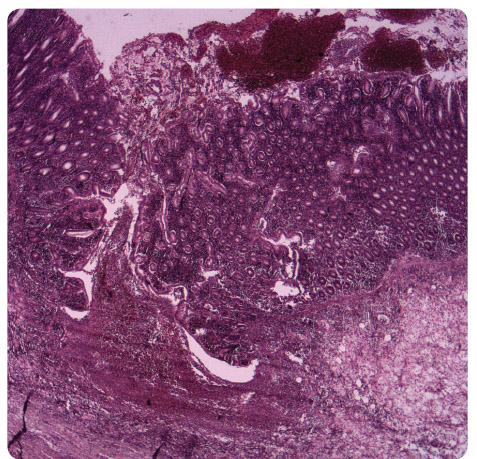 RDS (syndrom dechové tísně dospělých) v rámci syndromu multiorgánové dysfunkce, který vyžadoval osmidenní pobyt na ARO s UPV (umělou plicní ventilací); odtud byl již stabilizovaný pacient přeložen dne 2. 4. 2009 zpět na chirurgii a záhy propuštěn domů.
RDS (syndrom dechové tísně dospělých) v rámci syndromu multiorgánové dysfunkce, který vyžadoval osmidenní pobyt na ARO s UPV (umělou plicní ventilací); odtud byl již stabilizovaný pacient přeložen dne 2. 4. 2009 zpět na chirurgii a záhy propuštěn domů.
Dne 30. 6. 2009 byla provedena rekonstrukce střeva termino-terminální ileorektální anastomózou.
Závěr
Na této kazuistice jsme popsali případ klostridiové pseudomembranózní kolitidy u padesátiletého muže s nevýznamným předchorobím, jehož stav se od počátku klinicky prezentoval krvavými průjmy, bolestmi břicha a horečkou se zvýšenými markery zánětu. Při první návštěvě lékaře byl pro tyto obtíže podán Augmentin, Ercefuryl a Imodium, což nepochybně zhoršilo další průběh pseudomembranózní kolitidy, která vyústila v rozvoj toxického megakolon, i navzdory posléze již zahájené cílené léčbě. Jakékoli přípravky zpomalující motilitu střevní, jako je loperamid, jsou u horečnatých průjmů kontraindikovány a rovněž tak antibiotika při neznalosti etiologie.
V publikaci byly použity diapozitivy z archivu Ústavu patologie a molekulární medicíny FN Motol a snímky z archivu Kliniky zobrazovacích metod FN Motol.Podpořeno projektem IGA NT/14209.
Seznam použité literatury
- [1] Savage DC. The microbial flora in the gastrointestinal tract. Prog Clin Biol Res 1981; 77: 893–908.
- [2] Beneš J. Kolitida vyvolaná Clostridium difficile. In: Beneš J. Infekční lékařství. 1. vydání. Praha, Galén 2009: 271–273.
- [3] Cartman ST, Heap JT, Kuehne SA, et al. The emergence of ‚hypervirulence‘ in Clostridium difficile. Int J Med Microbiol 2010; 300: 387–395.
- [4] Davies KA, et al. Poster presentovaný na ECCMID 2013; LB2968.
- [5] Crobach MJ, Dekkers OM, Wilcox MH, Kuijper EJ. European Society of Clinical Microbiology and Infectious Diseases (ESCMID): data review and recommendations or diagnosing Clostridium difficile-infection (CDI). Clin Microbiol Infect 2009; 15: 1053–1066.
- [6] Nyč O, Pituch H, Matějková J, et al. Clostridium difficile PCR ribotype 176 in the Czech Republic and Poland. Lancet 2011; 377: 140.