Inhibitory Janusovy kinázy v léčbě revmatoidní artritidy
Ve dnech 8.‒10. ledna hostila Ostrava již tradiční Zimní revmatologické dny pořádané Českou revmatologickou společností ČLS JEP. Satelitní sympozium společnosti Pfizer bylo zaměřeno na užití inhibitorů Janusovy kinázy v terapii revmatoidní artritidy i na hodnocení kardiovaskulárního rizika při léčbě chorobu modifikujícími antirevmatickými léky.
Tofacitinib v léčbě RA – zkušenosti z reálné klinické praxe u nás a ve světě
Profesor MUDr. Jiří Vencovský, DrSc., z pražského Revmatologického ústavu seznámil účastníky sympozia s reálnými klinickými zkušenostmi s léčbou jedním z inhibitorů Janusovy kinázy (JAK) u pacientů s revmatoidní artritidou (RA). Hned na úvod zdůraznil, že je nutné uvědomit si odlišnost mezi klinickými hodnoceními, na jejichž základě jsou přípravky registrovány, a běžnou klinickou praxí. Převážná většina nemocných s RA by totiž nesplnila kritéria zařazení do studie, jak dokládá např. německý registr [1]. V klinických hodnoceních jsou primárně sledováni pacienti pouze s RA, a výsledky studií tedy nemohou zohledňovat případné komorbidity nemocných.
Počet léčených tofacitinibem
(Xeljanz) zaznamenaný v českém národním registru ATTRA
činil v období od prosince 2017 do listopadu 2019
celkem 181 osob, část z nich byla z analýzy vyloučena
z důvodu předchozího zařazení do studií (obr. 1A, B).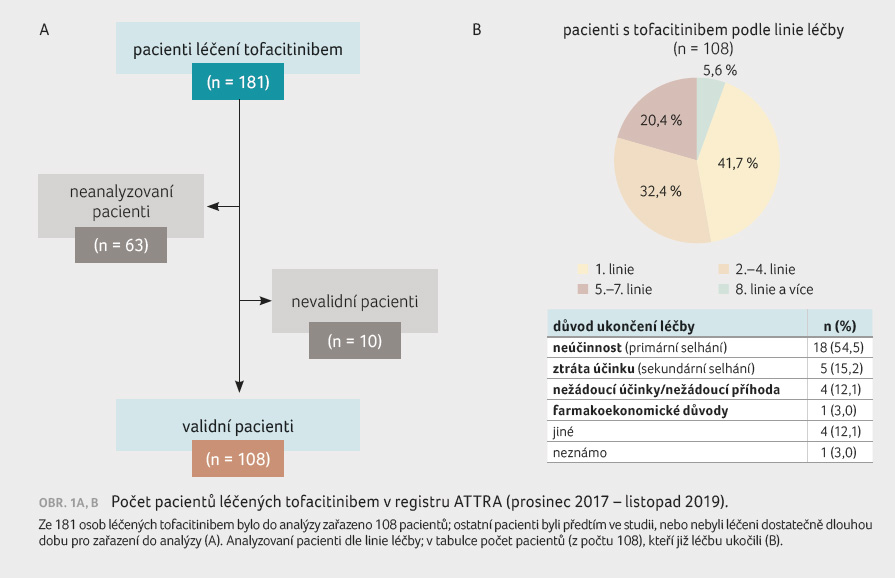 V současné době je tofacitinibem léčeno 75 pacientů.
Významná část nemocných (téměř 42 %) dostala tofacitinib
jako přípravek první linie, přes 30 % osob jako druhou
až čtvrtou léčebnou linii, 25 % osob jako pátou až osmou
léčebnou linii. „Rozhodné hodnocení efektu léčby může
nastat až po šesti měsících,“ zdůraznil profesor
Vencovský. Po třech měsících byl u nemocných
zaznamenán pokles aktivity choroby měřený pomocí skóre DAS28
na bázi sedimentace (Disease Activity Score) a po šesti
měsících i pokles závažnosti nemoci pomocí skóre SDAI
(Simple Disease Activity Index) a byla tak prokázána klinická
účinnost přípravku (graf 1A, B). Podle hodnocení pomocí SDAI dosahuje při
léčbě tofacitinibem po šesti měsících asi 70 % pacientů
nízké aktivity nemoci nebo remise.
V současné době je tofacitinibem léčeno 75 pacientů.
Významná část nemocných (téměř 42 %) dostala tofacitinib
jako přípravek první linie, přes 30 % osob jako druhou
až čtvrtou léčebnou linii, 25 % osob jako pátou až osmou
léčebnou linii. „Rozhodné hodnocení efektu léčby může
nastat až po šesti měsících,“ zdůraznil profesor
Vencovský. Po třech měsících byl u nemocných
zaznamenán pokles aktivity choroby měřený pomocí skóre DAS28
na bázi sedimentace (Disease Activity Score) a po šesti
měsících i pokles závažnosti nemoci pomocí skóre SDAI
(Simple Disease Activity Index) a byla tak prokázána klinická
účinnost přípravku (graf 1A, B). Podle hodnocení pomocí SDAI dosahuje při
léčbě tofacitinibem po šesti měsících asi 70 % pacientů
nízké aktivity nemoci nebo remise.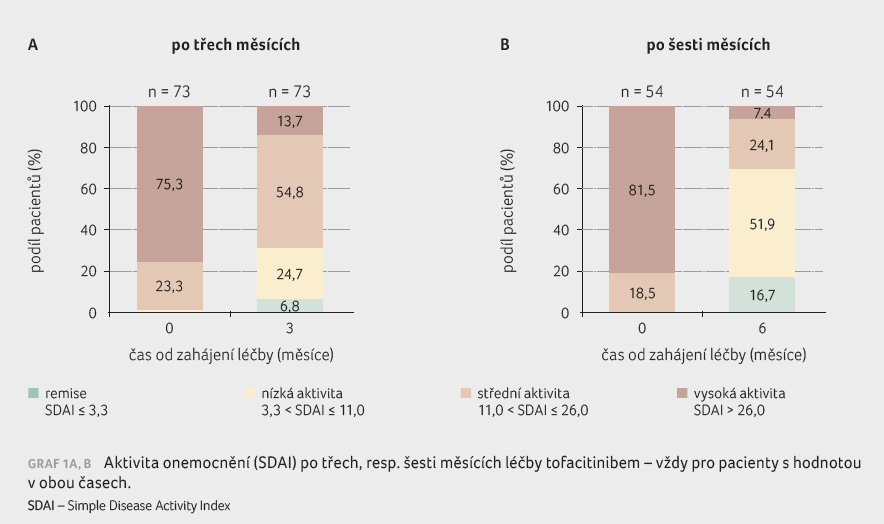
Ve stejném období bylo do registru ATTRA zařazeno téměř 1 300 pacientů léčených anti TNF (tumor nekrotizující faktor) přípravky. Skupiny pacientů léčených jednotlivými přípravky byly velmi podobné, lišily se v komedikaci pomocí bazálních léků a metotrexátu. V rámci registru byly porovnávány základní charakteristiky pacientů, u nichž byla zahájena léčba tofacitinibem a léčba anti TNF přípravkem, přičemž se jednalo především o parametry laboratorní (hodnota C reaktivního proteinu [CRP], počet citlivých a oteklých kloubů, skóre DAS28, pacientovo hodnocení, lékařovo hodnocení atp.). Ve všech aspektech vykazovali pacienti léčení tofacitinibem závažnější stav než pacienti léčení anti TNF přípravky. Vyšší aktivita nemoci byla asociována se zahájením terapie tofacitinibem. Z této analýzy také mimo jiné vyplynulo, že 60 % nemocných je u nás léčeno glukokortikoidy ve chvíli, kdy je u nich zahájena léčba biologickými nebo cílenými syntetickými chorobu modifikujícími antirevmatickými léky (biological/targeted synthetic disease modifying antirheumatic drugs, b/tsDMARDs).
Významná část pacientů v registru ATTRA byla léčena tofacitinibem v monoterapii – ze 108 pacientů dostávalo 69 osob konvenční syntetické antirevmatikum a 39 osob bylo léčeno monoterapií. Konvenční syntetické antirevmatikum ve většině případů představoval metotrexát (60), dále leflunomid, sulfasalazin nebo azatioprin (9). Při porovnání těchto dvou skupin byly vstupní charakteristiky prakticky stejné, pouze nemocní léčení kombinovanou terapií byli častěji séropozitivní a měli vyšší sedimentaci, popř. u nich bylo zaznamenáno horší hodnocení lékařem pomocí škály intenzity bolesti VAS (Visual Analogue Scale). „V případě porovnání aktivity onemocnění po třech měsících léčby byl výsledek rovněž prakticky stejný, statisticky významně horší parametr VAS byl zaznamenán u kombinované terapie. Pokud však přihlédneme ke vstupním charakteristikám, vychází v podstatě srovnatelný efekt u obou sledovaných skupin,“ vysvětlil profesor Vencovský. Při porovnání aktivity nemoci po šesti měsících léčby prokázala monoterapie tofacitinibem účinnost, většinou do této skupiny byli zařazeni nemocní, kteří nemohli dostat kombinovanou terapii.
Z nežádoucích účinků se vyskytly infekce ve 12 případech, z toho byly dvě herpes zoster, tedy infekce, která je asociována s podáváním inhibitorů JAK. Rovněž americký registr CORRONA doložil vyšší výskyt herpes zoster u pacientů léčených tofacitinibem oproti anti TNF přípravkům, ostatní nežádoucí účinky byly na stejné úrovni u obou skupin (jiné infekce, kardiovaskulární příhody atd.) [2]. V případě výskytu tromboembolických příhod, hluboké žilní trombózy nebo plicní embolie byla zaznamenána o něco nižší frekvence výskytu ve spojení s tofacitinibem oproti dalším biologickým lékům. „Uvedené výsledky jsou v kontrastu s tím, co se diskutuje u inhibitorů JAK ‒ že u nemocných užívajících inhibitory JAK byly hlášeny případy žilního tromboembolismu. Proto všechny pro léčbu RA schválené inhibitory JAK mají v Souhrnu údajů o přípravku (SPC) uvedeno upozornění týkající se těchto příhod. Registr CORRONA však dokládá, že v běžné klinické praxi tomu tak není,“ zdůraznil přednášející. Podle analýzy klinických studií s tofacitinibem zvyšuje frekvenci výskytu herpes zoster komedikace s glukokortikoidy [3].
Údaje z registru ATTRA u nemocných s RA ukazují, že tofacitinib je zatím preferenčně podáván pacientům se závažnějším onemocněním, tedy s vyšší aktivitou choroby a s horšími funkčními schopnostmi. U 36 % jedinců je tofacitinib podáván v monoterapii, efekt léčby v monoterapii a v kombinaci s konvenčními syntetickými DMARDs (csDMARDs) je srovnatelný. Přibližně 60 % nemocných má v komedikaci glukokortikoidy. Analýza bezpečnosti je prozatím nedostatečná z důvodu malého vzorku pacientů a krátké doby expozice danému léku.
Monoterapie revmatoidní artritidy cílenými léky
Docent MUDr. Petr Němec, Ph.D., z Fakultní nemocnice u sv. Anny v Brně prezentoval na sympoziu dvě kazuistiky pacientů, u kterých se rozhodl pro léčbu tofacitinibem.
Kazuistika 1
První pacientka (66 let), u níž byla diagnostikována séropozitivní RA už v roce 1988, byla předchozími dvěma revmatology léčena postupně řadou csDMARDs (hydroxychlorochin, zlato, sulfasalazin, leflunomid, metotrexát). Podávání těchto léků bylo ukončeno z důvodu toxicity, kromě sulfasalazinu, který měl nedostatečný terapeutický efekt. Poté byla u pacientky indikována léčba adalimumabem a v jejím průběhu byla nemocná předána do péče revmatologické ambulance FN u sv. Anny. Docházelo však k nárůstu aktivity onemocnění a terapie byla ukončena v květnu 2019. Z komorbidit byly zaznamenány hypertenze a mírná renální insuficience. V červnu 2019 měla pacientka vysoce aktivní onemocnění s oteklými klouby a hodnotou DAS28 (FW) 6,07, RA byla označena jako pokročilá choroba (RTG stadium 3). Po ukončení léčby adalimumabem byla nemocná léčena pouze metylprednisolonem v dávce 4 a 8 mg obden. Při otázce výběru další terapie byly zvažovány aktivita choroby, nemožnost použití csDMARDs, pokles renálních funkcí, bezpečnost léčby a preference pacientky. V červnu 2019 byla zahájena léčba tofacitinibem ve standardní dávce 2× 5 mg denně v monoterapii a pokračovala terapie metylprednisolonem. Skóre DAS28 už ve čtvrtém týdnu významně pokleslo ke střední aktivitě, ve 12. i 24. týdnu bylo dosaženo cíle léčby, tedy remise, resp. hraničně nízké aktivity nemoci. Rovněž hodnota CRP klesla ve čtvrtém týdnu terapie a snižovala se i nadále.
„Důvodem použití tofacitinibu v monoterapii byla v tomto případě mj. data ze tří klinických studií,“ vysvětlil docent Němec. V klinickém hodnocení ORAL Solo s pacienty s aktivní RA po selhání léčby alespoň jedním DMARD (konvenční, syntetický nebo biologický) byl tofacitinib srovnáván s placebem [4]. Primární cílový ukazatel představovala odpověď ACR20 (20% zlepšení podle American College of Rheumatology) ve 12. týdnu léčby a této odpovědi dosáhl statisticky významně větší podíl pacientů léčených v monoterapii tofacitinibem (60 %) ve srovnání s placebem (27 %). Statisticky významné rozdíly se projevily i v odpovědích ACR50 a ACR70 (50% a 70% zlepšení podle American College of Rheumatology). Studie prokázala podstatný vliv tofacitinibu na redukci bolesti oproti placebu už po dvou týdnech od zahájení léčby. Významné zmírnění bolesti bylo zaznamenáno i u pacientů, kteří ve 12. týdnu byli z placeba převedeni na tofacitinib [5].
Do studie ORAL Start byli zařazeni pacienti s RA doposud neléčení účinnou dávkou metotrexátu [6]. Tofacitinib zde byl porovnáván s metotrexátem a primární cílový ukazatel představovala odpověď ACR70 po šesti měsících léčby. Statisticky významně více pacientů léčených tofacitinibem oproti metotrexátu dosáhlo stanoveného primárního cíle. Také v ostatních parametrech byly doloženy statisticky signifikantní rozdíly ve prospěch monoterapie tofacitinibem.
ORAL Strategy byla non inferioritní studií, která přímo porovnávala tofacitinib v monoterapii, tofacitinib v kombinaci s metotrexátem a adalimumab v kombinaci s metotrexátem [7]. Primární cílový ukazatel představovala odpověď ACR50 po šesti měsících léčby. „Non inferiorita byla prokázána při srovnání tofacitinibu v kombinaci s metotrexátem a adalimumabu v kombinaci s metotrexátem (odpovědi ACR50 dosáhlo 46 %, resp. 43,8 % nemocných). U tofacitinibu v monoterapii non inferiorita k obou kombinacích prokázána nebyla, nicméně cíle ACR50 dosáhl významný počet pacientů (38 %),“ shrnul přednášející.
O účinnosti tofacitinibu svědčí
také téměř 9,5letá data setrvání na léčbě získaná
z dlouhodobých extenzí dvou klinických studií, v nichž
byla zaznamenána střední doba přežití na léčbě v délce
pěti let [8]. Při porovnání monoterapie s kombinační
léčbou byla délka přežití na léčbě srovnatelná.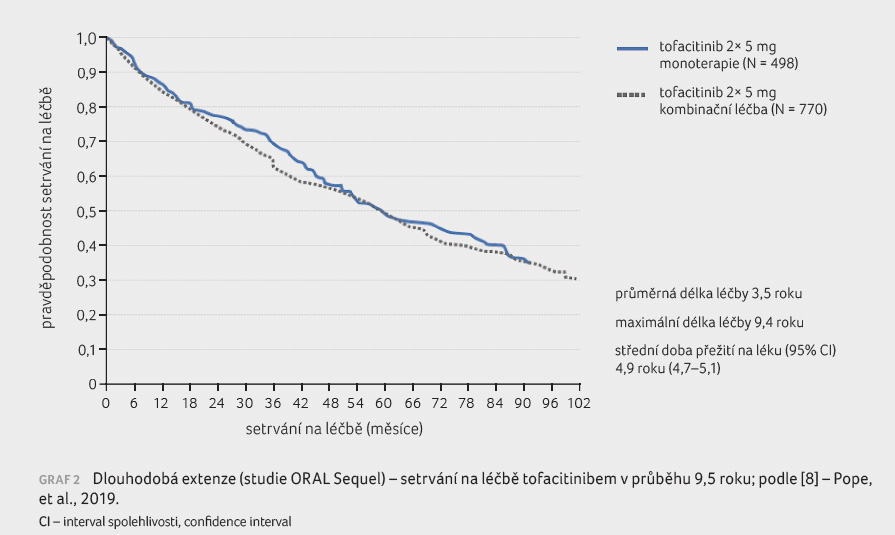
Data z reálné praxe přináší například švýcarský klinický registr, který porovnával monoterapii a kombinační léčbu tofacitinibem, inhibitory TNF a biologickými přípravky s jiným mechanismem účinku (abatacept a tocilizumab) [9]. „Výsledky ukazují, že není rozdíl v setrvání na léčbě, pokud je pacient léčen monoterapií nebo kombinační léčbou tofacitinibem nebo biologickým lékem s jiným mechanismem účinku, naopak inhibitory TNF pro dosažení delšího setrvání na léčbě vyžadují kombinaci s csDMARDs, jak to známe z klinické praxe,“ vysvětlil docent Němec (graf 2, 3).
Biologické DMARDs mají minimální
renální eliminaci, proto není nutná úprava dávky při renální
insuficienci. Tofacitinib je ledvinami vylučován asi z 30 %.
U pacientů při mírné až středně těžké renální
insuficienci není třeba úprava dávky, při těžké renální
insuficienci je doporučena redukce dávky na polovinu.
Například v případě baricitinibu je už však renální
clearance významnější (asi 75 % léku je vylučováno
ledvinami) – u pacienta s poklesem renálních
parametrů pod hodnotu 60 ml/min je proto doporučena redukce dávky
na 2 mg denně a přípravek není doporučen u nemocných
trpících závažnou renální insuficiencí [10,11].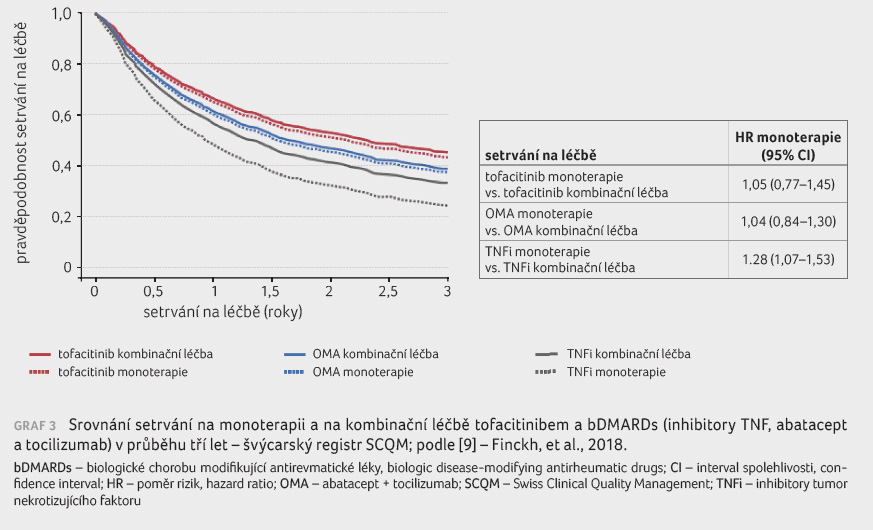
Kazuistika 2
U pacientky (72 let) byla diagnóza séropozitivní RA stanovena už v jejích 48 letech. Nejprve byla léčena sulfasalazinem, po několika letech došlo ke ztrátě efektu a následovala monoterapie metotrexátem, pacientka však netolerovala jeho vyšší dávky (maximální dávka v této době činila 15 mg týdně). V roce 2010 byla nemocná zařazena do klinického hodnocení ORAL Standard a následně pokračovala v otevřené dlouhodobé extenzi až do dubna 2016. Léčena byla vyšší dávkou tofacitinibu, která se standardně nepoužívá (2× 10 mg denně), v terapii metotrexátem pokračovala do července 2011, kdy se objevily komplikace v podobě infekce herpes zoster (přeléčena acyklovirem), a podávání metotrexátu bylo ukončeno pro dobrý efekt tofacitinibu. Ke konci hodnocení došlo k mírnému nárůstu aktivity onemocnění, proto bylo zahájeno užívání metotrexátu perorálně v dávce 10 mg týdně. Pacientka jej však netolerovala, po čtyřech měsících tedy byla převedena na subkutánní metotrexát ve stejné dávce (vyšší dávku nemocná opět netolerovala). V prosinci 2017 byla zaznamenána vysoká aktivita onemocnění (DAS28 v hodnotě 5,19) a byla zahájena léčba tofacitinibem v dávce 2× 5 mg denně, konkomitantně pokračovala terapie subkutánním metotrexátem. Po čtyřech týdnech došlo k významnému poklesu aktivity až na úroveň remise. V průběhu dalších dvou let byly remise nebo nízká aktivita choroby setrvalé, pacientka léčbu dobře tolerovala. V březnu 2019 prodělala nemocná tranzitorní ischemickou ataku v podobě lehké levostranné hemiparézy, jež byla přeléčena antiagregancii a došlo k úplné úpravě stavu.
Fleischmann a kol. provedli následnou analýzu studie ORAL Scan, v níž byli zařazeni pacienti po selhání léčby metotrexátem a léčení tofacitinibem nebo placebem v kombinaci s metotrexátem [12]. Autoři rozdělili pacienty do tří skupin podle dávky metotrexátu: s nízkou dávkou do 12 mg týdně, se střední dávkou 12,5 až < 17,5 mg, s vysokou dávkou 17,5 mg a více. Primární cílový ukazatel studie představovalo hodnocení účinnosti po šesti měsících léčby. Dávka konkomitantního metotrexátu neměla vliv na dosažený efekt a byl zaznamenán ve všech případech statisticky významný rozdíl léčby tofacitinibem oproti placebu v dosažení klinické odpovědi (ACR20, 50, 70). Hodnocena byla rovněž klinická remise podle kritéria CDAI (Clinical Disease Activity Index) – po šesti měsících nebyl zaznamenán signifikantní rozdíl v dosažení cíle u pacientů léčených tofacitinibem oproti placebu nezávisle na dávce metotrexátu.
„Tofacitinib je zástupcem tzv. cílených syntetických chorobu modifikujících léků a máme u něj dostatek důkazů z klinických studií i z reálné praxe o účinnosti v monoterapii. Použitelný je v dávce 2× 5 mg denně v monoterapii u pacientů s aktivní RA při selhání csDMARDs nebo bDMARDs. Délka setrvání na léčbě je podobná u monoterapie i kombinační terapie. Při zahájení léčby je nutno respektovat pacientovy komorbidity (tofacitinib je možné použít i u pacientů se středně závažnou a závažnou renální insuficiencí),“ shrnul docent Němec.
Kardiovaskulární riziko a jeho hodnocení při léčbě DMARDs
Riziku rozvoje kardiovaskulárních komplikací u revmatických onemocnění, zejména RA, a vlivu terapie DMARDs i způsobu hodnocení kardiovaskulárního rizika v revmatologii věnoval svoji přednášku docent MUDr. Michal Tomčík, Ph.D., z Revmatologického ústavu v Praze. „V posledních dekádách s nástupem nových a účinnějších léků můžeme u některých onemocnění lépe ovlivňovat aktivitu a zabránit tak v některých případech rozvoji ireverzibilních strukturálních změn. O to více se soustřeďuje pozornost na komorbidity, které pravděpodobně mají na zvýšené mortalitě pacientů s revmatickými chorobami vyšší podíl, než by se běžně očekávalo,“ uvedl téma přednášející. Nejzávažnější a nejčastější komorbiditu představují kardiovaskulární komplikace, jejichž podkladem je vyšší prevalence, časnější nástup a rychlejší progrese aterosklerózy či vyšší riziko náchylnosti k rupturám aterosklerotických plátů. U běžné populace je toto riziko dáno přítomností nebo nepřítomností ovlivnitelných nebo neovlivnitelných tradičních rizikových kardiovaskulárních faktorů – čtyřmi základními jsou kouření, diabetes, hypertenze a dyslipidemie, přičemž při současném výskytu vedou až ke dvacetinásobně zvýšenému kardiovaskulárnímu riziku. „Tyto faktory jsou u revmatologických pacientů většinou také přítomny ve zvýšené míře, nedokážou však vysvětlit celý rozsah zvýšeného kardiovaskulárního rizika,“ podotkl docent Tomčík. U revmatických onemocnění se vyskytují rovněž netradiční rizikové kardiovaskulární faktory, které jsou specifické pro jednotlivé choroby. V případě RA jsou to například aktivita nemoci, počet bolestivých a oteklých kloubů, systémová zánětlivá aktivita, extraartikulární manifestace, přítomnost autoprotilátek. U ankylozující spondylitidy (AS) můžeme uvést uveitidu, u psoriatické artritidy (PsA) daktylitidu, u systémového lupus erythematodes (SLE) neuropsychiatrický lupus, přítomnost autoprotilátek a aktivitu nemoci. Všechny vyjmenované faktory mají určitý podíl na zvýšeném kardiovaskulárním riziku.
Ucelenější přehled o tom, jaký vliv na kardiovaskulární riziko u RA mají DMARDs, poskytla metaanalýza většiny revmatologických přípravků z roku 2015 [13]. Podle ní metotrexát snížil riziko všech zaznamenávaných kardiovaskulárních příhod o 28 % oproti placebu. Anti TNF přípravky redukovaly toto riziko o 30 %, u infarktu myokardu (IM) o 41 %, u cévní mozkové příhody (CMP) o 43 %, u závažných kardiovaskulárních příhod (MACE) o 70 % [13]. „Velmi často diskutovaným tématem je riziko vzniku městnavého srdečního selhání při podávání anti TNF přípravků, kdy sice ve zmíněné analýze nebyl prokázán jejich negativní vliv, výsledky podobných sledování však v minulosti nebyly vždy tak příznivé, proto je třeba zvýšené opatrnosti. Anti TNF terapie nevede ke zmírnění kardiovaskulárního rizika paušálně, musíme si uvědomit, že k zásadnímu snížení kardiovaskulárního rizika dojde zejména u pacientů, kteří mají dobrou odpověď na léčbu,“ objasnil přednášející [14]. V případě přípravků s jiným mechanismem účinku než blokáda TNF doložila analýza s téměř 90 000 pacienty s RA a tocilizumabem jako komparátorem ve dvou různých kohortách, že kardiovaskulární riziko tocilizumabu je srovnatelné s rizikem u anti TNF přípravků nebo přípravků s odlišným mechanismem účinku jako například abatacept či rituximab [15]. V metaanalýze týkající se PsA byla popsána redukce kardiovaskulárního rizika až o 42 % při léčbě anti TNF přípravky oproti lokální terapii a až o 33 % ve srovnání s metotrexátem [16]. U AS se data týkají spíše subklinické a ultrazvukem detekované aterosklerózy, kde došlo k zastavení postupné progrese zvětšování intimomediální tloušťky karotid, ale nedošlo k ovlivnění počtu aterosklerotických plátů [17].
Některé studie uvádějí, že RA samotná jako diagnóza má 2‒3× vyšší riziko tromboembolických příhod, než je zaznamenáváno u běžné populace (hluboká žilní trombóza, plicní embolie). Pokud se zaměříme na inhibitory JAK, u baricitinibu byla zaznamenána incidence 0,5 případu/100 pacientoroků, tedy přibližně 42 pacientů z 3 500 osob v daném sledování (bez souvislosti s délkou expozice nebo s dávkou), u tofacitinibu 0,1/100 pacientoroků. Recentně publikovaná metaanalýza z roku 2019 srovnala veškeré dostupné studie a neprokázala zvýšené riziko hluboké žilní trombózy a plicní embolie u inhibitorů JAK jako celé skupiny, ani zvýšené jiné kardiovaskulární riziko [18‒23].
Evropská liga proti revmatismu (EULAR) doporučuje ve svých guidelines aktualizovaných roku 2016 kontrolu aktivity nemoci všemi dostupnými prostředky, dbát opatrnosti při podávání nesteroidních antirevmatik (NSA), glukokortikoidů, hodnotit kardiovaskulární riziko jednou za pět let, ideálně dle národních doporučení nebo skórovacích systémů. U skórovacích systémů je třeba násobit hodnoty koeficientem 1,5, neboť by mohlo dojít k podhodnocení rizika u revmatických pacientů. Monitorování hodnot lipidového spektra je ideální provádět ve stabilní fázi nebo v remisi, adekvátně intervenovat, modifikovat tradiční rizikové faktory dle národních doporučení [24,25]. Kardiovaskulární riziko u nerevmatické populace s anamnézou již manifestovaných kardiovaskulárních příhod léčené DMARDs sledovaly studie CANTOS s kanakinumabem (2017), CIRT s metotrexátem (2019) a COLCOT s kolchicinem (2019) [26‒28], výsledky čtvrté studie OXI s hydroxychlorochinem ještě nebyly publikovány [29].
Přes pokroky v léčbě zůstává mortalita pacientů s revmatickými chorobami zvýšená, především s ohledem na kardiovaskulární komorbidity, které mají většinou závažnější prognózu než u běžné populace. Jsou asociované se systémovým zánětem, který bychom měli adekvátně, individuálně, časně a agresivně tlumit dostupnými prostředky, s opatrností a zvážením jejich přínosu a rizika. K účinné prevenci a intervenci kardiovaskulárního rizika bychom ideálně měli přizvat mezioborovou spolupráci s preventivními kardiology, uzavřel docent Tomčík.
Redakčně zpracovala PhDr. Nikola
Homolová Richtrová
Seznam použité literatury
- [1] Zink A, Strangfeld A, Schneider M, et al. Effectiveness of tumor necrosis factor inhibitors in rheumatoid arthritis in an observational cohort study: Comparison of patients according to their eligibility for major randomized clinical trials. Arthritis Rheum 2006; 54: 3399‒3407.
- [2] Kremer JM, Rigby W, Singer NG, et al. Sustained Response Following Discontinuation of Methotrexate in Patients With Rheumatoid Arthritis Treated With Subcutaneous Tocilizumab. Arthritis Rheumatol 2018; 70(Suppl 10): 1200‒1208.
- [3] Curtis JR, Xie F, Yang S, et al. Risk for Herpes Zoster in Tofacitinib‑Treated Rheumatoid Arthritis Patients With and Without Concomitant Methotrexate and Glucocorticoids. Arthritis Care Res (Hoboken) 2019; 71: 1249‒1254.
- [4] Fleischmann R, Kremer J, Cush J, et al. Placebo‑Controlled Trial of Tofacitinib Monotherapy in Rheumatoid Arthritis. N Engl J Med 2012; 367: 495‒507.
- [5] Strand V, Kremer J, Wallenstein G, et al. Effects of tofacitinib monotherapy on patient‑reported outcomes in a randomized phase 3 study of patients with active rheumatoid arthritis and inadequate responses to DMARDs. Arth Res Ther 2015; 17: 307.
- [6] Lee EB, Fleischmann R, Hall S, et al. Tofacitinib versus methotrexate in rheumatoid arthritis. N Engl J Med 2014; 370: 2377‒2386.
- [7] Fleischmann R, Mysler E, Hall S, et al. Efficacy and safety of tofacitinib monotherapy, tofacitinib with methotrexate, and adalimumab with methotrexate in patients with rheumatoid arthritis (ORAL Strategy): a phase 3b/4, double‑blind, head‑to‑head, randomised controlled trial. Lancet 2017; 390: 457‒468.
- [8] Pope JE, Keystone E, Jamal S, et al. Persistence of Tofacitinib in the Treatment of Rheumatoid Arthritis in Open‐Label, Long‐Term Extension Studies up to 9.5 Years. ACR Open Rheumatology 2019; 2: 73‒82.
- [9] Finckh A, Tellenbach C, Scherer A, et al. The Impact of Comedication with Conventional Synthetic Dmards on Drug Retention and Clinical Effectiveness of Tofacitinib, Anti–Tumor Necrosis Factor Therapy and Biologics with an Alternative Mode of Action in Patients with Rheumatoid Arthritis. a Cohort Study. ACR Meeting 2018; Poster 557.
- [10] Xeljanz (SPC). Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/xeljanz‑epar‑product‑information_cs.pdf
- [11] Olumiant (SPC). Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/olumiant‑epar‑product‑information_cs.pdf
- [12] Fleischmann R, Mease PJ, Schwartzman S, et al. Efficacy of tofacitinib in patients with rheumatoid arthritis stratified by background methotrexate dose group. Clin Rheumatol 2017; 36: 15–24.
- [13] Roubille C, Richer V, Starnino T, et al. The effects of tumour necrosis factor inhibitors, methotrexate, non‑steroidal anti‑inflammatory drugs and corticosteroids on cardiovascular events in rheumatoid arthritis, psoriasis and psoriatic arthritis: a systematic review and meta‑analysis. Ann Rheum Dis 2015; 74: 480–489.
- [14] Ljung L, Rantapää‑Dahlqvist S, Jacobsson LT, Askling J. Response to biological treatment and subsequent risk of coronary events in rheumatoid arthritis. Ann Rheum Dis 2016; 75: 2087‒2094.
- [15] Xie F, Yun H, Levitan EB, et al. Tocilizumab and the Risk of Cardiovascular Disease: Direct Comparison Among Biologic Disease‑Modifying Antirheumatic Drugs for Rheumatoid Arthritis Patients. Arthritis Care Res (Hoboken) 2019; 71: 1004‒1018.
- [16] Yang Z, Lin N, Li L, Li Y. The Effect of TNF Inhibitors on Cardiovascular Events in Psoriasis and Psoriatic Arthritis: an Updated Meta‑Analysis. Clin Rev Allerg Immunol 2016; 2: 240‒247.
- [17] Arida A, Protogerou AD, Konstantonis G, et al. Subclinical Atherosclerosis Is Not Accelerated in Patients with Ankylosing Spondylitis with Low Disease Activity: New Data and Metaanalysis of Published Studies. J Rheumatol 2015; 42: 2098‒2105.
- [18] Taylor PC, Weinblatt ME, Burmester GR, et al. Cardiovascular Safety During Treatment With Baricitinib in Rheumatoid Arthritis. Arthritis Rheumatol 2019; 71: 1042‒1055.
- [19] Kim SC, Schneeweiss S, Liu J, Solomon DH. Risk of venous thromboembolism in patients with rheumatoid arthritis. Arthritis Care Res (Hoboken) 2013; 65: 1600‒1607.
- [20] Ogdie A, McGill NK, Shin DB, et al. Risk of venous thromboembolism in patients with psoriatic arthritis, psoriasis and rheumatoid arthritis: a general population‑based cohort study. Eur Heart J 2018; 39: 3608‒3614.
- [21] Kremer J, Huizinga TWJ, Chen L, et al. Analysis of neutrophils, lymphocytes, and platelets in pooled phase 2 and phase 3 studies of baricitinib for rheumatoid arthritis. Ann Rheum Dis 2017; 76(Suppl 2): 512.
- [22] Wollenhaupt J, Lee EB, Curtis JR, et al. Safety and efficacy of tofacitinib for up to 9.5 years in the treatment of rheumatoid arthritis:final results of a global, open‑label, long‑term extension study. Arthritis Res Ther 2019; 21: 89.
- [23] Xie W, Huang Y, Xiao S, et al. Impact of Janus kinase inhibitors on risk of cardiovascular events in patients with rheumatoid arthritis: systematic review and meta‑analysis of randomised controlled trials. Ann Rheum Dis 2019; 78: 1048‒1054.
- [24] Peters MJ, Symmons DP, McCarey D, et al. EULAR evidence‑based recommendations for cardiovascular risk management in patients with rheumatoid arthritis and other forms of inflammatory arthritis. Ann Rheum Dis 2010; 69: 325‒331.
- [25] Agca E, Heslinga SC, Rollefstad S, et al. EULAR recommendations for cardiovascular disease risk management in patients with rheumatoid arthritis and other forms of inflammatory joint disorders: 2015/2016 update. Ann Rheum Dis 2017; 76: 17‒28.
- [26] Ridker PM, Everett BM, Pradhan A, et al; CIRT Investigators. Low‑Dose Methotrexate for the Prevention of Atherosclerotic Events. N Engl J Med 2019; 380: 752‒762.
- [27] Ridker PM, Everett BM, Thuren T, et al. Antiinflammatory Therapy with Canakinumab for Atherosclerotic Disease. N Engl J Med 2017; 377: 1119‒1131.
- [28] Tardif JC, Kouz S, Waters DD, et al. Efficacy and Safety of Low‑Dose Colchicine after Myocardial Infarction. N Engl J Med 2019; 381: 2497‒2505.
- [29] Hartman O, Kovanen PT, Lehtonen J, et al. Hydroxychloroquine for the prevention of recurrent cardiovascular events in myocardial infarction patients: rationale and design of the OXI trial. Eur Heart J Cardiovasc Pharmacother 2017; 3: 92‒97.