Osimertinib v léčbě pacientů s mutací EGFR typu T790M
Souhrn:
Osimertinib představuje zástupce třetí generace tyrozinkinázových inhibitorů receptoru pro epidermální růstový faktor (EGFR). Oproti inhibitorům první a druhé generace je účinný rovněž u pacientů s mutací typu T790M, která je nejčastější příčinou selhání terapie předchozími tyrozinkinázovými inhibitory. Uvedená kazuistika ukazuje nejen léčebné možnosti cílené onkologické léčby osimertinibem u pacienta s pokročilým karcinomem plic po selhání třetí linie protinádorové terapie, ale i stále se rozšiřující možnosti léčby karcinomu plic obecně.
Key words: osimertinib – EGFR – T790M.
Summary:
Osimertinib belongs to the third generation of tyrosine kinase inhibitors that target the epidermal growth factor receptor (EGFR). In contrast with the first and the second generation of inhibitors, it is also effective in patients with T790M mutation that represents the most frequent reason for failure of therapy with previous tyrosine kinase inhibitors. The case report shows not only the therapeutic options of targeted therapy with osimertinib in a patient with advanced lung cancer after failure of the third line of oncological treatment but also the ever-expanding possibilities of lung cancer treatment in general.
Úvod
Karcinom plic patří mezi nejčastěji
diagnostikované druhy nádorových onemocnění a zůstává
i hlavní příčinou mortality z onkologických příčin
u nás i ve světě. Nemalobuněčný karcinom plic
(non small cell lung cancer, NSCLC) je nejběžnější
podskupinou a představuje 80 % všech případů plicních
karcinomů. Mezi NSCLC se nejčastěji vyskytují ade![GRAF 1 řídící genové mutace u adenokarcinomu plic; podle [15] – Mok, et al., 2015. Alk – anaplastic lymphoma kinase; BrAF / pik3CA – B‑raf proto‑oncogene/phosphatidylinositol‑ ‑4,5‑bisphosphate 3‑kinase; eGFr – epidermal growth factor receptor; her2/Mek – epidermal growth factor/mitogen activated protein kinase; krAs – kirsten rat sarcoma viral oncogene; MeT – multitargeted tyrosine kinase; reT – rearranged during transfection proto‑oncogene; ros – reactive oxygen species](https://www.remedia.cz/photo-a-31239---.jpg) nokarcinomy,
skvamózní karcinomy a méně často velkobuněčné,
sarkomatoidní, adenoskvamózní a jiné typy karcinomů.
Tradiční léčbou většiny pacientů s NSCLC zůstává
kombinovaná chemoterapie založená na platinovém derivátu.
Zlepšující se možnosti molekulárního rozlišení jednotlivých
kategorií NSCLC umožňují lépe definovat skupiny pacientů, kteří
mají prospěch z cílené léčby. Zejména identifikace
ovlivnitelné řídící genové mutace jako EGFR (receptor pro
epidermální růstový faktor, epidermal growth factor receptor)
a ALK (kináza anaplastického lymfomu, anaplastic
lymphoma kinase) mohou pomoci rozhodnout, zda daný
pacient s NSCLC bude mít prospěch z účinné a méně
toxické cílené léčby (graf 1).
nokarcinomy,
skvamózní karcinomy a méně často velkobuněčné,
sarkomatoidní, adenoskvamózní a jiné typy karcinomů.
Tradiční léčbou většiny pacientů s NSCLC zůstává
kombinovaná chemoterapie založená na platinovém derivátu.
Zlepšující se možnosti molekulárního rozlišení jednotlivých
kategorií NSCLC umožňují lépe definovat skupiny pacientů, kteří
mají prospěch z cílené léčby. Zejména identifikace
ovlivnitelné řídící genové mutace jako EGFR (receptor pro
epidermální růstový faktor, epidermal growth factor receptor)
a ALK (kináza anaplastického lymfomu, anaplastic
lymphoma kinase) mohou pomoci rozhodnout, zda daný
pacient s NSCLC bude mít prospěch z účinné a méně
toxické cílené léčby (graf 1).
Klinická studie AURA3
Tyrozinkinázové inhibitory (tyrosine
kinase inhibitor, TKI) zaměřené na EGFR jsou již
neodmyslitelnou součástí léčby pacientů s řídícími
mutacemi v genu pro EGFR [1]. První generace reverzibilních
TKI (gefitinib, erlotinib) i druhá generace TKI zastoupená
ireverzibilně se vázajícím afatinibem prokázaly významné
zlepšení doby do progrese onemocnění (progression free
survival, PFS) oproti dříve zavedené chemoterapii [2]. Nejčastější
příčinou selhání cílené terapie (zhruba v 60 % případů)
bývá mutace T790M, z ![OBR. 1 rozdělení tyrozinkinázových inhibitorů podle vývoje a působení; podle [6] – Cross, et al., 2014. eGFr‑Tki – tyrozinkinázové inhibitory zaměřené na receptor pro epidermální růstový faktor, epidermal growth factor receptor‑tyrosine kinase inhibitor EGFR-TKI první generace reverzibilní Druhá generace ireverzibilní Třetí generace ireverzibilní a selektivní Gefi tinib erlotinib afatinib osimertinib OBR. 2 předchozí léčba pacienta probíhající od dubna 2011 do března 2016 cílenou léčbou gefi tinibem a následně kombinovanou chemoterapií a udržovací terapií (z CT archivu Fn Brno).](https://www.remedia.cz/photo-a-31240---.jpg) ostatních méně častých příčin
může dojít k transformaci do malobuněčného karcinomu,
k vytvoření alternativní tzv. bypass cesty (prostřednictvím
amplifikace HER2, amplifikace MET či mutace PIK3CA). K léčbě
pacientů s rezistentní mutací typu T790M jsou určeny
EGFR TKI třetí generace (obr. 1),
jejichž zástupcem je právě osimertinib [3‒9]. Účinnost
a bezpečnost osimertinibu byla ověřena v mezinárodní
multicentrické randomizované studii AURA3.
ostatních méně častých příčin
může dojít k transformaci do malobuněčného karcinomu,
k vytvoření alternativní tzv. bypass cesty (prostřednictvím
amplifikace HER2, amplifikace MET či mutace PIK3CA). K léčbě
pacientů s rezistentní mutací typu T790M jsou určeny
EGFR TKI třetí generace (obr. 1),
jejichž zástupcem je právě osimertinib [3‒9]. Účinnost
a bezpečnost osimertinibu byla ověřena v mezinárodní
multicentrické randomizované studii AURA3.
Medián PFS byl při podávání osimertinibu významně delší než u kombinované chemoterapie platinou a pemetrexedem (10,1 měsíce vs. 4,4 měsíce; HR [poměr rizik] 0,30; 95% CI [interval spolehlivosti] 0,23‒0,41; p < 0,001). Míra objektivní odpovědi byla též signifikantně lepší u osimertinibu (71 %; 95% CI 65‒76) než u kombinované chemoterapie (31 %; 95% CI 24‒40). Ze 144 pacientů s metastázami do centrálního nervového systému (CNS) byla PFS u pacientů užívajících osimertinib významně delší než u nemocných léčených chemoterapií (8,5 měsíce vs. 4,2 měsíce; HR 0,32; 95% CI 0,21‒0,49). Podíl pacientů s nežádoucím účinkem stupně 3 nebo více byl při podání osimertinibu naopak nižší (23 %) než při chemoterapii (47 %). Mezi nejčastější nežádoucí účinky užívání přípravku patřily průjem, vyrážka, suchá kůže a paronychia. V rameni s chemoterapií to byly především nauzea, nechutenství, zácpa a anémie. Intersticiální plicní procesy byly zaznamenány u 4 % nemocných léčených osimertinibem a u jednoho pacienta léčeného chemoterapií. Studie AURA3 tak prokázala signifikantní zlepšení PFS vůči platinovému dubletu užívanému po předchozí progresi a také potvrdila účinnost osimertinibu u pacientů s metastázami do CNS [5,10].
Kazuistika
Pacientem je starší muž, 62 let,
pracující v zemědělství a celoživotní nekuřák.
Dříve nebýval významněji nemocný, avšak poslední rok
před zjištěním nádorové diagnózy trpěl migrující
tromboflebitidou v oblasti dolních končetin a prodělal
plicní embolii. Počátkem roku 2011 začal mít potíže s bolestí
pod levým žeberním obloukem, k níž se postupně přidala
dušnost. V březnu 2011 byl na základě biopsie plic
diagnostikován nízce diferencovaný adenokarcinom dolního laloku
levé plíce v pokročilém stadiu (klinické stadium IV)
s maligním pleurálním výpotkem. Z molekulárně
genetického zhodnocení nádorové tkáně byla detekována delece
v exonu 19 genu pro EGFR. Výkonnostní stav pacienta před
zahájením onkologické léčby byl velmi dobrý ‒ performance
status (PS) v hodnotě 1.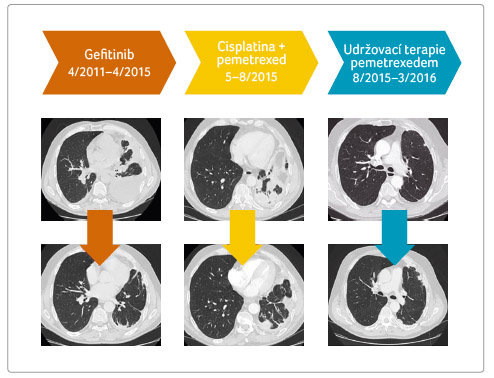
Léčba byla zahájena, vzhledem
k přítomnosti řídící mutace, TKI první generace ‒
gefitinibem. Při této terapii dochází k výrazné parciální
regresi tumoru, která trvala celé čtyři roky (obr. 2) a byla provázena vyrážkou a průjmem
maximálně 2. stupně, bez nutnosti úpravy dávkování.
Následně, v polovině roku 2015, dochází k progresi
onemocnění, kvůli níž byla zahájena druhá linie léčby
kombinovanou chemoterapií cisplatinou s pemetrexedem
ve standardním dávkování. Při terapii dochází opětovně
k parciální regresi nádoru i metastatického ložiska
pleury, a proto dále pokračujeme v udržovací léčbě
pemetrexedem až do března 2016 (obr. 2). Po 10 měsících dochází k další
progresi onemocnění v hrudníku. Následoval pokus o rebiopsii
tumoru, bronchoskopicky však bez záchytu nádorové tkáně, proto
byl proveden odběr krve ke zhodnocení cirkulující nádorové
DNA (circulating tumor DNA, ctDNA) ze vzorku plazmy, v němž byla
prokázána rezistentní mutace typu T790M. K úspěšné léčbě
pacientů s nálezem této rezistentní mutace je v České
republice schválen zatím jediný přípravek – osimertinib
‒, jemuž však nebyla stanovena úhrada. Podle dostupných
možností bylo tedy zažádáno o schválení terapie
na základě § 16 zákona č. 48/1997 Sb.,
o veřejném zdravotním pojištění, kdy příslušná
zdravotní pojišťovna hradí ve výjimečných případech
zdravotní služby jinak nehrazené, je li poskytnutí takových
zdravotních služeb jedinou možností z hlediska zdravotního
stavu pojištěnce. V době žádosti byla u pacienta
zahájena léčba EGFR TKI erlotinibem, která však byla
po dvou měsících ukončena z důvodu progrese
onemocnění. Mezitím jsme obdrželi vyjádření pojišťovny,
která žádost svého pojištěnce neschválila a doporučila
další léčbu chemoterapií. Vzhledem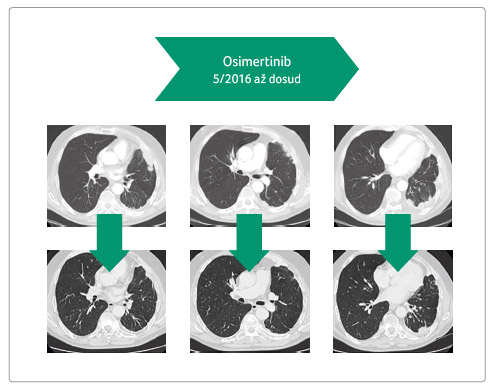 k dostupným důkazům
o neefektivitě a riziku značné toxicity chemoterapie
po předcházející kombinační terapii (navíc ve čtvrté
linii léčby) a vzhledem k současnému nálezu mutace,
u níž existuje možnost léčby za výrazně nižší
toxicity, byl požádán výrobce (společnost AstraZeneca), který
žádost o poskytnutí léku posoudil kladně. V květnu
2016 jsme tak mohli zahájit cílenou léčbu osimertinibem v dávce
80 mg denně.
k dostupným důkazům
o neefektivitě a riziku značné toxicity chemoterapie
po předcházející kombinační terapii (navíc ve čtvrté
linii léčby) a vzhledem k současnému nálezu mutace,
u níž existuje možnost léčby za výrazně nižší
toxicity, byl požádán výrobce (společnost AstraZeneca), který
žádost o poskytnutí léku posoudil kladně. V květnu
2016 jsme tak mohli zahájit cílenou léčbu osimertinibem v dávce
80 mg denně.
Při této terapii dochází k výrazné parciální regresi tumoru i metastáz, která trvá doposud, tedy již více než rok (obr. 3). Zároveň při léčbě ustoupily bolesti a dušnost a z nežádoucích účinků přetrvává pouze drobná vyrážka na hrudníku.
Diskuse
Uvedená kazuistika ukazuje léčebné možnosti osimertinibu u pacienta s pokročilým nádorem plic s výskytem mutace typu T790M. Výhody takové terapie jsou pro pacienta zřejmé ‒ vyšší efektivita, nižší toxicita a rovněž forma podání. Osimertinib (Tagrisso) se užívá v perorální formě jednou denně a může se podávat nezávisle na jídle. Tablety lze rozpustit ve vodě, což je výhodou pro pacienty s polykacími potížemi nebo se sondovou výživou.
Nežádoucí účinky léčby osimertinibem obvykle dosahují mírného stupně s převahou průjmu a vyrážky (tab. 1). Pouze výjimečně musí být dávka přípravku snížena nebo je nutné léčbu osimertinibem zcela ukončit. Mezi relativně vzácné, ale potencionálně závažné komplikace patří intersticiální pneumonie. Zejména při podávání osimertinibu po předchozí imunoterapii, kdy je dokumentován vyšší výskyt této komplikace a je nutné zahájit včasně léčbu kortikoidy, při níž dochází u většiny nemocných k uspokojivé regresi.
Dále se ukazuje i důležitost molekulární analýzy nádorové tkáně, která by měla být provedena u všech adenokarcinomů, u NSCLC spíše adenokarcinomu, u adenoskvamózního karcinomu a u NSCLC NOS (blíže nespecifikovaného), tedy i u nádorů smíšených, se složkou adenokarcinomu. Testovány jsou aktivační mutace EGFR v exonech 18–21 (80–90 % mutací vzniká v exonech 19 a 21). Aktivující mutace jsou primárně zkoušeny pomocí certifikovaných kitů různými metodami. Novým trendem v molekulárním profilování karcinomů plic je diagnostika částic uvolněných z nádoru do periferního oběhu ‒ tzv. cirkulujících nádorových buněk (circulating tumor cells, CTC), které se odloučily z nádoru, což vyžaduje nákladné technologie ‒ a dále vyšetřování ctDNA uvolňované z jednotlivých nádorových buněk [11–13]. Cílená detekce genových poruch v krátkých fragmentech DNA poskytuje pouze informaci o genových poruchách, avšak je technologicky dostupnější. Výsledek vyšetření ctDNA je směsným molekulárním profilem všech nádorových ložisek (primárních i sekundárních) ‒ celkovým obrazem o probíhajícím onemocnění. Představuje možnost vyšetření v případech, kdy nelze vzorek tkáně získat jednoduše jiným způsobem, a také možnost opakovaných tekutých biopsií v průběhu onkologické léčby s cílem sledování mutace, na niž je léčba zacílena, a časného záchytu další mutace značící nástup rezistence na terapii (např. mutace T790M). Metoda není univerzálně použitelná u všech onkologických pacientů, protože k uvolňování CTC i ctDNA dochází zejména u objemných nádorových mas v pokročilých stadiích onemocnění [14]. U plicních karcinomů lze dostupnými postupy běžně vyšetřit molekulární profil ctDNA přibližně u 50 % nemocných ve IV. stadiu choroby. S využitím nově vyvíjených specializovaných technologií, např. na bázi tzv. digitální amplifikace pomocí PCR (polymerázové řetězové reakce), se bude tento záchyt zlepšovat. Citlivost vyšetření mutace T790M se též významně liší podle použité technologie. V závislosti na použitém testu je pravděpodobnost falešně negativního nálezu 30‒40 %. Pokud je tedy vyšetření plazmatické ctDNA negativní, měl by se provést odběr nádorové tkáně vždy, pokud je to možné. I odběr nádorové tkáně formou biopsie má svá úskalí. Jednak se jedná o invazivní vyšetření a někteří pacienti ho nejsou schopni opakovaně podstupovat v době progrese nemoci, jednak se v souvislosti s heterogenitou nádorové tkáně mohou některé mutace vyskytovat pouze v určitých částech karcinomu. Vyšetřování plazmatické ctDNA je méně citlivé pro detekci mutace EGFR typu T790M než pro detekci delece exonu 19 nebo mutace L858R [15].
Důležitou otázkou do budoucna bude též načasování léčby osimertinibem. Podle recentních poznatků z molekulární genetiky se jeví pravděpodobnější koexistence klonu nádorových buněk s mutací T790M už od počátku terapie. Tento klon nebyl dostupnými metodami detekovatelný, ale s probíhající léčbou získává dominanci a stává se řídící mutací progrese onemocnění. V tomto případě se nabízí možnost zahájení terapie osimertinibem již v první linii léčby. Podle aktualizovaných výsledků dvou expanzních kohort studie fáze I AURA dosáhli pacienti léčení osimertinibem v první linii terapie 77% míry léčebné odpovědi. Medián PFS činil 19,3 měsíce u pacientů užívajících osimertinib v dávce 160 mg jednou denně (n = 30) a dosud ho nebylo dosaženo u nemocných užívajících dávku 80 mg osimertinibu jednou denně (n = 30). Mediánu délky léčebné odpovědi nebylo dosaženo [16]. Otázku možného zahájení terapie osimertinibem v první linii léčby by mohla zodpovědět studie fáze III FLAURA srovnávající gefitinib/erlotinib s osimertinibem v prvoliniové terapii u pacientů s mutacemi EGFR [17]. Výsledky této studie by měly být prezentovány na kongresu ESMO (European Society for Medical Oncology) v září tohoto roku.
Podobně jako u předchozích generací EGFR TKI se i na osimertinib vytváří rezistence. Již byla identifikována celá řada mechanismů, mezi něž patří získaná mutace BRAF, amplifikace MET, amplifikace HER2 a mutace KRAS. Dále jsou možné transformace do malobuněčného karcinomu a rozvoj rezistentní mutace L718Q a C797S. Zatím nejčastější rezistenci na osimertinib (mutaci C797S) by mohl překonat vyvíjený EGFR TKI čtvrté generace (EAI045) v kombinaci s cetuximabem [18‒23].
V neposlední řadě je třeba zmínit i nákladnost cílené onkologické léčby, s níž zápasí i země mnohem bohatší, než je Česká republika. V tomto případě je však třeba dodat, že pro terapii osimertinibem existují vcelku jasné prediktory [1‒6], podle nichž lze poměrně spolehlivě určit pacienty, kteří budou mít z léčby prospěch. Co se týká přístupu k novým onkologickým lékům, je situace pro české pacienty velmi nelichotivá, nejen ve srovnání s vyspělým světem, ale například i se sousedním Slovenskem. Pokud stát tuto léčbu hradit nemůže nebo nechce, bylo by dobré to budoucím pacientům sdělit a umožnit jim se pro tento případ připojistit.
Závěr
Uvedená kazuistika dokladuje účinnost, ale i komfortní perorální aplikaci a nízkou toxicitu osimertinibu při léčbě pokročilého karcinomu plic s mutací T790M. Vlivem cílené terapie a zapojením nových schémat chemoterapie pak ukazuje neustále se zlepšující možnosti léčby karcinomu plic obecně.
Seznam použité literatury
- [1] Lynch TJ, Bell DW, Sordella R, et al. Activating mutations in the epidermal growth factor receptor underlying responsiveness of non‑small‑cell lung cancer to gefitinib. N Engl J Med 2004; 350: 2129–2139.
- [2] Meador CB, Jin H, de Stanchina E, et al. Optimizing the sequence of anti‑EGFR‑targeted therapy in EGFR‑mutant lung cancer. Mol Cancer Ther 2015; 14: 542–552.
- [3] Soejima K, Yasuda H, Hirano T. Osimertinib for EGFR T790M mutation‑positive non‑small cell lung cancer. Expert Rev Clin Pharmacol 2017; 10: 31–38.
- [4] Socinski MA, Villaruz LC, Ross J. Understanding mechanisms of resistance in the epithelial growth factor receptor in non‑small cell lung cancer and the role of biopsy at progression. Oncologist 2016; pii: theoncologist.2016‑0285 (Epub).
- [5] Mok TS, Wu YL, Ahn MJ, et al. Osimertinib or platinum‑pemetrexed in EGFR T790M‑positive lung cancer. N Engl J Med 2017; 376: 629–640.
- [6] Cross DA, Ashton SE, Ghiorghiu S, et al. AZD9291, an irreversible EGFR TKI, overcomes T790M‑mediated resistance to EGFR inhibitors in lung cancer. Cancer Discov 2014; 4: 1046–1061.
- [7] Zhang H. Osimertinib making a breakthrough in lung cancer targeted therapy. Onco Targets Ther 2016; 9: 5489–5493.
- [8] Zugazagoitia J, Ferrer I, Paz‑Ares L. Osimertinib in EGFR‑mutant NSCLC: how to select patients and when to treat. Lancet Oncol 2016; 17: 1622–1623.
- [9] Greig SL. Osimertinib: first global approval. Drugs 2016; 76: 263–273.
- [10] Paz‑Ares L, de Marinis F, Dediu M, et al. Maintenance therapy with pemetrexed plus best supportive care versus placebo plus best supportive care after induction therapy with pemetrexed plus cisplatin for advanced non‑squamous non‑small‑cell lung cancer (PARAMOUNT): a double‑blind, phase 3, randomised controlled trial. Lancet Oncol 2012; 13: 247–255.
- [11] Benesova L, Belsanova B, Suchanek S, et al. Mutation‑based detection and monitoring of cell‑free tumor DNA in peripheral blood of cancer patients. Anal Biochem 2013; 433: 227–234.
- [12] Bin H, Youli Z. Detecting circulating tumor cells: current challenges and new trends. Theranostics 2013; 3: 377–394.
- [13] Ignatiadis M, Lee M, Jeffrey SS. Circulating tumor cells and circulating tumor DNA: challenges and opportunities on the path to clinical utility. Clin Cancer Res 2015; 21: 4786–4800.
- [14] Krebs MG, Hou JM, Sloane R, et al. Analysis of circulating tumor cells in patients with non‑small cell lung cancer using epithelial marker‑dependent and ‑independent approaches. J Thorac Oncol 2012; 7: 306–315.
- [15] Mok T, Wu Y, Lee JS, et al. Detection and dynamic changes of EGFR mutations from circulating tumor DNA as a predictor of survival outcomes in NSCLC patients treated with first‑line intercalated erlotinib and chemotherapy. Clin Cancer Res 2015; 21: 3196–3203.
- [16] Ramalingam S, Yang JC, Lee CK, et al. Osimertinib as first‑line treatment for EGFR mutation‑positive advanced NSCLC: updated efficacy and safety results from two phase I expansion cohorts. Presented at: 2016 European Lung Cancer Conference; April 13–16, 2016; Geneva, Switzerland. Abstract LBA 1.
- [17] AZD9291 Versus Gefitinib or Erlotinib in Patients With Locally Advanced or Metastatic Non‑small Cell Lung Cancer. NCT02296125. Dostupné na: https://www.clinicaltrials.gov/ct2/results?term =NCT02296125
- [18] Ho CC, Liao WY, Lin CA, et al. Brief report: acquired BRAF V600E mutation as resistant mechanism after treatment with osimertinib. J Thorac Oncol 2016; pii: S15560864(16)33539‑0.
- [19] Ou SH, Agarwal N, Ali SM. High MET amplification level as a resistance mechanism to osimertinib (AZD9291) in a patient that symptomatically responded to crizotinib treatment post‑osimertinib progression. Lung Cancer 2016; 98: 59–61.
- [20] Ortiz‑Cuaran S, Scheffler M, Plenker D, et al. Heterogeneous mechanisms of primary and acquired resistance to third‑generation EGFR inhibitors. Clin Cancer Res 2016; 22: 4837–4847.
- [21] Wang S, Song Y, Yan F, Liu D. Mechanisms of resistance to third‑generation EGFR tyrosine kinase inhibitors. Front Med 2016; 10: 393–388.
- [22] Steuer CE, Khuri FR, Ramalingam SS, et al. The next generation of epidermal growth factor receptor tyrosine kinase inhibitors in the treatment of lung cancer. Cancer 2015; 121: E1–6.
- [23] Thress KS, Paweletz CP, Felip E, et al. Acquired EGFR C797S mutation mediates resistance to AZD9291 in non‑small cell lung cancer harboring EGFR T790M. Nat Med 2015; 21: 560–562.