Koncept léčiv nevhodných ve stáří – farmakologické a farmakoepidemiologické aspekty
Předepisování léčiv v klinické praxi se obvykle řídí standardními terapeutickými postupy s doporučenými indikacemi, kontraindikacemi a dávkováním. Bohužel znalosti klinické farmakologie jsou zřídka využívány v terapeutické rozvaze nad účinností a bezpečností léčiv. V praxi se často setkáváme s nevhodnou preskripcí u seniorů. Kromě nedostatečné erudice lékaře přitom sehrávají významnou úlohu i neracionální rozhodnutí založená na vlastním přesvědčení o účinnosti léčiva, tlacích farmaceutických firem, požadavcích nemocného na předepsání určitého léku apod. Klinický význam tohoto problému dokumentuje několik studií. Například Lipton a kol. prokázali chyby v preskripci u 59 % nemocných při rozboru lékové anamnézy u 236 starých pacientů. Schmader a kol. zjistili preskripci léků bez oprávněné indikace u 55 % z 208 seniorů, užití neúčinného léku v 32,7 % případů a 16,8 % lékových duplikací. Individuálně posouzená léčba „šitá na míru“ konkrétnímu nemocnému je přitom důležitá právě u starých pacientů. Lékař předepisující seniorům musí zvažovat řadu fyziologických, farmakokinetických a farmakodynamických změn ve stáří [2], respektovat interakční potenciál podávaných léčiv (lékové interakce, interakce lék–nemoc), brát v úvahu compliance nemocného a jeho sociální situaci. Dalším úskalím pro lékaře jsou i nespecifické „geriatrické syndromy“, například nestabilita, pády, zmatenost, deprese, kognitivní dysfunkce nebo ztráta soběstačnosti, které mohou být zhoršeny nebo vyvolány užívanou medikací. Chybná diagnostika takových polékových reakcí vede k předepsání dalších léčiv (jev označovaný jako „preskripční kaskáda“ [3]) a k polypragmazii. Proto je geriatricky zaměřená medicína orientována nejen na správnou léčbu onemocnění s minimalizací polékových reakcí, ale především na zvýšení funkčních schopností, soběstačnosti pacienta a zlepšení celkové kvality života. Bezpečná a účinná preskripce je jedním z pěti nejvýznamnějších problémů kvality péče ve stáří [1, 4].
Nejčastější problémy v geriatrické preskripci
Chybám v preskripci u starších nemocných byla v České republice na rozdíl od zahraničí věnována menší pozornost, o čemž svědčí i nedostatečná terminologie nejčastějších preskripčních chyb. Dle zahraniční literatury jsou chyby v geriatrické preskripci klasifikovány do 3 oblastí:
1. ‑Overprescribing, tj. nadužívání, resp. nadměrné užívání léků. Do tohoto okruhu zahrnujeme neoprávněnou indikaci léčiva, polypragmazii a podávání vysokých dávek léčiva. (Pozor, u řady léků se může jednat o tzv. dávku „standardní", podávanou spíše ve středním věku).
2. ‑Underprescribing, tj. podužívání léků. Zahrnuje situace, kdy přes prokázaný přínos není indikované léčivo seniorům podáváno a/nebo je poddávkováno.
3. ‑Inappropriate prescribing, tj. nevhodné předepisování léků. Tento problémový okruh se soustřeďuje na užívání léčiv potenciálně rizikových ve stáří (z anglického inappropriate drugs, inappropriate medications). Zahrnuje dále širší problematiku lékových interakcí a interakcí lék–nemoc [1].
Koncept nevhodné preskripce a nevhodných léčiv u seniorů
Standardní kritéria léčiv potenciálně nevhodných ve stáří byla vytvořena počátkem 90. let minulého století a reagovala na vysoký výskyt rizikové preskripce v ošetřovatelských ústavech v USA. Tato kritéria uvádějí léčiva, u nichž riziko podávání ve stáří významně převyšuje prospěšnost léčby nebo která jsou neúčinná. Jedná se o kritéria věkově specifická, tj. určená pro starší nemocné ve věku 65 let a více. Většinu těchto léčiv jsou lékaři zvyklí předepisovat pacientům středního věku bez významných komplikací. V geriatrické praxi však mohou tato potenciálně nevhodná léčiva vést k častějším a/nebo závažným polékovým reakcím, negativně ovlivňovat funkční stav, kvalitu života a prognózu nemocného. Jejich potenciální riziko spočívá ve změnách farmakokinetiky a farmakodynamiky ve stáří a vyšším interakčním potenciálu při indikaci seniorům s častou polymorbiditou a polyfarmakoterapií. Paušální podávání těchto léčiv je neracionální, neboť na farmaceutickém trhu jsou široce dostupná bezpečnější léčiva pro většinu starých nemocných [5, 7, 8].
Všechna dosud publikovaná kritéria léčiv potenciálně nevhodných ve stáří (Beersova kritéria z roku 1991 [6], 1997 [7] a 2003 [5] a McLeodova kritéria z roku 1997 [8]) shrnují 3 základní oblasti nevhodné preskripce:
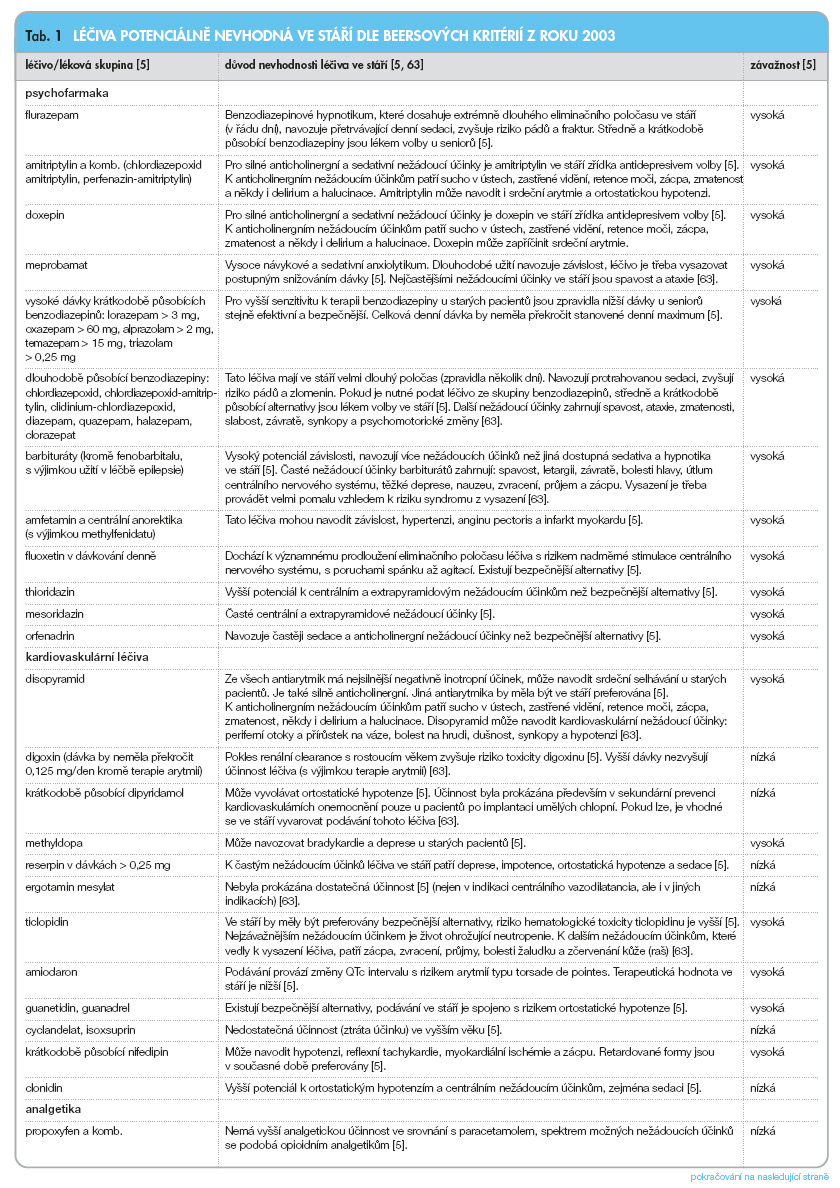
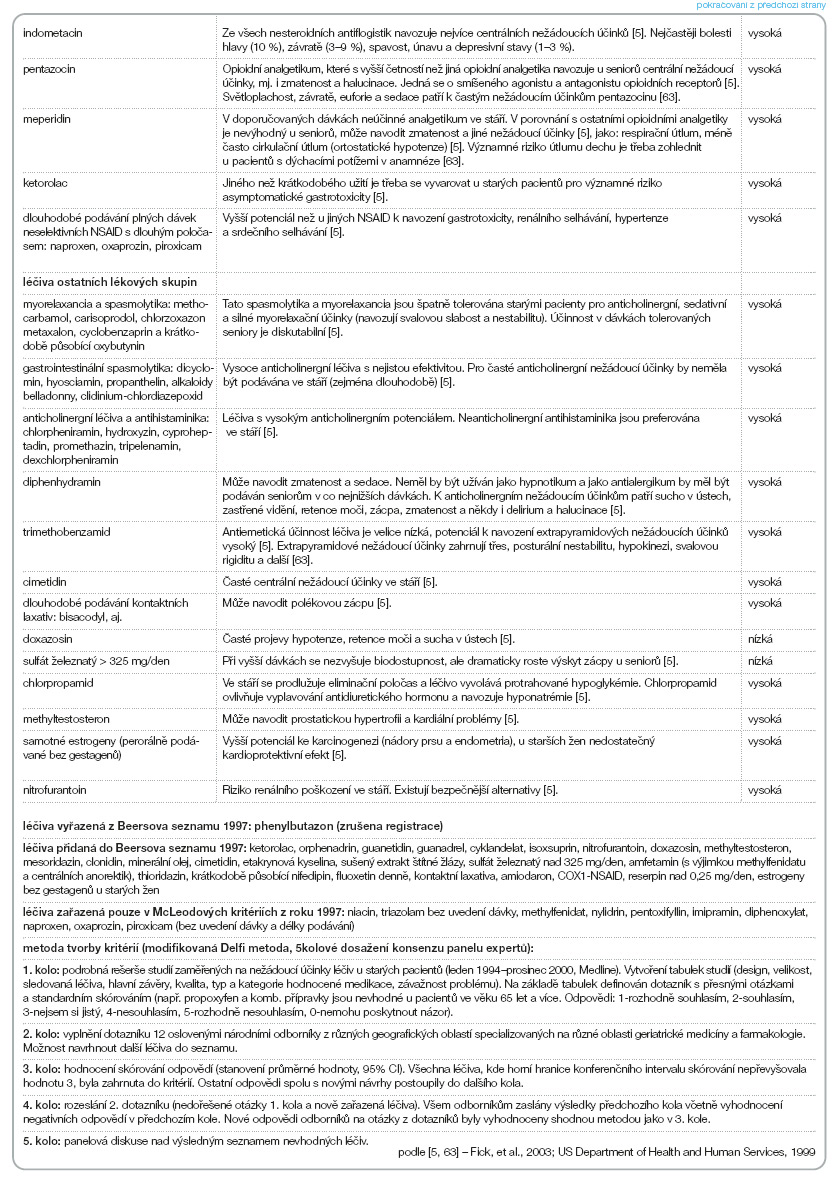
a) ‑léčiva potenciálně nevhodná ve stáří, kterých je třeba se vyvarovat u seniorů pro neúčinnost nebo vysoké riziko polékových komplikací (tab. 1);
b) ‑léčiva, kterých je třeba se vyvarovat u specifických onemocnění vzhledem k častým interakcím mezi lékem a nemocí;
c) ‑seznam závažných lékových interakcí.
Kritéria léčiv nevhodných ve stáří
První kritéria léčiv nevhodných ve stáří pocházejí z USA a byla formulována v roce 1991 [6] explicitně na základě konsenzu pracovní skupiny odborníků z oblasti akutní, ambulantní a dlouhodobé geriatrické péče se specializací v psychofarmakologii, farmakoepidemiologii, aplikované geriatrické farmakologii a geriatrické medicíně. Tato tzv. Beersova kritéria 1991 byla původně určena pro hodnocení preskripce seniorům v ošetřovatelských ústavech. Jejich cílem bylo edukovat předepisující lékaře a snížit vysoké a diskriminující podávání rizikových léčiv v ošetřovatelských zařízeních. V roce 1997 byla tato kritéria upravena pro všechny geriatrické pacienty nezávisle na typu poskytované péče, tzv. Beersova kritéria 1997 [7]. Zahrnovala 18 léků/lékových skupin potenciálně nevhodných ve stáří, 14 interakcí lék–nemoc a 4 lékové interakce.
Léčiva uvedená v Beersově seznamu z roku 1997 byla skupinou odborníků kolem Zhana v roce 2001 dále klasifikována podle rizikovosti do tří skupin [9]:
1. ‑léčiva, kterých je třeba se vždy vyvarovat při podávání seniorům;
2. ‑léčiva vhodná pouze ve výjimečných situacích;
3. ‑léčiva, která mají své indikace ve stáří, ale jsou obvykle chybně předepisována.
V roce 1997 byla publikována kanadská expertní kritéria léčiv potenciálně nevhodných ve stáří, McLeodova kritéria [8]. Za léčiva nevhodná ve stáří byla v těchto kritériích definována:
1. ‑léčiva, jejichž preskripce ve stáří představuje klinicky významné riziko závažných nežádoucích reakcí;
2. ‑léčiva, k nimž jsou pro většinu pacientů dostupné stejně nebo více účinné a méně rizikové lékové alternativy;
3. ‑léčiva, pro která platí, že změna jejich preskripce vede k významnému poklesu nemocnosti v populaci seniorů.
Kanadská kritéria zahrnují 18 léčiv/lékových skupin potenciálně nevhodných ve stáří, 16 interakcí lék–nemoc a 4 lékové interakce. Shodují se s Beersovým seznamem 1997 ve 13 nevhodných léčivech/lékových skupinách, 6 interakcích lék–nemoc a 2 lékových interakcích. Odlišnosti nevyjadřují pouze rozdílný postoj odborníků, ale též odlišné spektrum registrovaných léčiv a specifické preskripční zvyklosti v Kanadě. Například pentoxifyllin byl zařazen v kanadských kritériích pro v té době častou a neoprávněnou indikaci v terapii kognitivních dysfunkcí a demencí, kde je považován za neúčinný. K dalším léčivům, která se nově objevila v expertních kanadských seznamech, patřil např. doxepin (vysoce anticholinergní tricyklické antidepresivum), piroxicam (nesteroidní antiflogistikum se změnami farmakokinetiky ve stáří a významným gastrotoxickým potenciálem) a další léčiva (viz legenda k tab. 1).
Nejnovější expertní kritéria publikovaná v roce 2003 Fickovou a kol. [5] doplňují Beersova kritéria z roku 1997 a bývají označována jako tzv. Beersova kritéria 2003. Obsahují 48 léčiv potenciálně nevhodných ve stáří a 20 interakcí mezi lékem a nemocí. Jsou založena na nových vědeckých důkazech a u řady léčiv upřesňují podmínky jejich „nevhodnosti" při podávání ve stáří (dávku, délku doby podávání, specifické indikace) (tab. 1). Odrážejí přísun nových léčiv na farmaceutický trh v USA (do roku 2000), stažení řady léků a novější poznatky o účinnosti a bezpečnosti farmakoterapie ve stáří.
Jelikož všechna kritéria jsou vytvořena pro dané podmínky panující v nabídce trhu (a mnohdy i v geografických preskripčních zvyklostech), je třeba iniciovat snahy o vytvoření standardních kritérií odrážejících specifickou situaci v dalších zemích (v jiných podmínkách mohou být registrována jiná nevhodná léčiva). Jelikož Beersova kritéria 1997 uvádějí léčiva potenciálně riziková u všech seniorů bez ohledu na geografickou oblast, neměla by být tato léčiva plošně užívána ani v jiných zemích [10].
Beersova kritéria podobně jako terapeutická doporučení byla v minulosti kritizována pro přílišnou jednoduchost [11, 12]. Jejich koncept je však postaven na znalostech geriatrické farmakologie a farmakoepidemiologie a tato kritéria zvyšují obezřetnost lékařů k neuvážené indikaci rizikových léčiv ve stáří [5].
Studie v USA a v Kanadě zjistily časté užití nevhodných léčiv u seniorů v ošetřovatelských ústavech i v domácnostech (14–40 % případů) [9, 10, 13]. Současná metaanalýza 17 observačních studií také prokázala, že polékové hospitalizace jsou ve stáří časté a tvoří 6,6–41,3 % nemocničních příjmů v USA (hodnoceny byly studie o počtu 100–1 988 hospitalizací) [14]. V roce 1999 přijala americká agentura HCFA (Health Care Financing Administration) opatření, kterým omezila používání vysoce rizikových léčiv v dlouhodobé péči. Tato léčiva měla být nahrazena bezpečnějšími alternativami. Nevhodná léčiva s nižším rizikem se dostala do kompetence klinických farmaceutů s nutností pravidelné a podrobné revize lékového režimu [15]. Současné studie dokládají, že užití nevhodných léčiv má významný epidemiologický a ekonomický dopad a souvisí s vyšším výskytem polékových reakcí [16], horšením soběstačnosti u seniorů [17, 18], častějšími hospitalizacemi ve stáří [19] a vyšší spotřebou ambulantní péče i celkových nákladů [20].
Expertní kritéria léčiv nevhodných ve stáří nebyla vytvořena pouze na základě diskuse jednotlivých specialistů. Byla stanovena vědeckou metodou označovanou jako modifikovaná Delfi metoda (RAND corp., Kalifornie, USA) [5, 21] (viz legenda k tab. 1) , která umožňuje konsenzus odborníků různých oborů nad problematikou bez dostatečných vědeckých důkazů (geriatrická farmakoterapie k těmto oblastem patří vzhledem k malému počtu dvojitě slepých randomizovaných kontrolovaných studií).
Již výše bylo zmíněno, že rozpaky nad konceptem nevhodných léčiv vznikají na základě neznalostí geriatrické farmakologie a geriatrické farmakoepidemiologie, tedy posuzováním konceptu očima klasické interní medicíny. Další nedorozumění spočívá v „absolutním" přijetí expertních kritérií. Sami autoři upozorňují, že léčiva jsou označena jako potenciálně nevhodná ve stáří nikoliv proto, že by nebyla spojena s významným rizikem, ale proto, že tato doporučení „nesmí vést současnou klinickou praxi směrem, kdy paušální podání či nepodání léku je upřednostněno před komplexním, detailním a farmakologicko-epidemiologickým rozborem medikace pacienta" [5]. V situacích, kdy jsou bezpečnější alternativy neúčinné, nedostupné nebo nejsou tolerované pacientem, je nezbytné přikročit k podání rizikovější léčby (samozřejmě za zvýšené opatrnosti lékaře a monitorování stavu nemocného).
Změny farmakokinetiky, farmakodynamiky a homeostázy souvisí více s věkem fyziologickým než chronologickým a není pravdou, že u všech pacientů ve věku 65 let a více jsou přítomny farmakologické změny. Komplikace léčby při podávání léčiv potenciálně nevhodných ve stáří však hrozí i při náhlých změnách zdravotního stavu, které jsou u seniorů časté, například při dehydrataci, závažnější infekci, renálním selhávání atd. Z tohoto důvodu jsou vždy bezpečnější méně rizikové lékové alternativy.
V další části tohoto sdělení uvedeme několik vybraných příkladů nevhodných léčiv z oblasti kardiovaskulární, u nichž se podrobně zamýšlíme nad nevhodností indikace a/nebo dávky u starších nemocných
Digoxin – léčivo nevhodné ve stáří v dávkách ≥≥ 125 mg/den u pacientů bez arytmií [5]
Podle současných terapeutických postupů je digoxin v dlouhodobé terapii ve stáří vhodně indikován u pacientů se systolickým srdečním selháváním, kde kombinovaná terapie inhibitory ACE, b-blokátory a diuretiky nevede ke kontrole symptomů, a v terapii síňových fibrilací [22].
Pro první z indikací byla studiemi potvrzena dostatečná účinnost dávek ≤ ≤125 mg/den ve stáří a tyto dávky by neměly být u starých pacientů překračovány. Výjimkou jsou pacienti s rychlou eliminací digoxinu navozenou např. indukcí P-glykoproteinového transportu nebo nemocní, u nichž je digoxin indikován ke kontrole fibrilace síní [23]. Účinné terapeutické koncentrace digoxinu v léčbě chronického srdečního selhávání jsou ve stáří obvykle nižší (0,7–2,0 ng/ml) než u pacientů středního věku (2–3 ng/ml). Vyšší je senzitivita myokardiální Na+/K+ pumpy na působení digoxinu, což je vysvětlováno zvýšenou koncentrací Na+/K+-adenozin trifosfatázy ve stárnoucím myokardu, poklesem rezervní kapacity sodíkové pumpy a zvýšením intracelulární koncentrace kalcia [24, 25].
Nejen farmakodynamika, ale i farmakokinetika digoxinu se stárnutím organismu mění (zejména distribuce a eliminace léčiva). S poklesem celkové tělesné vody ve stáří klesá při nezměněné biologické dostupnosti distribuce digoxinu (jedná se o hydrofilní léčivo s vysokým distribučním objemem 4–7 l/kg). Snižuje se i depozice digoxinu ve svalové tkáni (u pacientů středního věku až 50 % biodostupného léčiva je vázáno na myokardiální a příčně pruhovanou svalovinu, kde tvoří neúčinné depo) [26]. Zastoupení svalové tkáně s rostoucím věkem klesá přibližně o 20 % mezi 20. a 70. rokem života, a snižuje se tak vazba digoxinu na svalovou tkáň [27]. U imobilních pacientů je tato vazba ještě dále snížena [23]. Nedistribuované léčivo zůstává ve vyšších volných koncentracích v plazmě. Vazba digoxinu na plazmatický albumin je nízká, 20–30 %, a s věkem se významně nemění. Roste tak podíl farmakodynamicky účinné volné frakce [25, 28].
60–80 % biodostupného digoxinu je eliminováno glomerulární filtrací a tubulární sekrecí. Rychlost obou procesů významně klesá s rostoucím věkem. U seniorů byl zaznamenán nárůst eliminačního poločasu z 30–40 hod. až na 4–6 dní, což při neredukovaném denním dávkování vede ke kumulaci léčiva. Ustálený stav může nastat za dobu delší než jeden týden, a to za 2–3 týdny. K riziku toxicity přispívá i skutečnost, že změny renální eliminace zpravidla nekorelují se změnami plazmatických hladin kreatininu. V jedné ze studií byl pozorován pokles clearance digoxinu až o 65 % při snížení plazmatického kreatininu pouze o 0,07 mg/dl. Při hodnocení renálních funkcí je třeba vycházet z odhadu renální clearance (např. výpočtu clearance podle Cocroftova-Gaultova vzorce) [26, 29].
Vysoký interakční potenciál digoxinu také významně komplikuje léčbu [30]. Toxicita byla popsána především při kombinacích s léčivy zpomalujícími vedení AV-uzlem (např. amiodaronem, verapamilem, chinidinem), zvyšujícími biodostupnost digoxinu (některá antibiotika – např. ketoconazol), s inhibitory P-glykoproteinového transportu [31, 32] a v souvislosti s komorbiditami častými ve stáří (při renálním a srdečním selhávání, hypokalémii apod.) [30].
Amiodaron
Amiodaron je v USA registrován k terapii život ohrožujících ventrikulárních arytmií, v Evropě se terapeuticky užívá i ke konverzi síňové fibrilace, neboť nedávné studie prokázaly jeho významnou účinnost téměř u všech typů síňových arytmií. Šance dosáhnout sinusového rytmu je při podávání amiodaronu 6x vyšší než u placebové skupiny (83 % úspěšných případů) a účinnost léčby srovnatelná s flecainidem a vyšší než u propafenonu [33].
Terapie amiodaronem však může být spojena se závažným rizikem toxicity. U seniorů byl výskyt nežádoucích účinků zaznamenán až v 90 % případů. Stáří je rizikovým faktorem tyreopatií navozených amiodaronem a hepatotoxicita po amiodaronu významně souvisí s chronickým srdečním selháváním (komorbiditou častou ve stáří). Krátkodobou toxicitu (bradykardie, hypotenze, poruchy zraku, nevolnost, zácpa a flebitida po i.v. podání) lze lépe předvídat než dlouhodobou toxicitu (plicní fibróza, depozita v oční rohovce, hepatopatie a tyreopatie) [34]. Dlouhodobá toxicita je podmíněna dlouhým eliminačním poločasem léčiva (35–110 hod.), vysokou lipofilitou a kumulací parentní látky i metabolitů v tukové tkáni, plicích, kůži a ostatních tkáních (z metabolitů zejména N-desethylamiodaronu). Navíc jaterní eliminace (99 % léčiva) s rostoucím věkem klesá a prodlužuje se eliminační poločas léčiva [35]. Antiarytmický účinek již po několika dnech podávání nekoreluje s podávanou dávkou a koncentrací amiodaronu a odpovídá spíše míře kumulace metabolitu N-desethylamiodaronu [36]. Potenciální toxicita léčiva je tedy zejména ve stáří obtížně předvídatelná.
Parentní látka i aktivní metabolit autoinhibují vlastní metabolismus a vstupují do řady metabolických interakcí [37]. Amiodaron je substrátem jaterního izoenzymu CYP2C8 a jaterního i intestinálního izoenzymu CYP3A4; středně silným inhibitorem CYP2D6, CYP3A4 a P-glykoproteinového transportu a slabým inhibitorem CYP2C8. N-desethylamiodaron inhibuje široké spektrum enzymatických systémů (středně silně izoenzymy CYP2D6 a CYP2C9, slabě izoenzymy CYP1A2, CYP2C19, CYP3A4, CYP2A6 a CYP2B6). Pozornost je třeba věnovat warfarinizovaným nemocným, kde amiodaron zvyšuje riziko krvácení, a uživatelům léčiv prodlužujících QTc interval, kde hrozí riziko život ohrožujících arytmií typu torsade de pointes (časté např. při kombinaci amiodaronu s chinidinem) [38].
Randomizované kontrolované studie CAMIAT a EMIAT [39, 40] dokumentovaly významný pokles úmrtnosti na srdeční arytmie při terapii amiodaronem, ale neprokázaly snížení celkové úmrtnosti. U rizikových starých nemocných je proto užití amiodaronu v prevenci fibrilace síní vyhrazeno pouze při netoleranci nebo neúčinnosti předchozí antiarytmické léčby a u nemocných, kde nebyla prokázána strukturální srdeční vada [34]. Terapie musí být vedena v nejnižších účinných dávkách s obezřetným monitorováním nežádoucích účinků léčby. Preventivní podávání není indikováno u pacientů se sníženou ejekční frakcí nebo komplexními arytmiemi. Doporučení užít amiodaron za specifických situací vycházejí z předpokladu, že v randomizovaných studiích amiodaron nesnížil, ale ani významně nezvýšil celkovou mortalitu [41].
Centrální antihypertenziva – clonidin, guanabenz, guanfacin, methyldopa
Centrální aktivace sympatiku je považována za důležitou etiopatogenetickou příčinu hypertenze, metabolického syndromu, hypertrofie levé komory srdeční a náhlé srdeční smrti. Mechanismus působení moderních centrálních antihypertenziv moxonidinu a rilmenidinu spočívá v agonizaci centrálních imidazolových I1-receptorů, zatímco starší antihypertenziva (clonidin, guanfacin, guanabenz a methyldopa) ovlivňují sympatikotonus působením na presynaptické nebo postsynaptické a2-receptory [42] (u clonidinu a guanabenzu byla prokázána také velmi nízká aktivita i k I1-receptorům).
Rozdílná selektivita generací centrálních antihypertenziv odpovídá za jejich odlišnou terapeutickou hodnotu ve stáří. Poměr disociačních konstant (Ki) pro I1- receptory a a2-adrenoreceptory je u moxonidinu a rilmenidinu významně vyšší – 32,6 a 29,5 – než u clonidinu a guanabenzu (pouze 3,8 a 0,0007) [43]. Zatímco rilmenidin a moxonidin příznivě ovlivňují inzulinovou rezistenci a některé typy dyslipidémií, starší generace centrálních antihypertenziv (převážně a2-agonisté) nedisponuje těmito vlastnostmi a navozuje řadu nežádoucích účinků, k nimž jsou predisponováni zejména senioři (sedace, ortostatická hypotenze, depresivní syndrom, kognitivní dysfunkce) [44].
Sucho v ústech, spavost a zácpa u pacientů nad 65 let byly pozorovány 2–3x častěji při terapii clonidinem než rilmenidinem a moxonidinem [45]. Také při podávání methyldopy byl výskyt sedativních, anticholinergních a hypotenzních nežádoucích účinků častější než u pacientů léčených rilmenidinem (pocit slabosti u 7/0 subjektů, ortostatická hypotenze 11/2, denní sedace 16/4, bolesti hlavy 15/6). Zaznamenán byl i trend k častějšímu výskytu depresí a kognitivních dysfunkcí u uživatelů methyldopy [46].
Stimulací centrálních a2-adrenoreceptorů dochází k usnadnění parasympatického přenosu, posílení baroreflexů a snížení srdeční frekvence (ovlivněny jsou především impulsy z objemových a tlakových baroreceptorů a chemoreceptorů odpovídajících za reakci na hypoxii). Při náhlém vysazení dlouhodobé léčby (např. nedodržením doporučení lékaře) nastává rebound fenomén s prudkým vzestupem krevního tlaku již během prvního dne po vysazení [47]. U agonistů imidazolových I1-receptorů naopak přetrvává účinek zpravidla týden po vysazení a rebound fenomén je vzácným jevem [43]. Vzestup krevního tlaku po náhlém vysazení clonidinu na konci prvního dne dosáhl až 14 % původních hodnot, zatímco u moxonidinu pouze 6 % (p < 0,01) [45].
Agonisté centrálních a2-receptorů nepřinášejí významnější benefit ve srovnání s jinými antihypertenzivy, ale negativně ovlivňují kvalitu života ve stáří častým výskytem nežádoucích účinků (xerostomie, impotence, únavy a spavosti během dne, psychomotorické sedace, deprese, snížení verbální paměti (methyldopa, clonidin), poruch spánku až děsivých snů, posturální hypotenze). K lékům volby u seniorů proto patří antihypertenziva s vyšší terapeutickou hodnotou (inhibitory ACE, diuretika, blokátory Ca a b-blokátory) [48].
Ticlopidin
Účinnost ticlopidinu byla dostatečně prokázána v randomizovaných dvojitě slepých placebem kontrolovaných studiích. U pacientů s tranzitorními ischemickými atakami (TIA) nebo po lehké cévní mozkové příhodě (CMP) ticlopidin (500 mg/den) ve srovnání s vysokými dávkami aspirinu (1 300 mg/den) významně snížil riziko další fatální a nefatální cévní mozkové příhody o 21 % a riziko úmrtí a nefatální CMP z jakékoliv příčiny o 12 % (studie TASS, Ticlopidine Aspirin Stroke Study) [49]. Jiná multicentrická studie (CATS, Canadian American Ticlopidine Study) [50] prokázala, že u pacientů po závažné CMP došlo ke snížení rizika rekurentní CMP, infarktu myokardu (IM) a vaskulární smrti o 30 % u uživatelů ticlopidinu. Incidence závažných nežádoucích reakcí vedoucích k vysazení léčiva však byla v obou studiích častá – průjem u 20 %, raš kůže 14% a těžká ireverzibilní neutropenie u ≤≤ 1 % pacientů.
V době uvedení ticlopidinu na trh v USA v roce 1991 obsahovala příbalová informace přípravku varování, že u uživatelů ticlopidinu se v předregistračních studiích vyskytly závažné hematologické komplikace – lehká neutropenie u 2,4 %, těžká neutropenie až agranulocytóza u 0,8 %. Již po 4 letech (v roce 1995) byly tyto informace doplněny z hlášení nežádoucích účinků o další nežádoucí účinky – pancytopenii, trombocytopenii, trombocytopenickou purpuru a aplastickou anémii [51]. Autoři španělské studie sledující výskyt polékové komunitní agranulocytózy u pacientů přijatých k hospitalizaci na hematologické jednotky v Barceloně zjistili, že léčivem nejsilněji asociovaným s výskytem agranulocytózy u ambulantních pacientů byl právě ticlopidin (OR = 103,2 (95% CI, 12,7–837,4), dále calcium dobesilat (OR = 77,84) a tyreostatika (OR = 52,8) (analýza 78,7 milionů pacientoroků s rozborem 177 komunitních agranulocytóz; studie případů a kontrol, 586 kontrol stejného věku, pohlaví a stejného zdravotnického zařízení). Riziko hematologické toxicity bylo významně vyšší u seniorů [52].
Přes doloženou účinnost ticlopidinu je třeba mít na paměti při jeho indikování ve stáří, že současné odhady udávají výskyt hematologických komplikací u seniorů v jednotkách procent a farmakokinetika a farmakodynamika léčiva je u seniorů obtížně předvídatelná. Terapeutický účinek ticlopidinu nekoreluje s plazmatickými hladinami ani parentní látky, ani aktivního metabolitu 2-hydroxyticlopidinu a není známo, jakým způsobem upravovat dávkování u pacientů s těžším renálním nebo hepatálním selháváním při zachování účinnosti léčby. Eliminační poločas (v začátku terapie 8 hod.) se s délkou léčby prodlužuje na 30–50 hod. I po vysazení účinné látky trvá její eliminace z organismu 10–14 dní a z tohoto důvodu je třeba monitorovat hematologické změny nejen každé 2–3 týdny v prvních 3 měsících terapie, ale také 2–3 týdny po vysazení léčby [53, 54].
Hematotoxicitu mohou signalizovat známky infekce nebo klinické a laboratorní změny (pokles hematokrytu, leukocytopenie, neutropenie pod 70 % původních hodnot, hematurie, petechie, teplota, infekce). Toxicita se může manifestovat dokonce náhlým septickým stavem, který rychle ustupuje po vysazení léčiva [55].
Ticlopidin inhibuje agregaci trombocytů indukovanou adenozindifosfátem a následně i produkci lokálních aktivačních faktorů, mírně brání i agregaci destiček po stimulaci adrenalinem, faktorem aktivujícím trombocyty a kolagenem. Jeho mechanismus účinku je shodný s clopidogrelem, který na rozdíl od ticlopidinu navozuje reverzibilní inhibici trombocytů a pravděpodobně vede k nižšímu výskytu závažných hematologických komplikací – neutropenie byla ve studii CAPRIE pozorována u 0,1 % nemocných (incidence srovnatelná s aspirinem) [56]. Studie CAPRIE (Clopidrogel versus Aspirin in Orient at Risk for Ischemic Events) sledující 19 000 subjektů po CMP, infarktu myokardu nebo s periferní vaskulární nemocí v anamnéze prokázala při terapii clopidrogelem (75 mg/den) ve srovnání s aspirinem (325 mg/den) snížení relativního rizika ischemické CMP, IM a vaskulární smrti (kombinovaný výstup) o 8,7 %. Vyšší účinnost clopidogrelu byla zaznamenána v prevenci IM (snížení relativního rizika o 19,2 %) než v prevenci CMP a vaskulární smrti (5,2 %, 7,6 %) [57]. Při intoleranci nebo neúčinnosti aspirinu je clopidogrel doporučován jako bezpečnější alternativa ticlopidinu (terapie nemusí být monitorována a je např. v USA i s ohledem na cenu přípravku méně nákladná).
Krátkodobě působící dipyridamol
Dipyridamol působí jako regulátor adenozinu a inhibitor fosfodiesterázy. Ve Spojených státech bylo toto léčivo podáváno (nejdříve v neretardované formě) jako antiagregans více než 40 let, ačkoliv jeho účinnost v sekundární prevenci kardiovaskulárních onemocnění byla zpochybňována. Řada provedených studií nezaznamenala významné snížení TIA, CMP nebo mortality při užití dipyridamolu samotného ani v kombinaci s aspirinem. Jeho užití v sekundární prevenci ischemické CMP v USA bylo tak po řadu let spíše empirické, nepodložené skutečnými důkazy [58, 59]. Nevhodnost krátkodobě působícího dipyridamolu ve stáří je přisuzována zejména častým komplikacím léčby – ortostatickým hypotenzím až myokardiální ischémii v důsledku reflexní tachykardie [53].
Po řadě neúspěšných studií demonstrovala European Stroke Prevention Study 2 (ESPS-2) účinnost retardovaného dipyridamolu v sekundární prevenci. Dipyridamol 200 mg/den při srovnání s aspirinem 50 mg/den snížil riziko další CMP o 16 %, při srovnání s placebem o 18 %, přičemž účinek aspirinu a dipyridamolu byl aditivní (37% pokles další CMP při kombinované léčbě ve srovnání s placebem) [60]. Účinnost byla potvrzena zejména u pacientů po implantaci umělých chlopní. Některé studie však neprokázaly významně vyšší účinnost retardovaného dipyridamolu než nízkodávkovaného aspirinu [61]. Přidání retardovaného dipyridamolu k aspirinu nebo užití kombinovaného preparátu může být terapeutickou možností v případě, že pacient vykazuje tranzitorní ischemické ataky i při léčbě nízkodávkovaným aspirinem. Kombinovaná terapie nezvyšuje významně riziko krvácení [62].
Závěr
Řada léků mění svůj přínos a riziko ve stáří a některá z těchto léčiv jsou identifikována expertními kritérii jako léčiva potenciálně nevhodná pro staré pacienty. V České republice nebyla této problematice dosud věnována dostatečná pozornost a tato práce jako první shrnuje pro naši klinickou praxi existující doporučení zahraničních odborníků.
Expertní kritéria zaměřují pozornost lékařů k léčivům, jejichž podávání je rizikovější ve vyšším než středním věku a jejichž užití v geriatrické praxi může být spojeno se závažnými komplikacemi. Tyto léky by měly být vyhrazeny pouze pro specifické situace. Jejich podávání je racionální u pacientů netolerujících bezpečnější léčbu nebo tam, kde bezpečnější léčiva nebyla dostatečně účinná. V případě užití potenciálně nevhodných léčiv je nutné pravidelně revidovat terapii a věnovat velkou pozornost situacím, které mohou vést k toxicitě léčiva.
Seznam použité literatury
- [1] Hanlon JT, Schmader KE, Ruby CM, Weinberger M. Suboptimal prescribing in older inpatients and outpatients. J Am Geriatr Soc 2001; 49: 200–209.
- [2] Fialová D, Topinková E. Specifika geriatrické farmakoterapie z pohledu farmakokinetických a farmakodynamických změn ve stáří. Remedia. 2002; 12 (6): 434–440.
- [3] Topinková E, Ficková (Fialová) D. Účinná a bezpečná farmakoterapie ve stáří. Postgraduální medicína 2002; 4: 477–482.
- [4] Brown J, Bowling A, Flynn T. Model of Duality of life: A taxonomy, overview and systematic review of the literature. European Forum Review 2004.
- [5] Fick DM, Cooper JW, Wade WE, Waller JL, Maclean JR, Beers MH. Updating the Beers criteria for potentially inappropriate medication use in older adults. Arch Intern Med 2003; 163: 2716–2724.
- [6] Beers MH, Ouslander JG, Rollingher I, Reuben DB, Brooks J, Beck J. Explicit criteria for determining inappropriate medication use in nursing home residents. Arch Intern Med 1991; 151: 1825–1832.
- [7] Beers MH. Explicit criteria for determining potentially inappropriate medication use by the elderly: an update. Arch Intern Med 1997; 157: 1531–1536.
- [8] McLeod PJ, Huang AR, Tamblyn RM, Gayton DC. Defining inappropriate practices in prescribing for elderly people: a national consensus panel. CMAJ 1997;156: 385–391.
- [9] Zhan C, Sangl J, Bierman AS, et al. Potentially inappropriate medication use in the community-dwelling elderly. JAMA 2001; 286: 2823–2829.
- [10] Fialová D, Topinková E, Gambassi G, et al. Potentially Inappropriate Medication Use Among Elderly Home Care Patients in Europe. JAMA 2005; 293 (11): 1348–1358.
- [11] Avorn J. Improving drug use in elderly patiens: getting to the next level. JAMA 2001; 286: 2866–2868.
- [12] Ruscin JM, Page RL II. Inappropriate prescribing for elderly patients. JAMA 2002; 287: 1264–1265.
- [13] Rochon PA, Lane ChJ, Bronskill SE, et al. Potentially Inappropriate Prescribing in Canada Relative to the US. Drugs Aging 2004; 21 (14): 939–947.
- [14] Beijer HJM, de Blaey CJ. Hospitalisations caused by adverse drug reactions (ADR): a meta-analysis of observational studies. Pharm World Sci 2002; 24 (2): 46–54.
- [15] Hanlon JT, Shimp LA, Semla TP. Recent advances in geriatrics: Drug-related problems in the elderly. Ann Pharmacotherapy 2000; 34: 360–365.
- [16] Onder G, Landi F, Liperoti R, Fialova D, Gambassi G, Bernabei R. Impact of inappropriate drug use among hospitalized older adults. Eur J Clin Pharmacol. 2005; 61(5–6): 453–459.
- [17] Fu AZ, Liu GG, Christensen DB. Inappropriate Medication Use and Health Outcomes in the Elderly. J Am Geriatr Soc 2004; 52: 1934–1939.
- [18] Hanlon JT, Fillenbaum GG, Kuchibhatla M, et al. Impact of inappropriate drug use on mortality and functional status in representative community dwelling elders. Med Care 2002; 40 (2): 166–176.
- [19] Lau DT, Kasper JD, Potter DE, Lyles A, Bennett RG. Hospitalization and death associated with potentially inappropriate medication prescriptions among elderly nursing home residents. Arch Intern Med 2005; 165: 68–74.
- [20] Fick DM, Waller JL, McLean JR, et al. Potentially inappropriate medication use in a Medicare-managed care population: association with higher costs and utilization. J Managed Care Pharm 2001; 7: 407–413.
- [21] Daleky N, Brown B, Cochran S. The Delphi Metod, III: Use of Self Ratings to Improve Group Estimates. Santa Monica, California: Rand Corp; November 1969. Publication RM-6115-PR.
- [22] Gheorghiade M, Adams KF Jr, Colucci WS. Digoxin in the management of cardiovascular disorders. Circulation 2004; 109 (24): 2959–2964.
- [23] Gosselink AT, van Veldhuisen DJ, Crijns HJ. When, and when not to use digoxin in the elderly. Drugs Aging 1997; 10: 411–420.
- [24] Kennedy R, Seilen E. Ouabain-sensitive 86Rb+ uptake rate and responsiveness to digoxin in rat left atrial muscle. J Pharmacol Exp Ther 1989; 248: 104–110.
- [25] Passmore AP, Johnston GD. Digoxin toxicity in the aged. Characterising and avoiding the problem. Drugs Aging 1991; 1: 364–379.
- [26] Hanratty CG, McGlinchey P, Johnston GD, Passmore AP. Differential pharmacokinetics of digoxin in elderly patients. Drugs Aging 2000; 17 (5): 353–362.
- [27] Tarpenning KM, Hamilton-Wessler M, Wiswell RA, Hawkins SA. Endurance training delays age of decline in leg strength and muscle morphology. Med Sci Sports Exerc 2004 ; 36 (1): 74–78.
- [28] Tsang P, Gerson B. Understanding digoxin use in the elderly patient. Clin Laborator Med 1990; 10: 479–492.
- [29] Cusack B, Kelly J, O´Malley K, et al. Digoxin in the elderly: pharmacokinetic consequences of old age. Clin Pharmacol Ther 1979; 25: 772–776.
- [30] Mooradian AD. Digitalis. An update of clinical pharmacokinetics, therapeutic monitoring techniques, and treatment recommendations. Clin Pharmacokinet 1988; 15: 165–179.
- [31] de Lannoy IA, Silverman M. The MDR1 gene product, P-glycoprotein, mediates the transport of the cardiac glycoside, digoxin. Biochem Biophys Res Commun 1992; 189: 551–557.
- [32] Ficková (Fialová) D, Vlček J, Topinková E. Role P-glykoproteinového transportu ve farmakokinetice léčiv a v lékových interakcích. Remedia 2002; 12 (3): 207–213.
- [33] Chatap G, Giraud K, Vincent JP. Atrial Fibrillation in the Elderly. Facts and Management. Drugs Aging 2002; 19 (11): 819–846.
- [34] Williams BR, Kim J. Cardiovascular drug therapy in the elderly: theoretical and practical considerations. Drugs Aging 2003; 20 (6): 445.
- [35] Vadiei K, Troy S, Korth-Bradley J, et al. Population pharmacokinetics of intravenous amiodarone and comparison with two-stage pharmacokinetic analysis. J Clin Pharmacol 1997; 37: 610–617.
- [36] Capucci A, Aschieri D, Villani GQ. Clinical Pharmacology of Antiarrhythmic Drugs. Drugs Aging 1998; 13 (1): 51–70.
- [37] Ohyama K, Nakajima M, Suzuki N, et al. Inhibitory effects of amiodarone and its N-deethylated metabolite on human cytochrome P450 activities: prediction of in vivo drug interactions. Br J Clin Pharmacol. 2000; 49: 244–253.
- [38] Yamreudeewong W, De Bisschop M, Martin LG, Lower DL. Potentially significant drug interactions of class III antiarrhythmic drugs. Drug Saf 2003; 26 (6): 421–438.
- [39] Cairns JA, Connolly SJ, Roberts R, et al. Randomized trial of outcome after myocardial infarction in patients with frequent or repetitive ventricular premature depolarizations: CAMIAT. Canadian Myocardial Infarctions Arrhythmia Trial Investigators. Lancet 1997; 349: 675–682.
- [40] Julian DG, Camm AJ, Frangin G, et al. Randomised trial of effect of amiodarone on mortality in patients with left ventricular dysfunction after recent myocardial infarction: EMIAT. European Myocardial Infarction Amiodarone Trial Investigators. Lancet 1997; 349: 667–674.
- [41] Larsen JA, Kadish AH, Schwartz JB. Proper Use of Antiarrhythmic Therapy for Reduction of Mortality After Myocardial Infarction. Drugs Aging 2000; 16 (5): 341–350.
- [42] Esler M. High blood pressure management: potential benefits of I1 agents. J Hypertens Suppl 1998; 16 (3): S19–24.
- [43] Ziegler D, Haxhiu MA, Kaan EC, Papp JG, Ernsberger P. Pharmacology of moxonidine, an I1-imidazoline receptor agonist. J Cardiovasc Pharmacol 1996; 27 Suppl 3: S26–37.
- [44] Prichard BN, Graham BR. I1 imidazoline agonists. General clinical pharmacology of imidazoline receptors: implications for the treatment of the elderly. Drugs Aging 2000; 17 (2): 133–159.
- [45] Planitz V. Comparison of moxonidine and clonidine HCl in treating patients with hypertension. J Clin Pharmacol. 1987; 27 (1): 46–51.
- [46] Fletcher AE, Beevers DG, Dollery CT, Wilkinson R, Bulpitt CJ. The effects of two centrally-acting anti-hypertensive drugs on the quality of life. Eur J Clin Pharmacol. 1991; 41 (5): 397–400.
- [47] Houston MC. Abrupt discontinuation of antihypertensive therapy. South Med J 1981; 74 (9): 1112–1123.
- [48] Fogari R, Zoppi A. Effect of antihypertensive agents on quality of life in the elderly. Drugs Aging 2004; 21 (6): 377–393.
- [49] Hass WK, Easton JD, Adams HP Jr, Pryse-Phillips W, Molony BA, Anderson S, et al. A randomized trial comparing ticlopidine hydrochloride with aspirine for the prevention of stroke in high risk patients. Ticlopidine Aspirin Stroke Study Group. N Engl J Med 1989; 321: 501–507.
- [50] Gent M, Blakely JA, Easton JD, et al. The Canadian American Ticlopidine Study (CATS) in tromboembolic stroke. Lancet 1989; 1: 1215–1220.
- [51] Wysovski, Diane K. Blood dyscrasias and hematologic reactions in ticlopidine users. JAMA 1996; 276 (12): 952.
- [52] Ibanez L, Vidal X, Ballarin E, Laporte JR. Population-based drug-induced agranulocytosis. Arch Intern Med 2005; 165 (8): 869–874.
- [53] Weinberger J. Adverse effects and drug interactions of antithrombotic agents used in prevention of ischaemic stroke. Drugs 2005; 65 (4): 461–471.
- [54] McTavish D, Faulds D, Goa KL. Ticlopidine. An updated review of its pharmacology and therapeutic use in platelet-dependent disorders. Drugs 1990; 40 (4): 238–259.
- [55] Love BB, Biller J, Gent M. Adverse haematological effects of ticlopidine. Prevention, recognition and management. Drug Saf 1998; 19 (2): 89–98.
- [56] Sharis PJ, Canon CP, Loscalzo J. The antiplatelet effects of ticlopidine and clopidrogel. Ann Intern Med 1998; 129: 394–405.
- [57] CAPRIE Steering Commitee. A randomised, blinded trial of Clopidrogel versus Aspirin in Patients at Risk of Ischemic Events (CAPRIE). Lancet 1996; 348: 1329–1339.
- [58] European Stroke Prevention Study. ESPS Group Stroke 1990; 21 (8): 1122–1130.
- [59] Collaborative overview of randomised trials of antiplatelet therapy – I: Prevention of death, myocardial infarction, and stroke by prolonged antiplatelet therapy in various categories of patients. Antiplatelet Trialists´ Collaboration. BMJ 1994; 8; 308 (6921): 81–106.
- [60] Diener HC, Cunha L, Forbes C, Sivenius J, Smets P, Lowenthal A. European Stroke Prevention Study 2. Dipyridamole and acetylsalicylic acid in the secondary prevention of stroke. J Neurol Sci 1996; 143 (1–2): 1–13.
- [61] Serebruany VL, Malinin AI, Sane DC, Jilma B, Takserman A, Atar D, Hennekens CH. Magnitude and time course of platelet inhibition with Aggrenox and Aspirin in patients after ischemic stroke: the AGgrenox versus Aspirin Therapy Evaluation (AGATE) trial. Eur J Pharmacol. 2004; 24; 499 (3): 315–324.
- [62] Pongracz E, Kaposzta Z. Antiplatelet therapy in ischemic stroke. Expert Rev Neurother. 2005; 5 (4): 541–549.
- [63] US Department of Health and Human Services. Transmittal 12 to the state operation manual. Washington DC: Health Care Financing Administration, Department of Health and Human Services, 1999.