Léčba chronické hepatitidy B v roce 2007
Cíle léčby chronické hepatitidy B jsou v současné době jasné a nepochybné – zabránit progresi choroby k cirhóze a zabránit vzniku závažných komplikací. Riziko komplikací koreluje s hladinou virémie a dobou trvání choroby. Účinná léčba musí proto vést k co možná nejhlubší a pokud možno trvalé supresi virémie. Tohoto cíle lze u omezeného počtu pacientů dosáhnout léčbou peginterferonem . Zbývající pacienti potřebují dlouhodobou či spíše trvalou léčbu syntetickými antivirotiky, jejichž největší nevýhodou je ztráta účinnosti selekcí rezistentních mutací. Současným standardem stále zůstává sekvenční léčba různými antivirotiky, jejichž záměna má být prováděna po průkazu rezistence. Kombinovaná léčba není účinnější z hlediska suprese virémie, ale snižuje frekvenci vzniku rezistentních mutací. Za odůvodněné lze považovat pouze přidání adefoviru k lamivudinu u pacientů s rezistencí na lamivudin. Ostatní kombinovaná léčba by zatím měla zůstat vyhrazena skupinám pacientů, kteří jsou zvlášť ohroženi vznikem rezistence (cirhotici, transplantovaní pacienti), nebo by se měla provádět v rámci klinických studií.
Současný pohled na riziko komplikací chronické HBV infekce
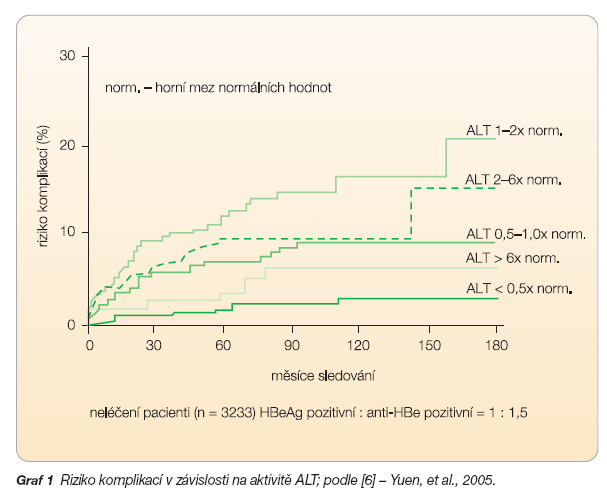
Za nejdůležitější cíle protivirové léčby infekce virem hepatitidy B (HBV) lze považovat zabránění rozvoji závažných komplikací a prodloužení života. V souladu se současnými doporučenými postupy léčby řady národních i mezinárodních hepatologických společností jsou k protivirové léčbě indikováni jen pacienti s aktivitou ALT převyšující dvojnásobek normy a s HBV-DNA >105 kopií/ml. Významný počet pacientů s nižší virémií tak k léčbě indikován není, a tito jsou vystaveni riziku vzniku cirhózy a hepatocelulárního karcinomu. Hodnota HBV-DNA < 105 kopií/ml je historicky odvozena zejména od dolní meze prokazatelnosti virémie hybridizačními metodami (bez amplifikace). Dnes již historická data ukazují, že HBeAg sérokonverze je provázena negativitou HBV-DNA v hybridizační metodě a histologickým zlepšením [1, 2]. Výsledky novějších studií ale ukazují, že riziko vzniku cirhózy a hepatocelulárního karcinomu koreluje s hladinou HBV-DNA. I ve skupině pacientů s hladinou HBV-DNA < 105 kopií/ml je relativní riziko vyšší než v kontrolní skupině bez HBV infekce [3]. Další studie s 3582 neléčenými pacienty s HBV infekcí na Taiwanu již riziko kvantifikovala dle virémie. Relativní riziko cirhózy ve skupině pacientů s virémií v rozmezí 104–105 kopií/ml bylo 2,5 ve srovnání s jedinci bez HBV infekce a ve skupině pacientů s virémií 105–106 kopií/ml dokonce relativní riziko vzrostlo na 5,6 [4]. Relativní riziko vzniku hepatocelulárního karcinomu 4,5 ve srovnání s jedinci bez HBV infekce popsal Chen u amerických Asiatů s virémií < 105 kopií/ml [5]. Další rozsáhlá asijská studie popřela význam HBeAg sérokonverze jako faktoru predikujícího dobrou dlouhodobou prognózu. Ukázala, že ke spontánní sérokonverzi na anti-HBe dochází v průměru ve věku 35 let, průměrný věk manifestace komplikací (cirhózy nebo hepatocelulárního karcinomu) byl ale 57 roků [6]. Více než dvě třetiny pacientů tak byly v době manifestace komplikací již po HBeAg sérokonverzi. HBeAg sérokonverze není vždy spojena s úplnou supresí virémie. Pacienti, u nichž přetrvává po HBeAg sérokonverzi nadále významná virémie, proto potřebují k supresi virémie trvalou léčbu. Konečně i zmíněné indikační kritérium ALT převyšující dvojnásobek normy determinuje skupinu pacientů s vyšší pravděpodobností dosažení HBeAg sérokonverze časově omezenou léčbou. Studie [6] ale stratifikovala riziko komplikací podle aktivity ALT, které bylo nejvyšší ve skupině s ALT mezi 1–2násobkem normy (graf 1). Další studie pak prokázala korelaci mezi hodnotou aktivity ALT a mortalitou na jaterní chorobu i ve skupině pacientů s aktivitou ALT v normálním rozmezí [7].
Výsledky popsaných studií dokládají, že pro zabránění vzniku závažných komplikací chronické HBV infekce musí být cílem léčby dlouhodobá a nejlépe trvalá suprese virémie. Postupem k dosažení dlouhodobé suprese virémie je na prvním místě časově omezená léčba pegylovaným interferonem a. Ta je ale účinná zejména u nemocných s HBeAg pozitivní formou chronické hepatitidy B, bohužel je však limitována řadou kontraindikací. Alternativou je dlouhodobá léčba syntetickými antivirotiky (nukleosidovými či nukleotidovými analogy), vzniku rezistence a ztrátě účinnosti lze pak nejlépe zabránit kombinovanou léčbou.
Peginterferon a v léčbě chronické HBV infekce
Účinnost peginterferonu a ve smyslu navozování HBeAg sérokonverzí a setrvalých virologických odpovědí byla již v předchozích letech ověřena velkými kontrolovanými klinickými studiemi [8–10]. Peginterferon a je jediným lékem, kterým lze roční léčbou navodit setrvalou virologickou odpověď i u pacientů s HBeAg negativní formou chronické hepatitidy B. Na rozdíl od syntetických antivirotik, kdy po skončení roční léčby u většiny pacientů virémie opět narůstá, se celkový efekt léčby peginterferonem a v průběhu času po jejím ukončení zlepšuje. To je odrazem dlouhodobé úpravy imunoreaktivity navozené léčbou. Hodnocení výsledků léčby 2 roky po jejím skončení vyznívá ještě lépe než první hodnocení 6 měsíců po skončení léčby. Marcellin popsal u svého souboru HBeAg negativních pacientů efekt léčby peginterferonem a-2a dva roky po léčbě a srovnával ho s původním hodnocením 6 měsíců po léčbě. Dva roky po léčbě dosáhlo 9 % HBeAg negativních pacientů též HBsAg negativity (po 6 měsících jen 4 % pacientů), 66 % léčených pacientů mělo normální ALT (po 6 měsících jen 59 %) a 23 % léčených pacientů mělo HBV-DNA < 400 kopií/ml (po 6 měsících jen 19 % pacientů). Podobná data, tj. trvání příznivého efektu i dlouho po skončení léčby, byla popsána také u pacientů léčených konvenčním interferonem a [11].
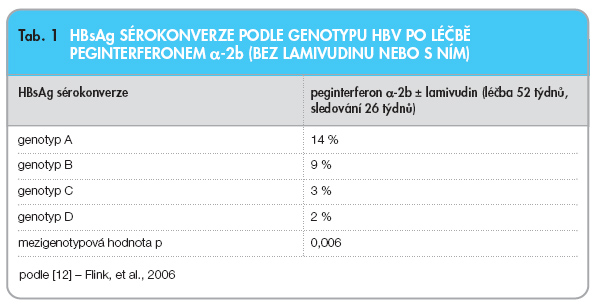
Peginterferon a lze považovat za vynikající lék první volby zejména u mladších pacientů infikovaných genotypem A nebo B. Genotyp HBV je důležitým prognostickým faktorem pro dosažení HBeAg sérokonverze léčbou peginterferonem a. Nejlepších výsledků lze dosáhnout u pacientů s genotypem A, mírně horších výsledků u pacientů s genotypem B. Odpověď u pacientů s genotypy C a D je velmi špatná a přínos léčby peginterferonem ve srovnání s nežádoucími účinky je u nich nutno pečlivě zvažovat (tab. 1).
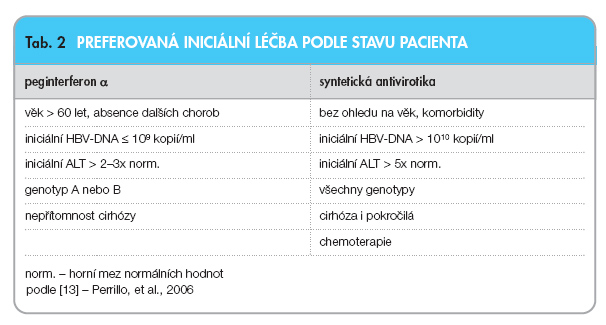
Genotyp HBV má vliv i na případné dosažení HBsAg negativity léčbou peginterferonem a [12]. Při seriózním rozhodování o indikaci léčby peginterferonem a by mělo být vyšetření genotypu HBV vždy provedeno (tab. 2).
Syntetická antivirotika v léčbě chronické HBV infekce
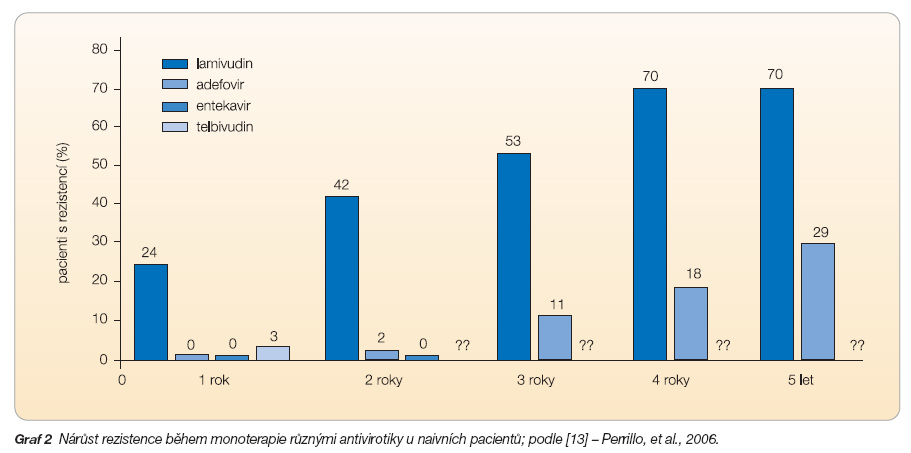
Nukleosidová a nukleotidová analoga se inkorporují do virových nukleových kyselin namísto přirozených molekul a ukončují další prodlužování řetězce HBV-DNA, o aktivní místo virové reverzní transkriptázy či DNA polymerázy kompetují s přirozenými nukleotidy. Nukleosidová a nukleotidová analoga proto suprimují replikaci HBV parciálně a reverzibilně, v řadě případů se takovou léčbou dosáhne maximálního antivirového účinku až po ročním podávání. Bohužel ale rezistence na zmíněné léky narůstá s prodlužující se léčbou. Rezistence je prokazatelná asi u 70 % pacientů po 5 letech léčby lamivudinem [14]. Rezistence na novější antivirotika vzniká pomaleji, přesto ve významném procentu, rezistenci na adefovir má 29 % pacientů po 5 letech léčby. Zdá se, že rezistence vzniká častěji, pokud jsou antivirotika podávána v monoterapii (graf 2) a sekvenčně.
Někteří autoři proto již před několika lety předpokládali, že k omezení vzniku rezistence mají být antivirotika podávána v kombinaci [15].
Adefovir dipivoxil
Navzdory pozvolnému vzniku rezistence (ve srovnání s lamivudinem) byl během 4 let léčby adefovirem popsán přibývající počet pacientů s HBeAg sérokonverzí a s neprokazatelnou virémií (metodou PCR). Kumulativní incidence rezistence na adefovir ovšem činí 0 % po 48 týdnech léčby, 2 % po 2 letech, 11 % po 3 letech, 18 % po 4 letech a 29 % za 5 let [16]. Vysoká virémie ve 48. týdnu léčby predikuje vysoké riziko vzniku rezistence. Izoláty viru s rezistencí na adefovir podmíněnou mutací N236T zůstávají citlivé na lamivudin a zdá se, že i na entekavir a telbivudin. Naopak rezistentní izoláty s mutací A181V mají mírně sníženou citlivost na tenofovir a ještě méně jsou citlivé na lamivudin a na entekavir. Adefovir je schválen k léčbě chronické hepatitidy B v USA i v EU, v ČR pak pouze pro pacienty s rezistencí na lamivudin.
Entekavir
Entekavir má velmi dobrou antivirovou účinnost, po 48 týdnech léčby HBeAg pozitivních pacientů byla virémie neprokazatelná (HBV-DNA < 300 kopií/ml) u 67 % pacientů, v kontrolní skupině léčené lamivudinem jen u 36 % pacientů (p < 0,0001) [17]. HBeAg sérokonverzi navodila léčba entekavirem trvající 2 roky u 31 % pacientů ve srovnání s 25 % po podávání lamivudinu. Entekavir je ve srovnání s lamivudinem též účinnější u HBeAg negativní formy chronické hepatitidy B. Ve srovnávací studii s HBeAg negativními pacienty bylo po 48 týdnech léčby entekavirem 90 % pacientů HBV-DNA negativních (< 300 kopií/ml), v kontrolní skupině léčené lamivudinem ale jen 72 % pacientů HBV-DNA negativních (p < 0,0001) [18]. U dosud neléčených pacientů nebyla po 2 letech léčby entekavirem prokázána rezistentní mutace. Ve skupině pacientů rezistentních na lamivudin byla genotypová rezistence na entekavir nalezena v 16 % po 2 letech léčby. Virus rezistentní na entekavir zůstává dobře citlivý na adefovir a tenofovir, ale jen málo citlivý na lamivudin. Entekavir na rozdíl od lamivudinu, adefoviru a tenofoviru neúčinkuje na HIV. Mezi léky v současné době schválenými k léčbě HBV infekce se ale entekavir zdá být lékem s nejlepším protivirovým účinkem a lékem s vynikajícím profilem rezistence, zejména u dosud neléčených pacientů. Entekavir je schválen k léčbě chronické hepatitidy B v USA i v EU.
Tenofovir
Tenofovir je acyklický nukleotid, inhibitor virové HBV polymerázy a HIV reverzní transkriptázy, jeho struktura je podobná adefoviru. První data o účinnosti tenofoviru pocházejí z malých nerandomizovaných studií s pacienty s HBV infekcí nebo s koinfekcí HBV/HIV [19–21]. Novější studie retrospektivně zhodnotily účinnost tenofoviru proti HBV jako součást kombinované antiretrovirové léčby u pacientů s koinfekcí HBV/HIV, průměrná doba léčby byla 6 měsíců. Za 12 měsíců po léčbě mělo negativní virémii 30 % pacientů HBeAg negativních a 82 % pacientů HBeAg pozitivních [22]. Další retrospektivní studie srovnávala účinnost tenofoviru a adefoviru, pacientů HBV-DNA negativních bylo po roce léčby tenofovirem 94 % a po léčbě adefovirem 32 %, po 2 letech bylo HBV-DNA negativních 100 %, resp. 49 % pacientů. Protivirová účinnost tenofoviru je vyšší ve srovnání s adefovirem, pacienti s virologickým průlomem při terapii adefovirem byli úspěšně léčeni tenofovirem [23]. Ve studiích in vitro i in vivo byly obě mutanty HBV rezistentní na adefovir (A236T a A181V) citlivé na tenofovir [24]. Schválení tenofoviru k léčbě hepatitidy B lze v USA očekávat ve velmi krátké době. Kombinovaný preparát obsahující tenofovir a emtricitabin je dosud ale schválen jen k léčbě HIV infekce, ačkoliv by teoreticky mohl být dobře účinný i u HBV infekce. Mutanty rezistentní na emtricitabin jsou totiž citlivé na tenofovir a naopak.
Telbivudin
Telbivudin je tzv. L-nukleosid. V klinických studiích byl srovnáván s lamivudinem a vykazoval vyšší protivirovou účinnost i nižší frekvenci rezistentních mutací. Léčba telbivudinem trvající 52 týdnů byla spojena s významně hlubší supresí virémie než léčba lamivudinem (-6,01 vs. -4,57 log kopií/ml; p < 0,05), HBV-DNA negativity bylo dosaženo u 61 % vs. 32 % pacientů (p < 0,05). Vyšší počet HBeAg sérokonverzí též navodil telbivudin než lamivudin (31 % vs. 22 %) a virologických rezistencí bylo méně po léčbě telbivudinem (4,5 % vs. 15,8 %; NS) [25]. V další studii telbivudin prokázal lepší účinnost než lamivudin též u pacientů HBeAg negativních. Rezistence na telbivudin (M204I) je ale zkřížena s rezistencí na lamivudin, mutanta rezistentní na adefovir (A181V) je méně citlivá na lamivudin než divoký typ viru.
Kombinovaná léčba
Problematika kombinované léčby antivirotiky je v posledních několika letech stále více diskutovaná a má řadu zastánců i odpůrců. Na rozdíl od HCV či HIV infekce, kde je kombinovaná protivirová léčba standardním postupem, tomu tak u chronické HBV infekce není. U chronické HBV infekce se již zkoušela účinnost řady kombinací antivirotik, ale žádná z nich nebyla účinnější v navozování setrvalých virologických odpovědí ve srovnání s monoterapií. Předpokládaný aditivní či synergický účinek kombinace antivirotik nebyl v tomto případě prokázán. Jediným prokázaným přínosem je skutečnost, že kombinovaná léčba snižuje frekvenci vzniku rezistence na lamivudin ve srovnání s monoterapií lamivudinem. Na druhou stranu není zatím prokázáno, že by kombinovaná léčba snižovala frekvenci vzniku mutací rezistentních na novější antivirotika, která mají nízkou frekvenci vzniku rezistentních mutací i při podávání v monoterapii.
Kombinovaná léčba peginterferonem a a lamivudinem u dosud neléčených pacientů sice vedla k hlubší supresi virémie během léčby než monoterapie, avšak z hlediska dosažení HBeAg sérokonverze nebo setrvalé virologické odpovědi účinnější nebyla. Tvrzení, že po roční kombinované léčbě peginterferonem a s lamivudinem vzniklo významně méně mutací rezistentních na lamivudin než po monoterapii lamivudinem, lze oponovat, neboť po monoterapii peginterferonem a nevznikla rezistence žádná [8–10]. U pacientů již dříve neúspěšně léčených konvenčním interferonem a neměla další léčba kombinací konvenčního interferonu a s lamivudinem lepší účinnost [26].
Kombinovaná léčba lamivudinem s adefovirem u pacientů dosud neléčených nukleosidovými analogy byla srovnávána s monoterapií adefovirem a lamivudinem. Protivirová účinnost kombinace (tj. procento pacientů HBV-DNA negativních, HBeAg sérokonverze a normalizace ALT) byla srovnatelná s monoterapií po 52 i 104 týdnech léčby [27, 28]. Po 104 týdnech léčby bylo ve skupině léčené kombinací adefovir + lamivudin méně rezistencí na lamivudin (YMDD mutací) než ve skupině léčené monoterapií lamivudinem (15 % vs. 43 %). Na druhou stranu nebyl vznik mutací rezistentních na lamivudin potlačen zcela. U pacientů s rezistencí na lamivudin se ale ukazuje, že lepším postupem je přidání adefoviru a ponechání lamivudinu než výměna lamivudinu za adefovir. Kombinovaná léčba sice nebyla účinnější v supresi virémie, ale docházelo méně často k ohrožujícímu vzplanutí zánětu a frekvence vzniku rezistence na adefovir byla nižší [29, 30].
Lai a kol. srovnávali účinnost roční léčby kombinací telbivudin s lamivudinem s monoterapií telbivudinem a lamivudinem. Spíše než synergismus byl popsán antagonismus v protivirové účinnosti obou léčiv. Vysvětlením je kompetice obou enzymů v aktivním místě virové DNA polymerázy nebo kombinace při iniciální fosforylaci [31].
Lau a kol. popsali synergický antivirový účinek emtricitabinu s adefovirem, pacientů HBV-DNA negativních bylo po roční léčbě kombinací 79 %, ale jen 38 % po monoterapii adefovirem. Studie má bohužel ale omezenou validitu kvůli malému počtu pacientů a krátké periodě sledování po léčbě [32].
Závěr
Nové poznatky o virémii jako rizikovém faktoru rozvoje jaterní cirhózy a jejích komplikací popřely dosud platnou verzi, že „léčíme chronickou hepatitidu, nikoliv replikaci viru". Cílem léčby je co možná nejhlubší a trvalá suprese virémie. Dlouhodobé suprese virémie lze u vybraných pacientů dosáhnout léčbou PEG-IFN a, u ostatních pacientů je na místě dlouhodobá léčba syntetickými antivirotiky, jejichž spektrum se stále rozšiřuje.
Seznam použité literatury
- [1] Hoofnagle JH, Dusheiko GM, Seeff LB, et al. Seroconversion from hepatitis B e antigen to antibody in chronic type B hepatitis. Ann Intern Med 1981; 94: 744–748.
- [2] Fattovich G, Rugge M, Brollo L, et al. Clinical, virologic and histologic outcome following seroconversion from HBeAg to anti-HBe in chronic hepatitis type B. Hepatology 1986; 6: 167–172.
- [3] Yang HI, Lu SN, Liaw YF, et al. Hepatitis B e antigen and the risk of hepatocellular carcinoma. N Engl J Med 2002; 347: 168–174.
- [4] Iloje UH, Yang HI, Su J, et al. Predicting liver cirrhosis risk based on the level of circulating hepatitis B viral load. Gastroenterol 2006; 130: 678–686.
- [5] Chen CJ, Yang HI, Su J, et al. Risk of hepatocellular carcinoma across a biological gradient of serum hepatitis B virus DNA level. JAMA 2006; 65–73.
- [6] Yuen MF, Yuan HJ, Wong DK, et al. Prognostic determinants for chronic hepatitis B in Asians: therapeutic implications. Gut 2005; 54: 1610–1614.
- [7] Kim HC, Nam CM, Jee SH, et al. Normal serum aminotransferase concentration and risk of mortality from liver diseases: prospective cohort study. BMJ 2004; 328: 983.
- [8] Janssen HL, van Zonneveld M, Sentruk H, et al. Pegylated interferon alfa-2b alone or in combination with lamivudine for HBeAg-positive chronic hepatitis B: a randomised trial. Lancet 2005; 365: 123–129.
- [9] Lau GK, Piratvisuth T, Luo KX, et al. Peginterferon alfa-2a, lamivudine and the combination for HBeAg positive chronic hepatitis B. N Engl J Med 2005; 352: 2682–2695.
- [10] Marcelin P, Lau GK, Bonino F, et al. Peginterferon alfa-2a alone, lamivudine alone and the two in combination in patients with HBeAg-negative chronic hepatitis B. N Engl J Med 2004; 351: 1206–1217.
- [11] Van Zonneveld M, Honkop P, Hansen BE, et al. Long-term follow-up of alpha-interferon treatment of patients with chronic hepatitis B. Hepatology 2004; 39: 804–810.
- [12] Flink HJ, Sprengers D, Hansen BE, et al. Treatment with Peg-interferon alpha-2b for HBeAg positive chronic hepatitis B: HBsAg loss is associated with HBV genotype. Am J Gastroenterol 2006; 101: 297–303.
- [13] Perrillo RP, Craig MA, King E, et al. The changing face of antiviral therapy in hepatitis B. Clinical Care Options: Hepatitis. LLC. 2006; http://clinicaloptions.com/Hepatitis.aspx.
- [14] Lok AS, Lai CL, Leung N, et al. Long-term safety of lamivudine treatment in patients with chronic hepatitis B. Gastroenterol 2003; 125: 1714–1722.
- [15] Richman DD. The impact of drug resistance on the effectiveness of chemotherapy for chronic hepatitis B. Hepatology 2000; 125: 866–867.
- [16] Angus P, Vaughan R, Xiong S, et al. Resistance to adefovir dipivoxil therapy associated with the selection of a novel mutation in the HBV polymerase. Gastroenterol 2003; 125: 292–297.
- [17] Chang TT, Gish RG, de Man R, et al. A comparison of entecavir and lamivudine for HBeAg-positive chronic hepatitis B. N Engl J Med 2006; 354: 1001–1010.
- [18] Lai CL, Shouval D, Lok AS, et al. Entecavir versus lamivudine for patients with HBeAg-negative chronic hepatitis B. N Engl J Med 2006; 354: 1011–1020.
- [19] Van Bommel F, Wunsche T, Mauss S, et al. Comparison of adefovir and tenofovir in the treatment of lamivudine-resistant hepatitis B virus infection. Hepatology 2004; 40: 1421–1425.
- [20] Ristig MB, Crippin J, Aberg JA, et al. Tenofovir disoproxil fumarate therapy for chronic hepatitis B in human immunodeficiency virus/hepatitis B virus-coinfected individuals for whom interferon-alpha and lamivudine therapy have failed. J Infect Dis 2002; 186: 1844–1847.
- [21] Nelson M, Portsmouth S, Stebbing J, et al. An open-label study of tenofovir in HIV-1 and hepatitis B virus co-infected individuals. AIDS 2003; 17: F7–F10.
- [22] Benhamou Y, Fleury H, Trimoulet P, et al. Anti-hepatitis B virus efficacy of tenofovir disoproxil fumarate in HIV-infected patients. Hepatology 2006; 43: 548–555.
- [23] Ratziu V, Thibault V, Benhamou Y, Poynard T. Successful rescue therapy with tenofovir in a patient with hepatic decompensation and adefovir resistant HBV mutant. Comp Hepatol 2006; 5: 1.
- [24] Brunelle NM, Jacquard AC, Pichoud C, et al. Susceptibility to antivirals of a human HBV strains with mutations conferring resistance to both lamivudine and adefovir. Hepatology 2005; 41: 1391–1398.
- [25] Lai CL, Leung N, Teo EK, et al. Telbivudine Phase II Investigator Group. A 1-year trial of telbivudine, lamivudine and the combination in patients with hepatitis B e antigen-positive chronic hepatitis B. Gastroenterol 2005; 129: 528–536.
- [26] Schiff ER, Dienstag JL, Karayalcin S, et al. Lamivudine and 24 weeks of lamivudine/interferon combination therapy for hepatitis B e antigen positive chronic hepatitis B in interferon nonresponders. J Hepatol 2003; 38: 818–826.
- [27] Sung JJY., Lai JY, Zeuzem S., et al. A randomized double-blind phase II study of lamivudine compared to lamivudine plus adefovir dipivoxil for treatment naive patients with chronic hepatitis B: week 52 analysis. J Hepatol 2003; 38: 25–26.
- [28] A phase II study of lamivudine compared to lamivudine plus adefovir dipivoxil for subjects with chronic hepatitis B. http://ctr.gsk.co.uk/Summary/lamivudine/studylist.asp; (studie NUC20912).
- [29] Peters MG, Hann H, Martin P, et al. Adefovir dipivoxil alone or in combination with lamivudine in patients with lamivudine-resistant chronic hepatitis B. Gastroenterol 2004; 126: 91–101.
- [30] Lok ASF, McMahon BJ. AASLD Practice Guidelines: Chronic hepatitis B. Hepatology 2007; 45: 507–543.
- [31] Lai CL, Leung NW, Teo EK, et al. Phase IIb extended treatment trial of telbivudine (LdT) vs lamivudine vs combination treatment in hepatitis B patiens: two years results (Abstract). Gastroenterol 2005; 128: A692.
- [32] Lau GK, Cooksley H, Ribiero RM, et al. Randomized, double-blind study comparing adefovir dipivoxil (ADV) plus emtricitabine (FTC) combination therapy versus ADV alone in HBeAg-positive chronic hepatitis B: efficacy and mechanisms of treatment response, Hepatology 2004; 40: A1155.