Registrovaný léčivý přípravek a doplněk stravy – rozdíly a dopady na zdraví pacienta
Souhrn:
Krajčová V. Registrovaný léčivý přípravek a doplněk stravy – rozdíly a dopady na zdraví pacienta. Remedia 2019; 29: 52–55.
Rozdíly mezi registrovaným léčivým přípravkem a doplňkem stravy nalezneme v několika základních rovinách ‒ legislativní, kvalitativní a terapeutické. Na českém trhu (a nejen na něm) je přítomno mnoho produktů, které svým vzhledem, složením a případně i informacemi uváděnými na obalu vystupují podobně, což může mít negativní dopad na zdraví pacienta. Ten většinou není schopen posoudit informace deklarované na obalu a jejich spolehlivost. Proto je nutné uvést zde alespoň několik zásadních faktů o této problematice.
Summary:
Krajcova V. A registered medicinal product and a dietary supplement – the differences and the impact on patient health. Remedia 2019; 29: 52–55.
The differences between a registered medicinal product and a food supplement can be found on several basic levels – legislative, qualitative and therapeutic. There are many products on the Czech market (and not only there) that, based on their appearance, composition and possibly the information on the packaging, are similar, with possible negative impact on the health of the patient. Patients are not usually able to assess the information declared on the packaging and their reliability. Therefore, there are at least some important facts about this issue.
Key words: registered medicinal product, dietary supplement, Pharmaceuticals Act, State Institute for Drug Control.
Legislativní rámec
Zákon o léčivech (378/2007 Sb., §2, odst. 1) definuje pojem léčivý přípravek takto: „Léčivým přípravkem se rozumí: a) látka nebo kombinace látek prezentovaná s tím, že má léčebné nebo preventivní vlastnosti v případě onemocnění lidí nebo zvířat, nebo b) látka nebo kombinace látek, kterou lze použít u lidí nebo podat lidem, nebo použít u zvířat či podat zvířatům, a to buď za účelem obnovy, úpravy či ovlivnění fyziologických funkcí prostřednictvím farmakologického, imunologického nebo metabolického účinku, nebo za účelem stanovení lékařské diagnózy“ [1].
Doplněk stravy je dle zákona o potravinách a tabákových výrobcích (110/1997 Sb., §2, odst. 1, g) potravina, která: a) má doplňovat běžnou stravu, b) je koncentrovaným zdrojem vitaminů a minerálních látek nebo dalších látek s nutričním nebo fyziologickým účinkem, obsažených v potravině samostatně nebo v kombinaci, c) je určena k přímé spotřebě v malých odměřených množstvích [2].
Směrnice o sbližování právních předpisů členských států týkající se doplňků stravy č. 46/2002 ES udává pro doplňky stravy následující definici: „Potraviny, jejichž účelem je doplňovat běžnou stravu a které jsou koncentrovanými zdroji živin nebo jiných látek s výživovými nebo fyziologickými účinky, samostatně nebo v kombinaci, jsou uváděny na trh ve formách dávek, a to ve formě tobolek, pastilek, tablet, pilulek, a v jiných podobných formách“ [3].
Dále na trhu existují tzv. hraniční přípravky. Jedná se o výrobky, u nichž může vznikat pochybnost o jejich zařazení; za hraniční přípravky se považují buď: a) léčivé látky či léčivé přípravky (včetně homeopatik), nebo b) jiné výrobky, které nejsou regulovány v režimu léčivých přípravků (např. doplňky stravy, kosmetické prostředky, zdravotnické prostředky či další kategorie výrobků se zvláštním regulačním režimem) [4]. Hraniční přípravky mohou být předmětem posuzování Státním ústavem pro kontrolu léčiv (SÚKL), a to z hlediska, zda jsou léčivým přípravkem, či spadají do jiné kategorie produktů – SÚKL ale nerozhoduje o jiné konkrétní kategorii.
Léčivý přípravek
Posuzování a schvalování léčivých přípravků v ČR je v kompetenci SÚKL [5]. Na rozdíl od doplňků stravy procházejí léčivé přípravky před svým uvedením na trh registračním řízením, v jehož rámci je hodnocena jakost, bezpečnost a účinnost přípravku ve vymezených léčebných či preventivních indikacích. Hodnocení účinnosti léčivého přípravku je nutno doložit příslušnými klinickými studiemi, jejichž provádění musí splňovat přísná kritéria stanovená právními předpisy. Uváděné indikace u léčivého přípravku jsou podloženy výsledky provedených klinických studií a musejí být s nimi v souladu (tzn. že u léčivých přípravků na rozdíl od doplňků stravy nesmějí být uváděny takové indikace nebo účel použití, na které klinické studie nebyly provedeny). Bezpečnost léčivých přípravků je pravidelně sledována a vyhodnocována po celou dobu, kdy je léčivý přípravek uváděn do oběhu, a to jak ze strany držitele rozhodnutí o registraci, tak ze strany SÚKL. Pokud dojde k situaci, že riziko z používání léčivého přípravku je větší než prospěch z léčby, provedou se příslušná opatření tak, aby nebylo ohroženo zdraví pacientů.
Na obalu a v příbalové informaci léčivého přípravku, jemuž byla v rámci registračního řízení udělena registrace, musí být podle právních předpisů uvedeno tzv. registrační číslo.
Struktura registračního čísla závisí na tom, zda byl léčivý přípravek zaregistrován pouze v ČR (tzv. národní registrace), nebo zda se jedná o tzv. centralizovanou registraci s platností ve všech členských státech Evropské unie. Registrační číslo u národních registrací přiděluje SÚKL a má tuto strukturu: AA/BBB/XX C (např. 15/062/98 C).
AA – vyjadřuje tzv. indikační skupinu, ve které je léčivý přípravek zařazen (v indikační skupině jsou zahrnuty všechny léky vztahující se k léčbě daného okruhu onemocnění, např. antibiotika, antidepresiva, anestetika, laxativa, hormony).
BBB – jedná se o přírůstkové číslo rozhodnutí o registraci v daném kalendářním roce.
XX – vyjadřuje poslední dvojčíslí roku registrace.
C – jedná se o zeměpisný údaj (země, kde byl léčivý přípravek zaregistrován, tj. ČR). Registrační číslo u centralizovaných registrací přiděluje Evropská léková agentura (European Medicines Agency, EMA) a má tuto strukturu: EU/A/BB/CCC/DDD (např. EU/1/08/123/007).
EU – vyjadřuje, že se jedná o centralizovaně registrovaný léčivý přípravek.
A – označuje povahu léčivého přípravku (humánní nebo veterinární přípravek nebo přípravek pro vzácná onemocnění).
BB – vyjadřuje poslední dvojčíslí roku registrace.
CCC – jedná se o pořadové číslo registrace v daném kalendářním roce.
DDD – vyjadřuje číslo varianty léčivého přípravku.
Na webových stránkách SÚKL je k dispozici databáze registrovaných léčivých přípravků, v níž je možné vyhledávat podle názvu přípravku, účinné látky, ATC skupiny (Anatomicko terapeuticko chemická klasifikace léčiv) nebo kódu SÚKL. V případě pochybností o druhu výrobku je v uvedené databázi možné zjistit, zda se jedná o registrovaný léčivý přípravek, či nikoliv.
Doplněk stravy
Doplňky stravy jsou potraviny, které se od potravin pro běžnou spotřebu odlišují vysokým obsahem vitaminů, minerálních látek nebo jiných látek s nutričním nebo fyziologickým účinkem a které byly vyrobeny za účelem doplnění běžné stravy spotřebitele na úroveň příznivě ovlivňující jeho zdravotní stav. Nejsou tedy určeny k léčbě či prevenci onemocnění.
Na obalu doplňku stravy musí být podle právních předpisů uvedeno označení „doplněk stravy“. U některých doplňků stravy se lze setkat s tzv. číslem HEM, které někteří výrobci dosud uvádějí na obalu těchto výrobků. Jedná se o jednací číslo rozhodnutí, pod nímž byl v minulosti vydán Ministerstvem zdravotnictví ČR (MZ ČR) souhlas s uváděním daného výrobku do oběhu jako potraviny.
Doplňky stravy v ČR posuzuje a schvaluje MZ ČR. Před uvedením těchto výrobků na trh MZ ČR posuzuje pouze jejich zdravotní nezávadnost, což znamená, že jejich dlouhodobé užívání by nemělo vést k poškození zdraví.
Účinky deklarované výrobcem nejsou nikým ověřovány, protože u doplňků stravy není posuzována jejich účinnost [1]. Pokud uváděné účinky výrobku nejsou v rozporu s právními předpisy pro označování potravin a doplňků stravy, je umožněno jejich uvádění na obalech a v dalších materiálech doprovázejících výrobek bez ohledu na jejich pravdivost.
Doplňky stravy nemohou dle platných právních předpisů deklarovat vlastnosti prevence, léčby nebo vyléčení onemocnění nebo na tyto vlastnosti odkazovat. Přesto se lze u doplňků stravy často setkat s tvrzeními, jež jsou přinejmenším zavádějící, neboť výrobci se snaží navodit dojem, že výrobek má vlastnosti prevence nebo léčby, i když to výslovně neuvádějí. Nejčastěji jsou to tvrzení o léčivých vlastnostech jednotlivých složek výrobku, o prokázání jeho účinků v klinických studiích, popř. o jeho schválení MZ ČR. K tvrzení, že u výrobku byly deklarované účinky prokázány v klinických studiích, je nutno přistupovat s opatrností. Výrobce se často odkazuje na studie prováděné s danou účinnou látkou mimo živý organismus nebo na studie zahrnující sice pacienty, avšak obtížně objektivně vyhodnotitelné, protože na ně nejsou aplikována kritéria pro klinická hodnocení léčivých přípravků. Tam, kde doplněk stravy obsahuje stejné účinné látky jako registrovaný léčivý přípravek, se výrobce bohužel mnohdy odkazuje na klinické studie provedené s daným léčivým přípravkem, čímž nekalým způsobem „podporuje“ užívání doplňku stravy při deklarovaném účelu použití. Informace, že výrobek byl schválen MZ ČR, znamená, že u výrobku byla posouzena zdravotní nezávadnost (viz výše), nikoliv že MZ ČR posuzovalo nebo schválilo jeho účinnost, či výrobek dokonce doporučuje užívat.
V porovnání s léčivými přípravky mají potravinové doplňky cestu ke konečnému spotřebiteli kratší (a levnější). Složení potravinových doplňků upravuje v ČR vyhláška 352/2009 Sb., jíž se mění dřívější vyhláška 225/2008 Sb. Tyto dokumenty zapracovávají příslušné předpisy Evropských společenství a upravují požadavky na složení doplňků stravy, jejich označování a způsob použití. Součástí vyhlášky jsou přílohy (1‒5), kde jsou uvedeny tzv. povolené látky, jejich formy, požadavky na čistotu látek a současně i seznam látek, které nesmí potravinový doplněk obsahovat.
Podle zákona o potravinách a tabákových výrobcích se doplňky stravy musejí notifikovat. To znamená, že před uvedením na trh se musí zaslat text české etikety na MZ ČR, odbor ochrany veřejného zdraví, a jsou zapsány do Registru rozhodnutí hlavního hygienika (ROHY, dostupný na internetu pro registrované). V České republice podléhají doplňky stravy stejně jako potraviny dozoru Státní zemědělské a potravinářské inspekce. Fyzická nebo právnická osoba uvádějící doplněk stravy na trh nese plnou odpovědnost za to, že bude zdravotně nezávadný. Musí vyrábět a dovážet výrobek té kvality, v níž byl schválen nebo notifikován. Výrobce i dovozce musí mít ověřeno, zda výrobky, jež nabízí k prodeji, odpovídají vlastnostmi výrobkům schváleným nebo notifikovaným.
Před uvedením do prodeje takových doplňků stravy, které obsahují látky dosud neuvedené v citované vyhlášce, vystaví odborné stanovisko Státní zdravotní ústav (SZÚ).
Doplňky stravy neprocházejí dlouhým, ekonomicky náročným ověřováním účinnosti v podobě klinických studií. Z hlediska schvalování do prodeje se na ně pohlíží jako na potravinu, nikoliv jako na lék. Rozsah požadavků nezbytných k tomu, aby byl uveden do oběhu doplněk stravy, je významně užší než dokumentace nezbytná k registraci léčiva. Se vstupem do EU se celý proces schvalování ještě významně zúžil. Uvedení doplňku stravy do oběhu podléhá pouze notifikaci.
Propagace a reklama
Na léčivé přípravky i doplňky stravy lze pohlížet i jako na zboží, které se prodává, je předmětem marketingu a podpory prodeje [6]. Propagace léčivých přípravků se musí řídit zákonem o regulaci reklamy (zákon číslo 40/1995 Sb., ze dne 9. února 1995, o regulaci reklamy a o změně, a doplnění zákona č. 468/1991 Sb., o provozování rozhlasového a televizního vysílání, ve znění pozdějších předpisů). Reklama na volně prodejné léky zaměřená na širokou veřejnost může obsahovat pouze údaje uváděné na obalu či v oficiálně schválené (SÚKL) příbalové informaci těchto humánních léčivých přípravků a musí splňovat veškeré další podmínky, které jsou uvedeným zákonem vymezeny. Reklama na léky, jejichž výdej je vázán na lékařský předpis, nesmí být zaměřena na širokou veřejnost.
Reklama na doplňky stravy nebyla do poloviny devadesátých let nikterak omezována. Výrobci a distributoři mohli uvádět, že doplněk stravy léčí, zlepšuje zdravotní stav u konkrétního onemocnění, aniž pro to měli jediný důkaz charakteru evidence based medicine (EBM) v podobě jediné statisticky průkazné studie.
V současnosti podle vyhlášky 352/2009 Sb. nesmí reklama stejně jako označení na obalu či údaje v příbalové informaci přisuzovat doplňkům stravy vlastnosti týkající se prevence, léčby nebo vyléčení lidských onemocnění nebo na tyto vlastnosti odkazovat. Nesmí obsahovat žádné tvrzení uvádějící nebo naznačující, že vyvážená a pestrá strava obecně nemůže poskytnout dostatečné množství vitaminů anebo minerálních látek. Na obalu musí být však uvedeno, že jde o doplněk stravy.
Na druhou stranu existují potravinové doplňky, jejichž účinnost byla ověřena klinickými studiemi, ale protože obsahují látky, které splňují i kritéria potravinových doplňků (neobsahují tzv. zakázané látky či nepovolené koncentrace látek, nebo byly schváleny jako potraviny nového typu), uvádí je výrobce (distributor) na trh jako doplňky stravy, aby se vyhnul často zdlouhavému a nákladnému registračnímu řízení.
Zdravotní a výživová tvrzení
Od roku 2006 jsme svědky snahy vytvořit seznam schválených potravinových a zdravotních tvrzení v obchodních sděleních (včetně propagace) týkajících se potravinových doplňků, který by byl platný jednotně pro celou EU [6]. V současnosti již proběhl sběr tvrzení navržených jednotlivými výrobci a posouzení podstatné části z nich. Zodpovědnou institucí je Evropský úřad pro bezpečnost potravin (European Food Safety Authority, EFSA), na jehož stránkách jsou schválená potravinová a zdravotní tvrzení zveřejňována [7].
Základem posuzování je nařízení Evropského parlamentu a Rady pro označování potravin a doplňků stravy (č. 1924/2006), které je platné od poloviny roku 2007. Léčivé přípravky a doplňky stravy prodávané v ČR procházejí systémem schvalování a podléhají kontrole kvality a bezpečnosti. Ovšem jen tehdy, pokud pocházejí od renomované farmaceutické firmy a jsou koupené v lékárně.
Při prezentaci a nabízení doplňků stravy v lékárně je třeba se vyhnout jejich zaměňování s volně prodejnými léčivými přípravky. Jak je uvedeno výše, jedná se o odlišné kategorie výrobků s odlišným účelem použití. Není proto vhodné je v rámci jejich prodeje prezentovat společně takovým způsobem, aby nebylo pro spotřebitele/pacienta rozlišitelné, o jaký druh výrobku se jedná a jaké účinky je od něj možné očekávat. Důsledné rozlišování mezi kategoriemi výrobků při jejich prezentaci je pak třeba dodržet i v případě komunikace lékárníka s pacientem. Při popisování vlastností doplňků stravy je tak možné využít pouze schválených zdravotních či výživových tvrzení.
Závěr
Jako zdravotničtí profesionálové se
vždy musíme zamyslet nad tím, co pacientovi doporučujeme
a s jakým účelem. Pacienta se vždy musíme snažit
nasměrovat k nákupu v lékárně, kde mu poradí
farmaceut či farmaceutický asistent. I přesto, že se může
doplněk stravy a registrovaný léčivý přípravek zdát
v některých případech jako podobný (tab. 1), je nutné si uvědomit, že se jedná o dvě
zcela odlišné kategorie – potravinu a léčivo,
a nezaměňovat tyto pojmy ani při prezentaci a dispenzaci.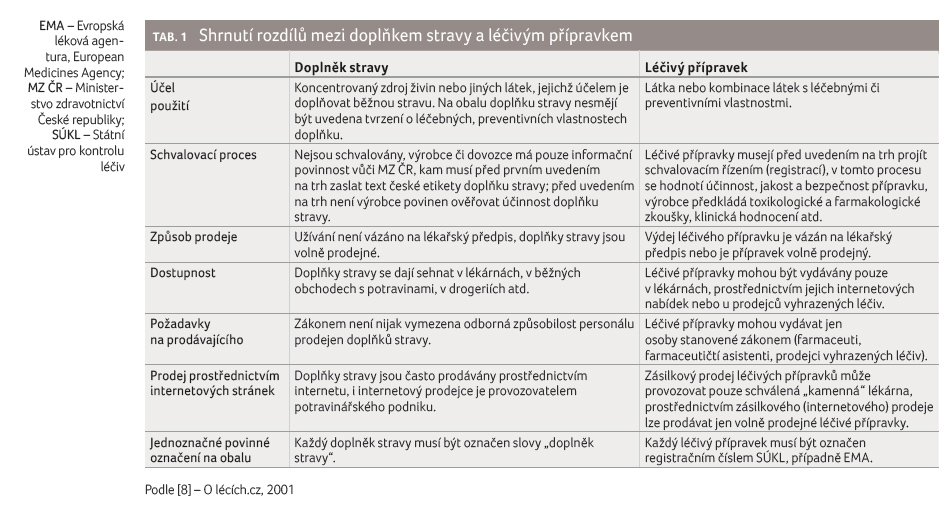
Seznam použité literatury
- [1] Zákon o léčivech, 378/2007 Sb. Zákony pro lidi ‒ Sbírka zákonů ČR v aktuálním konsolidovaném znění [online]. Copyright [cit. 20. 11. 2018]. Dostupné na: https://www.zakonyprolidi.cz/cs/2007‑378
- [2] Zákon o potravinách a tabákových výrobcích, 110/1997 Sb. Zákony pro lidi ‒ Sbírka zákonů ČR v aktuálním konsolidovaném znění [online]. Copyright [cit. 20. 11. 2018]. Dostupné na: https://www.zakonyprolidi.cz/cs/1997‑110
- [3] EUR‑Lex ‒ 32002L0046 ‒ EN ‒ EUR‑Lex. EUR‑Lex — Access to European Union law — choose your language [online]. Dostupné na: https://eur‑lex.europa.eu/legal‑content/CS/ALL/?uri=celex:32002L0046
- [4] Hraniční přípravky, Státní ústav pro kontrolu léčiv. Státní ústav pro kontrolu léčiv [online]. Copyright 2001 [cit. 20. 11. 2018]. Dostupné na: http://www.sukl.cz/leciva/hranicni‑pripravky
- [5] Rozlišení doplňků stravy od léčivých přípravků, Státní ústav pro kontrolu léčiv. Státní ústav pro kontrolu léčiv [online]. Copyright 2001 [cit. 20. 11. 2018]. Dostupné na: http://www.sukl.cz/leciva/rozliseni‑doplnku‑stravy‑od‑lecivych‑pripravku
- [6] Šimůnková M. Libo lék, nebo potravinový doplněk? Medical Tribune 2010. Copyright 2000 [cit. 20. 11. 2018]. Dostupné na: https://www.tribune.cz/clanek/17384
- [7] http://www.efsa.europa.eu/en/ndaclaims/ ndaclaims13.htm
- [8] Jaký je rozdíl mezi lékem a doplňkem stravy? O lécích.cz. O lécích.cz [online]. Copyright 2001 [cit. 20. 11. 2018]. Dostupné na: http://www.olecich.cz/encyklopedie/jaky‑je‑rozdil‑mezi‑lekem‑a‑doplnkem‑stravy