Vztah mezi depresivní poruchou a kardiovaskulárními chorobami je oboustranný
Oblastí intenzivní spolupráce odborníků a cílem společenské poptávky se v mezioborové medicíně stává v posledních letech téma provázaného vzájemného vztahu kardiovaskulárních chorob a duševních poruch. Jedním z hlavních důvodů je nepochybně to, že kardiovaskulární choroby jsou významným problémem současné zdravotní péče spojeným také s významným hospodářským dopadem. Mortalita na kardiovaskulární choroby v ČR – zhruba 600 úmrtí na 100 000 obyvatel ročně – je stále významně vyšší než v zemích západní Evropy. V důsledku těchto chorob u nás umírá více než 50 % jedinců. Závažná kardiovaskulární morbidita, která se odráží také v počtu hospitalizací, je v ČR také vysoká, představuje více než 50 % všech hospitalizací na interních odděleních nemocnic a stále narůstá. Zmíněný nárůst dosáhl za posledních 10 let 25 %.
Psychické poruchy také nepatří mezi řídká onemocnění. Ilustrují to nedávno publikované výsledky jedné z největších epidemiologických studií [1], která zkoumala prevalenci duševních poruch mezi obyvateli Evropské unie. Bylo zjištěno, že během jednoho roku postihne 27 % populace EU (93 miliónů lidí) některá z duševních poruch, jako je depresivní porucha, bipolární afektivní porucha, schizofrenie, závislost na alkoholu, lécích či nikotinu, sociální fobie, panická porucha, generalizovaná úzkostná porucha, obsedantně-kompulzivní nebo somatoformní porucha. Celoživotní riziko výskytu duševní choroby je téměř 50%, přičemž v některých případech se může jednat o několik týdnů či měsíců trvání nebo o epizodický výskyt, ale také o dlouhodobé onemocnění. Jen velmi málo se od sebe země liší v měřítku úspěšného rozpoznání duševních poruch. Pouhých 26 % všech duševních poruch je léčebně ovlivňováno! Tragické je, že za více než 90 % sebevražd lze nalézt vliv duševní poruchy, přičemž depresivní porucha patří k těm nejčastějším. Více než 45 000 osob v zemích Evropské unie takto zemře každý rok, přičemž počet suicidiálních pokusů je odhadován na osminásobek tohoto čísla. Odhlédneme-li od trýznivého utrpení nemocných a jejich blízkých, je nutné zamýšlet se i nad náklady spojenými s léčbou (např. pobyty na jednotkách intenzivní péče, rehabilitace, pracovní neschopnost, trvalá poškození s invaliditou a potřebou trvalé zdravotní péče). Počet sebevražd kolísá od 7/100 000 obyvatel ve Velké Británii po 36/100 000 v Estonsku [2]. Ve většině zemí je riziko suicidia nejvyšší mezi staršími muži a riziko suicidiálního pokusu mezi mladými ženami. Důležitým praktickým výstupem studie je však zjištění, že 40 % těch, kteří spáchají sebevraždu, mělo kontakt s lékařem v průběhu předchozích 4 týdnů. Tento fakt vede k úvaze o nezbytnosti dobré edukace lékařů všech oborů, neboť existuje vysoká pravděpodobnost, že se mohou s takovými nemocnými setkat v každodenní praxi.
Je zřejmé, že nemocní trpící duševními poruchami tvoří a budou tvořit stále větší podíl mezi ošetřenými u praktických lékařů i specialistů [3]. Ti se tak mohou setkat s celým spektrem duševních poruch (neurózy, psychózy, poruchy osobnosti a intelektu, závislosti různého typu, psychosomatické choroby), ale v řadě případů také s jejich rozmanitou kombinací se somatickými poruchami, při kterých jsou duševní poruchy považovány za primární (hypertenze, dráždivý tračník, astma) nebo kdy tvoří sekundární doprovod závažných somatických chorob (např. diabetu, arteriosklerózy, stavů po infarktech myokardu a cévních mozkových příhodách, dlouhodobějších onemocněních).
Vznik depresivní poruchy u somatických onemocnění
Do současnosti bylo uvedeno mnoho hypotéz vzniku depresivní poruchy. Mnoho autorů se zabývalo vlivem stresu a životních událostí na vznik a průběh poruch nálady. Ukazuje se, že životní stresory mají vliv nejen na rozvoj deprese, ale i na její závažnost. Na počátku vzniku depresivní epizody lze často identifikovat řadu nepříznivých životních událostí.
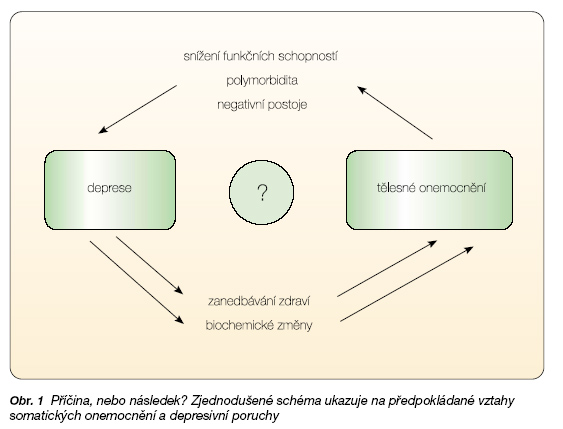
Specifickou oblastí je patogeneze poruch nálady doprovázející tělesná onemocnění, kde samozřejmě hrají roli i všechny faktory tak jako u deprese primární. U somatických chorob bude část mechanismů společná a část specifická pro každou zvláštní tělesnou chorobu (viz obr. 1).
Úhlem pohledu tzv. biopsychosociálního modelu duševních chorob lze uvažovat o vlivu samotné nemoci na procesy v organismu (bio-), které vedou k rozvoji deprese (např. poškození tkáně mozku při cévní mozkové příhodě, prudké zatížení volnými kyslíkovými radikály, excitotoxicita uvolněných aminokyselin; imobilizace organismu spojená s nižším průtokem krve nebo snížená koncentrace dopaminu u Parkinsonovy choroby apod.). Spolupůsobí jistě i faktory, které nalézáme u primárních depresí, tj. alterace osy hypothalamus–hypofýza–kůra nadledvin nebo změny osy hypothalamus–hypofýza–štítná žláza.
Ve vulnerabilitě jedince pro rozvoj depresivních poruch vznikajících v důsledku působení chronického onemocnění hraje nejspíše klíčovou roli serotoninergní systém, což dokumentuje i nedávno publikovaná práce. Autoři ve shodě s předchozími prokázali, že významnou roli v interakci prostředí vs geny lze hledat v oblasti funkčního polymorfismu transportéru pro serotonin (genotyp SLC6A4) [4]. Mezi zkoumané stresory byla tentokrát zařazena kromě sociálních stresorů (jak známe z předchozích prací) i přítomnost chronického tělesného onemocnění. Za nezanedbatelnou formu stresu lze u chronicky nemocných považovat nutnost přizpůsobit se nové kondici organismu, bolesti, ztrátě schopnosti fungovat v běžných podmínkách, ale i ztrátě dosavadních sociálních vazeb (psychosociální). Vede-li somatické onemocnění navíc k invaliditě a ztrátě zaměstnání, je působení u kapacitně oslabeného nemocného stejné intenzity jako u zdravých jedinců. Sumací těchto faktorů dochází k negativnímu ovlivnění hned několika zásadních sociálních determinant zdraví (nadměrně se zvyšuje míra stresu, vzrůstá sociální izolace, dochází ke ztrátě nebo přerušení práce a jedinec není aktuálně schopen dosáhnout plného uplatnění).
Vzájemné vztahy kardiovaskulárních a psychických poruch
Spojení mezi psychickými faktory a kardiovaskulárními chorobami je dnes již plně akceptováno. Jde o vztah komplexní zahrnující jak vliv psychosociálních faktorů na srdce a cévy, tak také vliv stavu kardiovaskulárního systému na psychické funkce. Při bližším pohledu zejména na vztah depresivních poruch a kardiovaskulárních onemocnění se zdá, že deprese může být obojím, jak příčinou, tak následkem tělesného onemocnění.
Např. poměrně dlouho je známa vazba ischemické choroby srdeční k tzv. osobnostnímu typu A, který je charakterizován výraznou dynamikou, aktivitou, ctižádostivostí, zaměřením na čin spojeným s nedostatkem odpočinku a nedostatkem pochopení ostatních lidí. Jako prediktory výskytu kardiovaskulárních onemocnění byly sledovány i tzv. negativní emoce, mezi něž jsou řazeny mimo jiné depresivní příznaky, agresivní soutěživost, snadná frustrovatelnost, úzkostnost a hostilita (negativní zaujatost) [5]. Víme, že přítomnost depresivních symptomů (měřená psychometrickými stupnicemi) zvyšuje riziko kardiovaskulárních chorob v průběhu života 1,5–2krát.
Na druhou stranu, kardiovaskulární onemocnění jsou velmi často doprovázena depresivními poruchami. Afektivní porucha se může vyskytnout u jedince poprvé v životě v přímé souvislosti např. s infarktem myokardu, potom hovoříme o organické depresivní poruše (dle MKN-10 F 06.32). Vliv a okolnosti kardiovaskulárního onemocnění také mohou vyvolat depresivní potíže u jedince, který již v minulosti depresi prodělal nebo se pro ni léčí. Potom označíme poruchu spíše jako exacerbaci periodické depresivní poruchy (F 33), přičemž somatické onemocnění tvoří provokující faktor již přítomné psychické choroby. Nabízí se pochopitelně myšlenka, že jedinci, kteří již mají s afektivní poruchou zkušenost, jsou v rámci nově vzniklého kardiovaskulárního onemocnění náchylnější ke vzniku deprese, ale důkazy prozatím nemáme. Ze studií s velkým počtem probandů vyplynulo, že závažnost kardiovaskulárního onemocnění neovlivňuje stupeň závažnosti deprese, ale oproti tomu závažnost deprese ovlivňuje riziko mortality v důsledku onemocnění. Riziko mortality je dvojnásobné u těžší deprese oproti mírné depresi, bez ohledu na přítomnost kardiovaskulárního onemocnění na začátku sledování a současně riziko mortality na kardiovaskulární onemocnění je třikrát vyšší při přítomnosti než při absenci choroby při zahájení sledování [6].
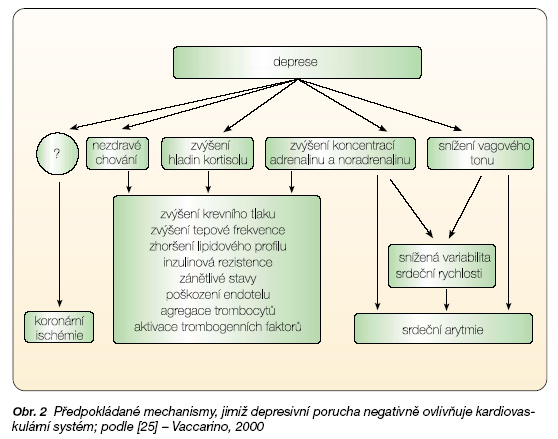
Průběh deprese provází řada biologických změn, které jsou rizikové z pohledu kardiovaskulární morbidity a mortality (přehled viz obr. 2).
Řadíme k nim poruchu rovnováhy autonomního nervového systému, snížení variability srdečního rytmu, změnu agregability trombocytů, zvýšení plazmatické koncentrace prokoagulačních faktorů a aktivaci imunitního systému [7, 8]. Hlouběji se analyzuje vaskulární endoteliál-ní dysfunkce doprovázející proces aterosklerózy, jejímž prostřednictvím může docházet u depresivních pacientů ke zvýšení kardiovaskulárního rizika [9–11]. Objevují se genetické studie zkoumající polymorfismus, které přicházejí s tvrzením, že spojení kardiovaskulárních, depresivních a úzkostných poruch by mohlo být projevem dysfunkce katecholaminergního systému postihující organismus v různých úrovních. Tato dysfunkce je spojována s vyšší sympatickou aktivitou vyplývající z polymorfismu a2C-adrenoreceptoru [12]. A v neposlední řadě je stále živým tématem vliv projevů specifického chování – hostility – na kardiovaskulární riziko, zejména ve spojení s metabolickým syndromem [13].
Diagnostika
Prvním předpokladem včasné diagnostiky je informovanost lékaře o možném výskytu podobné komplikace. Depresivní poruchy vznikající v souvislosti se somatickou chorobou nelze nikdy považovat za součást tělesného onemocnění. Symptomy se mohou vyvíjet postupně nebo vzniknout i v krátkém časovém období. Nemocný si může stěžovat na jeden nebo několik tělesných příznaků (únava, bolesti, poruchy spánku), případně prezentuje podrážděnost, úzkost nebo nervozitu a teprve podrobnější vyšetření odkryje pokles nálady neodpovídající okolnostem či přítomnost ztráty zájmů. Tyto změny jsou doprovázeny změnou všeobecné úrovně aktivity a většina dalších příznaků je druhotných nebo snadno srozumitelných v kontextu změn nálady a aktivity.
Samo onemocnění nazvané depresivní porucha je definováno základními příznaky, mezi kterými dominuje depresivní nálada takového stupně, že je pro jedince naprosto nenormální, musí být přítomna po většinu dne a téměř každý den po dobu alespoň 2 týdnů, přičemž není ovlivněna okolnostmi. K dalším hlavním příznakům patří ztráta zájmů a radosti z aktivit, které jedince obvykle těší, nebo je přítomen pocit snížené energie a zvýšená únavnost.
K častým doprovodným příznakům patří:
1. ‑ztráta sebedůvěry a sebeúcty;
2. ‑neoprávněné sebevýčitky nebo přehnané a bezdůvodné pocity viny;
3. ‑nedostatek emočních reakcí na události nebo aktivity, které normálně vyvolávají emoční odpověď;
4. ‑vracející se myšlenky na smrt nebo sebevraždu nebo jakékoliv sebevražedné jednání;
5. ‑snížená schopnost myslet nebo se soustředit, jako je například nerozhodnost nebo váhavost;
6. ‑změna psychomotorické aktivity s agitovaností nebo retardací, pro niž máme objektivní důkaz (chování nemocného při vyšetření, popis chování jinými osobami);
7. ‑poruchy spánku jakéhokoliv druhu (nejčastěji ranní probouzení dvě nebo více hodin před obvyklou dobou často spojené s těžšími depresivními prožitky v ranních hodinách);
8. ‑změna chuti k jídlu (zvýšená nebo snížená s odpovídající změnou hmotnosti);
9. ‑zřetelná ztráta libida.
Přesná diagnostika je samozřejmě záležitostí vědomostí lékaře, ale také jeho klinické zkušenosti s určitou skupinou pacientů. Podobně jako v řadě jiných situací, kde se prolíná psychiatrie a somatická medicína, se setkáváme s problémem včasné a co nejpřesnější diagnostiky. „Nejjednodušší" diagnostika zahrnuje pouhé dvě otázky, a naopak k „nejpřísnějším" nástrojům patří strukturované klinické rozhovory vedené zkušeným psychiatrem a takto stanovená diagnóza depresivní poruchy musí naplňovat kritéria MKN-10! Ilustrativním příkladem rozdílné „hloubky" přístupu jsou epidemiologické studie, kde se zvolená diagnostická kritéria a postupy významně promítnou v získaných výsledcích. Pomocnými vyšetřovacími nástroji se mohou stát stupnice, které jsou nemocným předkládány k vyplnění, nebo psychiatrické stupnice objektivního hodnocení pacientova stavu, k nimž ale patří určitá dovednost vést řízený rozhovor za účelem získat potřebné informace. Příkladem může být snaha zachytit prevalenci depresivní poruchy u nemocných trpících diabetem, kdy narážíme v provedených studiích na řadu metodologických problémů. Na těchto výsledcích lze demonstrovat rozdíl v záchytu depresivní poruchy dle tzv. sebeposuzovacích stupnic a strukturovaných diagnostických rozhovorů (v jedné z čerstvých metaanalýz je tento rozdíl 26 % vs 9 % [14]).
K moderním trendům, zejména po zjištění, jak vysoká je prevalence duševních poruch, patří snaha psychiatrů poskytovat lékařům somaticky zaměřených oborů takové nástroje, které by jim usnadnily často složitou diagnostiku komorbidity. Příkladem může být Prime MD [15], což je vcelku jednoduchý nástroj, který dokáže lékaře upozornit na problematické oblasti psychické kondice nemocného a neomezuje se pouze na depresivní symptomy, ale zahrnuje například i projevy úzkosti, poruchy příjmu potravy, somatizační a hypochondrickou poruchu. Je dostupný i ve velmi přehledné počítačové verzi, která vyplněný dotazník okamžitě vyhodnocuje, čímž může mimo jiné lékaři ušetřit čas i ulehčit dilema, zda odeslat, či neodeslat pacienta ke specialistovi.
Terapie depresivních poruch u kardiovaskulárně nemocných
Z pohledu farmakoterapie depresivních poruch u kardiologicky nemocných je nutné zdůraznit, že tvrzení o užitečnosti takové léčby se týkají převážně antidepresiv typu SSRI a vycházejí z prvních kontrolovaných studií prováděných u nemocných po infarktu myokardu. V rámci těchto studií byl mimo jiné zkoumán i vliv na prokoagulační faktory a ukazuje se, že ovlivnění těchto parametrů hraje velmi důležitou roli v určitém „kardioprotektivním" účinku SSRI. Tricyklická antidepresiva nejsou vhodnou skupinou pro užití v populaci kardiologicky nemocných postižených depresí [16–18] a někteří je považují přímo za kontraindikovaná. Prokazatelně zvyšují mortalitu nemocných trpících kardiovaskulárním onemocněním z řady důvodů včetně toho, že působí podobně jako antiarytmika 1A třídy.
Prozatím nejrozsáhlejší publikovaná studie v populaci nemocných po infarktu myokardu byla uskutečněna se sertralinem pod názvem SADHART (Sertraline Antidepressant Heart Attack Randomized Trial) [19]. Jedná se o randomizovanou dvojitě slepou placebem kontrolovanou studii. Pacientům byl podáván po dobu 24 týdnů sertralin v dávkách 50–200 mg/ den, nebo placebo. Ze závěrů vyplývá, že léčba sertralinem nemá ve srovnání s placebem signifikantní vliv na ejekční frakci levé komory ani na ostatní kardiologické parametry hodnocené 12svodovým EKG a holterovským 24hodinovým monitorováním. Z hodnocení skóre psychiatrických posuzovacích stupnic bylo patrné signifikantní zmírnění depresivních symptomů u pacientů léčených sertralinem. V podstatně menších souborech byly prověřovány fluoxetin [20] nebo paroxetin [21] a koncipovány jsou i další projekty, např. s mirtazapinem [22], jejichž výsledky očekáváme.
Existují i studie, kdy byla použita psychoterapie. Pro řadu odborníků byl jistě mírným překvapením definitivní výsledek studie ENRICHD (Enhancing Recovery in Coronary Heart Disease) [23], v níž bylo sledováno celkem 2481 pacientů po infarktu myokardu. Kognitivně behaviorální terapie byla zahájena cca 17 dní po koronární příhodě. Nemocní absolvovali 11 individuálních sezení během 6 měsíců a skupinovou formu terapie, když to bylo proveditelné. Léčba farmaky (SSRI) byla zahájena u nemocných trpících těžší formou deprese. Studie neprokázala pozitivní vliv psychoterapie na přežití během 30měsíčního sledování, ale tato intervence vedla k redukci depresivní symptomatiky a zvýšení sociální podpory, především během kritických 6 měsíců léčby. Přestože výsledek nelze přiřadit ke skupině tzv. „tvrdých dat" podporujících užitou intervenci (nevedla k ovlivnění doby přežití nebo snížení frekvence dalších kardiovaskulárních potíží), došlo ke zmírnění depresivních obtíží nemocných a ke zmírnění sociální izolace. Autoři nedávno publikovali následné tříleté sledování skupiny nemocných [24], u kterých byla indikována antidepresivní léčba. Práce také dokumentuje fakt, že inhibitory zpětného vychytávání serotoninu patří k nejužívanějším antidepresivům, a proto také bylo jejich použití u zkoumaného vzorku nejpočetnější. Z 301 pacientů bylo 50 % nemocných léčeno sertralinem, 30 % paroxetinem, 13 % fluoxetinem a 8 % citalopramem, což do určité míry odráží také situaci z pohledu vědeckých důkazů. Zjištěné zhruba 40% snížení výskytu dalších život ohrožujících událostí u léčených nelze v žádném případě ignorovat i přes určité metodologické nedostatky této práce.
Závěr
Jedním z nejaktuálnějších témat pomezí kardiologie a psychiatrie je ovlivnění doby přežití nebo výskytu dalších kardiovaskulárních komplikací u pacientů po infarktu myokardu, u kterých vznikla depresivní porucha. Prozatím žádná z provedených studií neodpověděla přesně na otázku, zda antidepresivní léčba nemocných postižených infarktem myokardu vede ke snížení následné morbidity a mortality, ale uvedená data podporují tuto myšlenku a věřme, že povedou k provedení průkazných klinických studií. V každém případě již dnes existují důkazy, že lze účinně a bezpečně léčit depresivní obtíže u kardiovaskulárně nemocných.
Seznam použité literatury
- [1] Wittchen HU, Jacobi F. Size and burden of mental disorders in Europe – a critical review and ap-praisal of 27 studies. European Neuropsycho-pharmacology 2005; 15: 357–376.
- [2] http://www.who.int/topics/suicide/en/
- [3] Ansseau M, Dierick M, Buntinkx F, et al. High prevalence of mental disorders in primary care. Journal of Affective Disorders 2004; 78: 49–55.
- [4] Grabe HJ, Lange M, Wolff B, et al. Mental and physical distress is modulated by a polymorphism in the 5-HT transporter gene interacting with social stressors and chronic disease burden. Molecular Psychiatry 2005;10: 220–224.
- [5] Booth-Kewley S, Friedman HS. Psychological predictors of heart disease: A quantitative review. Psychol Bull 1987; 101: 343–362.
- [6] Penninx BW, Beekman AT, Honig A, et al. Depression and cardiac mortality: results from a community-based longitudinal study. Arch Gen Psychiatry 2001; 58: 221–227.
- [7] Lett HS, Blumenthal JA, Babyak MA, et al. Depression as a risk factor for coronary artery disease: evidence, mechanisms, and treatment. Psychosom Med 2004; 66: 305–15.
- [8] Joynt KE, Whellan DJ, O´Connor CM. Depression and cardiovascular disease: mechanisms of interaction. Biol Psychiatry 2003; 54: 248–261.
- [9] Sherwood A, Hinderliter AL, Watkins LL, et al. Impaired Endothelial Function in Coronary Heart Disease Patients With Depressive Symptomatology. J Am Coll Cardiol 2005; 46: 656–659.
- [10] Bonetti PO, Lerman LO, Lerman A. Endothelial dysfunction: a marker of atherosclerotic risk (review). Arterioscler Thromb Vasc Biol 2003; 23: 168–175.
- [11] Brevetti G, Silvestro A, Schiano V, Chiariello M. Endothelial dysfunction and cardiovascular risk prediction in peripheral arterial disease: additive value of flow-mediated dilation to ankle-brachial pressure index. Circulation 2003; 108: 2093–2098.
- [12] Neumeister A, Charney DS, Belfer I, et al. Sympathoneural and adrenomedullary functional effects of [alpha]2C-adrenoreceptor gene polymorphism in healthy humans. Pharmacogenetics and Genomics 2005;15: 143–149.
- [13] Todaro JF, Noc A, Niaura R, et al. Combined Effect of the Metabolic Syndrome and Hostility on the Incidence of Myocardial Infarction (The Normative Aging Study). Am J Cardiol 2005; 96: 221–226.
- [14] Anderson RJ, Freedland KE, Clouse RE, Lustman PJ. The prevalence of comorbid depression in adults with diabetes: A meta-analysis. Diabetes Care 2001; 24: 1069–1078.
- [15] Spitzer RL, Kroenke K, Williams JB. Validation and utility of a self-report version of PRIME-MD: The PHQ Primary Care Study. JAMA 1999; 282: 1737–1744.
- [16] Bingefors K, Isacson D, Knorring LV, et al. Antidepressant-treated patients in ambulatory care. Mortality during a nine-year period after first treatment. Br J Psychiatry 1996; 169: 647–654.
- [17] Cohen HW, Gibson G, Alderman MH. Excess risk of myocardial infarction in patients treated with antidepressant medications: association with use of tricyclic agents. Am J Med 2000; 108: 2–8.
- [18] Kitzlerová E, Slavíček J, Pišvejcová K, et al. M. Plasma Levels of Dosulepine and Heart Electric Field Physiol Res 2003; 52: 319–325.
- [19] Glassman AH, O´Connor CM, Califf RM, et al., for the Sertraline Antidepressant Heart Attack Randomized Trial (SADHART) Group. Sertraline Treatment of Major Depression in Patients With Acute MI or Unstable Angina. JAMA 2002; 288: 701–709.
- [20] Strik JJ, Honig A, Lousberg R, et al. Efficacy and safety of fluoxetine in the treatment of patients with major depression after first myocardial infarction: findings from a double blind placebo-controlled trial. Psychosom Med 2000; 62: 783–789.
- [21] Roose SP, Laghrissi-Thode F, Kennedy JS, et al. Comparison of paroxetine and nortriptyline in depressed patients with ischemic heart disease. JAMA 1998; 279: 287–291.
- [22] Van den Brink RH, van Melle JP, Honig A, et al. and on behalf of the MIND-IT Investigators Treatment of depression after myocardial infarction and the effects on cardiac prognosis and quality of life: Rationale and outline of the Myocardial INfarction and Depression-Intervention Trial (MIND-IT). Am Heart J 2002; 144: 219–225.
- [23] Writing Committee for the ENRICHD Investigators. The Effects of Treating Depression and Low Perceived Social Support on Clinical Events After Myocardial Infarction: the Enhancing Recovery in Coronary Heart Disease Patients (ENRICHD) Randomized Trial. JAMA 2003; 289: 3106–3116.
- [24] Taylor CB, Youngblood ME, Catellier D, et al., for the ENRICHD Investigators. Effects of Antidepressant Medication on Morbidity and Mortality in Depressed Patients After Myocardial Infarction. Arch Gen Psychiatry 2005; 62: 792–798.
- [25] Vaccarino V. The association between depression and coronary heart disease incidence. Drugs of Today 2000; 36: 715–724.