Subkutánní tocilizumab v léčbě revmatoidní artritidy
Souhrn:
Tocilizumab je monoklonální protilátka proti receptoru pro interleukin 6 (IL 6). V intravenózní formě aplikace byl tocilizumab schválen pro léčbu revmatoidní artritidy (RA), avšak nyní přibyla i možnost jeho subkutánního podávání s terapeuticky srovnatelným účinkem a bezpečnostním profilem. Klinické studie BREVACTA, SUMMACTA a MUSASHI hodnotily účinnost podávání subkutánního tocilizumabu a jejich výsledky podpořily zavedení tohoto způsobu aplikace do klinické praxe. Pro evropskou populaci se jako optimální jeví dávka 162 mg podávaná jednou týdně.
Key words: tocilizumab, rheumatoid arthritis, interleukin 6.
Summary:
Tocilizumab is a monoclonal antibody against the interleukin 6 receptor (IL 6). Intravenous application of tocilizumab was licensed for the treatment of rheumatoid arthritis (RA) but it became possible to administer this drug subcutaneously as well – with comparable efficacy and safety profile. Clinical trials BREVACTA, SUMMACTA, and MUSASHI evaluated the efficacy of subcutaneous tocilizumab and their results supported the introduction of this form of tocili-zumab application into clinical practice. The dose of 162 mg applied once a week seems to be optimal for the European population.
Úvod
Revmatoidní artritida (RA) je chronické zánětlivé autoimunitní onemocnění, které typicky postihuje pohybový aparát a je spojeno s kloubní destrukcí. Revmatoidní artritidu provázejí také mimokloubní projevy v dalších orgánových systémech (kardiovaskulárním, plicním, kožním a dalších). Přesná patogeneze RA není dosud plně objasněna, je zřejmé, že při rozvoji a progresi RA převažují prozánět-livé pochody nad protizánětlivými. Přežívání aktivovaných autoreaktivních klonů lymfocytů T a B a dalších buněčných elementů společ-ně s produkcí prozánětlivých cytokinů vede k aktivaci a následné chronické zánětlivé aktivitě, která má za následek poškození tkáně (kloubní i mimokloubní). Cílem úspěšné terapie RA je včasná diagnóza následovaná účelnou léčbou s cílem dosažení rychlé remise onemocnění [1–3].
Nástup biologické léčby výrazně zlepšil prognózu pacientů se závažnými formami RA. Tumor nekrotizující faktor alfa (TNFα) se stal jedním z prvních terapeutických cílů v léčbě RA. TNFα se významně podílí na regulaci buněčné zánětlivé odpovědi, stimuluje ex-presi molekul HLA (human leukocyte antigens, lidské leukocytární antigeny), podporuje angiogenezi, zvyšuje expresi adhezních mole-kul a také diferenciaci osteoklastů. V organismu je přítomen ve dvou formách – solubilní a transmembránové. Obě jsou biologicky ak-tivní a mají schopnost stimulovat a regulovat další cytokiny ve složitých kaskádách (interleukin 1, IL 1; interleukin 6, IL 6; prostaglan-diny a jiné) [4,5].
IL 6 je cytokin podílející se na patogenezi RA, má schopnost aktivovat lymfocyty T či indukovat sekreci imunoglobulinu. IL 6 se podílí na produkci jaterních proteinů akutní fáze, stimuluje hematopoezu a má význam i u dalších autoimunitních onemoc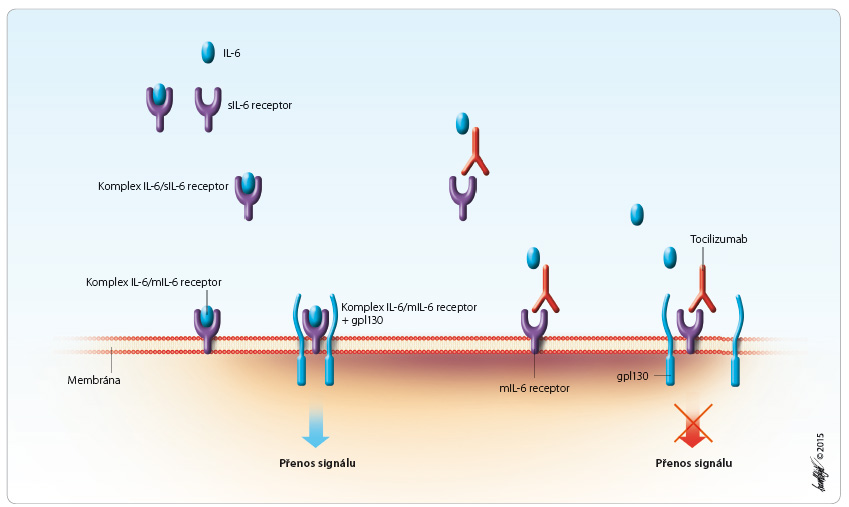 nění, osteo-porózy a nádorových onemocnění. Exprese IL 6 je zprostředkována převážně endoteliálními buňkami, mononukleáry a fibroblasty. Receptory pro IL 6 se nacházejí na povrchu lymfocytů B, lymfocytů T a dalších buněk. Samotné navázání IL 6 na jeho receptor není dostatečné k převedení signálu, k tomu je potřeba teprve spojení komplexu IL 6/receptor pro IL 6 s další povrchovou molekulou – tzv. transducerem signálů gp130 [6–9], obr. 1.
nění, osteo-porózy a nádorových onemocnění. Exprese IL 6 je zprostředkována převážně endoteliálními buňkami, mononukleáry a fibroblasty. Receptory pro IL 6 se nacházejí na povrchu lymfocytů B, lymfocytů T a dalších buněk. Samotné navázání IL 6 na jeho receptor není dostatečné k převedení signálu, k tomu je potřeba teprve spojení komplexu IL 6/receptor pro IL 6 s další povrchovou molekulou – tzv. transducerem signálů gp130 [6–9], obr. 1.
Charakteristika tocilizumabu
Tocilizumab je monoklonální protilátka G1 proti receptoru pro IL 6 [9–11]. Má schopnost vázat jak membránovou, tak solubilní formu receptoru pro IL 6, čímž dokáže blokovat přenos signálu zprostředkovaný IL 6, obr. 1. Původně se předpokládalo, že funkce IL 6 spočí-vá pouze v ovlivnění diferenciace lymfocytů B v buňky prezentující antigen [6]. Teprve následné studie in vitro na myších modelech prokázaly jeho další vlastnosti a ovlivnění nejen lymfocytů B, ale i dalších buněk (lymfocytů T, hepatocytů, hematopoetických progeni-torových buněk a dalších).
Interleukin 6 pozitivně ovlivňuje diferenciaci CD4+ naivních lymfocytů T na buňky Th17 za přítomnosti transformujícího růstového faktoru β (transforming growth factor beta, TGFβ), zatímco inhibuje diferenciaci regulačních lymfocytů T (Treg) indukovanou TGFβ. Interleukin 6 napomáhá proměně Treg na Th17. Nepoměr mezi Th17 a Treg je považován za jednu z mnoha alterací imunitního systému u autoimunitních onemocnění [9,12].
Farmakokinetický profil intravenózního a subkutánního tocilizumabu se liší v závislosti na způsobu aplikace. Studie SUMMACTA sledovala vedle dalších cílových ukazatelů i farmakokinetické změny závislé na způsobu podávání tocilizumabu. U pacientů, jimž byl tocilizumab podáván intravenózně, docházelo k nárůstu sérových koncentrací léčiva rychleji než při subkutánním podání. V dalším prů-běhu podávání se ve 12. týdnu plazmatické koncentrace tocilizumabu u obou způsobů aplikace vyrovnaly a rovnovážného stavu bylo dosaženo ve 24. týdnu s hodnotami minimální účinné koncentrace cmin (± SD) 42 (± 27,4) μg/ml při subkutánním podávání a 18 (± 14,2) μg/ml při intravenózní aplikaci [11,13,14]. Studie se zdravými dobrovolníky prokázala u intravenózní a subkutánní formy klinicky srov-natelnou biologickou dostupnost, stejně tak srovnatelné ovlivnění solubilního receptoru pro IL 6 a koncentrací C reaktivního proteinu (CRP) při podávání dávky 162 mg [14].
U pacientů s RA, jimž byl podáván subkutánní tocilizumab v dávce 162 mg, představovala doba potřebná k dosažení vrcholové kon-centrace v séru (tmax) 2,8 dne. Předpokládá se 80% biologická dostupnost subkutánní formy. Biologický poločas eliminace (t½) subkután-ní formy tocilizumabu u pacientů s RA je závislý na koncentraci – do 13 dnů při podání dávky 162 mg každý týden a do pěti dnů při podání 162 mg každý druhý týden v ustáleném stavu [11,13].
V klinických studiích byl pozorován rychlý pokles hodnot reaktantů akutní fáze (CRP) a sedimentace erytrocytů (Fährae-us Westergren, FW), dále došlo k normalizaci počtu trombocytů. Vzhledem k blokádě IL 6 dochází k ovlivnění produkce hepcidinu, což vede ke zvýšení dostupnosti železa a k následnému zvýšení hodnot hemoglobinu. Při subkutánním podávání tocilizumabu (81 mg a 162 mg) byl rovněž prokázán pokles absolutního počtu neutrofilů, nejnižší hodnoty byly zaznamenány ve 2. a 5. dni po podání, následně se počet neutrofilů postupně vrátil k původním hodnotám [11,14,15].
Dosud chybí podrobnější studie sledující změny ve farmakokinetických a farmakodynamických vlastnostech tocilizumabu u seniorů či pacientů s ledvinným nebo jaterním onemocněním [11].
Mezi nejdůležitější vlastnosti tocilizumabu patří skutečnost, že jeho podání nemá vliv na konkomitantní medikaci u RA (metho-trexat – MTX, nesteroidní antiflogistika, glukokortikoidy), ani tato léčiva neovlivňovala clearance tocilizumabu. Interleukin 6 působí negativně na expresi cytochromu P450 (CYP450), podávání tocilizumabu v důsledku inhibice IL 6 expresi CYP450 normalizuje. Studie in vitro prováděné na kulturách lidských hepatocytů zjistily, že IL 6 vede ke snížení exprese i dalších cytochromů podílejících se na eliminačních pochodech řady léčiv (CYP1A2, CYP2C9, CYP2C19, CYP3A4 a dalších), naopak tocilizumab jejich expresi norma-lizuje. Při zahájení terapie tocilizumabem a po jejím ukončení je nutno přistupovat k pacientům užívajícím léčiva metabolizovaná těmito cytochromy (statiny, blokátory kalciových kanálů, warfarin, cyklosporin, benzodiazepiny a další) individuálně a pro udržení terapeutic-kého účinku jejich dávky upravit. Je třeba vzít v úvahu relativně dlouhou dobu eliminace tocilizumabu z organismu a s tím související dobu jeho působení na aktivitu enzymů CYP450 [11,16,17].
V průběhu klinických sledování byla u 2 876 pacientů hodnocena tvorba protilátek proti tocilizumabu. Celkem 46 pacientů vyvinulo protilátky proti tocilizumabu, z toho šest pacientů vykazovalo výraznou přecitlivělost, která vedla k ukončení terapie u pěti z nich [8,17].
Dávkování tocilizumabu u pacientů s RA
Tocilizumab je indikován k léčbě pacientů se středně těžkou a těžkou RA, u nichž došlo k selhání konvenční terapie léky modifikujícími chorobu (disease modifying antirheumatic drugs, DMARD) či jiným biologickým lékem. Obvykle se podává v kombinované terapii s jinými DMARD, ale při srovnání kombinované léčby s monoterapií byla prokázána vyšší účinnost tocilizumabu v monoterapii [18,20].
Tocilizumab je možno podávat jak intravenózně, tak subkutánně. Intravenózní tocilizumab se podává v jednohodinové infuzi v dávce 8 mg/kg každé čtyři týdny (maximální jednotlivá dávka je 800 mg); v případě dosažení remise je možno dávku snížit na 4 mg/kg. Vzhle-dem k farmakokinetickým parametrům je při subkutánní aplikaci nutná kratší perioda podávání. Je doporučována dávka 162 mg jednou týdně. Tocilizumab by měl být podáván v kombinaci s MTX. V případě intolerance MTX nebo pokud je pokračování léčby MTX ne-vhodné, lze tocilizumab podávat i v monoterapii [11,13,17].Mezi schválené indikace podávání tocilizumabu patří kromě RA také juvenilní idiopatická artritida [11].
Vybraná klinická hodnocení tocilizumabu
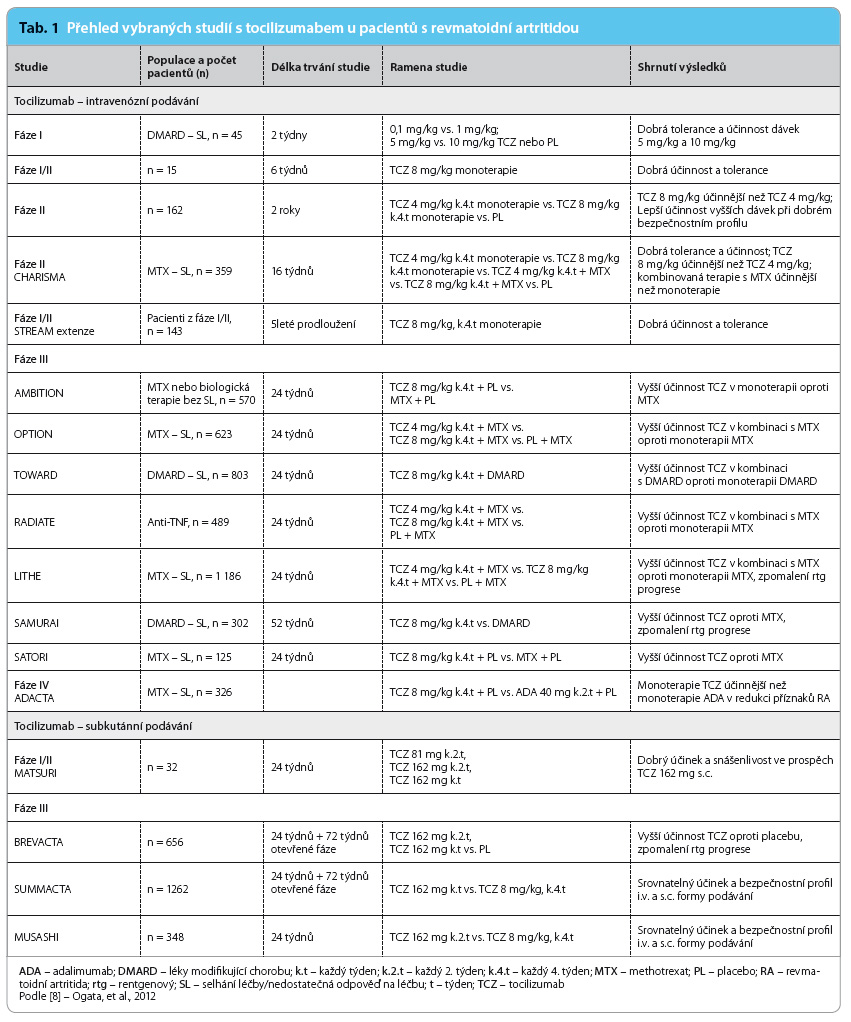
Účinnost a bezpečnost léčby intravenózním tocilizumabem u pacientů s RA byla prokázána v řadě klinických studií fáze I, II a III, dále byl tocilizumab porovnáván i s dalšími biologickými léčivy (studie ADACTA). Studie CHARISMA, OPTION, RADIATE a další uve-dené v tab. 1 prokázaly dobrou účinnost tocilizumabu s navozením a udržením remise a zpomalením rentgenové progrese u pacientů s RA, u kterých došlo k selhání předchozí léčby DMARD a v případě studie RADIATE i k selhání předchozí biologické léčby [19]. Tyto studie hodnotily účinnost a bezpečnost intravenózní formy tocilizumabu (4 mg/kg nebo 8 mg/kg dle protokolu). Studie SATORI a AMBITION potvrdily poprvé v historii biologické léčby vyšší klinický účinek monoterapie tocilizumabem oproti monoterapii MTX (tab. 1, graf 1) [8,10,11,17,18,20].
![Graf 1 Procentuální zastoupení pacientů s revmatoidní artritidou, kteří ve studiích dosáhli terapeutické odpovědi ACR20, ACR50 a ACR70; podle [10] – Alonso, et al., 2009. Vyhodnocení proběhlo ve 24. týdnu trvání studií, s výjimkou studie CHARISMA (vyhodnocení v 16. týdnu) a SAMURAI (vyhodnocení po roce). V grafu jsou zobrazeny výsledky u skupiny pacientů, jimž byl podáván tocilizumab v dávce 8 mg/kg každé 4 týdny v konkomitatní terapii s methotrexatem či s jinými DMARD, eventuálně v monoterapii. ACR – American College of Rheumatology; DMARD – léky modifi kující chorobu; TCZ – tocilizumab](https://www.remedia.cz/photo-a-30097---.jpg) Intravenózní podávání vyžaduje pravidelné návštěvy zdravotnického zařízení s nutností pobytu po dobu podání infuze každé čtyři týdny, což může být pro některé pacienty omezující a často obtížně slučitelné s pracovními povinnostmi. Vzhledem k tomuto byla hledá-na jiná aplikační cesta tocilizumabu a byla prováděna klinická hodnocení subkutánního podávání. Bylo nutno překonat řadu úskalí, a sice především malý objem injekce v poměru k dávce tocilizumabu s přihlédnutím k jeho omezené rozpustnosti (180 mg/ml). Vzhledem k tomuto musí být pro dosažení účinku srovnatelného s intravenózní aplikací zkrácen interval podávání. Potřeba častější aplikace vyvo-lávala obavy z kumulace nežádoucích účinků, eventuálně i z možné zvýšené imunogenicity, ty se však nepotvrdily [14,15,21].
Intravenózní podávání vyžaduje pravidelné návštěvy zdravotnického zařízení s nutností pobytu po dobu podání infuze každé čtyři týdny, což může být pro některé pacienty omezující a často obtížně slučitelné s pracovními povinnostmi. Vzhledem k tomuto byla hledá-na jiná aplikační cesta tocilizumabu a byla prováděna klinická hodnocení subkutánního podávání. Bylo nutno překonat řadu úskalí, a sice především malý objem injekce v poměru k dávce tocilizumabu s přihlédnutím k jeho omezené rozpustnosti (180 mg/ml). Vzhledem k tomuto musí být pro dosažení účinku srovnatelného s intravenózní aplikací zkrácen interval podávání. Potřeba častější aplikace vyvo-lávala obavy z kumulace nežádoucích účinků, eventuálně i z možné zvýšené imunogenicity, ty se však nepotvrdily [14,15,21].
Studie MATSURI
MATSURI byla multicentrická otevřená studie fáze I/II, jejímž cílem bylo vyhodnotit optimální dávku subkutánní formy tocilizumabu u pacientů s RA, která by byla ekvivalentní k intravenózní dávce 8 mg/kg. Pacienti byli rozděleni do skupin podle dávky a periody podá-vání studijní medikace: 8 pacientů dostávalo tocilizumab v dávce 81 mg každé dva týdny, 12 pacientů dávku 162 mg každé dva týdny, 12 pacientů s RA pak dostávalo dávku 162 mg každý týden po dobu 24 týdnů. Sérové koncentrace tocilizumabu ≥ 1 µg/ml ekvivalentní dávce tocilizumabu 8 mg/kg podávané intravenózně dosáhli pacienti, jimž bylo podáno každý týden subkutánně 162 mg tocilizumabu; to se odrazilo i v normalizaci CRP a zlepšení hodnot podle klasifikačních kritérií American College of Rheumatology (ACR) pro RA ozna-čovaných jako ACR20, ACR50 a ACR70. Nejčastějšími nežádoucími účinky byly laboratorní abnormality v oblasti lipidového spektra a infekce horních cest dýchacích [15].
Studie BREVACTA, SUMMACTA a MUSASHI
BREVACTA, SUMMACTA a MUSASHI byly rozsáhlé studie fáze III hodnotící účinnost a bezpečnost subkutánního tocilizumabu v terapii RA.
BREVACTA byla randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie s dvojitě zaslepenou periodou trvající 24 týdnů, která byla následována otevřeným 72týdenním pokračováním. Celkem 656 pacientů s RA bylo randomizováno v poměru 2 : 1 (tocilizu-mab 162 mg vs. placebo). Studijní medikace byla podávána každý druhý týden, ve 12. týdnu bylo možno v rámci záchranné léčby pře-vést pacienty, kteří nedosáhli alespoň 20% terapeutické odpovědi (ACR20), na podávání tocilizumabu každý týden. Primárním cílem studie bylo dosažení skóre ACR20 ve 24. týdnu. Sekundárním cílem bylo dosažení skóre ACR50 a ACR70, zhodnocení radiografické progrese a bezpečnosti léčby. Obou cílů bylo dosaženo. Ve 24. týdnu dosáhlo ACR20 60,9 % pacientů dostávajících tocilizumab a pouze 31,5 % pacientů z placebové skupiny (p < 0,0001). Odpovědi ACR50 dosáhlo 40 % oproti 12 % (p < 0,0001) a ACR70 docílilo 20 % oproti 5 % pacientů (p < 0,0001) ve prospěch pacientů dostávajících tocilizumab. Pokles skóre DAS28 (Disease Activity Score 28) na hodnotu nižší než 2,6 byl zaznamenán u 32 % pacientů ve skupině s tocilizumabem, ale pouze u 4 % pacientů ze skupiny s placebem (p < 0,0001). Průměrná změna modifikovaného Sharpova van der Heijde skóre byla statisticky signifikantně nižší u skupiny s tocilizumabem oproti placebu (0,62 vs. 1,23; p = 0,0149). Výskyt nežádoucích účinků byl v obou skupinách srovnatelný. Nicméně v průběhu sledování došlo ke třem úmrtím ve skupině pacientů, kde byl podáván tocilizumab (sepse – původce Haemophilus influenzae, sepse z gastrointestinální příčiny, infekce dolních cest dýchacích) [22].
SUMMACTA byla studie, jejímž cílem bylo srovnání účinku intravenózního tocilizumabu (8 mg/kg každé 4 týdny + placebo s.c. každý týden, n = 631) s jeho subkutánní formou (162 mg týdně + placebo i.v. každé 4 týdny, n = 558) v kohortě 1 262 pacientů. Primár-ním cílem bylo prokázat rovnocenný účin![Graf 2a–c Výsledky sledovaných parametrů aktivity a funkčních zhodnocení v týdnu 24 u pacientů s revmatoidní artritidou ve studii SUMMACTA; podle [13] – Burmester, et al., 2014. ACR – skóre podle klasifi kačních kritérií American College of Rheumatology (ACR); CI –confi dence interval, interval spolehlivosti; DAS – Disease Activity Score, skóre aktivity nemoci; HAQ – dotazník dle Health Assessment. Questionnaire; TCZ – tocilizumab; WMD – weighted mean diff erence, vážená hodnota průměrného rozdílu](https://www.remedia.cz/photo-a-30098---.jpg) ek subkutánní a intravenózní formy tocilizumabu v dosažení terapeutické odpovědi ACR20 ve 24. týdnu. Sekundárním cílem pak bylo zhodnocení terapeutického účinku pomocí kritérií DAS28, skóre ACR50 a ACR70, dotazníku HAQ (Health Assessment Questionnaire) a bezpečnosti léčby. Primárních i sekundárních cílů bylo dosaženo a obě formy vykazovaly srovnatelné výsledky z hlediska účinnosti i bezpečnosti (graf 2a–c) [13].
ek subkutánní a intravenózní formy tocilizumabu v dosažení terapeutické odpovědi ACR20 ve 24. týdnu. Sekundárním cílem pak bylo zhodnocení terapeutického účinku pomocí kritérií DAS28, skóre ACR50 a ACR70, dotazníku HAQ (Health Assessment Questionnaire) a bezpečnosti léčby. Primárních i sekundárních cílů bylo dosaženo a obě formy vykazovaly srovnatelné výsledky z hlediska účinnosti i bezpečnosti (graf 2a–c) [13].
Studie MUSASHI měla obdobný cíl jako SUMMACTA, jen s tím rozdílem, že subkutánní tocilizumab v dávce 162 mg byl podáván každé dva týdny a studie byla zaměřena na japonskou populaci pacientů s RA. Byl rovněž prokázán srovnatelný účinek obou způsobů podávání tocilizumabu [21].
Závěr
Klinické studie BREVACTA, SUMMACTA a MUSASHI zaměřené na subkutánní tocilizumab poskytly data podporující tuto formu podávání. Subkutánní tocilizumab prokázal účinnost v terapii RA včetně ovlivnění rentgenové progrese srovnatelnou s intravenózní formou jak v monoterapii, tak v kombinaci s DMARD. Rozdíly v četnosti podávání subkutánní formy jednou týdně a jednou za čtrnáct dní byly dány výběrem specifické populace pacientů, pro evropské nemocné se jeví jako optimální interval podávání tocilizumabu jednou týdně v dávce 162 mg.
Možnost výběru mezi dvěma formami podávání tocilizumabu poskytne příležitost zvolit optimální způsob aplikace léčiva, který respektuje individuální potřeby a možnosti pacienta s revmatoidní artritidou.
Práce byla podpořena projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 00023728 (Revmatologický ústav).
Seznam použité literatury
- [1] Scott DL, Wolfe F, Huizinga TW. Rheumatoid arthritis. Lancet 2010; 376: 1094–1108.
- [2] Kaplan MJ. Role of neutrophils in systemic autoimmune diseases. Arthritis Res Ther 2013; 15: 219.
- [3] Hohensinner PJ, Goronzy JJ, Weyand CM. Targets of immune regeneration in rheumatoid arthritis. Mayo Clin Proc 2014; 89: 563–575.
- [4] Feldmann M, Maini RN. Anti TNF alpha therapy of rheumatoid arthritis: what have we learned? Annu Rev Immunol 2001; 19: 163–196.
- [5] Matsumoto I, Inoue A, Takai C, et al. Regulatory roles of tumor necrosis factor alpha induced proteins (TNFAIPs) 3 and 9 in arthritis. Clin Immunol 2014; 153: 73–78.
- [6] Hirano T, Yasukawa K, Harada H, et al. Complementary DNA for a novel human interleukin (BSF 2) that induces B lymphocytes to produce immunoglobulin. Nature 1986; 324: 73–76.
- [7] Akira S, Taga T, Kishimoto T. Interleukin 6 in biology and medicine. Adv Immunol 1993; 54: 1–78.
- [8] Ogata A, Hirano T, Hishitani Y, Tanaka T. Safety and Efficacy of Tocilizumab for the Treatment of Rheumatoid Arthritis. Clin Med Insights Arthritis Musculoskelet Disord 2012; 5: 27–42.
- [9] Kishimoto T. Interleukin 6: from basic science to medicine – 40 years in immunology. Annu Rev Immunol 2005; 23: 1–21.
- [10] Alonso RB, Bilbao MA. Inhibition of interleukin 6, a new therapeutic option in rheumatoid arthritis. Reumatol Clin 2009; 5: 121–127.
- [11] Souhrn údajů o přípravku RoActemra, dostupné na http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_ _Product_Information/human/000955/WC500054890.pdfk (navštíveno 1. 12. 2014)
- [12] Kimura A, Kishimoto T. IL 6: regulator of Treg/Th17 balance. Eur J Immunol 2010; 40: 1830–1835.
- [13] Burmester GR, Rubbert Roth A, Cantagrel A, et al. A randomised, double blind, parallel group study of the safety and efficacy of subcutaneous tocilizumab versus intravenous tocilizumab in combination with traditional disease modifying antirheumatic drugs in patients with moderate to severe rheumatoid arthritis (SUMMACTA study). Ann Rheum Dis 2014; 73: 69–74.
- [14] Zhang X, Georgy A, Rowell L. Pharmacokinetics and pharmacodynamics of tocilizumab, a humanized anti interleukin 6 receptor monoclonal antibody, following sin-gle dose administration by subcutaneous and intravenous routes to healthy subjects. Int J Clin Pharmacol Ther 2013; 51: 443–455.
- [15] Ohta S, Tsuru T, Terao K, et al. Mechanism based approach using a biomarker response to evaluate tocilizumab subcutaneous injection in patients with rheumatoid arthritis with an inadequate response to synthetic DMARDs (MATSURI study). J Clin Pharmacol 2014; 54: 109–119.
- [16] Kim S, Östör AJ, Nisar MK. Interleukin 6 and cytochrome P450, reason for concern? Rheumatol Int 2012; 32: 2601–2604.
- [17] Smolen JS1, Schoels MM, Nishimoto N, et al. Consensus statement on blocking the effects of interleukin 6 and in particular by interleukin 6 receptor inhibition in rheumatoid arthritis and other inflammatory conditions. Ann Rheum Dis 2013; 72: 482–492.
- [18] Nishimoto N, Miyasaka N, Yamamoto K, et al. Study of active controlled tocilizumab monotherapy for rheumatoid arthritis patients with an inadequate response to methotrexate (SATORI): significant reduction in disease activity and serum vascular endothelial growth factor by IL 6 receptor inhibition therapy. Mod Rheumatol 2009; 19: 12–19.
- [19] Emery P, Keystone E, Tony HP, et al. IL 6 receptor inhibition with tocilizumab improves treatment outcomes in patients with rheumatoid arthritis refractory to anti tumour necrosis factor biologicals: results from a 24 week multicentre randomised placebo controlled trial. Ann Rheum Dis 2008; 67: 1516–1523.
- [20] Jones G. The AMBITION trial: tocilizumab monotherapy for rheumatoid arthritis. Expert Rev Clin Immunol 2010; 6: 189–195.
- [21] Ogata A, Tanimura K, Sugimoto, et Musashi Study Investigators. Phase III study of the efficacy and safety of subcutaneous versus intravenous tocilizumab monotherapy in patients with rheumatoid arthritis. Arthritis Care Res (Hoboken) 2014; 66: 344–354.
- [22] Kivitz A, Olech E, Borofsky M, et al Subcutaneous tocilizumab versus placebo in combination with disease modifying antirheumatic drugs in patients with rheumatoid arthritis. Arthritis Care Res (Hoboken) 2014; 66: 1653–1661.