Perspektivy hypolipidemické léčby aneb Co umíme a co se nám moc nedaří
V poslední době padl další mýtus – ateroskleróza není „civilizačním“ onemocněním, byla zcela běžná již před třemi až čtyřmi tisíci lety.
V poslední době padl další mýtus – ateroskleróza není „civilizačním“ onemocněním, byla zcela běžná již před třemi až čtyřmi tisíci lety. Jak ukázalo vyšetření 52 staroegyptských mumií v rámci studie HORUS, pokročilejší aterosklerotické změny v oblasti karotid, v koronárním či v tepenném zásobení končetin byly přítomny u plných 45 % jedinců, kteří zemřeli ve čtvrté až šesté věkové dekádě [1]. Zdá se tedy, že ateroskleróza provází lidstvo mnohem déle, než jsme si dosud uvědomovali. A je tak nanejvýš nepravděpodobné, že se nám kdy podaří aterotrombotická onemocnění „eradikovat“, jak si to vzala za cíl jedna z posledních sovětských „pětiletek“. O to důležitější je účinná a bezpečná léčba. Jedna ze strategií prevence a léčby aterotrombotických příhod je směřována na léčbu dyslipidemie. Nad otázkami „Proč?“, „Kde jsme?“ a „Kudy směřuje vývoj?“ se zamýšlí tento článek.
Když hodnotíme současný stav léčby dyslipidemií, můžeme vidět určité schizma. Na jedné straně velmi účinná léčba snižující vysoké hladiny cholesterolu vázaného v lipoproteinech o nízké hustotě (LDL-C). Doložen máme významný dopad na zlepšení prognózy jak pro statiny, jež blokují syntézu cholesterolu, tak pro pryskyřice vázající žlučové kyseliny ve střevě a zvyšující katabolismus cholesterolu [2]. Pro třetí z trojice – ezetimib (inhibitor transportního proteinu NPC1L1, který umožňuje resorpci cholesterolu) – doklad o efektu na prognózu zatím dán nebyl. Prognostická studie IMPROVE-IT však stále probíhá. Dosud doložený pokles hladiny LDL-C o pětinu je z pohledu strategie dosahování cílových hodnot jistě významný, prognostickou studii však nenahradí.
Na straně druhé pokulhávají postupy, které zvyšují hladinu cholesterolu vázaného ve vysokodenzitním lipoproteinu (HDL-C). Pro fibráty jsou zatím nálezy nejednoznačné, doložen je sice pokles výskytu kardiovaskulárních příhod, nikoli však snížení mortality. V případě inhibitoru CETP (cholesterol ester transfer protein) torcetrapibu, zvyšujícího hladinu HDL-C o neuvěřitelných 50–80 %, byl pozorován dokonce výrazně negativní dopad na prognózu. Mírné zvýšení krevního tlaku stimulací výdeje aldosteronu, které je označováno jako hlavní příčina negativního účinku, se mohlo podílet na negativním dopadu studie ILLUMINATE, s více než 50% vzestupem mortality, jen menším dílem.
Podíváme-li se na vývoj v léčbě dyslipidemií, vidíme plejádu velmi zajímavých léčebných strategií směřovaných jak na ovlivnění LDL-C, tak HDL-C. Pro lepší pochopení mechanismů nebude na škodu zrekapitulovat současný pohled na lipoproteiny typu LDL a HDL. Zdaleka již neplatí, že se jedná jen o částice umožňující transport lipidů. Jejich biologický význam, jak bude ukázáno, je daleko širší.
Význam lipoproteinu o nízké hustotě (LDL) a lipoproteinu (a)
Nízkodenzitní lipoprotein (low-density lipoprotein – LDL) je jedním z lipoproteinů transportujících lipidy, zejména cholesterol a triglyceridy, do tkání. Každá částice obsahující především estery cholesterolu a polynenasycené mastné kyseliny v jádře a fosfolipidy s neesterifikovaným cholesterolem v kůře nese jednu molekulu apolipoproteinu B-100 (apo B-100). Tento apolipoprotein pomáhá udržet vlastní micelu v rozpustném stavu v plazmě a zejména aktivuje receptor pro LDL (LDL receptor), jehož pomocí předává svůj obsah zejména cholesterolu do tkání.
Nicméně apo B-100 má ještě řadu dalších funkcí. Kontroluje hlavně řadu pochodů v rámci zánětlivých a reparačních dějů v cévní stěně (zejm. aktivací sekreční fosfolipázy A2 – sPLA2). Dále ovlivňuje metabolismus a degradaci lipidů v subendoteliálním prostoru (např. hydrolýzou sfingomyelinu na ceramid či oxidací lipidů). V neposlední řadě je významná aktivace trombocytů, apo B-100 se tak zapojuje do hemostázy (cestou stimulace lipoproteinové fosfolipázy A2 – Lp-PLA2). Stejný enzym pak aktivuje též monocyty a makrofágy [3]. Nelze nezmínit též ovlivnění tonu cévní stěny, a tak i tkáňové perfuze. Toho je docíleno řadou mechanismů, například aktivací endotelií či modulací funkce adrenergních receptorů a1 či receptorů pro angiotenzin II typu 1 (AT1) [4]. Tak se do lidské patofyziologie promítá fylogeneticky prastarý princip, kdy trofické a reparační pochody sdružovaly nejen aktivaci zánětu, hemostázy, ale i perfuzi tkání jako přímou odpověď na poškození.
Akumulace lipidů, převážně původu z LDL i vlastních LDL částic v cévní stěně a jejich oxidace, glykosylace či jiná modifikace, je klíčovým momentem aterogeneze. Setrvání LDL v subendoteliálním prostoru je umožněno vazbou apo B-100 na proteoglykany matrix. Aktivované endotelie uvolní řadu vazoadhezních molekul (selektinů a integrinů), které umožní penetraci monocytů/makrofágů arteriální intimou. Modifikované lipidy jsou fagocytovány pomocí specifických receptorů makrofágy a část těchto makrofágů již není schopna vycestovat a zůstává ve tkáni jako pěnové buňky. Tyto buňky jsou pak nejen podkladem aterosklerotické léze, ale produkcí oxidačních či proteolytických enzymů (metaloproteináz) a zánětlivých cytokinů (zejména tumor necrosis faktoru α – TNF-α, interleu-kinu-1 – IL-1) akcelerují aterogenezi a degradací krytu plátu vedou k destabilizaci léze a k trombotické okluzi.
Mluvíme-li o zvýšeném riziku trombotické okluze, nelze se nezmínit o subpopulaci LDL – lipoproteinu (a) – Lp(a); ten má obdobou strukturu jako LDL, rozdíl je však ten, že kovalentní vazbou je k jeho apolipoproteinu apo B navázán další biologicky aktivní protein – apolipoprotein (a). Koncentrace Lp(a) v populaci výrazně kolísá, interindividuální variabilita se liší až o tři řády. Přítomnost apolipoproteinu (a) snižuje trombolytický potenciál endotelu. Vlastní protein tvoří na povrchu lipoproteinu řadu „kliček“, které mají obdobnou strukturu jako plazminogen a aktivátor tkáňového plazminogenu (tPA). Vzájemnou kompeticí katalytické sekvence apo(a) a 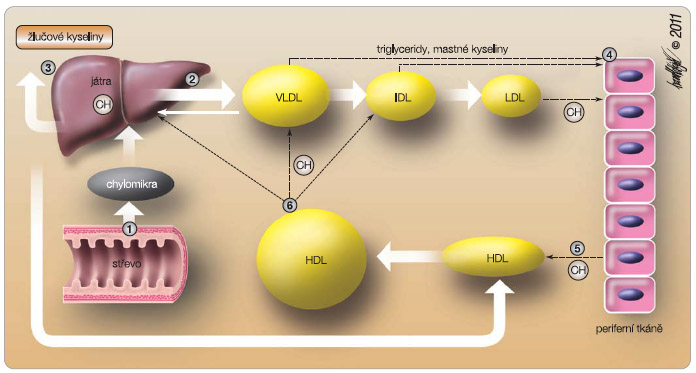 plazminogenu dochází k inhibici fibrinolýzy. Navíc Lp(a) stimuluje sekreci přirozeného inhibitoru fibrinolýzy PAI-1 (inhibitor aktivátoru plazminogenu 1), čímž též přispívá k trombogenezi.
plazminogenu dochází k inhibici fibrinolýzy. Navíc Lp(a) stimuluje sekreci přirozeného inhibitoru fibrinolýzy PAI-1 (inhibitor aktivátoru plazminogenu 1), čímž též přispívá k trombogenezi.
Tento nástin pochodů ukazuje na klíčovou úlohu LDL v iniciaci a progresi aterosklerózy i v trombogenezi. Nepřekvapí proto, že většina úspěšných léčebných strategií byla cílena na snížení hladiny právě LDL (obr. 1).
Význam lipoproteinu o vysoké hustotě (HDL)
V biologických systémech, tedy i u člověka, musí fungovat vyváženost kontrolních mechanismů. V případě aterotrombotického procesu je tak efekt LDL vyvažován zejména aktivitou vysokodenzitního lipoproteinu HDL. Podobně jako LDL má HDL funkci nejen v transportu lipidů, je také částicí multifunkční – pleiotropní. Populace HDL je výrazně heterogenní, na jedné straně máme „mladou“ diskoidní částici HDL3 tvořenou apolipoproteiny a dvojvrstvou membrány fosfolipidů, na straně druhé vidíme „zralou“ sférickou částici HDL2 s jádrem naplněným estery cholesterolu. Rozdílná funkce je dána rozdílným osazením jednotlivých částic HDL mozaikou apolipoproteinů. Hlavním apolipoproteinem je apo A-I, dále jsou však přítomny apolipoproteiny další, např. apo A-II až IV, apo C či apo E. Primární funkcí apo A-I je reverzní transport cholesterolu z makrofágů ve tkáních do jater, navíc však může stabilizovat některé vazodilatační, mitogenní a antiagregační působky (zejména prostacyklin) a tak významně prodloužit jejich efekt. Apo A-II, druhý nejčastěji se vyskytující apolipoprotein, má odlišný účinek. Útlumem řady enzymů inhibuje hepatální hydrolýzu HDL, zpomaluje obrat HDL2, což vede k proaterogennímu a negativnímu metabolickému účinku [5]. Ostatní apolipoproteiny jsou začleněny do metabolismu triglyceridů a jejich úloha v HDL je méně významná.
Úkolem vysokodenzitních lipoproteinů je odsun přebytečného cholesterolu z tkání, konkrétně z makrofágů stěny tepny, a jeho předání – při nadbytku cholesterolu – do jater k vyloučení do žluče; naopak při jeho nedostatku je cholesterol přesunut do lipoproteinů typu VLDL (lipoproteiny o velmi nízké hustotě) či IDL (lipoproteiny se střední hustotou), viz obr. 1. Reverzní transport cholesterolu je zprostředkován pouze aktivitou HDL. Zapojeny jsou dva mechanismy: aktivní reverze cestou transportních proteinů typu ABC uplatňujícího se u diskoidních částic, či pasivní cestou gradientu se zapojením receptoru SR-BI (scavenger receptor B typu I), který hraje dominantní úlohu u částic sférických. Vedle odsunu cholesterolu plní HDL ještě další funkce. Je pasivním transportérem řady lipofilních látek (např. amyloidu) z tkání do jater, jeho povrch je osazen některými enzymy (např. paroxonázou) inhibujícími oxidaci lipidů či inhibičními lipidy (např. kardiolipinem) blokujícími řadu koagulačních faktorů. O vazodilatační a protidestičkové úloze apo A-I byla již zmínka. Nejvýznamnější „extralipidovou“ funkcí je však pravděpodobně protizánětlivý účinek HDL. Na straně jedné tlumením exprese vazoadhezních molekul inhibuje vstup i maturaci monocytů/makrofágů do subendoteliálního prostoru, na straně druhé snižuje sekreci řady prozánětlivých cytokinů, zejména TNF-α [6].
O významu jednotlivých podtypů HDL v prevenci aterogeneze nepanuje shoda. Na jedné straně jsou diskoidní, cholesterolem „nenasycené“ částice biologicky aktivnější. Na straně druhé se traduje, že epidemiologické studie ukazují, že osoby s vysokým rizikem aterogeneze mají vyšší hladinu diskoidních HDL3 a naopak nižší hladinu sférických HDL2. Recentní pozorování a rozbor stávajících deseti epidemiologických studií dokládá důležitost obou subfrakcí HDL [7].
Pro význam HDL3 svědčí zjištění, že zvýšení hladiny HDL2 na úkor HDL3 při léčbě blokátorem CETP torcetrapibem ve studii ILLUMINATE nevedlo k potlačení aterogeneze. Také významnější inhibice primární hemostázy aktivitou receptorů SR-B1 v „mladých“ částicích ukazuje na význam právě HDL3 [8]. Z pohledu farmakoterapie se tak zdá, že není optimální zpomalit degradaci HDL2 a zvýšit obsah cholesterolu v těchto částicích, naopak výhodnější bude pravděpodobně urychlení cirkulace cholesterolu od jeho předání pěnovou buňkou, přes jeho transport v částicích HDL3 a HDL2, až po jeho přesun do jater a eliminaci do žluče. Stanovování či ovlivňování vlastní koncentrace cholesterolu v HDL nemusí být tak důležité, výhodnější je sledování a intervenování koncentrace apo A-I.
Nastíněný a velmi zjednodušený přehled ukazuje na rizika spojená s intervencí dyslipidemie. Ta nejsou omezena pouze na akumulaci či reverzi lipidů z cévní stěny, ale na komplexní působení – od zásahu do tkáňové perfuze, primární a sekundární hemostázy, zánětlivých a reparačních pochodů, až po látkovou výměnu na úrovni celého organismu. Znalost funkce a fyziologických pochodů pomůže při pochopení nově se naskytujících možností terapeutického zásahu.
Význam dalších složek lipidového spektra, zejména triglyceridů, není jednoznačný. Nepanuje shoda v určení jejich významu a v optimálním léčebném přístupu. Pro složitost situace se raději rekapitulaci funkce a možností intervence kvůli omezenému prostoru vyhýbám. Obecně však platí, že význam triglyceridů je zejména v jejich působení na aterogenní a antiaterogenní lipoproteinové částice, kdy obsah triglyceridů mění jejich velikost, biologickou aktivitu, náchylnost k oxidaci i schopnost průniku do subendoteliálního prostoru.
Možnosti snížení hladiny LDL cholesterolu
Logickou a zatím nejúspěšnější léčebnou strategií je snížení hladiny nízkodenzitních lipoproteinů – LDL, resp. obsahu cholesterolu v nich – LDL-C. Možností je více: snížení nabídky cholesterolu v potravě, snížení resorpce cholesterolu ve střevě, snížení nabídky jednotlivých komponent aterogenních lipidů (zejména apo B, cholesterolu, triglyceridů) v játrech či zvýšení katabolismu cholesterolu.
Dietní opatření
Historicky nejstarší, středně účinnou, ale obtížně aplikovatelnou cestu představuje snížení přísunu exogenního cholesterolu, tedy dietní opatření. Analýza výsledků intervence u 130 000 probandů sledovaných v rámci Nurses’ Health Study a Health Professionals’ Follow-up Study doložila, že jen malá část účastníků studie byla schopna dlouhodobě dodržovat dietu. Po 26 letech dodržování diety s větším přísunem zeleniny a s restrikcí kalorií došlo k poklesu kardiovaskulární úmrtnosti o 23 % [9]. Výsledky byly modifikovány tím, že byla intervenována zdravotnická populace, v praxi u obecné populace nikdy nebylo dosaženo obdobných výsledků. Velká metaanalýza 38 „dietologických“ studií z Cochranova institutu doložila asi 5% pokles hladiny LDL-C (o 0,18 mmol/l) a obdobný pokles celkového cholesterolu (o 0,16 mmol/l), žádný účinek nebyl pozorován na hladinu triglyceridů či HDL-C [10]. Nutno zdůraznit velmi nízkou úroveň prací, žádná ze studií totiž nesplňovala nároky na ni kladené z pohledu současných požadavků „medicíny založené na důkazech“. Recentní pokus nalézt alespoň jednu kvalitní studii zcela ztroskotal, nebyla nalezena ani jedna studie zaměřená na dietní opatření, která by splňovala současné nároky na kvalitu [11]. Shrneme-li, máme málo kvalitních informací o dopadu intervence dietou, efekt je relativně malý (pokles koncentrace LDL-C o méně než 5 % není přesvědčivý) a jen u „osvícené“ populace při aplikaci dietních opatření trvajících několik desítek let je doložen významný pokles kardiovaskulární mortality.
Inhibice resorpce cholesterolu
Druhou cestou snížení přísunu cholesterolu je blokáda enterální resorpce (obr. 2). Tato strategie inhibuje nejen vstřebávání cholesterolu exogenního, ale též kvantitativně výrazně většího množství cholesterolu, který cirkuluje v enterohepatálním cyklu. Na straně enterálních mikroklků je resorpce cholesterolu závislá na Niemanově-Pickově C1-L1 proteinu (NPC1L1), který umožní vstřebání cholesterolu vezikulární endocytózou ve střevě a eliminaci nadbytečného cholesterolu hepatocytem do žluče. Účinným inhibitorem tohoto proteinu je ezetimib, užívaný již léta. Jak bylo řečeno, efekt na snížení hladiny LDL-C je významný. Průkaz ovlivnění prognózy zatím podán nebyl, budeme muset počkat do zveřejnění výsledků studie IMPROVE-IT. Ve fázi vývoje jsou inhibitory acetylace cholesterolu v enterocytu, což je krok nutný k jeho dalšímu transportu do jater.
Vývoj ve skupině inhibitorů ACAT (acyl-CoAcholesterolacyltransferázy) dlouho stagnoval, nicméně v poslední době je opět aktivní, v preklinické fázi vývoje se nacházejí nadějné deriváty dříve testovaného pactimibu. V experimentu se ukazuje, že inhibice ACAT povede nejen k inhibici resorpce, ale též ke snížení oxidace cholesterolu v subendoteliálním prostoru, k modifikaci funkce makrofágů a ke zpomalení aterogeneze [12]. Resorpci cholesterolu můžeme tlumit též zvýšeným příjmem fytosterolů v potravě. Nicméně i v tucích s vysokým obsahem fytosterolů není výsledná koncentrace tak veliká, aby tuk kaloricky významně nezatěžoval léčeného, rovněž doklad o dopadu fytosterolů na prognózu není doložen.
Třetí možností snížení hladiny aterogenních lipidů je cesta inhibice hepatální syntézy VLDL – lipoproteinu o velmi nízké hustotě, který transportuje zejména triglyceridy a cholesterol. K syntéze tohoto prvého lipoproteinu z řetězce VLDL – IDL – LDL jsou vedle cholesterolu potřeba triglyceridy, fosfolipidy a bílkovinná složka apolipoprotein B (apo B). V současné době máme několik možností, jak inhibovat syntézu aterogenních lipoproteinů snížením nabídky jejich komponent.
Inhibice biosyntézy cholesterolu – statiny
Blokáda syntézy cholesterolu inhibitory 3-hydroxy-3-methylglutaryl koenzym A reduktázy – statiny – je zatím nejúspěšnější cestou zásahu do syntézy cholesterolu. V celém řetězci steroidogeneze blokujeme prvý krok ![Graf 1 Srovnání efektu statinů na pokles hladiny LDL cholesterolu (LDL-C); podle [31] – Jones, et al., 2003.](https://www.remedia.cz/photo-a-28333---.jpg) syntézy, prekurzor acyl-CoA se nehromadí a není toxický. Pokusy o inhibici syntézy v pokročilejších stadiích nebyly úspěšné, vždy se hromadil víceméně toxický meziprodukt. Doložen je účinek na snížení mortality a morbidity v celé plejádě statinů, pokles celkové mortality se pohybuje kolem 20–30 %, pokles výskytu aterotrombotických příhod kolem 40–60 % v rámci primární či sekundární prevence. Efekt je
syntézy, prekurzor acyl-CoA se nehromadí a není toxický. Pokusy o inhibici syntézy v pokročilejších stadiích nebyly úspěšné, vždy se hromadil víceméně toxický meziprodukt. Doložen je účinek na snížení mortality a morbidity v celé plejádě statinů, pokles celkové mortality se pohybuje kolem 20–30 %, pokles výskytu aterotrombotických příhod kolem 40–60 % v rámci primární či sekundární prevence. Efekt je ![Graf 2 Srovnání efektu statinů na vzestup hladiny HDL cholesterolu (HDL-C); podle [31] – Jones,et al., 2003.](https://www.remedia.cz/photo-a-28334---.jpg) významně závislý na dosaženém snížení hladiny LDL-C, včasnosti iniciace léčby a na délce podávání. Platí tak triáda – „čím níže, tím lépe“, „čím dříve, tím lépe“ a „čím déle, tím lépe“. Mezi jednotlivými statiny můžeme najít rozdíly v účinku. Vycházíme-li z „lipidové“ teorie rizika, pak bude významné procentuální snížení hladiny LDL-C a zvýšení HDL-C. V grafu 1 a 2 je patrno, že rosuvastatin s nejdelším biologickým poločasem má největší dopad na příznivé ovlivnění lipidogramu [31]. Přitom má velmi dobrý poměr bezpečnost/účinnost a nízký potenciál k lékovým interakcím.
významně závislý na dosaženém snížení hladiny LDL-C, včasnosti iniciace léčby a na délce podávání. Platí tak triáda – „čím níže, tím lépe“, „čím dříve, tím lépe“ a „čím déle, tím lépe“. Mezi jednotlivými statiny můžeme najít rozdíly v účinku. Vycházíme-li z „lipidové“ teorie rizika, pak bude významné procentuální snížení hladiny LDL-C a zvýšení HDL-C. V grafu 1 a 2 je patrno, že rosuvastatin s nejdelším biologickým poločasem má největší dopad na příznivé ovlivnění lipidogramu [31]. Přitom má velmi dobrý poměr bezpečnost/účinnost a nízký potenciál k lékovým interakcím.
Snížení nabídky triglyceridů – niacin a fibráty
Druhou složkou aterogenních lipidů jsou triglyceridy. Jejich nabídku snižuje jak niacin, tak fibráty. Účinek niacinu je komplexní, v efektu na pokles triglyceridemie se nejspíše uplatňuje antilipolytický efekt cestou inhibice adenylylcyklázy v adipocytech. Současně však zvyšuje nabídku HDL-C. Prvým mechanismem zvýšení hladiny HDL-C je zřejmě snížení přesunu cholesterolu do aterogenních lipidů a zvýšení vychytávání cholesterolu z HDL v játrech, druhým je zpomalení degradace HDL [13]. Niacin je lékem užívaným několik desítek let, pro častý výskyt „návalů“ byl léta opomíjen, byť byl doložen příznivý prognostický efekt. Sekundárně preventivní studie CDP s monoterapií niacinem doložila 27% pokles výskytu nefatálního infarktu myokardu po pěti letech sledování a 16% pokles celkové mortality po 15 letech sledování. Nález pak potvrdila též metaanalýza 9 studií provedených se samotným neretardovaným niacinem [14].
Vzhledem k nedostatečné snášenlivosti neretardovaného niacinu se většího uplatnění jistě dočká inovovaná retardovaná forma niacinu kombinovaná s laropiprantem, blokátorem prostaglandinových receptorů D2 v epidermis, které jsou zodpovědné za vlastní vazodilataci a flush. Tolerance této kombinované formy niacinu s laropiprantem je výrazně lepší. Prognostická studie s fixní kombinací probíhá (HPS2-THRIVE), výsledky jsou očekávány nejdříve v roce 2013. K dalšímu zlepšení tolerance jsou vyvíjeny nové aktivátory niacinového receptoru, které by neovlivňovaly D2 receptory v Langerhansových buňkách epidermis, jež jsou zodpovědné za flush [15].
Rovněž deriváty kyseliny fibrové – fibráty – byly zavedeny již v 80. letech. Jejich mechanismus účinku – stimulace peroxizomálních transkripčních receptorů a – je rovněž komplexní. Regulací syntézy řady enzymů (zejména lipoproteinové lipázy) a apolipoproteinů účastnících se lipolýzy a b-oxidace mastných kyselin snižují hladinu triglyceridů (asi o třetinu) a v malé míře (asi o 5 %) zvyšují nabídku HDL-C. Dopad na pokles hladiny LDL-C je minimální. Prognostická data pro fibráty jsou nejednoznačná. Populace zařazená do dvou megastudií FIELD a ACCORD bohužel nereprezentovala optimální cílovou skupinu nemocných, tedy nemocné s nízkou hladinou HDL-C a optimálně též s hypertriglyceridemií. Ve studii FIELD byl sice pozorován pokles výskytu kardiovaskulárních příhod, nicméně kardiovaskulární či celková mortalita měla tendenci k vzestupu, ve druhé studii fibrát v kombinaci se statinem neměl žádný efekt na výskyt kardiovaskulární mortality či morbidity. Post hoc analýzy těchto studií s fenofibrátem v podskupině nemocných s nízkou hladinou HDL-C a vysokou hladinou triglyceridů ukázaly pouze trend ke snížení výskytu závažných kardiovaskulárních příhod. Teprve metaanalýza pěti velkých studií s fibráty dokládá významný pokles incidence kardiovaskulárních onemocnění o 17 % v populaci s nízkou hladinou HDL-C, o 28 % v populaci s hypertriglyceridemií a o 30 % u pacientů s kombinací obou typů dyslipidemie [16]. Nutno však zdůraznit, že pokles kardiovaskulární či celkové mortality ve studiích s fibráty doložen nebyl.
Postupy cílené na nabídku a funkci apolipoproteinu B
Ve fázi klinického hodnocení se nachází zajímavá skupina inhibitorů MTP (microsomal triglyceride transfer protein). Principem působení je inhibice vazby triglyceridů s apo B v játrech, výsledkem je snížení syntézy VLDL a druhotně též nabídky LDL. Nejpokročilejší, tedy 3. fází hodnocení, jež sleduje lipidový efekt u homozygotních nemocných s familiární hypercholesterolemií, prochází lomitapid; dosavadní výsledky hodnocení ukazují pokles hladiny LDL-C o 38 % a v kombinaci s ezetimibem dokonce pokles o 46 % [17].
Další skupinou, rovněž v pokročilé fázi klinického hodnocení, jsou léky snižující syntézu apo B v játrech. Mechanismem je urychlení odbourávání apo B navozené aktivací mRNA, která stimuluje degradaci tohoto klíčového apolipoproteinu aterogenních lipidů. Výsledkem je snížení nabídky apo B se sekundárním poklesem syntézy VLDL, LDL i Lp(a). U nemocných s familiární hypercholesterolemií byl pozorován při léčbě mipomersenem pokles hladiny LDL-C, apo B a Lp(a) o 20–30 % [18]. Nápadná byla velká interindividuální variabilita účinku na hladinu LDL-C, u některých nemocných nebyl zaznamenán žádný efekt, u jiných pokles až o 90 %. V současné době je mipomersen ve 3. fázi hodnocení u nemocných s familiární hypercholesterolemií, sledován je zatím vliv na lipidové spektrum a tolerance (RADICHOL II).
Pro nemocné s familiární hypercholesterolemií je určena i další strategie – zvýšení nabídky LDL receptoru zpomalením jeho degradace. Podpora utilizace cholesterolu ve tkáních vede k poklesu hladiny LDL-C. Odbourávání LDL receptoru v lysozomech je kontrolováno konvertázou PCSK9 (proprotein convertase subtilisin/kexin type 9). V časných fázích vývoje se nacházejí inhibitory konvertázy (protilátkami či anexinem A2).
Urychlení eliminace a zvýšení katabolismu cholesterolu
Poslední strategií snižující nabídku LDL-C je urychlení eliminace cholesterolu či zvýšení katabolismu cholesterolu. Prvou možnost prezentuje podávání ezetimibu – vedle blokády vstřebávání zvyšujeme též odpad cholesterolu z enterohepatálního cyklu i cholesterolu z potravy do stolice. Druhou cestou je zvýšení katabolismu cholesterolu. Jednou z významných cest odsunu cholesterolu z hepatocytu je jeho přeměna na žlučové kyseliny. Zvýšení katabolismu cholesterolu na žlučové kyseliny můžeme dosáhnout navozením deplece žlučových kyselin či aktivní stimulací přeměny cholesterolu na žlučové kyseliny. Prvou možností je podávání pryskyřic, neresorbovatelných polymerů vážících více či méně selektivně žlučové kyseliny ve střevě a zabraňujících jejich resorpci. Sekundárně dochází ke snížení hladiny LDL-C aktivací hepatální přeměny cholesterolu. Přínos cholestyraminu pro snížení kardiovaskulární morbidity byl doložen již v 80. letech minulého století [19]. Pokles hladiny LDL-C je významný, pohybuje se kolem 20 %, efekt je aditivní k působení statinu či ezetimibu. Nicméně pro špatnou toleranci je tato cesta rezervována převážně k léčbě dyslipidemie v graviditě či u mladších dětí, eventuálně k léčbě pruritu při cholestáze. Lépe snášený kolesevelam není zatím v ČR dostupný.
Ve fázi klinického hodnocení jsou thyreomimetika, léky zvyšující syntézu žlučových kyselin stimulací receptoru T3-β, tedy hepatálního receptoru pro trijodtyronin (T3). Na rozdíl od něj však thyreomimetika nestimulují receptory v extrahepatálních tkáních. Ve třetí fázi klinického hodnocení u nemocných s familiární hypercholesterolemií je analog T3 eprotirom. Pokles hladiny LDL-C, apo B i Lp(a) se pohyboval kolem 30 % [20]. Zatím není hlášeno zahájení studií v pokročilejších fázích klinického hodnocení.
Možnosti snížení hladiny lipoproteinu (a)
Účinná léčba vysokých hladin výrazně aterogenního a zejména protrombogenního lipoproteinu Lp(a) je problémem, byť se v reálné praxi s touto problematikou zpravidla nesetkáváme. Stanovení hladin Lp(a) přece jen patří do rukou lipidologa. Z běžně dostupných postupů snižuje hladinu Lp(a) zejména niacin. Též řada léků ve fázi hodnocení, např. eprotirom či mipomersen, snižuje významně jeho hladinu. Specifickým postupem, testovaným zatím jen ve fázi preklinického výzkumu, jsou inhibitory funkce apolipoproteinu (a) na bázi oligonukleotidů [21].
Malé povědomí v lékařské veřejnosti je o významné možnosti snížení hladin Lp(a) kyselinou acetylsalicylovou. Řada studií dokumentuje pokles o 20–30 %. Poslední práce u nemocných po iktu ukazuje pokles při antiagregačních dávkách kyseliny acetylsalicylové dokonce o 40 % [22]. Je možné, že na příznivém prognostickém působení se podílí nejen protidestičkový efekt, ale též úprava fibrinolýzy či antiaterogenní působení.
Možnosti zvýšení hladiny vysokodenzitního lipoproteinu HDL
Jak již bylo řečeno, ovlivnění nízkých hladin cholesterolu v HDL zdaleka není tak úspěšné jako redukce cholesterolu vázaného do LDL částic. Respektive asi bychom se měli více snažit o zvýšení koncentrace vlastních HDL částic nežli o zvýšení obsahu cholesterolu v nich. Navíc, jak bylo řečeno v obecné části, musíme mít na zřeteli, že na funkci HDL má zásadní vliv typ apolipoproteinu, a my bychom se měli snažit o zvýšení populace HDL obsahující apolipoprotein A-I.
Pro inhibici aterogeneze je pravděpodobně významné snížit přesun cholesterolu z lipoproteinu HDL do aterogenních částic VLDL, IDL a LDL. Naopak vychytávání cholesterolu z HDL v játrech je žádoucí. V různé míře a různými mechanismy zde zasahují agonisté peroxizomálních proliferačních receptorů (PPAR) a a g, tj. agonisté PPAR-α – fibráty, agonisté PPAR-gamma – glitazony, a dále duální agonisté PPAR-α a PPAR-gamma – glitazary. Obdobně zasahuje do metabolismu HDL niacin či skupina vyvíjených inhibitorů či modulátorů CETP. Vedle léků zasahujících do funkce transportního proteinu CETP jsou v časných fázích vývoje molekuly přímo stimulující transkripci a syntézu apolipoproteinu A-I, tzv. apo A-I up-regulátory.
Zcela novým postupem je užití rekombinantní technikou získaného apolipoproteinu A-I, účinnějšího analoga apolipoproteinu A-I Milano či mimetik apolipoproteinu A-I, fragmentů různých částí základního řetězce s různě akcentovanou funkcí. Tedy i zde se před farmakoterapií otevírají nové perspektivy, nicméně ani nefarmakologické postupy nelze opominout.
Dietní opatření, zvýšení fyzické aktivity a změny v životním stylu
V ovlivnění nízkých hladin HDL-C má ovlivnění životního stylu ještě větší význam nežli v intervenci LDL, kde účinná léčba je běžně dostupná. Bohužel v oblasti modifikace životního stylu nemáme větší kontrolované studie, takže doporučení se opírá spíše o konsenzus odborníků nežli o hmatatelné důkazy. Jednou z mála výjimek je zde recentní metaanalýza několika desítek studií zabývajících se účinkem malých dávek alkoholu, konkrétně pravidelné 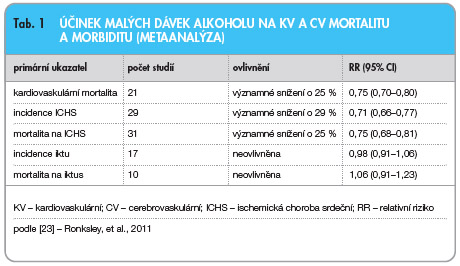 konzumace maximálně 30 g čistého alkoholu denně, např. ve formě vína [23]. Primárním nálezem rozboru 33 studií sledujících laboratorní ukazatele bylo zvýšení hladiny HDL-C i apo A-I asi o 10 % a snížení hladiny fibrinogenu o 20 %, ovlivnění jiných ukazatelů bylo nekonzistentní. Většina studií byla též prognostická – při relativně vysoké homogenitě studií byl doložen pokles morbidity a mortality na kardiovaskulární příhody o čtvrtinu a více, naopak cerebrovaskulární příhody ovlivněny nebyly (tab. 1). Snad se na selhání efektu v profylaxi iktů přece jen podílí negativní dopad alkoholu na vzestup krevního tlaku. Limitem rozboru je skutečnost, že studie byly povětšinou observační, nikoli intervenční. Závěr, že snížení výskytu kardiovaskulárních příhod je důsledkem zvýšení hladiny HDL-C a je v kauzálním vztahu k umírněné konzumaci alkoholu, může být proto nepřesný a příznivý efekt může souviset s celkovým životním stylem.
konzumace maximálně 30 g čistého alkoholu denně, např. ve formě vína [23]. Primárním nálezem rozboru 33 studií sledujících laboratorní ukazatele bylo zvýšení hladiny HDL-C i apo A-I asi o 10 % a snížení hladiny fibrinogenu o 20 %, ovlivnění jiných ukazatelů bylo nekonzistentní. Většina studií byla též prognostická – při relativně vysoké homogenitě studií byl doložen pokles morbidity a mortality na kardiovaskulární příhody o čtvrtinu a více, naopak cerebrovaskulární příhody ovlivněny nebyly (tab. 1). Snad se na selhání efektu v profylaxi iktů přece jen podílí negativní dopad alkoholu na vzestup krevního tlaku. Limitem rozboru je skutečnost, že studie byly povětšinou observační, nikoli intervenční. Závěr, že snížení výskytu kardiovaskulárních příhod je důsledkem zvýšení hladiny HDL-C a je v kauzálním vztahu k umírněné konzumaci alkoholu, může být proto nepřesný a příznivý efekt může souviset s celkovým životním stylem.
Při interpretaci dalších způsobů úpravy životního stylu již máme daleko méně dokladů o efektu. Redukce nadváhy spojená s kalorickou restrikcí a současně se zvýšením tělesné aktivity, zejména při obezitě centrálního typu, vede k proporčnímu inverznímu zvýšení hladiny HDL-C. Dokladů o prognostickém dopadu právě zvýšení HDL-C je málo, spíše musíme předpokládat komplexní působení. Též abstinence od kouření významně zvyšuje hladinu HDL-C, tj. přibližně o 10 %, a hladinu apo A-I asi o 5 %; asi stejnou měrou předtím kouření obě hladiny snížilo. Podobně dieta s nízkým příjmem nasycených mastných kyselin a zvýšeným obsahem nenasycených mastných kyselin (zejména typu n-3-nenasycených) či obohacení stravy koncentráty omega-3 mastných kyselin zvyšuje hladinu HDL-C a mění zejména poměr LDL-C/ HDL-C. Doklady o vlivu na prognózu však opět chybějí či nejsou zcela jednoznačné.
Shrneme-li efekt úpravy životního stylu, pak máme před sebou nejméně jednu dobrou zprávu: příznivý dopad malých – to nutno zdůraznit – a pravidelných dávek alkoholu. Též intervence ostatních negativních vlivů má pravděpodobně význam a není možno na ně zapomínat. Při relativně „suboptimálních“ možnostech farmakoterapie v intervenci nízkých hladin HDL-C, resp. apo A-I, je každá pomoc vítána.
Efekt statinů
Statiny ovlivňují hladinu HDL-C různou měrou, rosuvastatin je dle srovnávacích studií nejúčinnější. Vzestup hladiny HDL-C při léčbě rosuvastatinem se pohybuje mezi 5–10 % (graf 2). Zajímavé je, že není vždy jednoznačný vztah mezi dávkou a efektem. U atorvastatinu je dokonce vztah inverzní – vyšší dávky zvyšují hladinu HDL-C méně než dávky nízké [24]. ![Graf 2 Srovnání efektu statinů na vzestup hladiny HDL cholesterolu (HDL-C); podle [31] – Jones,et al., 2003.](https://www.remedia.cz/photo-a-28334---.jpg) Mechanismus zvýšení HDL-C při léčbě statiny není jasný, doloženo je zvýšení jaterní syntézy apolipoproteinu A-I se sekundárně se zvyšující tvorbou HDL. Dále se předpokládá inhibice aktivity CETP s útlumem přesunu cholesterolu z HDL do aterogenních lipidů, zejména do VLDL a IDL [25]. Dlouho se předpokládalo, že dopad zvýšení hladiny HDL-C na prognózu při léčbě statiny je relativně malý. Nedávno však byl multifaktoriální analýzou doložen význam intervence HDL-C, který je nezávislý a aditivní k poklesu hladiny LDL-C, zvýšení o 7,5 % mělo přímý dopad na zlepšení prognózy, které již bylo klinicky i statisticky významné [26].
Mechanismus zvýšení HDL-C při léčbě statiny není jasný, doloženo je zvýšení jaterní syntézy apolipoproteinu A-I se sekundárně se zvyšující tvorbou HDL. Dále se předpokládá inhibice aktivity CETP s útlumem přesunu cholesterolu z HDL do aterogenních lipidů, zejména do VLDL a IDL [25]. Dlouho se předpokládalo, že dopad zvýšení hladiny HDL-C na prognózu při léčbě statiny je relativně malý. Nedávno však byl multifaktoriální analýzou doložen význam intervence HDL-C, který je nezávislý a aditivní k poklesu hladiny LDL-C, zvýšení o 7,5 % mělo přímý dopad na zlepšení prognózy, které již bylo klinicky i statisticky významné [26].
Zvýšení hladiny HDL-C – efekt niacinu
V současné době je ve stávajícím spektru hypolipidemik niacin lékem s největším potenciálem ovlivnit koncentrace HDL-C. Zvýšení se v klinických studiích pohybuje kolem 15–35 %, vzestup není lineárně úměrný dávce, největšího poklesu je dosaženo dávkami kolem 1,0 až 1,5 g denně. Mechanismus účinku niacinu na vysokodenzitní lipoprotein je komplexní. Vedle inhibice lipolýzy snižující zejména hypertriglyceridemii se při zvýšení HDL-C uplatňuje za prvé snížení přesunu cholesterolu zejména do VLDL (zřejmě inhibicí CETP). Druhým efektem je zvýšení jaterní clearance cholesterolu obsaženého v HDL. A v neposlední řadě hraje roli snížení jaterní clearance apolipoproteinu A-I, což vede ke zpomalení degradace celého komplexu HDL [13]. Klinický efekt niacinu, a to jak samotného, tak v kombinaci s laropiprantem, již byl diskutován.
Zvýšení hladiny HDL-C – efekt aktivátorů PPAR-α a PPAR-gamma (fibráty, glitazony a glitazary)
Peroxizomální proliferační receptory a kontrolují převážně utilizaci lipidů, naopak receptory g utilizaci glycidů. Nicméně v řadě případů je efekt promiskuitní. Vlastní skupina agonistů PPAR-α – fibráty – je heterogenní, jednotliví představitelé se liší v poměru působení na oba receptory, neplatí tak tzv. class-effect. Účinek fibrátů, konkrétně u nás užívaného fenofibrátu, na vzestup hladin HDL-C není velký. Sice při krátkodobé aplikaci byl pozorován vzestup o 10–15 %, při dlouhodobé aplikaci je však dosahováno nárůstu jen kolem 5 %. I tento mírný vzestup může být u nemocných s výrazně nízkými hladinami HDL-C klinicky významný. Ve studii VA-HIT s velmi nízkými vstupními hladinami vedl již 6% vzestup HDL-C při léčbě gemfibrozilem k 22% poklesu kardiovaskulárních příhod. Multivariantní analýza přiřkla tento pokles právě na vrub změnám HDL-C.
Antidiabetika glitazony čili thiazolidindiony aktivují převážně PPAR-gamma. Jediný v současné době dostupný glitazon pioglitazon však má významný aktivační efekt též na receptory α. Tento duální efekt se projevuje nejen ve zlepšení inzulinorezistence, ale též ve vzestupu hladin HDL-C. Tak například v prognostické studii PRO-ACTIVE byl pozorován téměř desetiprocentní vzestup hladin HDL-C (po korekci na efekt placeba) a pokles kombinovaného ukazatele – celkové mortality, nefatálního infarktu myokardu či iktu – o 16 % [27]. Velkým překvapením byly recentní závěry multifaktoriální analýzy studie, které dokládají, že zlepšení prognózy nebylo ve vztahu k poklesu koncentrace glykovaného hemoglobinu, ale právě ve vztahu ke vzestupu hladiny HDL-C [28]. Tyto optimistické nálezy vedly k intenzivnímu výzkumu nových duálních aktivátorů peroxizomálních receptorů α a gamma – glitazarů. Při plně zachovaném účinku na pokles inzulinorezistence je akcentován účinek na lipidogram. Ve druhé fázi klinického hodnocení byl například u ragaglitazaru zaznamenán výrazný pokles triglyceridemie (o více než 60 %) i zvýšení hladiny HDL-C (o více než 30 %), pro špatnou toleranci však byl vývoj ukončen. Velkým nedostatkem dosud testovaných glitazarů je retence tekutin vedoucí až k srdečnímu selhání. Další duální agonisté, např. aleglitazar, u kterých se zdá být efekt na retenci tekutin slabší, jsou v časných fázích hodnocení.
Inhibitory a modulátory CETP
Jedním z důležitých faktorů kontrolujících metabolismus lipidů je CETP (cholesterol ester transfer protein). Jeho úlohou je přenášet estery cholesterolu mezi lipoproteiny (zejména z HDL do VLDL) či mezi lipoproteiny a tkáněmi (zejména z HDL do jater), viz obr. 3. Druhým účinkem je konformace apolipoproteinu B, čímž je docíleno lepšího předání esterů cholesterolu do tkání. CETP tak má jednak proaterogenní efekt – stimuluje přesun cholesterolu z HDL do LDL, jednak antiaterogenní účinek – zvýšení přesunu cholesterolu z HDL do jater a 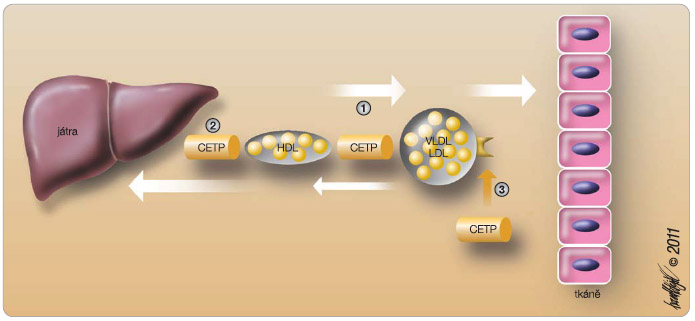 konformace apo B v lipoproteinu LDL usnadňující předání cholesterolu do tkání. Inhibice CETP tak vede ke střádání cholesterolu v lipoproteinu HDL a k enormnímu zvýšení koncentrace HDL-C na více než dvojnásobek. Klinické hodnocení prvého představitele – torcetrapibu – skončilo fiaskem, nárůst mortality o 58 % oproti placebu ve studii ILLUMINATE byl již zmíněn. V současné době prochází pokročilými fázemi hodnocení další inhibitor CETP – anacetrapib. Proti torcetrapibu je efekt omezen na blokádu CETP, nedochází k aktivaci aldosteronu a zvýšení krevního tlaku. Dopad léčby na lipidogram je snad až příliš optimistický – ve studii DEFINE se hladina HDL-C zvýšila o 140 % a hladina LDL-C poklesla o 40 %. Tento vzestup svědčí o zamezení odsunu cholesterolu z HDL, což dle mého názoru nemusí být tím nejoptimálnějším přístupem. Proti torcetrapibu neaktivuje anacetrapib aldosteron a nezvyšuje krevní tlak. Vzhledem ke komplikovanému účinku inhibitorů CETP je vidět snahu o vývoj parciálních inhibitorů CETP, tzv. modulátorů CETP, u kterých by byla zachována inhibice přesunu cholesterolu do aterogenních lipoproteinů a potlačen účinek na blokádu transportu cholesterolu z HDL do jater i efekt na konformaci apo B v lipoproteinech LDL. Nejdále ve vývoji pokročil dolcetrapib, jeho efekt na lipidogram je sice menší, je však zachován reverzní transport cholesterolu do jater. V současné době je prověřována účinnost v řadě prospektivních klinických studií, např. dal-OUTCOMES, dal-ACUTE.
konformace apo B v lipoproteinu LDL usnadňující předání cholesterolu do tkání. Inhibice CETP tak vede ke střádání cholesterolu v lipoproteinu HDL a k enormnímu zvýšení koncentrace HDL-C na více než dvojnásobek. Klinické hodnocení prvého představitele – torcetrapibu – skončilo fiaskem, nárůst mortality o 58 % oproti placebu ve studii ILLUMINATE byl již zmíněn. V současné době prochází pokročilými fázemi hodnocení další inhibitor CETP – anacetrapib. Proti torcetrapibu je efekt omezen na blokádu CETP, nedochází k aktivaci aldosteronu a zvýšení krevního tlaku. Dopad léčby na lipidogram je snad až příliš optimistický – ve studii DEFINE se hladina HDL-C zvýšila o 140 % a hladina LDL-C poklesla o 40 %. Tento vzestup svědčí o zamezení odsunu cholesterolu z HDL, což dle mého názoru nemusí být tím nejoptimálnějším přístupem. Proti torcetrapibu neaktivuje anacetrapib aldosteron a nezvyšuje krevní tlak. Vzhledem ke komplikovanému účinku inhibitorů CETP je vidět snahu o vývoj parciálních inhibitorů CETP, tzv. modulátorů CETP, u kterých by byla zachována inhibice přesunu cholesterolu do aterogenních lipoproteinů a potlačen účinek na blokádu transportu cholesterolu z HDL do jater i efekt na konformaci apo B v lipoproteinech LDL. Nejdále ve vývoji pokročil dolcetrapib, jeho efekt na lipidogram je sice menší, je však zachován reverzní transport cholesterolu do jater. V současné době je prověřována účinnost v řadě prospektivních klinických studií, např. dal-OUTCOMES, dal-ACUTE.
Léčba apolipoproteinem A-I a jeho analogy či mimetiky
V poslední části přehledu je třeba shrnout stav v oblasti mimetik apolipoproteinu A-I. Tato heterogenní skupina má společného jmenovatele, a to biologickou aktivitu vlastního apo A-I. Jedním z přístupů je aplikace infuzí rekombinantního přirozeného apo A-I či apo A-I Milano (mutace přirozeného apo A-I s vyšším antiaterogenním efektem). Doložena byla regrese aterosklerotických plátů při infuzní léčbě i při genovém transferu [29]. Většímu klinickému využití již dostupných komerčních přípravků s apo A-I zatím brání vysoká cena.
Alternativou přirozeně se objevujících apolipoproteinů A-I jsou jejich analoga. Různé části řetězce mají jiný efekt, některá analoga stimulují eflux esterů cholesterolu z makrofágů, u jiných převažuje antiflogistický, antioxidační či vazodilatační efekt. V současné době jsou tyto postupy ve fázi preklinické, stejně jako vývoj zcela syntetických nanodisků s efektem HDL s akcentovaným efluxním účinkem [30].
Podíváme-li se na plejádu již dostupných hypolipidemik a řadu nových perspektivních léčivých postupů i na postupy, které se ukázaly být slepou vývojovou větví, uvědomíme si, jak těžké je „vylepšovat přírodu“. Dlouho se nám to nedařilo zejména v ovlivnění HDL a Lp(a). Nicméně v posledních letech se zdá, že se blýská na lepší časy. Řada navržených a ve studiích klinického hodnocení prověřovaných léčebných strategií se zdá být perspektivní.
Další zajímavou oblastí, která navazuje na strategii léčby dyslipidemie, jsou postupy ovlivňující vlastní aterosklerotický plát, tedy nejen obsah lipidů, ale stabilitu krytu a podobně. Nadějné jsou například inhibitory fosfolipáz (lipoproteinové Lp-PLA2 či sekreční s-PLA2) blokující např. zánětlivé a apoptotické procesy, dále řada inhibitorů metaloproteináz degradujících matrix či inhibitorů angioneogeneze ve vlastním plátu. To však je jiná kapitola.
Seznam použité literatury
- [1] Allam AH, Thompson RC, Wann LS, et al. Atherosclerosis in Ancient Egyptian Mummies The Horus Study. JACC Cardiovasc Imaging 2011; Mar 17. [Epub ahead of print].
- [2] Gupta A, Guyomard V, Zaman MJ, et al. Systematic review on evidence of the effectiveness of cholesterol-lowering drugs. Adv Ther 2010; 27: 348–364.
- [3] Adibhatla RM, Dempsy R, Hatcher JF. Integration of cytokine biology and lipid metabolism in stroke. Front Biosci 2008; 13: 1250–1270.
- [4] Jerez S, Sierra L, Scacchi F, Peral de Bruno M. Hypercholesterolemia modifies angiotensin II desensitisation and cross talk between alpha(1) – adrenoceptor and angiotensin AT(1) receptor in rabbit aorta. Eur J Pharmacol 2010; 635: 149–155.
- [5] Hedrick CC, Castellani LW, Wong H, et al. In vivo interactions of apoA-II, apoA-I, and hepatic lipase contributing to HDL structure and antiatherogenic functions. J Lipid Res 2001; 42: 563–570.
- [6] Nofer JR, Brodde MF, Kehrel BE. High-density lipoproteins, platelets and the pathogenesis of atherosclerosis. Clin Exp Pharmacol Physiol 2010; 37: 726–735.
- [7] Williams PT, Pendyala L, Superko R. Prospective study of coronary heart disease vs. HDL2, HDL3, and other lipoproteins in Gofman's Livermore Cohort. Atherosclerosis 2011; 214: 196–202.
- [8] Brodde MF, Korporaal SJ, Herminghaus G, et al. Native high-density lipoproteins inhibit platelet activation via scavenger receptor BI Role of negatively charged phospholipids. Atherosclerosis 2011; 215: 374–382.
- [9] Fung TT, van Dam RM, Hankinson SE, et al. Low-carbohydrate diets and all-cause and cause-specific mortality: two cohort studies. Ann Intern Med 2010; 153: 289–298.
- [10] Brunner EJ, Rees K, Ward K, et al. Dietary advice for reducing cardiovascular risk. Cochrane Database Syst Rev 2007 Oct 17; (4):CD002128.
- [11] Smart NA, Marshall BJ, Daley M, et al. Low-fat diets for acquired hypercholesterolaemia. Cochrane Database Syst Rev 2011 Feb 16; 2: CD007957.
- [12] Ohta M, Takahashi K, Kasai M, et al. Novel tetrahydroisoquinoline derivatives with inhibitory activities against acyl-CoA: cholesterol acyltransferase and lipid peroxidation. Chem Pharm Bull (Tokyo) 2010; 58: 1066–1076.
- [13] Guyton JR. Niacin in cardiovascular prevention: mechanisms, efficacy, and safety. Curr Opin Lipidol 2007; 18: 415–420.
- [14] Canner PL, Furberg CD, McGovern ME. Benefits of niacin in patients with versus without the metabolic syndrome and healed myocardial infarction (from the Coronary Drug Project). Am J Cardiol 2006; 97: 477–479.
- [15] Wanders D, Judd RL. Future of GPR109A agonists in the treatment of dyslipidemia. Diabetes Obes Metab 2011; Mar 21. [Epub ahead of print].
- [16] Bruckert E, Labreuche J, Deplanque D, et al. Fibrates Effect on Cardiovascular Risk is Greater in Patients with High Triglyceride Levels or Atherogenic Dyslipidemia Profile A Systematic Review and Metanalysis. J Cardiovasc Pharmacol 2010; 57: 267–272.
- [17] Samaha FF, McKenney J, Bloedon LT, et al. Inhibition of microsomal triglyceride transfer protein alone or with ezetimibe in patients with moderate hypercholesterolemia. Nat Clin Pract Cardiovasc Med 2008; 5: 497–505.
- [18] Raal FJ, Santos RD, Blom DJ, et al. Mipomersen, an apolipoprotein B synthesis inhibitor, for lowering of LDL cholesterol concentrations in patients with homozygous familial hypercholesterolaemia: a randomised, double-blind, placebo-controlled trial. Lancet 2010; 375: 998–1006.
- [19] Gordon DJ, Knoke J, Probstfield JL, et al. High-density lipoprotein cholesterol and coronary heart disease in hypercholesterolemic men: the Lipid Research Clinics Coronary Primary Prevention Trial. Circulation 1986; 74: 1217–1225.
- [20] Ladenson PW, Kristensen JD, Ridgway EC, et al. Use of the thyroid hormone analogue eprotirome in statin-treated dyslipidemia. N Engl J Med 2010; 362: 906–916.
- [21] Merki E, Graham M, Taleb A, et al. Antisense Oligonucleotide Lowers Plasma Levels of Apolipoprotein (a) and Lipoprotein (a) in Transgenic Mice. J Am Coll Cardiol 2011; 57: 1611–1621.
- [22] Ranga GS, Kalra OP, Tandon H, et al. Effect of aspirin on lipoprotein(a) in patients with ischemic stroke. J Stroke Cerebrovasc Dis 2007; 16: 220–224.
- [23] Ronksley PE, Brien SE, Turner BJ, et al. Association of alcohol consumption with selected cardiovascular disease outcomes: a systematic review and metaanalysis. BMJ 2011; 342: d671.
- [24] McTaggart F, Jones P. Effects of statins on high-density lipoproteins: a potential contribution to cardiovascular benefit. Cardiovasc Drugs Ther 2008; 22: 321–338.
- [25] Yamashita S, Tsubakio-Yamamoto K, Ohama T, et al. Molecular mechanisms of HDL-cholesterol elevation by statins and its effects on HDL functions. J Atheroscler Thromb 2010; 17: 436–451.
- [26] Nicholls SJ, Tuzcu EM, Sipahi I, et al. Statins high-density lipoprotein cholesterol, and regression of coronary atherosclerosis. JAMA 2007; 297: 499–508.
- [27] Erdmann E, Dormandy J, Wilcox R, et al. PROactive 07: pioglitazone in the treatment of type 2 diabetes: results of the PROactive study. Vasc Health Risk Manag 2007; 3: 355–370.
- [28] Ferrannini E, Betteridge DJ, Dormandy JA, et al. HDL-cholesterol and not HbA1c was directly related to Cardiovascular Outcome in PROactive. Diabetes Obes Metab 2011; Apr 1. [Epub ahead of print].
- [29] Feng Y, Van Craeyveld E, Jacobs F, et al. Wild-type apo A-I and apo A-I(Milano) gene transfer reduce native and transplant arteriosclerosis to a similar extent. J Mol Med 2009; 87: 287–297.
- [30] Davidson MH. Apolipoprotein A-I therapy promise, challenges, and disappointment. J Am Coll Cardiol 2011; 57: 1120–1121.
- [31] Jones PH, Davidson MH, Stein EA, et al. Comparison of the efficacy and safety of rosuvastatin versus atorvastatin, simvastatin, and pravastatin across doses (STELLAR* Trial). Am J Cardiol 2003; 92: 152–160.