Atectura® Breezhaler® – fixní kombinace IKS/LABA v léčbě astmatu
Souhrn:
Sobotík O. Atectura® Breezhaler® – fixní kombinace IKS/LABA v léčbě astmatu. Remedia 2021; 31: 6–9.
V současné době je pro udržovací léčbu astmatu k dispozici celá řada inhalačních léků a jejich kombinací v různých inhalačních systémech. V květnu 2020 byl Evropskou lékovou agenturou (EMA) schválen pro léčbu astmatu léčivý přípravek Atectura® Breezhaler®, který obsahuje fixní dvojkombinaci indakaterol/mometason furoát a je podáván jednou denně prostřednictvím práškového inhalátoru.
Summary:
Sobotik O. Atectura® Breezhaler® – fixed combination of ICS/LABA in the treatment of asthma. Remedia 2021; 31: 6–9.
Currently, a variety of inhaled drugs and its combinations in different types of inhaler devices exist on the market that are available for the maintenance treatment of asthma. In May 2020, the European Medicines Agency (EMA) approved Atectura® Breezhaler® containing fixed combination of indacaterol and mometasone furoate administered once daily via a dry powder inhaler for the treatment of asthma.
Key words: asthma, bronchodilator treatment, inhaled corticosteroids,indacaterol, mometason, asthma maintenance treatment
Úvod
Asthma bronchiale je definováno jako heterogenní onemocnění průdušek spojené s jejich hyperreaktivitou a s variabilní, často do různé míry reverzibilní bronchiální obstrukcí. Podkladem onemocnění je chronicky probíhající zánět dolních cest dýchacích, na kterém se podílí řada buněk a mediátorů. Zánětlivé postižení průdušek je spojeno se zvýšenou reaktivitou průdušek na stimuly různé povahy (bronchiální hyperreaktivita) a vede k projevům bronchiální obstrukce, která je typicky variabilní v čase nebo v závislosti na fázi nemoci a v neposlední řadě na terapii (reverzibilita obstrukce). Při diagnostice astmatu je zapotřebí postupovat důsledně, pečlivě odebírat anamnézu a výsledky provedených vyšetření hodnotit komplexně. Správně stanovená diagnóza astmatu pak bývá často celoživotní.
Indikace
Léčivý přípravek Atectura® Breezhaler® je indikován jako udržovací léčba astmatu u dospělých a dospívajících ve věku od 12 let, u kterých samotná terapie inhalačními kortikosteroidy (IKS) a krátkodobě působícími β2 adrenergními agonisty nevedla k dostatečné kontrole astmatu [1].
Inhalační systém
Breezhaler představuje stran obsluhy jednoduchý inhalační systém pro práškovou formu léku. Jednotlivé denní dávky léku ve formě průhledných inhalačních tobolek pacient po vyjmutí z blistru vkládá po odklopení náústku do „komůrky inhalátoru“. Po opětovném uzavření inhalátoru pacient zmáčkne postranní tlačítka, čímž dojde k perforaci tobolky a lék je připraven k inhalaci. Výhodou inhalačního systému je trojnásobná zpětná vazba – „vidím, slyším, cítím“. Pacient vidí dávku v tobolce, pacient slyší při správně vedeném nádechu víření perforované tobolky a následně po inhalaci cítí sladkou příchuť laktózy v ústech. Charakteristikami inhalačního systému Breezhaler jsou nízký vnitřní odpor inhalátoru a doporučená hodnota nádechové rychlosti ≥ 60 l/min [2]. Edukace pacientů a nácvik správné inhalační techniky jsou u většiny pacientů snadné, což dokládá i studie INHALER, která srovnávala chybovost inhalační techniky u jednotlivých inhalačních systémů u 2 935 pacientů, přičemž osm z 10 pacientů užívalo Breezhaler správně [3].
Účinné látky
Atectura® Breezhaler® patří mezi fixní kombinace dlouhodobě působícího β2 adrenergního agonisty a inhalačního kortikoidu (LABA/IKS), tyto léky jsou řazeny dle ATC klasifikace do farmakoterapeutické skupiny R03A – sympatomimetika inhalační a do skupiny R03BA – inhalační glukokortikoidy. Kombinace sympatomimetik a IKS jsou pak řazeny do skupiny R03AK. Jedna inhalační tobolka Atectura obsahuje indacaterolum 150 mikrogramů (jako indacateroli acetas) a mometasoni furoas 80 mikrogramů.
Indakaterol
Indakaterol patří společně s vilanterolem a olodaterolem k inhalačně podávaným ultradlouhodobě působícím agonistům β2 adrenoreceptorů (U LABA). Po navázání molekuly na receptor dochází k aktivaci adenylátcyklázy uvnitř buňky, která aktivuje přeměnu adenosintrifosfátu (ATP) na cyklický adenosin 3´,5´-monofosfát (cAMP) a výsledkem je relaxace hladké svaloviny bronchů. Indakaterol vykazuje vysokou a dlouhotrvající β2 agonistickou aktivitu s rychlým nástupem účinku [4] a i další terapeutické působení: stabilizuje žírné buňky a inhibuje imunoglobulinem E mediované uvolnění leukotrienů a prostaglandinů [5]. Beta adrenergní agonisté mohou mít nežádoucí kardiovaskulární účinky vyvolané přítomností β1 a β2 receptorů v srdci. Kardiovaskulární bezpečnost indakaterolu byla hodnocena několika klinickými studiemi, přičemž nebyly zaznamenány žádné významné EKG abnormality a doložena byla také nízká incidence změn QT intervalu [6].
Mometason furoát
Do skupiny IKS (tab. 1) řadíme beklometason dipropionát (BDP), budesonid (BUD), ciklesonid
(CIC), flutikason propionát (FP), flutikason furoát (FF)
a mometason furoát (MF) [7]. Mechanismus účinku IKS byl
doposud objasněn jen částečně. Jedná se o látky lipofilní
povahy, které prostupují cytoplazmatickou membránou a váží
se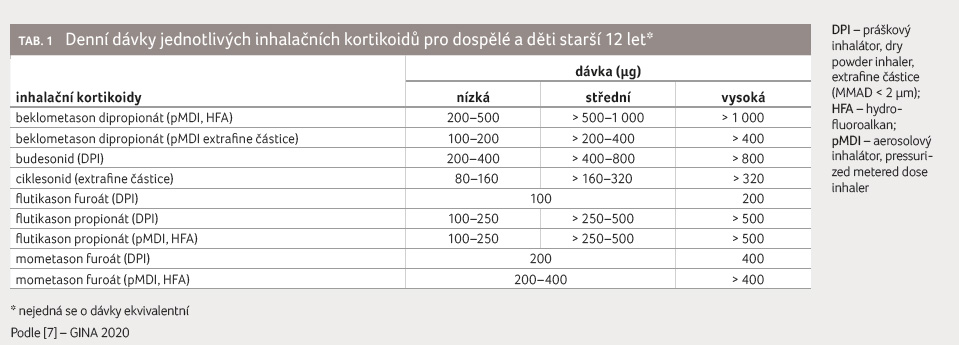 na glukokortikoidový receptor uvnitř buňky. Kortikoidy
jsou schopny cestou negenomové transrepresivní blokády inhibovat
produkci celé škály cytokinů – interleukiny, interferon
gama, tumor nekrotizující faktor alfa a další proteiny
zánětlivé kaskády (faktor stimulující růst granulocytů
a monocytů [GM CSF], endotelin 11, RANTES) [8]. Oproti
tomu jsou genomově transaktivační cestou pozitivně regulovány
geny kódující protizánětlivě působící látky. Vlivem IKS je
dále snižována exprese adhezních molekul na endoteliích
(ICAM1, E selektin), epiteliální buňky redukují tvorbu
chemokinů a snižují produkci GM CSF. Při dlouhodobém
užívání IKS dochází ke snížení sekrece hlenu, k obnově
řasinkového epitelu a ke snížení bronchiální
reaktivity jak na specifické, tak i na nespecifické
podněty. Mometason furoát vykazuje vysokou receptorovou afinitu,
silnou vazbu na plazmatické proteiny a velmi nízkou
biologickou dostupnost (< 1 %), která je důležitá
z hlediska nízkého výskytu systémových nežádoucích
účinků [9].
na glukokortikoidový receptor uvnitř buňky. Kortikoidy
jsou schopny cestou negenomové transrepresivní blokády inhibovat
produkci celé škály cytokinů – interleukiny, interferon
gama, tumor nekrotizující faktor alfa a další proteiny
zánětlivé kaskády (faktor stimulující růst granulocytů
a monocytů [GM CSF], endotelin 11, RANTES) [8]. Oproti
tomu jsou genomově transaktivační cestou pozitivně regulovány
geny kódující protizánětlivě působící látky. Vlivem IKS je
dále snižována exprese adhezních molekul na endoteliích
(ICAM1, E selektin), epiteliální buňky redukují tvorbu
chemokinů a snižují produkci GM CSF. Při dlouhodobém
užívání IKS dochází ke snížení sekrece hlenu, k obnově
řasinkového epitelu a ke snížení bronchiální
reaktivity jak na specifické, tak i na nespecifické
podněty. Mometason furoát vykazuje vysokou receptorovou afinitu,
silnou vazbu na plazmatické proteiny a velmi nízkou
biologickou dostupnost (< 1 %), která je důležitá
z hlediska nízkého výskytu systémových nežádoucích
účinků [9].
Výsledky klinických studií
Bezpečnost a účinnost přípravku Atectura® Breezhaler® u pacientů s astmatem byla hodnocena ve dvou randomizovaných, dvojitě zaslepených studiích fáze III (PALLADIUM a QUARTZ) [1].
PALLADIUM byla 52týdenní studie
hodnotící léčbu přípravkem Atectura
Breezhaler 125 µg/127,5 µg
podávaným jednou denně (n = 439) a Atectura
Breezhaler 125 µg/260 µg
podávaným jednou denně (n = 445) v porovnání s MF
400 µg jednou denně (n = 444) a MF 800 µg denně
podávaným ve dvou denních dávkách (n = 442)
v uvedeném pořadí [10]. Třetí aktivní kontrolní rameno
studie zahrnovalo pacienty léčené salmeterolem/flutikason
propionátem 50 µg/500 µg p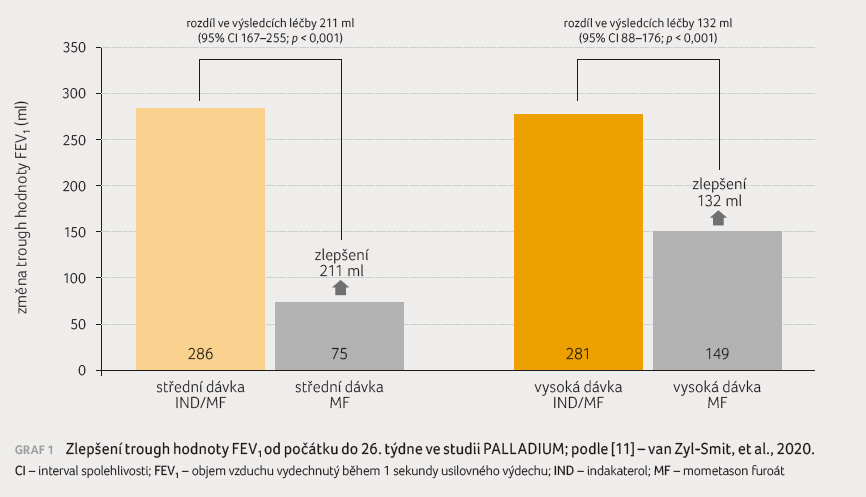 odávaným dvakrát denně
(n = 446). U všech pacientů bylo požadováno, aby
měli příznaky astmatu (skóre dotazníku Asthma Control
Questionnaire, ACQ 7, ≥ 1,5) a aby dostávali
udržovací léčbu astmatu IKS s LABA nebo bez LABA alespoň
tři měsíce před vstupem do studie. Ve screeningu mělo
31 % pacientů v anamnéze exacerbaci v předchozím
roce. Při vstupu do studie byly nejběžnějšími léky
užívanými v léčbě astmatu střední dávka IKS (20 %),
vysoká dávka IKS (7 %) nebo nízká dávka IKS v kombinaci
s LABA (69 %). Primárním cílem studie bylo prokázat
superioritu Atectura
Breezhaler podávaného
jednou denně ve dvou různých dávkách (125 µg/127,5 µg
nebo 125 µg/260 µg) nad MF 400 µg podávaným jednou nebo
dvakrát denně. Ve 26. týdnu prokázaly obě síly
přípravku Atectura
Breezhaler podávaného
jednou denně statisticky významná zlepšení v hodnotě
trough FEV1 (objem vzduchu vydechnutý během
jedné sekundy usilovného výdechu, graf 1) a ve skóre
ACQ 7 v porovnání s MF 400 µg jednou nebo
dvakrát denně. Zjištění v 52. týdnu byla konzistentní
s výsledky v 26. týdnu. Obě síly přípravku
prokázaly klinicky také významné snížení v ročním
výskytu středně těžkých nebo těžkých exacerbací (sekundární
cílový ukazatel) v porovnání s MF 400 µg jednou
a dvakrát d
odávaným dvakrát denně
(n = 446). U všech pacientů bylo požadováno, aby
měli příznaky astmatu (skóre dotazníku Asthma Control
Questionnaire, ACQ 7, ≥ 1,5) a aby dostávali
udržovací léčbu astmatu IKS s LABA nebo bez LABA alespoň
tři měsíce před vstupem do studie. Ve screeningu mělo
31 % pacientů v anamnéze exacerbaci v předchozím
roce. Při vstupu do studie byly nejběžnějšími léky
užívanými v léčbě astmatu střední dávka IKS (20 %),
vysoká dávka IKS (7 %) nebo nízká dávka IKS v kombinaci
s LABA (69 %). Primárním cílem studie bylo prokázat
superioritu Atectura
Breezhaler podávaného
jednou denně ve dvou různých dávkách (125 µg/127,5 µg
nebo 125 µg/260 µg) nad MF 400 µg podávaným jednou nebo
dvakrát denně. Ve 26. týdnu prokázaly obě síly
přípravku Atectura
Breezhaler podávaného
jednou denně statisticky významná zlepšení v hodnotě
trough FEV1 (objem vzduchu vydechnutý během
jedné sekundy usilovného výdechu, graf 1) a ve skóre
ACQ 7 v porovnání s MF 400 µg jednou nebo
dvakrát denně. Zjištění v 52. týdnu byla konzistentní
s výsledky v 26. týdnu. Obě síly přípravku
prokázaly klinicky také významné snížení v ročním
výskytu středně těžkých nebo těžkých exacerbací (sekundární
cílový ukazatel) v porovnání s MF 400 µg jednou
a dvakrát d
enně [11].
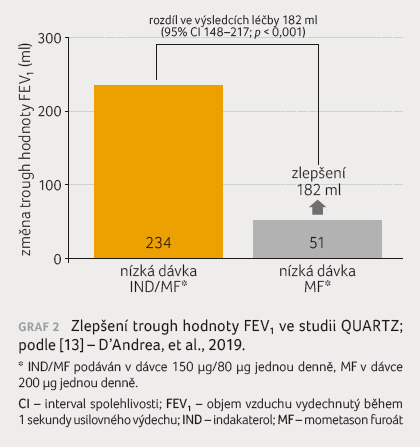
QUARTZ byla 12týdenní studie hodnotící přípravek Atectura Breezhaler 125 µg/62,5 µg podávaný jednou denněv porovnání s monoterapií MF 200 µg jednou denně [12]. QUARTZ jako první srovnává fixní kombinaci IKS/LABA v nízkých dávkách podávanou jednou denně s monoterapií IKS v nízkých dávkách u dospělých a dospívajících pacientů s nedostatečnou mírou kontroly astmatu. Při vstupu do studie byly nejběžnějšími léky užívanými k léčbě astmatu nízké dávky IKS (43 %) a LABA/nízké dávky IKS (56 %). Hlavním cílem bylo porovnat kombinaci indakaterol/MF v nízkých dávkách (jednou denně) aplikovaných prostřednictvím inhalátoru Breezhaler a MF podávaný v nízkých dávkách (jednou denně) prostřednictvím inhalátoru Twisthaler a zhodnotit jejich účinnost a bezpečnost v oblasti zlepšení funkce plic (trough FEV1) a dosažení kontroly astmatu (skóre ACQ 7) u pacientů s nedostatečnou mírou kontroly astmatu. Primární cílový ukazatel byl naplněn: kombinace indakaterol/MF v nízkých dávkách prokázala statisticky významné zlepšení trough hodnoty FEV1 ve srovnání s MF v nízkých dávkách po 12 týdnech léčby – průměrný rozdíl činil 182 ml (95% CI 0,148–0,217, p < 0,001, graf 2). Sekundární cílový ukazatel byl také naplněn: kombinace indakaterol/MF prokázala statisticky významné zlepšení kontroly astmatu měřené pomocí skóre ACQ 7 po 12 týdnech léčby ve srovnání s monoterapií MF v nízkých dávkách – průměrný rozdíl v léčbě představoval –0,218 (95% CI –0,293 až –0,143, p < 0,001, graf 3).
Dosažení klinické významnosti
v oblasti skóre ACQ 7 bylo navíc podpořeno výsledky
analýzy u respondérů: ve skupině užívající
indakaterol/MF v nízkých dávkách docházelo k dosažení
vyšší míry zlepšení ACQ 7 – o 0,5 bodu a více
(minimální klinicky významný rozdíl, MCID) – než
ve skupině užívající MF v nízkých dávkách (74,7 %
vs. 64,9 %, v uvedeném pořadí) [13].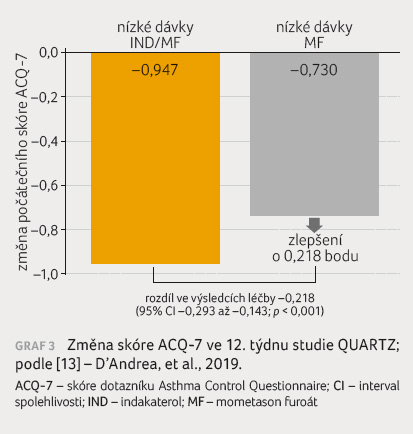
Zařazení do současné palety léčiv
V komplexní terapii astmatu se dnes uplatňují následující skupiny léků: úlevová a kontrolující antiastmatika, antihistaminika, antileukotrieny, teofyliny, biologická léčba, léčebná rehabilitace, klimatická a lázeňská léčba, ve vybraných případech bronchiální termoplastika a specifická imunoterapie. Podle doporučených postupů Globální iniciativy pro astma (GINA) z roku 2020 by u pacientů, u nichž nedocílíme dostatečné kontroly astmatu monoterapií IKS, měla být zvažována astma kontrolující a udržující léčba ve složení IKS + LABA. V současnosti je dostupných hned několik přípravků s fixní kombinací IKS/LABA podávaných dvakrát denně a dvě fixní kombinace pro podávání jednou denně: FF/vilanterol a nyní i MF/indakaterol.
Kontraindikace
Jedinou absolutní kontraindikací léčby Atectura Breezhaler je známá hypersenzitivita na léčivé látky nebo na některou z pomocných látek (monohydrát laktózy, želatina nebo potiskový inkoust obsažené v tobolce) [1].
Nežádoucí účinky
Nejčastějšími hlášenými nežádoucími účinky léčby byly exacerbace astmatu (26,9 %), nazofaryngitida (12,9 %), infekce horního respiračního traktu (5,9 %) a bolest hlavy (5,8 %) [1].
Lékové interakce
Současné podání inhalovaného indakaterolu a MF v klinických studiích neprokázalo vliv na farmakokinetiku ostatních léčiv [1].
Závěr
Fixní kombinace indakaterolu a mometason furoátu v nízkých dávkách prokázala v klinických studiích zlepšení funkce plic a kontroly astmatu ve srovnání s monoterapií MF u symptomatických dospělých a dospívajících pacientů s nedostatečnou kontrolou astmatu. Užívání jednou denně může zlepšit adherenci k léčbě ve srovnání s užíváním kombinace dvakrát denně, a tudíž může u některých pacientů vést k lepší úrovni kontroly astmatu. Inhalační systém Breezhaler je jednoduchý na obsluhu a poskytuje pacientovi zpětnou vazbu a kontrolu nad správnou inhalační technikou.
Seznam použité literatury
- [1] Souhrn údajů o přípravku Atectura® Breezhaler®. Dostupné na: www.sukl.cz
- [2] Kašák V. Inhalační systémy v léčbě nemocí s chronickou bronchiální obstrukcí. Praha; Maxdorf, 2017.
- [3] Molimard M, Raherison C, Lignot S, et al. Chronic obstructive pulmonary disease exacerbation and inhaler device handling: real‑life assessment of 2935 patients. Eur Respir J 2017; 49: 1601794.
- [4] Battram C, Charlton SJ, Cuenoud B, et al. In vitro and in vivo pharmacological characterization of 5‑[(R)‑2‑(5,6‑diethyl‑indan‑2‑ylamino)‑1‑hydroxy‑ethyl]‑8‑hydroxy‑1H‑quinolin‑2‑one (indacaterol), a novel inhaled beta(2) adrenoceptor agonist with a 24‑h duration of action. J Pharmacol Exp Ther 2006; 317: 762–770.
- [5] Scola AM, Loxham M, Charlton SJ, et al. The long‑acting beta‑adrenoreceptor agonist, indacaterol, inhibits IgE‑dependent response of human lung mast cells. Br J Pharmacol 2009; 158: 267–276.
- [6] Khindri S, Sabo R, Harris S, et al. Cardiac safety of indacaterol – no clinical effect on QT in healthy subjects [abstract No P2031] 19th Annual Congress of the European Respiratory Society 2009; Vienna.
- [7] GINA Report, Global Strategy for Asthma Management and Prevention 2020. Dostupné na: https://ginasthma.org
- [8] Hogger P. Current Concepts for Optimizing the Therapeutic Index of Glucocorticoid Receptor Ligands for Oral and Inhalative Use: Basic Considerations and Clinical Reality. Curr Med Chem Anti Inflamm Anti‑Allergy Agents 2003; 2: 395–408.
- [9] Inman MD, Wtason RM, Rerecich T, et al. Dose‑dependent effects of inhaled mometason furoate on airway function and inflammation after allergen challenge. Am J Respir Crit Care Med 2001; 164: 569–574.
- [10] ClinicalTrials.gov. https://clinicaltrials.gov/ct2/show/NCT02554786
- [11] van Zyl‑Smit RN, Krüll M, Gessner C, et al. Once‑daily mometasone plus indacaterol versus mometasone or twice‑daily fluticasone plus salmeterol in patients with inadequately controlled asthma (PALLADIUM): a randomised, double‑blind, triple‑dummy, controlled phase 3 study. Lancet Respir Med 2020; 8: 987–999.
- [12] ClinicalTrials.gov. NCT02892344. https://clinicaltrials.gov/ct2/show/
- [13] D’Andrea P, Kornmann O, Mucsi J, et al. Efficacy and safety of once‑daily low‑dose indacaterol/mometasone via Breezhaler in symptomatic adult and adolescent patients with inadequately controlled asthma: Phase III randomised QUARTZ study findings. Eur Respir J 2019; 54: doi: 10.1183/13993003.congress‑2019.RCT3780.