Degludek – nový inzulinový analog
Inzulin degludek je nový, ultradlouze působící bazální analog. Po subkutánní aplikaci tvoří depo rozpustných multihexamerů, které pomalu a stejnoměrně disociují. Výsledkem je kontinuální, plochý a stabilní profil s délkou účinku přesahující 42 hodin. Studie fáze II a III klinického zkoušení, které srovnávaly u diabetiků 1. i 2. typu degludek s glarginem a detemirem v léčebném režimu bazál-bolus, prokázaly, že degludek vykazuje obdobný vliv na kompenzaci diabetu, provázený však nižším procentem hypoglykemických příhod.
Farmakologická skupina
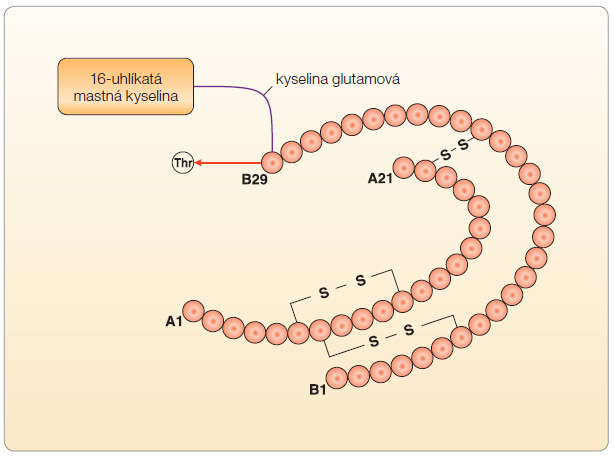 Degludek je nový, ultradlouze působící inzulinový analog. Váže se specificky na lidský inzulinový receptor a má identické farmakologické účinky jako nativní inzulin. Stejná s humánním inzulinem je i sekvence aminokyselin s výjimkou delece ThrB30 a přídavku 16-uhlíkaté dikarboxylové kyseliny přidané k LysB29 přes kyselinu glutamovou (obr. 1) [1]. Hlavní vlastností degludeku je delší doba účinku ve srovnání s ostatními dlouhodobě působícími analogy, zásadním pozitivem je však fakt, že inzulin degludek by měl být zcela bez vrcholu účinku („peakless“).
Degludek je nový, ultradlouze působící inzulinový analog. Váže se specificky na lidský inzulinový receptor a má identické farmakologické účinky jako nativní inzulin. Stejná s humánním inzulinem je i sekvence aminokyselin s výjimkou delece ThrB30 a přídavku 16-uhlíkaté dikarboxylové kyseliny přidané k LysB29 přes kyselinu glutamovou (obr. 1) [1]. Hlavní vlastností degludeku je delší doba účinku ve srovnání s ostatními dlouhodobě působícími analogy, zásadním pozitivem je však fakt, že inzulin degludek by měl být zcela bez vrcholu účinku („peakless“).
Mechanismus účinku, farmakodynamika
Mezi hlavní požadavky kladené na nové druhy inzulinů patří nízké riziko výskytu hypoglykemií. Variabilita v absorpci inzulinu, délka trvání účinku a vrchol aktivity spojený se subkutánní aplikací jsou s výskytem hypoglykemií v přímé souvislosti. Snahou výzkumných pracovníků je proto vytvořit takové druhy inzulinů, které by měly lepší farmakokinetické vlastnosti než samotný humánní inzulin. Jedná se zejména o dostatečně dlouhou dobu účinnosti a dobře předvídatelný účinek u daného jedince.
Při aplikaci humánního inzulinu do podkoží je jeho kinetika v organismu jiná než při jeho fyziologické sekreci do portálního řečiště. Množství inzulinu je regulováno v závislosti na nutričních a dalších stimulech. U diabetiků 1. typu (DM1T) je díky imunologické reakci sekrece inzulinu pankreatem zaniklá, u diabetiků 2. typu (DM2T) je jak bazální, tak prandiální sekrece porušena a v závislosti na mnoha podmínkách se v dalších fázích rozvoje onemocnění ještě dále snižuje.
Cílem exogenní aplikace inzulinu je imitovat fyziologickou situaci, tj. udržet určitou stabilní bazální hladinu inzulinu a zajistit dostatečné množství inzulinu na postprandiální vzestup glykemií tak, aby bylo dosaženo euglykemických hodnot po celých 24 hodin. Paradoxem je, že humánní inzulin aplikovaný exogenní cestou tyto nároky nesplňuje. Inzulinový peptid se v β-buňkách spojuje do hexamerů. Při vysoké koncentraci inzulinu a za přítomnosti iontů zinku se tato asociace do hexamerů jeví jako adaptační mechanismus, který zajišťuje dostatečnou zásobu inzulinu ve vezikulách pankreatických β-buněk. Při exocytóze dochází k disociaci hexamerů na dimery a biologicky aktivní monomery. Je-li inzulin aplikován do podkoží, je jeho disociace na monomery zpomalena [1]. Také přechod inzulinu z podkožního depa přes kapilární membránu do cirkulace je pomalejší, stejně jako vrchol účinku a jeho odeznění. Aplikací humánního inzulinu do podkoží tak nelze fyziologickou sekreci napodobit. Proto se ve vývojových laboratořích molekula inzulinu modifikuje tak, aby se její vlastnosti této potřebě co nejvíce přiblížily, aby její kinetika byla odpovídající, nebo dokonce vylepšená oproti kinetice inzulinu za fyziologické situace.
Vazba degludeku na albumin přispívá k jeho protrahovanému účinku v organismu [2]. Acylace molekuly inzulinu mastnou kyselinou modifikuje afinitu inzulinu k albuminu a způsobí reverzibilní vazbu na albumin s rovnoměrným a dlouhodobým uvolňováním inzulinových monomerů po subkutánní aplikaci [3]. Afinita degludeku k sérovému albuminu odpovídá 99% vazebnosti na plazmatické proteiny v lidské plazmě.
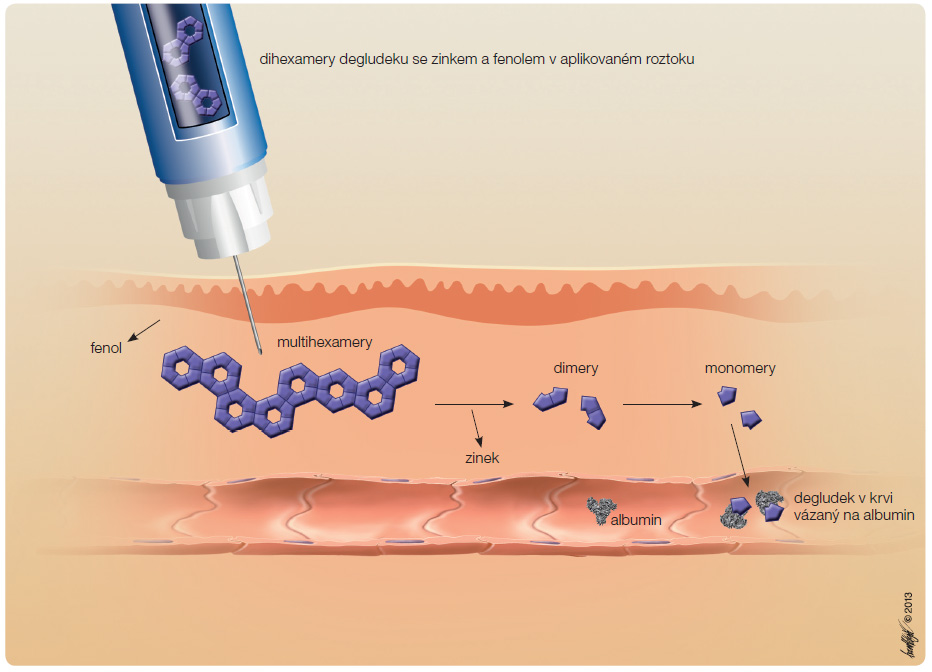 Degludek tvoří v roztoku, který se aplikuje do podkoží, v přítomnosti fenolu a zinku rozpustné a stabilní dihexamery. Po subkutánní aplikaci fenol difunduje do okolí, degludek se reorganizuje do multihexamerových řetězců a dlouhou dobu setrvává v místě depa. V depu se díky následné difuzi iontů zinku do okolí z konců multihexamerů odštěpují dimery a posléze monomery degludeku, které se absorbují do cirkulace (obr. 2). Absorpci analoga limituje oproti ostatním bazálním inzulinům výdej monomerů degludeku z depa spíše než průtok krve depem.
Degludek tvoří v roztoku, který se aplikuje do podkoží, v přítomnosti fenolu a zinku rozpustné a stabilní dihexamery. Po subkutánní aplikaci fenol difunduje do okolí, degludek se reorganizuje do multihexamerových řetězců a dlouhou dobu setrvává v místě depa. V depu se díky následné difuzi iontů zinku do okolí z konců multihexamerů odštěpují dimery a posléze monomery degludeku, které se absorbují do cirkulace (obr. 2). Absorpci analoga limituje oproti ostatním bazálním inzulinům výdej monomerů degludeku z depa spíše než průtok krve depem.
Farmakokinetika
Intraindividuální variabilita inzulinu odpovídá rozdílu ve velikosti poklesu glykemie po aplikaci stejné dávky inzulinu za srovnatelných podmínek a u stejného pacienta v různé dny. Je spojena s absorpcí analoga z místa vpichu a je závislá na fyzikálně-chemických vlastnostech látky a charakteristice místa vpichu. U degludeku se jeho afinita k albuminu zdá být jedním z hlavních faktorů, které určují nízkou variabilitu jeho účinku [1]. Je-li intraindividuální variabilita nízká, vykazuje stejná dávka dobře předvídatelný účinek na pokles glykemie. Dávka se pak dá titrovat agresivněji a tím je možno dosáhnout těsnější kompenzace diabetu. Inzulin glargin má oproti inzulinu NPH (Neutral Protamin Hagedorn) menší intraindividuální variabilitu [4] a inzulin degludek se při clampové studii u pacientů s DM1T vyznačoval ve srovnání s glarginem až čtyřikrát nižší intraindividuální variabilitou a stabilnějším účinkem na snižování hladin krevní glukózy [5].
Biologický poločas účinku (t1/2) dosahuje v humánních studiích 25 hodin. Farmakokinetická a farmakodynamická data ukazují, že v klinické praxi trvá účinek degludeku více než 42 hodin [1], a tak degludek podávaný denně dosahuje při ustáleném stavu velmi ploché a velmi stabilní křivky [6]. Farmakokinetické studie nás tudíž přesvědčují o ultradlouhém účinku s plochým profilem bez vrcholu (peaku), díky čemuž může tento inzulinový analog poskytnout ve srovnání s ostatními bazálními inzuliny větší flexibilitu v načasování dávky a významně redukovat riziko výskytu nočních hypoglykemií [7, 8]. Ustáleného stavu sérové koncentrace je dosaženo po dvou až třech dnech denního podávání degludeku.
Variabilita účinku mezi jednotlivými dny (day-to-day variability) byla u degludeku stabilně nízká během celé 24hodinové periody, zatímco u glarginu byla signifikantně vyšší, zvyšovala se postupně mezi 6.–8. hodinou po aplikaci inzulinu a maxima dosahovala mezi 14.–16. hodinou po podání dávky glarginu. Celkový metabolický efekt hodnocený dle ukazatelů z clampových měření byl u degludeku oproti glarginu vyšší [9]. Odbourávání inzulinového analoga degludeku je obdobné jako u lidského inzulinu a všechny následné metabolity jsou inaktivní.
V současnosti jsou v naší republice diabetologům k dispozici další dvě dlouhodobě působící inzulinová analoga – detemir a glargin, s jejichž účinkem jsme již měli možnost se seznámit. Přes počáteční nadšení se však ukazuje, že tato analoga dostatečně neimitují fyziologickou bazální sekreci inzulinu. Zvláště ve vysokých dávkách není profil jejich účinku zcela plochý, lze zaznamenat mírný vzestup a následný mírný pokles efektivity [10]. Naopak při aplikaci nízkých dávek nedosahuje jejich plazmatická koncentrace u všech pacientů dostatečné bazální hladiny v průběhu celých 24 hodin [11]. Výsledky původních studií s glarginem podávaným jednou denně referovaly o tom, že nedochází k vzestupu účinku inzulinu ani u pacientů s DM1T a ani u pacientů s DM2T. Nicméně v současnosti se dle výsledků recentních studií zdá, že k malému peaku pravděpodobně při podávání tohoto dlouhodobě působícího analoga dochází [12].
Doba trvání účinku detemiru, studovaná pomocí clampových metod, je závislá na dávce [13] a pohybuje se přibližně v rozmezí mezi délkou trvání účinku inzulinu NPH a inzulinu glarginu [14]. Existují studie, v nichž i podávání glarginu ve dvou denních dávkách zlepšilo kompenzaci a redukovalo množství nočních hypoglykemií oproti léčbě jednou denní dávkou [11]. I z praxe je známo, že pro určitou skupinu pacientů s DM1T je vhodnější podávání dlouhodobých inzulinových analog ve dvou denních dávkách, které zaručí dostatečnou 24hodinovou bazální hladinu. To samé však platí i pro nemocné s DM2T, zejména pro ty pacienty, kteří už mají minimální vlastní produkci inzulinu a nebo významnější inzulinovou rezistenci. Z těchto důvodů bude jistě mít mnoho pacientů s DM1T i DM2T ze zavedení tohoto nového, ultradlouze působícího analoga degludeku do klinické praxe prospěch.
Klinické zkušenosti
Degludek již prošel fází II i III klinického výzkumu.
Ve fázi II se potvrdilo, že u DM1T vykazuje degludek stejnou účinnost na kompenzaci diabetu jako glargin [7], a navíc bylo při léčbě degludekem prokázáno statisticky významně méně případů hypoglykemie [7, 8]. Také u DM2T je degludek ve stejných molárních a jednotkových dávkách jako glargin v účinku na pokles hodnoty glykovaného hemoglobinu (HbA1c) stejně efektivní. V 16týdenní studii byl degludek aplikován pacientům s DM2T (bez předchozí léčby jakýmkoli typem inzulinu) buď jednou denně (počáteční dávka 10 j) nebo 3krát týdně (počáteční dávka 20 j) a glargin jednou denně (počáteční dávka také 10 j). Degludek zajistil kompenzaci srovnatelnou s glarginem, a může tedy být aplikován – díky svému ultradlouhému účinku – i s touto nižší frekvencí, tj. třikrát týdně. Faktem zůstává, že se při podávání 3krát týdně vyskytlo více hypoglykemií. Toto zjištění se vysvětluje vyšší jednotlivou dávkou degludeku, která musí být podána, aby pokryla týdenní potřebu inzulinu [8]. Výskyt hypoglykemií byl ale srovnatelný s kontrolní skupinou léčenou glarginem.
Ve fázi III klinického zkoušení byl jako srovnávací inzulin použit jak detemir, tak glargin u pacientů s DM1T i DM2T. Degludek byl testován při podávání jednou denně v tzv. režimu bazál-bolus u DM1T [15] a u DM2T [16] a srovnán s glarginem. Výsledky studií ukazují, že se nenalezly rozdíly v poklesu HbA1c při podávání degludeku jedenkrát denně a při podávání glarginu. Léčba degludekem však vedla k signifikantně nižšímu výskytu hypoglykemií.
Při ročním sledování se srovnávala účinnost režimu bazál-bolus u pacientů s DM1T a degludek byl opět srovnáván s glarginem. Vliv na pokles hodnoty HbA1c byl sice stejný, ale degludek v kombinaci s prandiálním podáváním aspartu redukoval riziko noční hypoglykemie o 25 % ve srovnání s léčbou glarginem. Celkový počet hypoglykemií byl obdobný při podávání degludeku i glarginu. V této studii navíc degludek prokázal vyšší účinnost na pokles ranních lačných glykemií. Dalším pozitivním zjištěním bylo, že jedinci léčení degludekem měli nižší celkovou, bolusovou i bazální dávku inzulinu [15].
V obdobné studii, které se účastnili pacienti s DM2T, byl degludek podáván v režimu bazál-bolus (bolus představoval inzulin aspart) a jeho účinek byl srovnáván s glarginem podávaným ve stejném režimu. Degludek byl v účinnosti na kompenzaci a pokles HbA1c stejně efektivní jako glargin, avšak u pacientů léčených degludekem byl opět zaznamenán menší celkový počet hypoglykemií, ale i nižší výskyt nočních hypoglykemií [16].
Ve velké recentní roční studii BEGIN Once Long byl účinek degludeku podávaného jedenkrát denně (v kombinaci s perorálními antidiabetiky) sledován u pacientů s DM2T a srovnán s účinkem glarginu. Prokázal se obdobný pokles HbA1c v obou skupinách, ale signifikantně méně nočních hypoglykemií bylo zaznamenáno při léčbě degludekem. Navíc měli pacienti léčení degludekem nižší hodnoty lačné glykemie [17]. Obdobné výsledky vykazovaly i studie s degludekem aplikovaným třikrát týdně [8].
Účinek léčby degludekem v dávkování 0,4 j/kg, 0,6 j/kg a 0,8 j/kg byl předmětem clampové studie s pacienty trpícími DM1T. Efekt degludeku na pokles glykemie rostl lineárně s dávkou a přesáhl 26 hodin. Účinek inzulinu byl plochý, bezvrcholový a ve všech sledovaných dávkách stabilní. Fluktuace hladin inzulinu byly redukovány přesahem efektu další dávky. Glykemické profily během 26hodinového clampového vyšetření byly téměř horizontální, bez výkyvů pro všechny tři zvolené inzulinové hladiny. Clampové vyšetření v trvání 26 hodin nebylo u nikoho ukončeno pro elevaci glykemie, která by přesáhla předem stanovenou horní hranici 8,3 mmol/l. Pro všechny tři zvolené dávky degludeku se pohyboval t1/2 v rozmezí 24,4–26,8 hod., v průměru 25,1 hod. Fakticky je tedy poločas účinku degludeku delší než 25 hodin a potvrzuje pomalou a stejnoměrnou absorpci, která vede k ultradlouhému účinku tohoto inzulinového analoga [6].
Stejný protokol měla i další clampová studie s pacienty s DM2T, v níž účinek degludeku na hladinu glukózy přesáhl 42 hodin u všech tří sledovaných dávek inzulinu [9]. V obou studiích byl degludek detekovatelný v séru i po 120 hodinách po poslední aplikaci.
Ve studii s pacienty s DM2T, která sledovala účinnost a bezpečnost degludeku aplikovaného 3krát týdně (injekce v pondělí, ve středu a v pátek, sobota a neděle bez injekce!), bylo prokázáno obdobné zlepšení kompenzace a obdobný počet pacientů hlásících hypoglykemie jako při léčbě glarginem aplikovaným jednou denně [8].
Riziko výskytu hypoglykemií
Při inzulinoterapii se klade velký důraz na to, aby léčba probíhala bez hypoglykemií [18], protože strach z hypoglykemií patří mezi hlavní a často velmi těžko překonatelné překážky dobré kompenzace při inzulinoterapii. Navíc strach z injekcí inzulinu, ze vpichů při odběru krve na kontrolu glykemie, z nárůstu tělesné hmotnosti, ze snížení kvality života a v dnešní době i strach o zaměstnání [19] jsou dalšími příčinami, proč se pacienti inzulinoterapie obávají a mohou ji dlouho odmítat.
Snížení frekvence hypoglykemií bylo donedávna více soustředěno na pacienty s DM1T, nicméně nyní se pozornost přesunuje na daleko větší skupinu nemocných s DM2T. Ve světle poznatků recentních studií potvrzujících postupný úbytek sekreční kapacity u nemocných s DM2T a následnou nutnost inzulinoterapie vystupuje do popředí i problematika vyšší frekvence hypoglykemií u pokročilé fáze onemocnění DM2T, tj. s inzulinovým deficitem, často potencovaným inzulinovou rezistencí. Z výsledků studie ACCORD vyplynulo, že hypoglykemie je u DM2T nezávislým prediktorem mortality [20]. Další dvě velké studie prokázaly, že hypoglykemie je u DM2T prediktorem smrti z kardiovaskulárních příčin a celkové mortality [21, 22]. Hypoglykemie mohou u pacientů s DM2T také zvyšovat riziko vzniku akutních kardiovaskulárních příhod [23]. Noční hypoglykemie, která může být a často bývá klinicky asymptomatická, snižuje kvalitu spánku a produktivitu práce následující den [24], ale může mít i další velmi závažné následky.
Mezi hlavní faktory přispívající ke vzniku hypoglykemií patří variabilita v absorpci inzulinu, délka trvání účinku a vrchol jeho aktivity spojený se subkutánní aplikací. Proto se modifikují humánní inzuliny tak, aby měly lepší farmakokinetické vlastnosti, prodlužuje se doba trvání účinku – efekt je pak lépe předvídatelný.
Studie srovnávající degludek s ostatními analogy dokládají vesměs nižší nebo stejné riziko výskytu hypoglykemií [7, 15–17], pouze při podávání degludeku třikrát týdně ve fázi II klinického zkoušení byl zaznamenán oproti podávání degludeku jednou denně častější výskyt hypoglykemických příhod [8].
Účinek na hmotnost
Velká část pacientů s DM2T (až 80 %) trpí obezitou, proto je jedním z hlavních požadavků kladených na léčbu, aby nevedla ke zvyšování tělesné hmotnosti. Nárůst hmotnosti je znám při terapii humánními inzuliny zejména u pacientů s DM2T a inzulinovou rezistencí. Tito jedinci často potřebují k dosažení cílových hodnot kompenzace vysoké dávky inzulinu a hmotnost u nich může stoupnout o mnoho kilogramů.
Nevelký, ale postupný a statisticky významný pokles hmotnosti o 1 kg jak u pacientů s DM1T, tak u pacientů s DM2T byl prokázán ve srovnání s inzulinem NPH pouze při léčbě analogem detemirem [25]. Ne všechny studie porovnávající degludek s ostatními dlouhodobými analogy byly zaměřeny na sledování změn hmotnosti. Navíc zatím také chybějí dostatečně dlouhodobé studie zabývající se tímto ukazatelem. Birkeland srovnával degludek s glarginem ve studii trvající 16 týdnů a sledoval u pacientů s DM1T také jejich hmotnost. V obou skupinách došlo k malému vzestupu hmotnosti, řádově o 1 kg, bez signifikantního rozdílu mezi degludekem a glarginem [7], v další studii vzrostla během ročního sledování hmotnost u pacientů s DM1T obdobně – o 1,6 kg při podávání glarginu a o 1,8 kg při podávání degludeku [15]. V další roční studii došlo při srovnání degludeku s glarginem v léčbě pacientů s DM2T k obdobnému průměrnému vzestupu hmotnosti (o 2,4 kg vs. 2,1 kg) [17]. V jiné roční studii byl při režimu bazál-bolus (jako bolus byl podáván rychle působící humánní inzulin 3krát denně preprandiálně) zaznamenán vyšší přírůstek hmotnosti, nicméně také srovnatelný jako při podávání degludeku s glarginem. V případě léčby degludekem činil přírůstek hmotnosti za rok 3,6 kg, zatímco při podávání glarginu dosáhl přírůstek hmotnosti za stejné období 4,0 kg [16].
Použití do inzulinových směsí
Degludek má oproti ostatním dlouhodobým analogům ještě další výhodu. Je rozpustný a je ho možné použít do inzulinových směsí bez toho, že by se měnily jeho farmakokinetické vlastnosti. V 16týdenní studii byl zkoumán efekt dvou typů směsného inzulinu – degludek s aspartem v poměru 70 : 30 % a 55 : 45 % – ve srovnání s glarginem. Všechny tři typy inzulinů, resp. směsí, byly aplikovány před večeří. Z původní nedostačující léčby různými typy perorálních antidiabetik byli pacienti s DM2T převedeni na jednotnou léčbu metforminem.
Počáteční dávka inzulinového analoga byla 10 jednotek a titrovala se dle ranní lačné glykemie na cílovou hodnotu 4–6 mmol/l. Titrace se prováděla po týdnu dle průměru posledních tří měření ranních lačných glykemií. Po dosažení cílových lačných glykemií se dávka dále zvyšovala tak, aby bylo po večeři dosaženo postprandiální glykemie nižší než 8 mmol/l, ovšem za předpokladu, že nedocházelo k hypoglykemiím. Pozitivem bylo, že při stejném poklesu HbA1c byly dávky směsí degludeku s aspartem asi o 20 % nižší než dávka glarginu. Léčba se neprojevila na vzestupu hmotnosti a nevyskytly se žádné těžké hypoglykemie. Menší procento lehčích hypoglykemií bylo zaznamenáno při podávání směsi degludeku s aspartem v poměru 70 : 30 % a při podávání glarginu, naproti tomu více hypoglykemií nastávalo při léčbě směsí s poměrem 55 : 45 %. Při léčbě směsí degludek-aspart v poměru 70 : 30 % dosáhlo během studie 50 % jedinců hodnot HbA1c < 5,3 % a byly u nich zaznamenány rovněž lepší postprandiální glykemie po večeři. Přitom byl výskyt hypoglykemií v této skupině srovnatelný s glarginovou skupinou, a to vše při signifikantně nižší dávce inzulinu.
Směs inzulinů degludek a aspart se tedy do budoucna jeví jako velmi nadějná, přestože je třeba vzít v úvahu, že se jedná o první studii svého druhu a výsledky budou muset být ověřeny dalším klinickým výzkumem. Podávání bude vhodné zejména při zahájení inzulinoterapie, eventuálně k její potenciaci, pro pacienty s DM2T, kteří jsou špatně kompenzováni při léčbě perorálními antidiabetiky [26].
Imunogenicita
Důležitým hlediskem nového analoga je také imunogenicita, to znamená, jakou má degludek schopnost vytvářet protilátky. Pro všechny subjekty zařazené do studie byla hladina specifických protilátek proti degludeku i zkříženě reagujících proti humánnímu inzulinu zanedbatelná [7, 8, 15, 17, 25].
Zařazení do současné palety léčiv
Nejnovější doporučení mezinárodních diabetologických společností se shodují na vhodnosti včasného zahájení inzulinoterapie i u pacientů s DM2T. Léčba se nejčastěji zahajuje jednou dávkou bazálního humánního inzulinu nebo inzulinového analoga, tedy i degludeku. Podávání bazální dávky může navazovat přímo na monoterapii metforminem. Inzulin a analoga lze ale podávat v podstatě kdykoli v dalším průběhu diabetu při neúčinnosti kombinované léčby více typy perorálních antidiabetik (event. s agonisty GLP-1, glukagonu podobného peptidu 1, nebo bez nich). Inzulin je pak nutné titrovat tak, aby bylo dosaženo cílových hodnot kompenzace [18].
Indikace
Degludek je indikován v léčbě jak DM1T, tak DM2T. U pacientů s DM1T by měl degludek díky své velmi dlouhé době účinku a bezvrcholovému efektu účinně zajistit bazální dávku inzulinu při aplikaci jedenkrát denně. Stejně vhodný bude i pro intenzivnější léčebné režimy – pro tzv. bazál plus s jednou prandiální dávkou k hlavnímu jídlu, nebo pro režim intenzifikovaný se třemi preprandiálními dávkami rychle působícího inzulinu.
U pacientů ve věku nad 65 let je nutné častější sledování glykemie a úprava dávek inzulinu dle jejích aktuálních hladin. U dětí a dospívajících nebyla bezpečnost a účinnost degludeku stanovena a nelze zatím učinit žádná doporučení ohledně dávkování. Pacienti s poruchou funkce jater i ledvin mohou degludek užívat s doporučením častějšího sledování glykemie.
Kontraindikace
Kontraindikací léčby degludekem je přecitlivělost na jakoukoli složku podávaného přípravku.
Nežádoucí účinky
Mezi nejčastější nežádoucí účinky patří hypoglykemie, které se mohou dostavit, je-li dávka analoga příliš vysoká, při zvýšené fyzické aktivitě a nebo při snížení příjmu potravy. Celkové alergické reakce na inzulin nebo některou složku roztoku nejsou časté, stejně jako reakce v místě vpichu – zarudnutí, otok, bolestivost atd. [8]. Lipodystrofiím lze předcházet změnou místa vpichů.
Četnost závažných nežádoucích účinků se u DM2T nelišila od té, která byla zaznamenána u skupiny léčené glarginem (21 příhod na 100 pacientoroků při léčbě degludekem oproti 20 příhodám na 100 pacientoroků při podávání glarginu). Deset pacientů zemřelo – osm ze 753 (1 %) jedinců léčených degludekem a dva z 251 (1 %) léčených glarginem. U žádného úmrtí nebylo shledáno, že nastalo v souvislosti s podáváním studijního léčiva, s výjimkou infarktu myokardu ve skupině léčené glarginem. Nelišila se ani četnost výskytu kardiovaskulárních příhod mezi sledovanou skupinou léčenou degludekem a skupinou léčenou glarginem.
Mezi další příhody spojené s léčbou degludekem patřila onemocnění horních cest dýchacích, bolesti kloubů, zad, bolesti hlavy, zvracení, průjem, dermatitida, pruritus, periferní edémy, kašel a zvýšení krevního tlaku [16, 17].
Ve studii Zinmana se také výskyt závažných událostí nelišil mezi skupinou léčenou degludekem, kde představoval 8,1 % (62/766) pacientů a skupinou léčenou glarginem, v níž dosáhl 10,1 % (26/257) pacientů. Nejčastěji se jednalo o hypoglykemie a malignity. Jejich výskyt byl v obou skupinách obdobný, ale žádná z událostí nebyla uvedena do souvislosti s inzuliny aplikovanými během studie [17].
O něco více nežádoucích příhod zaznamenala studie u pacientů s DM1T (8,7 a 6,5 příhody/pacientorok ve větvi s degludekem, oproti 9,1 příhody/pacientorok u léčených glarginem). Závažné nežádoucí příhody se v této studii vyskytly čtyři – abdominální distenze, hypoglykemie s bezvědomím, těžká hypoglykemie při podávání degludeku a diabetická ketoacidóza u skupiny léčené glarginem [7].
Lékové interakce
Mnohá léčiva zasahují do glukózového metabolismu a mohou mít vliv na dávkování při inzulinoterapii. Potřebu inzulinu mohou obecně snížit perorální antidiabetika, agonisté receptoru GLP-1, inhibitory monoaminooxidázy (IMAO), betablokátory, inhibitory angiotenzin konvertujícího enzymu (ACE), salicyláty, anabolické steroidy a sulfonamidy.
Potřeba inzulinu může být naopak vyšší při užívání perorální antikoncepce, thiazidů, glukokortikoidů, hormonů štítné žlázy, sympatomimetik, dále při užívání růstového hormonu a danazolu.
Těhotenství a kojení
Dlouhodobější studie týkající se těhotenství a kojení nejsou v současné době k dispozici. Reprodukční studie na zvířatech však neprokázaly žádný rozdíl mezi degludekem a humánním inzulinem, co se týká embryotoxicity a teratogenity. U potkanů se inzulin degludek vylučoval do mléka, ale jeho koncentrace byla nižší než v plazmě. Jak je tomu u lidí, není známo, ale neočekávají se žádné metabolické účinky na kojené děti a novorozence.
Ovlivnění pozornosti
U degludeku platí stejná doporučení jako u ostatních inzulinů. Nejčastěji ohrožuje pacientovu pozornost, schopnost soustředění a reakce nízká hladina krevní glukózy – hypoglykemie. Při podávání degludeku je sice riziko výskytu hypoglykemií nízké, ale v některých případech, jako je řízení motorových vozidel, práce s různými typy strojů a zařízení, kde by nepozornost nebo zpomalená reakce mohla znamenat ohrožení zdraví pacienta nebo jiných osob, je nutné zvážit, zda by nebylo vhodnější pacientovi doporučit změnu zaměstnání.
Dávkování
Degludek je bazální inzulin určený pro subkutánní aplikaci jednou denně kdykoli v průběhu dne, ale je vhodné ho podávat ve stejnou dobu. Načasování dávky inzulinu na dobu před večeří či později, nebo naopak ráno se řídí individuálně dle pacientova denního rozvrhu a profilu glykemií. Degludek je určen pro pacienty s DM1T, DM2T a v indikovaných případech i pro pacienty s ostatními typy diabetu.
Terapie se zahajuje nízkou dávkou (tj. 0,1–0,2 j/kg/den, tedy asi 10 jednotek v jedné dávce). Vyšší počáteční dávkování je možné tehdy, je-li hyperglykemie vysoká a rezistentní k léčbě. Pacientům, kteří si degludek aplikují večer, se doporučuje, aby si zvyšovali dávku inzulinu o 2 jednotky tak, aby dosáhli doporučené výše ranní glykemie. Titraci se doporučuje provádět minimálně po třech dnech, optimálně po týdnu dle průměrů ranních lačných glykemií. Dosahuje-li hodnota ranní glykemie maximálně 6 mmol/l, je vhodné zvýšit dávku degludeku o 2 jednotky, pohybuje-li se v rozmezí 6–8 mmol/l, doporučuje se zvýšit dávku analoga až o 4 jednotky. Při přetrvávání lačných glykemií s hodnotami vyššími než 8 mmol/l může pacient přidat až 6 jednotek analoga. Ohlásí-li pacienti hypoglykemie, doporučuje se obdobně po 2 jednotkách dávku dlouhodobého inzulinu snižovat.
U pacienta s DM1T, nejčastěji léčeného režimem bazál-bolus, je nutné degludek kombinovat s rychle působícím inzulinem před hlavními jídly. Tento nejvíce flexibilní režim, který představuje jednu dávku bazálního inzulinu a tři preprandiální dávky rychle působícího inzulinu [18], je vhodný nejen pro DM1T, ale i pro inzulin-dependentní DM2T. Degludek se dá dobře využít i při režimu bazál-plus, tj. přidání jedné dávky rychle působícího analoga k největšímu jídlu ze dne.
Zapomene-li si pacient degludek aplikovat, je vhodné ho poučit, aby tak učinil ihned poté, kdy toto opomenutí zjistí, dále pak ať pokračuje v zavedeném dávkování. V případech, kdy není aplikace možná ve stejnou denní dobu, má degludek jednu velkou výhodu oproti ostatním dlouhodobě působícím inzulinům – umožňuje velkou flexibilitu v načasování dávek. Pravidlem by však mělo být, že odstup mezi jednotlivými injekcemi je alespoň osm hodin. Jedna jednotka degludeku odpovídá jedné mezinárodní jednotce humánního inzulinu, glarginu nebo detemiru. Při převodu pacienta z léčby jinými dlouhodobými inzuliny na léčbu degludekem se dávka odhaduje v poměru jedna ku jedné. Má-li pacient horší kompenzaci, je třeba dávku stanovit individuálně, za následného častějšího monitorování glykemií.
Způsob podání
Degludek je určen pouze pro subkutánní podávání, nesmí se podávat intravenózně ani v infuzních pumpách pro riziko těžké hypoglykemie a ani intramuskulárně, odkud by se mohl vstřebávat jinou rychlostí. Degludek nesmí být míchán s žádným jiným přípravkem, což se netýká plánované výroby předpřipravených hotových inzulinových směsí.
Seznam použité literatury
- [1] Jonassen I, Havelund S, Hoeg-Jensen T, et al. Design of the novel protraction mechanism of insulin degludec, an ultra-long-acting basal insulin. Pharm Res 2012; 29: 2104–2014.
- [2] Havelund S, Plum A, Ribel U, et al. The mechanism of protraction of insulin detemir, a long-acting, acylated analog of human insulin. Pharm Res 2004; 21: 1498–1504.
- [3] Zinman B, Fulcher GR, Rao PV, et al. Insulin degludec, a new generation ultra-long acting insulin, used once daily or 3-times weekly in people with type 2 diabetes: comparison to insulin glargine (abstract). Diabetes 2010; 59 (suppl 1): A11.
- [4] Scholtz HE, Pretorius SG, Wessels DH, et al. Pharmacokinetic and glucodynamic variability: assessment of insulin glargine, NPH insulin and insulin ultralente in healthy volunteers using a euglyceamic clamp technique. Diabetologia 2005; 48: 1988–1995.
- [5] Heise T, Hermanski L, Nosek L, et al. Insulin degludec: less pharmacodynamic variability than insulin glargine under steady state conditions. Diabetologia 2010; 53 (suppl 1): S387.
- [6] Heise T, Nosek L, Bøttcher SG, et al. Ultra-long insulin degludec has a flat and stable glucose-lowering effect in type 2 diabetes. Diabetes Obes Metab 2012; 14: 944–950.
- [7] Birkeland KI, Home PD, Wendisch U, et al. Insulin degludec in type 1 diabetes. Diab Care 2011; 34: 661–665.
- [8] Zinman B, Fulcher G, Rao PV, et al. Insulin degludec, an ultra-long-acting basal insulin, once a day or three times a week versus insulin glargine once a day in patient with type 2 diabetes: a 16-week, randomised, open-label, phase 2 trial. Lancet 2011; 377: 924–931.
- [9] Heise T, Hermanski L, Nosek L, et al. Insulin degludec: four times lower pharmacodynamic variability than insulin glargine under steady-state conditions in type 1 diabetes. Diabetes Obes Metab 2012; 14: 859–864.
- [10] Heise T, Pieber TR. Towards peakless, reproducible and long-acting insulins. An assessment of the basal analogues based on isoglycaemic clamp studies. Diabetes Obes Metab 2007; 9: 648–659.
- [11] Ashwell SG, Gebbie J, Home PD. Twice-daily compared with once-daily insulin glargine in people with Type 1 diabetes using meal-time insulin aspart. Diabet Med 2006; 23: 879–886.
- [12] DeVries JH: To: Scholtz HE, Pretorius SG, Wessels DH, Becker RHA. Pharmacokinetic and glucodynamic variability: assessment of insulin glargine, NPH insulin and insulin ultralente in healthy volunteers using a euglycemic clamp technique. Diabetologia 2005; 48: 1988–1995. Diabetologia 2006; 49: 1125–1126.
- [13] Plank J, Bodenlenz M, Sinner F, et al. A double-blind, randomized, dose-response study investigating the pharmacodynamic and pharmacokinetic properties of the long-acting analog detemir. Diab Care 2005; 28: 1107–1112.
- [14] Heise T, Nosek L, Ronn BB, et al. Lower within-subject variability of insulin detemir in comparison to NPH insulin and insulin glargine in people with type 1 diabetes. Diabetes 2004; 53: 1614–1620.
- [15] Heller S, Buse J, Fisher M, et al. Insulin degludec, an ultra-longacting basal insulin, versus insulin glargine in basal-bolus treatment with mealtime insulin aspart in type 1 diabetes (BEGIN Basal-Bolus Type 1): a phase 3, randomised, open-label, treat-to-target non-inferiority trial. Lancet 2012; 379: 1489–1497.
- [16] Garber A, King AB, Del Prato S, et al. Insulin degludec, an ultra-longacting basal insulin, versus insulin glargine in basal-bolus treatment with mealtime insulin aspart in type 2 diabetes (BEGIN Basal-Bolus Type 2): a phase 3, randomised, open-label, treat-to-target non-inferiority trial. Lancet 2012; 379: 1498–1507.
- [17] Zinman B, Philis-Tsimikas A, Cariou B, et al. Insulin degludec versus insulin glargine in insulin-naive patients with type 2 diabetes. A 1-year, randomized, treat-to-target trial (BEGIN Once Long). Diabetes Care Publish Ahead of Print, published online October 5, 2012. care.diabetesjournal.org
- [18] Inzucchi SE, Bergenstal RM, Buse JB, et al. Management of hyperglycaemia in type 2 diabetes: a patient-centered approach. Position statement of the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologia 1012; 55: 1577–1596.
- [19] Nathan DM, Buse JB, Davidson MB, et al. Medical management of hyperglycemia in type 2 diabetes: a consensus statement of the American Diabetes Association and the European Association for the Study of Diabetes. Diab Care 2009; 32: 193–203.
- [20] Bonds DE, Miller ME, Bergenstal RM, et al. The association between symptomatic severe hypoglycaemia and mortality in type 2 diabetes: retrospective epidemological analysis of the ACCORD study. BMJ 2010; 240: b4909.
- [21] Zoungas S, Patel A, Chalmers J, et al. Severe hypoglycemia and risk of vascular events and death. N Engl J Med 2010; 363: 1410–1418.
- [22] Frier BM, Schernthaner G, Heller SR. Hypoglycemia and cardiovascular risks. Diab Care 2011; 34 (suppl 2): S132–137.
- [23] Johnston SS, Conner CM, Aagren M, et al. Evidence linking hypoglycemic events to an increased risk of acute cardiovascular events in patients with type 2 diabetes. Diab Care 2011; 34: 1164–1170.
- [24] Brod M, Christensen T, Thompsen TL, et al. The impact of non-severe hypoglycemic events on work productivity and diabetes management. Value Health 2011; 14: 665–671.
- [25] Hermansen K, Davies M. Does insulin detemir have a role in reducing risk of insulin-associated weight gain? Diabetes Obes Metab 2007; 9: 209–217.
- [26] Heise T, Tack CJ, Cuddihy R, et al. A new-generation ultra-long-acting basal insulin with a bolus boost compared with insulin glargine in insulin-naive people with type 2 diabetes. Diab Care 2011; 34: 669–674.