Solifenacin
Solifenacin sukcinát je kompetitivním antagonistou specifických cholinergních receptorů, a to především muskarinových receptorů subtypu M3 s minimální nebo žádnou afinitou k dalším receptorům a iontovým kanálům. Příznivým dávkováním jednou denně částečně obchází nízkou compliance pacientů se symptomy hyperaktivního močového měchýře (overactive bladder, OAB). Vede k významné redukci urgencí a je prvním z anticholinergik, u kterého byla prokázána statisticky významná redukce nočních mikcí [1].
Farmakologická skupina
Mechanismus účinku a farmakodynamika
V evropské populaci dosahuje prevalence symptomů hyperaktivního močového měchýře (OAB) 15–17 % dospělých [2, 3]. Podle dotazníkové akce z britského království [4] u obyvatel starších 40 let dosahuje prevalence 28,5 % a incidence 14 %.
Mikce u člověka je řízena složitou mnohaúrovňovou linií, zahrnující korové centrum, pontinní mikční centrum a sakrální centrum cestou sympatiku a parasympatiku. Korová centra umožňují volně oddálit mikci do vhodné doby a místa. Vzájemnou koordinaci sfinkteru a detruzoru umožňuje pontinní centrum a podílí se tak na jímací a vyprazdňovací fázi mikčního cyklu. Regulace centrálního mikčního centra se účastní řada neurotransmiterů – serotonin, dopamin, noradrenalin, GABA (g-aminomáselná kyselina). Ve výši S2-4 (Onufovo centrum) odstupuje somatická inervace cestou nervi pudendi. Sympatická nervová vlákna vycházejí z Th10–L2 a přes plexus hypogastricus inervují především oblast trigona i hrdla močového měchýře a proximální uretry. Parasympatická inervace pochází z S2-4 a cestou plexus pelvicus směřuje především k fundu močového měchýře. Zde je lokalizováno nejvíce muskarinových (M) receptorů, které na podráždění acetylcholinem reagují kontrakcí svaloviny. Nikotinové parasympatické receptory jsou lokalizovány v oblasti svěrače a na podráždění reagují relaxací. V jímací fázi mikčního cyklu převládá tonus sympatiku (odpovídá za kontrakci hladké svaloviny hrdla i proximální uretry a za relaxaci detruzoru), mikční fáze naopak podléhá vlivu parasympatiku.
V souvislosti s hyperaktivitou detruzoru se soustředí pozornost na muskarinové receptory močového měchýře. V současnosti bylo izolováno 5 subtypů M-receptorů (M1–M5). Subtypy jsou kódovány rozdílnými geny. Všechny M-receptory patří mezi transmembránové receptory vázané na G-protein, jsou však strukturálně i farmakologicky odlišné. M-receptory je možné detekovat i v uroteliálních buňkách a v buňkách sympatických a parasympatických zakončení (presynaptické muskarinové receptory). M-receptory nacházíme v různých tkáních u člověka (tab. 1) – kromě detruzoru např. ve slinných žlázách, v myokardu a dalších [5]. Na buněčných membránách detruzoru je 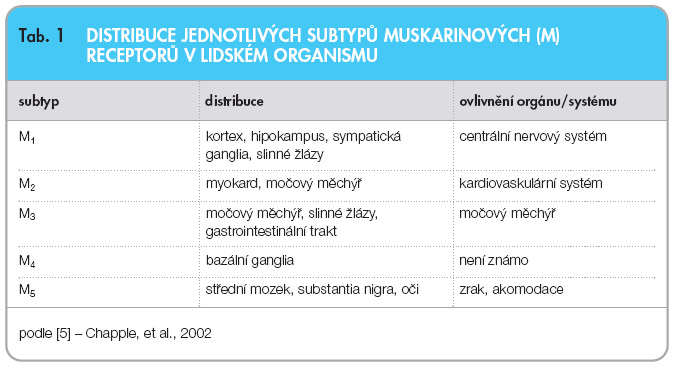 nejvyšší exprese receptorů M2 a M3. Subtyp M2 receptorů je početně dominantní, subtyp M3 tvoří asi 20 % z celkového počtu. Receptory M3 iniciují kontraktilitu detruzoru, receptory M2 tuto kontrakci usnadňují a současně inhibicí b-adrenergních stimulů mají tlumivý účinek na detruzor. V močovém měchýři jsou exprimovány především b2- a b3-adrenergní receptory s relaxačním účinkem na detruzor a a1-adrenergní receptory, jejichž aktivace vede ke kontrakci hladké svaloviny v oblasti hrdla močového měchýře, v malém množství jsou lokalizovány i v buňkách detruzoru (obr. 1). Zvýšená citlivost a-adrenergních receptorů se může podílet na zvýšené kontraktilitě detruzoru. Navíc receptory M2 ovlivňují kontraktilitu detruzoru blokádou
nejvyšší exprese receptorů M2 a M3. Subtyp M2 receptorů je početně dominantní, subtyp M3 tvoří asi 20 % z celkového počtu. Receptory M3 iniciují kontraktilitu detruzoru, receptory M2 tuto kontrakci usnadňují a současně inhibicí b-adrenergních stimulů mají tlumivý účinek na detruzor. V močovém měchýři jsou exprimovány především b2- a b3-adrenergní receptory s relaxačním účinkem na detruzor a a1-adrenergní receptory, jejichž aktivace vede ke kontrakci hladké svaloviny v oblasti hrdla močového měchýře, v malém množství jsou lokalizovány i v buňkách detruzoru (obr. 1). Zvýšená citlivost a-adrenergních receptorů se může podílet na zvýšené kontraktilitě detruzoru. Navíc receptory M2 ovlivňují kontraktilitu detruzoru blokádou 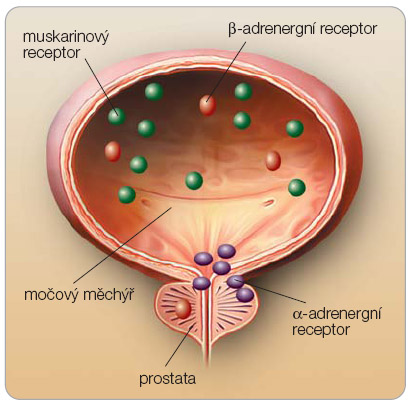 kalciových kanálů [6]. Muskarinové receptory urotelu zprostředkovávají uvolnění mediátorů, které inhibují kontrakci detruzoru. Hustota muskarinových receptorů je v urotelu přibližně 2krát vyšší než ve svalových buňkách detruzoru [7]. Zastoupení subtypů M2 a M3 je nejspíše shodné se zastoupením ve svalovině. Muskarinové receptory byly prokázány na presynaptických zakončeních jak parasympatiku, tak i sympatiku. Presynaptické receptory M1 působí na svalovou kontrakci facilitačně zvýšeným uvolňování acetylcholinu, naopak presynaptické receptory M2 a M4 působí inhibičně. U hyperaktivního měchýře byla prokázána zvýšená aktivita receptorů M1, jejich farmakologické charakteristiky se mění a blíží receptorům M3 [8]. Problematika je složitá, nicméně současné trendy farmakoterapie jsou zaměřeny na ovlivnění muskarinových receptorů, především pak M3. Solifenacin má nejvyšší selektivní afinititu k receptorům M3 ze všech přípravků na našem trhu [9].
kalciových kanálů [6]. Muskarinové receptory urotelu zprostředkovávají uvolnění mediátorů, které inhibují kontrakci detruzoru. Hustota muskarinových receptorů je v urotelu přibližně 2krát vyšší než ve svalových buňkách detruzoru [7]. Zastoupení subtypů M2 a M3 je nejspíše shodné se zastoupením ve svalovině. Muskarinové receptory byly prokázány na presynaptických zakončeních jak parasympatiku, tak i sympatiku. Presynaptické receptory M1 působí na svalovou kontrakci facilitačně zvýšeným uvolňování acetylcholinu, naopak presynaptické receptory M2 a M4 působí inhibičně. U hyperaktivního měchýře byla prokázána zvýšená aktivita receptorů M1, jejich farmakologické charakteristiky se mění a blíží receptorům M3 [8]. Problematika je složitá, nicméně současné trendy farmakoterapie jsou zaměřeny na ovlivnění muskarinových receptorů, především pak M3. Solifenacin má nejvyšší selektivní afinititu k receptorům M3 ze všech přípravků na našem trhu [9].
Solifenacin má poměrně rychlý nástup účinku, obvykle do 1 týdne od začátku užívání. Z metaanalýzy 4 kontrolovaných studií fáze III vyplývá ústup inkontinence až u 50 % nemocných a u 35 % nemocných došlo ke snížení frekvence močení. Účinnost přetrvávala stabilní po dobu minimálně 12 měsíců. Příznivý dopad měla léčba hyperaktivity měchýře na kvalitu života, na celkové vnímání zdravotního stavu, vnímání inkontinence, na pracovní, fyzická a sociální omezení, emoce, intenzitu obtíží, kvalitu spánku a na zachování životní energie.
Farmakokinetické vlastnosti
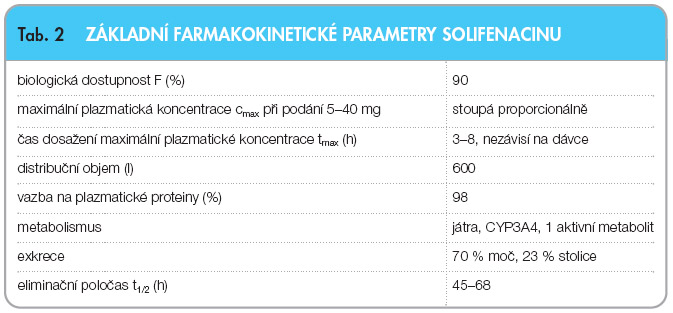 Základní farmakokinetické vlastnosti solifenacinu jsou přehledně shrnuty v tab. 2. V rozmezí terapeutických dávek je farmakokinetika lineární.
Základní farmakokinetické vlastnosti solifenacinu jsou přehledně shrnuty v tab. 2. V rozmezí terapeutických dávek je farmakokinetika lineární.
Absorpce
Solifenacin po perorálním podání dosahuje maximální plazmatické koncentrace (cmax) za 3 až 8 hodin. Hodnota tmax nezávisí na dávce. Hodnota cmax a plocha pod křivkou (AUC) stoupá proporcionálně s dávkou v rozmezí 5 až 40 mg. Absolutní biologická dostupnost je přibližně 90 %. Příjem potravy nemá na cmax a AUC žádný vliv.
Distribuce
Zjevný distribuční objem solifenacinu po intravenózním podání je 600 l. Solifenacin je v přibližně 98 % vázán na plazmatické bílkoviny, především na kyselý a1-glykoprotein.
Metabolismus
Solifenacin je ve významné míře metabolizován v játrech, především cytochromem P-450 (CYP3A4). Existují i alternativní metabolické dráhy. Systémová clearance solifenacinu je přibližně 9,5 l/h a konečný poločas se pohybuje mezi 45–68 hodinami. Po perorálním podání je možné v plazmě identifikovat ještě jeden farmakologicky aktivní metabolit (4R-hydroxysolifenacin) a tři neaktivní metabolity (N-glukuronid, N-oxid a 4R-hydroxy-N-oxid solifenacinu).
Exkrece
Po jednorázové aplikaci solifenacinu značeného 14C bylo přibližně 70 % radioaktivity detekováno v moči a 23 % ve stolici po dobu 26 dnů. Zhruba 11 % radioaktivity připadá na nezměněnou látku, asi 18 % na N-oxid metabolit, 9 % na 4R-hydroxy-N-oxid metabolit a 8 % na 4R-hydroxy aktivní metabolit.
Klinické zkušenosti
Výstupy klinických studií dokládají vysoce signifikantní redukci symptomů OAB [10]. Navíc je solifenacin prvním z anticholinergik, u kterého byla prokázána statisticky významná redukce nykturií [1]. Podle metaanalýzy 4 velkých multicentrických studií fáze III [11], provedených s více než 2800 pacienty (zařazeno > 80 % žen), bylo dosaženo u pacientů léčených solifenacinem v dávce 5 mg p.d. redukce epizod urgence o 66,1 %, redukce epizod inkontinence 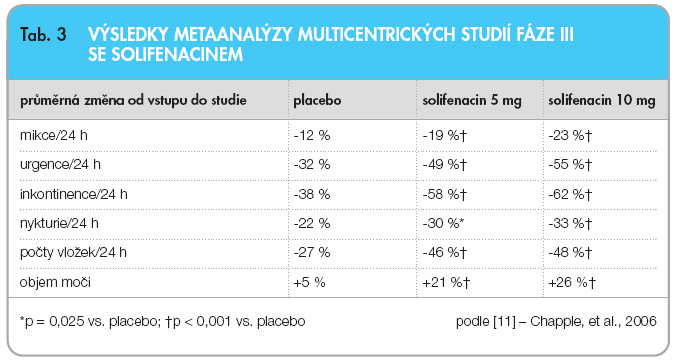 o 100 % a redukce frekvence mikcí o 19,4 % (tab. 3). Mikční objem se zvýšil o 19 %. Poprvé vůbec byla zaznamenána statisticky významná redukce počtu nykturií, a to o 36,4 %. U 29 % pacientů, kteří trpěli v úvodu léčby urgencemi, odezněly tyto symptomy po tříměsíční léčbě, u 51 % pacientů s inkontinencí při zahájení léčby po tříměsíční terapii inkontinence vymizela. Léčbu solifenacinem ukončilo předčasně pro výskyt nežádoucích účinků pouze 2,8 % léčených pacientů při dávkování 5 mg p.d. (ve skupině s placebem 4,4 %). Mezi nejčastější nežádoucí účinky patří sucho v ústech, obstipace a rozmazané vidění.
o 100 % a redukce frekvence mikcí o 19,4 % (tab. 3). Mikční objem se zvýšil o 19 %. Poprvé vůbec byla zaznamenána statisticky významná redukce počtu nykturií, a to o 36,4 %. U 29 % pacientů, kteří trpěli v úvodu léčby urgencemi, odezněly tyto symptomy po tříměsíční léčbě, u 51 % pacientů s inkontinencí při zahájení léčby po tříměsíční terapii inkontinence vymizela. Léčbu solifenacinem ukončilo předčasně pro výskyt nežádoucích účinků pouze 2,8 % léčených pacientů při dávkování 5 mg p.d. (ve skupině s placebem 4,4 %). Mezi nejčastější nežádoucí účinky patří sucho v ústech, obstipace a rozmazané vidění.
Dlouhodobé podávání dále signifikantně zvyšuje sledované parametry [12]. Po 52 týdnech léčby zaznamenal Haab oproti výchozímu stavu redukci frekvencí o 27 %, redukci nykturií o 50 % a redukci urgencí o 89 %. Současně došlo ke vzestupu objemu moči při každé mikci o 31 %. U nežádoucích účinků nedošlo při dlouhodobém užívání ke zvýšení frekvence nebo jejich závažnosti. Roční podávání dokončilo 81 % nemocných a pouze 4,7 % ukončilo terapii pro nežádoucí účinky. Srovnatelné studie s oxybutininem (dokončilo 46 % a pro nežádoucí účinky ukončilo 24 % léčených) a trospiem (dokončilo 75 % a pro nežádoucí účinky ukončilo 6 % léčených) dokládají lepší výsledky při podávání solifenacinu. Vyšší efektivita solifenacinu v redukci epizod urgencí a urgentních inkontinencí při srovnatelné míře nežádoucích účinků je doložena i při srovnání s tolterodinem IR (4 mg p.d.) [10]. Studie STAR na souboru 1355 pacientů srovnává účinnost a bezpečnost flexibilního podávání solifenacinu (5–10 mg denně) s tolterodinem SR 4 mg denně [13]. Ve skupině se solifenacinem bylo dosaženo signifikantně větší redukce epizod urgence, urgentní inkontinence a inkontinence, stejně i snížení spotřeby vložek oproti skupině léčené tolterodinem SR. Signifikantně nižší byl i výskyt nežádoucích účinků srovnávaných na suchosti v ústech. Solifenacin poskytuje více vyváženou léčbu z hlediska účinnosti a bezpečnosti než tolterodin.
Jiným sledovaným faktorem je vnímání urgence, jde o výraz úsilí objektivizovat parametr urgence jako symptomu OAB. Parametrem je nutnost přerušit činnost pro urgenci; 12týdenní sledování nemocných léčených solifenacinem vs. placebem signifikantně prodlužuje dobu vnímání urgence pacientem a zlepšuje kvalitu života pacienta [14].
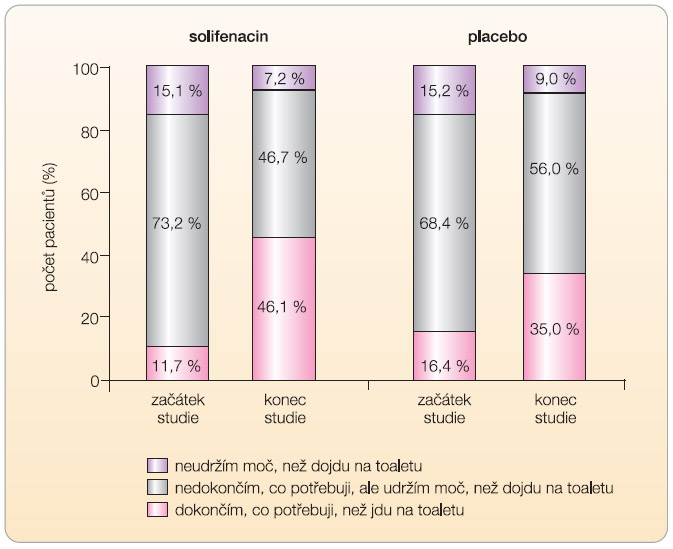 Dalším novým faktorem je tzv. warning time, tedy čas od začátku vnímání urgence do začátku vyprazdňování měchýře (mikce či únik moči). Prodloužení intervalu mezi nucením a močením umožňuje vyhledat toaletu (graf 1) a vede k posílení sebedůvěry pacienta [15]. Studie VENUS prokazuje, že solifenacin je prvním antimuskarinikem signifikantně zlepšujícím warning time ve schváleném dávkování, neboť darifenacin je účinný pouze v dávkách přesahujících DDD (30 mg) a tolterodin je prakticky neúčinný. Studie VENUS představuje nejrozsáhlejší klinickou studii u pacientů s OAB, která hodnotí warning time a proměnné údaje z mikčních deníků ve stejné populaci. Léčba solifenacinem v porovnání s placebem výrazně prodloužila warning time (31,5 vs. 12 s; p = 0,008).
Dalším novým faktorem je tzv. warning time, tedy čas od začátku vnímání urgence do začátku vyprazdňování měchýře (mikce či únik moči). Prodloužení intervalu mezi nucením a močením umožňuje vyhledat toaletu (graf 1) a vede k posílení sebedůvěry pacienta [15]. Studie VENUS prokazuje, že solifenacin je prvním antimuskarinikem signifikantně zlepšujícím warning time ve schváleném dávkování, neboť darifenacin je účinný pouze v dávkách přesahujících DDD (30 mg) a tolterodin je prakticky neúčinný. Studie VENUS představuje nejrozsáhlejší klinickou studii u pacientů s OAB, která hodnotí warning time a proměnné údaje z mikčních deníků ve stejné populaci. Léčba solifenacinem v porovnání s placebem výrazně prodloužila warning time (31,5 vs. 12 s; p = 0,008).
Nově jsou dále sledovány parametry, které hodnotí vliv solifenacinu na kognitivní funkce – učení, pozornost, paměť. Studie SUNRISE [16] porovnává vliv solifenacinu 10 mg, oxybutininu 10 mg a placeba na kognitivní funkce. Solifenacin na rozdíl od oxybutininu neprokázal negativní tlumivý účinek na bdělost, pozornost a učení starších pacientů. Přímé srovnání solifenacinu s ostatními močovými spasmolytiky není v současné době k dispozici.
Zařazení do současné palety léčiv
Solifenacin rozšiřuje skupinu retardovaných močových spasmolytik o léčivo s dobrou účinností a přijatelným, spíše nižším výskytem vedlejších nežádoucích účinků. Léčivo je bezpečné i v geriatrické praxi.
Indikace
Symptomatická léčba urgentní inkontinence a/nebo zvýšené frekvence močení a naléhavosti močení u pacientů s hyperaktivním močovým měchýřem. Přípravek má stanovené preskripční omezení „P“, kdy je hrazen z veřejného zdravotního pojištění.
Léčiva ze skupiny anticholinergik – tolterodin, fesoterodin, darifenacin a solifenacin předepisuje urolog nebo gynekolog:
- při nesnášenlivosti (nutnost přerušení léčby pro významné vedlejší účinky),
při nedostatečné účinnosti (snížení urgentních nebo inkontinentních epizod o méně než 50 % a počtu mikcí o méně než 20 %) jiných léčiv ze skupiny anticholinergik a spasmolytik (oxybutinin, propiverin, trospium) u nemocných postižených hyperaktivním měchýřem (počet mikcí 8 a více/24 h, z toho minimálně jedna mikce za noc, nejméně jedna epizoda urgence nebo jedna epizoda inkontinence/24 h), - při urgentní inkontinenci (nejméně jedna epizoda urgentní inkontinence/24 h).
- Po 3 měsících terapie bude hodnocen stav pacienta na základě anamnestických údajů před zahájením terapie anticholinergiky. Pokud dojde k poklesu počtu mikcí za 24 hod. nejméně o 20 % nebo k poklesu počtu urgentních epizod nejméně o 50 % nebo k poklesu počtu inkontinentních epizod nejméně o 50 %, je možné v terapii pokračovat.
Kontraindikace
Léčba solifenacinem je kontraindikována u pacientů s močovou retencí, závažnými gastrointestinálními poruchami (včetně toxického megakolon), s myasthenia gravis a glaukomem s úzkým úhlem; dále u pacientů, kde existuje toto riziko:
- přecitlivělost na léčivou látku nebo jinou látku obsaženou v přípravku,
- léčba dialýzou,
- závažné postižení jater,
- závažné poškození ledvin nebo středně závažné poškození jater se současnou léčbou silným inhibitorem CYP3A4.
Pacienti s dědičnou intolerancí galaktózy, laponským deficitem laktázy nebo malabsorpcí glukózy/galaktózy by neměli přípravek užívat. Před zahájením léčby je nezbytné zvážit jiné příčiny častého močení (srdeční selhání, onemocnění ledvin). Přítomnou močovou infekci je třeba léčit vhodnými antimikrobiálními přípravky před zahájením léčby solifenacinem.
Zvláštní pozornosti je třeba u pacientů:
- s klinicky významnou infravezikální obstrukcí s rizikem vzniku retence moči,
- s poruchami gastrointestinálního traktu obstrukčního typu,
- s rizikem snížené motility gastrointestinálního traktu,
- se závažným poškozením funkce ledvin (clearance kreatininu < 30 ml/min); nepodávat dávku vyšší než 5 mg denně,
- se středně závažným poškozením jater (Childovo-Pughovo skóre 7–9); nepodávat dávku vyšší než 5 mg denně,
- se současnou léčbou silným inhibitorem CYP3A4,
- s hiátovou hernií nebo gastroezofageálním refluxem a s terapií léky, které mohou vyvolat či zhoršit ezofagitidu (např. bisfosfonáty),
- s vegetativní neuropatií.
U pacientů s neurogenními příčinami zvýšené aktivity detruzoru nebyla bezpečnost a účinnost stanovena. Maximální účinek přípravku lze stanovit nejdříve po 4 týdnech léčby.
Nežádoucí účinky
Podávání solifenacinu může vést k anticholinergním nežádoucím účinkům. Ty obvykle dosahují mírné až střední intenzity (tab. 4). Jejich výskyt závisí na 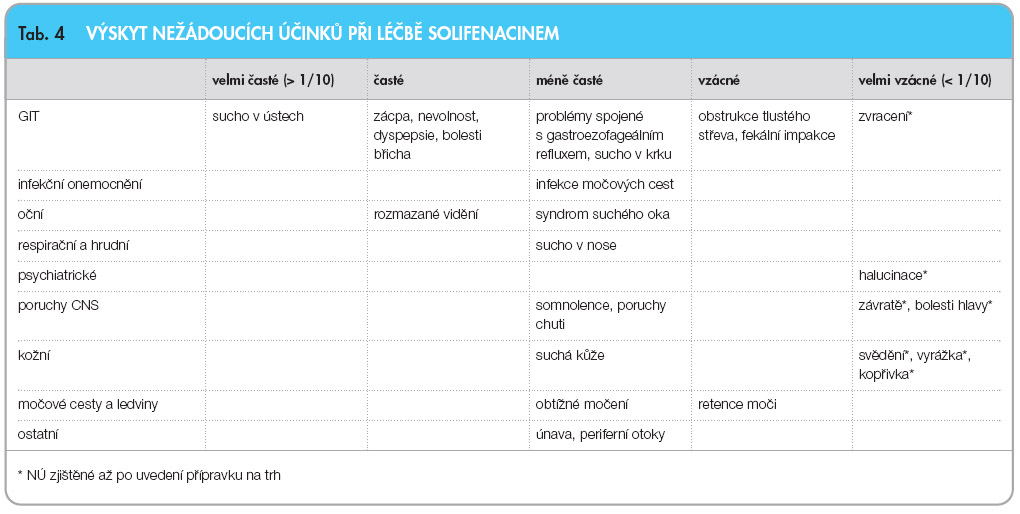 použité dávce.
použité dávce.
Nejčastějším nežádoucím účinkem je suchost v ústech, pozorovaná u 11 % nemocných léčených dávkou 5 mg denně a u 22 % nemocných léčených dávkou 10 mg denně, resp. u 4 % pacientů, kterým bylo podáváno placebo. Intenzita suchosti v ústech je nízká a jen zřídka vedla k ukončení léčby. Celkově je adherence k léčbě solifenacinem vysoká ve srovnání s ostatními léčivy ze skupiny močových spasmolytik a překračuje 90 %.
Předávkování
Příznaky
Předávkování solifenacin sukcinátem může mít závažné anticholinergní účinky a musí být adekvátně léčeno. Nejvyšší dávka solifenacin sukcinátu podaná náhodně jednomu pacientovi ve výši 280 mg během 5 hodin vedla k psychickým změnám nevyžadujícím hospitalizaci.
Léčba
 V případě předávkování solifenacin sukcinátem by měl být pacient léčen aktivním uhlím. Výplach žaludku je užitečný, pokud se provede do 1 hodiny, vyvolat zvracení není vhodné. Obdobně jako u ostatních anticholinergik mohou být příznaky léčeny, viz tab. 5. Při předávkování je třeba věnovat zvláštní pozornost pacientům se známým rizikem prodloužení QT intervalu (hypokalemie, bradykardie, současná léčba farmaky, která prodlužují QT interval) a pacientům s rizikem relevantních již existujících srdečních chorob (ischemie myokardu, arytmie, městnané srdeční selhávání).
V případě předávkování solifenacin sukcinátem by měl být pacient léčen aktivním uhlím. Výplach žaludku je užitečný, pokud se provede do 1 hodiny, vyvolat zvracení není vhodné. Obdobně jako u ostatních anticholinergik mohou být příznaky léčeny, viz tab. 5. Při předávkování je třeba věnovat zvláštní pozornost pacientům se známým rizikem prodloužení QT intervalu (hypokalemie, bradykardie, současná léčba farmaky, která prodlužují QT interval) a pacientům s rizikem relevantních již existujících srdečních chorob (ischemie myokardu, arytmie, městnané srdeční selhávání).
Interakce
Farmakologické interakce
Současné podávání s jinými anticholinergními látkami může vést k výraznějšímu léčebnému efektu, ale i k významnějším nežádoucím účinkům. Mezi ukončením léčby solifenacinem a zahájením jiné anticholinergní terapie je nutná přestávka přibližně 1 týden. Léčebný účinek solifenacinu může být snížen současným podáváním agonistů cholinergních receptorů. Solifenacin může snižovat účinek farmak, která stimulují motilitu gastrointestinálního traktu (metoklopramid, cisaprid).
Farmakokinetické interakce
Studie provedené in vitro prokázaly, že v terapeutických koncentracích solifenacin neinhibuje CYP1A1/2, 2C9, 2C19, 2D6 nebo 3A4 z lidských jaterních mikrozomů. Solifenacin pravděpodobně neovlivňuje clearance léků metabolizovaných těmito izoenzymy. Solifenacin je metabolizován CYP3A4. Současné podávání ketokonazolu (200 mg denně) vede k dvojnásobnému zvýšení AUC solifenacinu, dávka 400 mg až trojnásobně navýší AUC solifenacinu. Pokud je solifenacin podáván s ketokonazolem (nebo s jinými potentními inhibitory CYP3A4), pak je nezbytné omezit maximální dávku solifenacinu na 5 mg denně. Možné jsou farmakokinetické interakce s jinými substráty s vyšší afinitou k CYP3A4 (např. verapamil, diltiazem) a s induktory CYP3A4 (např. rifampicin, fenytoin, karbamazepin). Konkomitatní léčba solifenacinem a potentním inhibitorem CYP3A4 je kontraindikována u pacientů se závažným poškozením ledvin a středně závažným poškozením jater. Solifenacin nevykazuje žádnou farmakokinetickou interakci s kombinovanými orálními kontraceptivy (ethinylestradiol/levonorgestrel), nemění farmakokinetiku R-warfarinu ani S-warfarinu nebo jejich účinek na protrombinový čas a nemá žádný vliv na farmakokinetiku digoxinu.
Těhotenství a kojení
Studie na zvířatech nenaznačují přímé škodlivé účinky na fertilitu, embryonální či fetální vývoj nebo porod. Míra potencionálního rizika pro člověka není známa. K dispozici nejsou žádné údaje o ženách, které otěhotněly během užívání solifenacinu. Při preskripci gravidním ženám je nutno postupovat opatrně. O vylučování solifenacinu do mateřského mléka nejsou rovněž k dispozici žádné údaje. V pokusu na myši byly solifenacin a jeho metabolity vylučovány do mléka a způsobovaly špatné prospívání novorozených mláďat, které bylo závislé na podané dávce. Během kojení je nezbytné vyhnout se užívání přípravku.
Schopnost řídit a obsluhovat stroje
Solifenacin může stejně jako ostatní anticholinergika způsobit rozmazané vidění, méně často i ospalost a únavu, čímž může být schopnost řídit a obsluhovat stroje negativně ovlivněna.
Dávkování a způsobpodání
Doporučenou denní dávkou je 5 mg solifenacin sukcinátu jednou denně. V případě potřeby je možné dávku zvýšit na 10 mg solifenacin sukcinátu jednou denně. Obsah 5 nebo 10 mg solifencin sukcinátu odpovídá 3,8, resp. 7,5 mg solifenacinu. Přípravek není určen pro podávání dětem. Užívá se perorálně, polyká se celá tableta a zapíjí se tekutinou. Může se podávat s jídlem i bez něj.
Pacienti s poškozením ledvin
U pacientů s mírným až středně těžkým poškozením ledvin (clearance kreatininu > 30 ml/min) není nutná redukce dávky. U pacientů s vážným poškozením ledvin (clearance kreatininu < 30 ml/min) je nutno nepodávat dávku vyšší než 5 mg denně.
Pacienti s poškozením jater
U pacientů s lehkým poškozením jater není úprava dávky nutná. Pacienty s vážným poškozením jater (Childovo-Pughovo skóre 7–9) je třeba léčit s opatrností dávkou nepřesahující 5 mg.
Vysoce účinné inhibitory cytochromu P-450 3A4
Pokud se solifenacin podává současně s ketokonazolem nebo s jinými vysoce účinnými inhibitory CYP3A4 (např. ritonavir, nelfinavir nebo itrakonazol v terapeutických dávkách), neměla by maximální denní dávka přesáhnout 5 mg.
Farmakoekonomika
V posledních letech, pravděpodobně v souvislosti s vysokou prevalencí, je řada zahraničních prací věnována ekonomickým dopadům OAB. Hyperaktivní měchýř je spojován s řadou komorbidit a komplikací – uroinfekce, deprese, pády, ale především s negativním ovlivněním kvality života lidí postižených inkontinencí. V roce 2006 byla publikována nákladová studie z pěti evropských zemí [17]. Studie zahrnovala přímé zdravotní náklady na onemocnění a jeho komplikace. Klinická účinnost byla definována dosažením kontinence v období 3 měsíců od zahájení léčby. V rámci studie byl stanoven osmiramenný model ke sledování farmakoterapie. Jednotlivé přípravky nejsou srovnávány mezi sebou, ale ve vztahu ke kvalitě života. Při hodnocení byly sledovány následující komorbidity: močové infekce, deprese a používání inkontinenčních pomůcek a sledování kvality života. Náklady ve sledovaných evropských zemích se pohybovaly mezi 269 EUR na pacienta a rok v Itálii až 706 EUR na pacienta a rok v Británii. Dominantní jsou pomůcky pro inkontinenci, které představují 63 % všech zdravotních nákladů.
Z evropské studie vyplynulo, že solifenacin 5 mg je nejlevnější s nejvyšší účinností v léčbě OAB při srovnání různých anticholinergik. Přenos farmakoekonomických dat na úroveň České republiky je jen obtížně proveditelný. Studie vycházející metodologicky z práce, jejímiž autory jsou Ko a kol., srovnává oxybutinin a solifenacin v našich ekonomických podmínkách [18]. Výstupy dokládají, že oxybutinin by neměl nadále představovat první volbu léčby OAB. Po selhání či nesnášenlivosti neretardovaných forem močových spasmolytik je vhodné plynule upravit medikaci na retardované formy s vyšší pravděpodobností dosažení kontinence a lepší snášenlivostí. Možnou alternativou může být podávání solifenacinu.
Závěr
Seznam použité literatury
- [1] Cardozo L, Lisec M, Miliard R, et al. Randomized, double blind placebo controlled trial of the once daily antimuscarinic agent solifenacine succinate in patient with overactive bladder. J Urol 2004; 172: 1919–1924.
- [2] Hampel C, Gillitzer R, Pahernik S, et al. Epidemiology and etiology of overactive bladder. Urologe A 2003; 42: 776–786.
- [3] Milsom I, Abrams P, Cardozo L, et al. How widespread are the symptoms of an overactive bladder and how are they managed? A population-based prevalence study. BJU Int 2001; 87: 760–766.
- [4] McGrother CW, Donaldson MM, Shaw C, et al. MRC Incontinence Study Team. Storage symptoms of the bladder: prevalence, incidence and need for services in the UK. BJU Int 2004; 93: 763–769.
- [5] Chapple CR, Yamanishi T, Chess-Williams R. Muscarinic receptor subtypes and management of overactive bladder. Urology 2002; 60 (suppl. 5A): 82–89.
- [6] Hampel C, Thuroff JW. Pharmakologie des Harntraktes. In: Palmtag H, Goepel M, Heider H Urodynamik. Springer, Berlin Heidelberg New York Tokio, 2004: 17–33.
- [7] Hawthorn MH, Chapple CR, Cock M, Chess-Williams R. Urothelium-derived inhibitory factor(s) influences on detrusor muscle contractility in vitro. Br J Pharmacol 2000; 129: 416–419.
- [8] Uchiyama T, Chess Williams R. Muscarinic receptor subtypes of the bladder and gastrointestinal tract. J Smooth Muscle Res 2004; 40: 237–247.
- [9] Nelson CP, Gupta P, Napier CM, et al. Functional selectivity of muscarinic receptor antagonists for inhibition of M3-mediated phosphoinositide responses in guinea pig urinary bladder and submandibular salivatory gland. J Pharmacol Exp Ther 2004; 310: 1255–1265.
- [10] Chapple CR, Rechberger T, Al-Shukri S, et al. Randomised, double-blind placebo- and tolterodine-controlled trial of the once-daily antimuscarinic agent solifenacin in patiens with symptomatic overactive bladder. BJU Int 2004; 93: 303–310.
- [11] Chapple CR, Cardozo L, Steers WD, Govier FE. Solifenacin significantly improves all symptomes of overactive bladder syndrome. Int J Clin Pract 2006; 60: 959–966.
- [12] Haab F, Cardozo L, Chapple CR, et al. Long-term open-label solifenacin treatment associated with persistence with therapy in patient with overactive bladder syndrome. Eur Urol 2005; 47: 376–384.
- [13] Chapple CR, Martinez-Garcia R, Selvaggi L, et al. A comparison of the efficacy and tolerability of solifenacin succinate and extended release tolterodine at treating overactive bladder syndrome: results of the STAR trial. Eur Urol 2005; 48: 464–470.
- [14] Serels S, Masakazu A, Smith N. Solifenacin Significantly Improves Urgency in Overactive Bladder Patients Compared to Placebo. Urology 2006; 68 (suppl. 1): 72.
- [15] Toglia M, Andoh M, Hussain I. Solifenacin improves warning time significantly compared to placebo in patients with overactive bladder. STAR 227705. 36th Annual Meeting of the International Continence Society (ICS), Christchurch, New Zealand, Nov. 2006, poster 123.
- [16] Wesnes K, Edgar C, Tretter RN, et al. Solifenacin is not associated with cognitive impairment or sedation in the elderly: the randomised, double-blind SCOPE study. Autumn Meeting of British Geriatric Society, Birmingham, UK, Nov. 2008, poster 68.
- [17] Ko Y, Malone DC, Armstrong EP. Pharmacoeconomic Evaluation of Antimuscarinic Agents for the Treatment of Overactive Bladder. Pharmacotherapy 2006; 26: 1694–1702.
- [18] Skoupá J. Hyperaktivní měchýř: nákladová efektivita oxybutininu IR a solifenacinu. Urolog pro praxi 2008; 9: 61–63.