HET subkutánním ofatumumabem u léčebně naivní pacientky s roztroušenou sklerózou
Souhrn
Zimek D. HET subkutánním ofatumumabem u léčebně naivní pacientky s roztroušenou sklerózou. Remedia 2024; 34: 453–456.
Aktuální platná úhradová kritéria umožňují lékařům zahájit vysoce efektivní imunomodulační terapii, tzv. HET (high‑efficacy treatment), již od první ataky za předpokladu splnění nepříznivých prognostických známek, kterými jsou přítomnost T1 gadolinium enhancující nebo infratentoriální léze a/nebo spinální léze. Tato možnost poskytuje pacientům obrovskou výhodu, která vede prokazatelně k oddálení nebo minimalizaci rizika progrese nezávislé na relapsech, stejně tak významně redukuje i riziko relapsu a v neposlední řadě taktéž i riziko radiologické progrese. Efektivita vysoce účinné terapie je v rámci článku prezentována v kazuistice pacientky, u níž se pomocí HET podařilo dosáhnout klinické i radiologické stability, a tedy i statusu NEDA‑3.
Klíčová slova: HET – ofatumumab – radiologicky nepříznivé faktory – roztroušená skleróza.
Summary
Zimek D. HET with a subcutaneous ofatumumab in a treatment‑naïve patient with multiple sclerosis. Remedia 2024; 34: 453–456.
Current reimbursement rules make it possible for physicians to start the highly effective immunomodulatory therapy (so called HET) of multiple sclerosis since the first attack of the disease when unfavorable prognostic traits are present, i.e. gadolinium‑enhancing T1 or infratentorial and/or spinal lesions. This fact represents an enormous advantage for the patients, clearly postponing or minimizing progression independent of relapses and also reducing significantly the risk of relapse or, last but not least, of radiological progression. In this article, the effectiveness of highly effective therapy is demonstrated by a case study of a female patient in whom both clinical and radiological stability, i.e. NEDA‑3 status, were achieved using HET.
Key words: HET – ofatumumab – unfavorable radiological factors – multiple sclerosis.
Úvod
Roztroušená skleróza mozkomíšní je chronické autoimunitní onemocnění, které se řadí k nejčastějším příčinám disability u mladých dospělých, zejména žen [1]. Roztroušená skleróza vzniká na pozadí genetických a environmentálních predispozic, jež následně přispívají k rozvoji autoreaktivity buněk imunitního systému, narušení hematolikvorové bariéry a k infiltraci centrálního nervového systému (CNS) lymfocyty [2–4]. Následná demyelinizace a zánět nervového systému jsou posilovány buňkami, jež jsou uloženy přímo v CNS – zejména mikrogliemi. Roztroušená skleróza probíhá nejčastěji pod obrazem relapsů, po kterých následuje různě dlouhé „klidové” období remise, méně často se projevuje progresivními formami onemocnění charakterizovanými pozvolným vleklým zhoršováním zdravotního stavu, tedy jako primárně nebo sekundárně progresivní forma roztroušené sklerózy [5,6].
Aktuální platná úhradová kritéria dávají lékařům šanci začít léčit pacienty již od prvního relapsu léky s vysokým stupněm účinnosti, tzv. HET (high‑efficacy treatment), přičemž tato možnost představuje reálný „game changer“ v současném léčebném paradigmatu roztroušené sklerózy, význam tohoto časného nasazení lze demonstrovat četnými studiemi ze zahraničí. Například analýza dánského registru z roku 2019 prezentovaná Chalmerem jednoznačně prokázala benefit u pacientů léčených HET ve srovnání s pacienty léčenými nízce účinnými (low‑efficacy treatment, LET) a středně účinnými imunomodulačními léčivy (moderate‑efficacy treatment, MET), a to statisticky významně zejména v podobě zmírnění disability, redukce míry relapsů i redukce rizika progrese nezávislé na relapsech (progression independent of relapse activity, PIRA) [7]. Autoři další studie – He a kol. – využili data ze švédského registru a na jejich základě ve své práci v roce 2020 jednoznačně prokázali superioritu HET oproti méně účinným přípravkům i v podobě statisticky významně pozitivního rozdílu v míře progrese po 10 letech trvání nemoci [8]. Podobná data vypovídající o efektu HET na klinickou a radiologickou progresi přinesli i Laffaldano a kol., kteří ve své práci z roku 2021 analyzovali údaje z italského registru [9]. Navíc lze pomocí HET prokazatelně oddálit přechod roztroušené sklerózy do sekundárně progresivní fáze nemoci a tím zabránit postupu neurodegenerace a progresivní axonální ztráty [10].
Dle současných úhradových kritérií se do skupiny HET v souladu s platnými úhradovými kritérii v České republice zařazují perorální kladribin jakožto zástupce selektivní imunorekonstituční léčby (IRT), subkutánní ofatumumab a infuzní okrelizumab jakožto zástupci léků cílících na molekulu CD20. V zahraničí jsou do skupiny HET zařazovány ještě infuzní/subkutánní natalizumab, jenž má za léčebný cíl integrin α4, a infuzní alemtuzumab, který cílí na molekulu CD52 [11]. Úhradová kritéria v současnosti umožňují zahájit HET u pacienta s aktivní formou roztroušené sklerózy (jeden dokumentovaný a léčený relaps v předchozím roce nebo dva dokumentované a léčené relapsy v předchozích dvou letech) a zároveň s významným nálezem na magnetorezonančním zobrazení (MRI) – přítomnost T1 gadolinium enhancující/nebo infratentoriální léze a/nebo spinální léze, tedy s nálezem tzv. radiologicky nepříznivých faktorů [12–14]. Významný klinický efekt a příznivý bezpečnostní profil jednoho ze zástupců HET – subkutánního ofatumumabu – bude nyní prezentován na případu konkrétního pacienta.
Kazuistika
Pacientka, ročník 1989, začala poprvé v roce 2022 pociťovat potíže spojené s asi dva týdny trvajícím pnutím v pravém lýtku, které posléze poměrně rychle odezněly a mohla odcestovat na čtyřtýdenní dovolenou do Egypta. Nicméně po návratu z dovolené začala pozorovat klonické záškuby pravé dolní končetiny (PDK), které neustupovaly ani po jednom týdnu, což ji přimělo k návštěvě ambulantního neurologa. Ten pacientce předepsal hořčík, s jehož pomocí došlo k plné úpravě stavu, nicméně asi o dva měsíce později se objevilo brnění a necitlivost pravé tváře, které pacientku dovedly až k hospitalizaci na neurologickém oddělení okresní nemocnice.
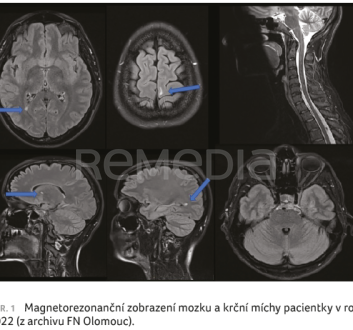 V osobní anamnéze pacientka udává prodělanou plicní embolii v 17 letech a dva prodělané potraty, které podnítily pátrání po riziku antifosfolipidového syndromu. V rodinné anamnéze nebyla zjištěna žádná interní, chirurgická a onkologická onemocnění. Pacientka aktuálně neužívala žádné léky a neudávala žádné alergie. V objektivním neurologickém nálezu byly přítomny pozitivní iritační pyramidové jevy na všech čtyřech končetinách, kvadruhyperreflexie a necitlivost pravé poloviny těla – stupeň postižení na stupnici Expanded Disability Status Scale (EDSS) 2. Po vysloveném podezření na demyelinizační onemocnění bylo provedeno MRI mozku a krční míchy, kde byla popsána vícečetná mozková ložiska s diseminací v čase i prostoru, dále plaka vychytávající gadolinium v oblasti temporálního rohu postranní komory vlevo; infratentoriální prostor a krční mícha byly bez ložisek (tedy obraz s tzv. radiologicky nepříznivými faktory) – obr. 1. V návaznosti na MRI nález byla provedena lumbální punkce s obrazem lehké proteinocytologické asociace s cytologicky převažující aktivací plazmatických buněk, dále bylo nalezeno celkem 13 oligoklonálních IgG pásů (oligoclonal bands, OCB) – vzorec typu II, jinak byla vyloučena neuroinfekce. S ohledem na anamnézu byl proveden i základní revmatologický a trombofilní screening, kde byly vyloučeny systémový lupus erythematodes a systémová sklerodermie. V kooperaci s hematology bylo zároveň vyvráceno i podezření na antifosfolipidový syndrom. S ohledem na zvažovanou diagnózu autoimunitní demyelinizace CNS charakteru roztroušené sklerózy byly podány celkem 3 g metylprednisolonu rozdělené do tří dávek v průběhu tří dnů.
V osobní anamnéze pacientka udává prodělanou plicní embolii v 17 letech a dva prodělané potraty, které podnítily pátrání po riziku antifosfolipidového syndromu. V rodinné anamnéze nebyla zjištěna žádná interní, chirurgická a onkologická onemocnění. Pacientka aktuálně neužívala žádné léky a neudávala žádné alergie. V objektivním neurologickém nálezu byly přítomny pozitivní iritační pyramidové jevy na všech čtyřech končetinách, kvadruhyperreflexie a necitlivost pravé poloviny těla – stupeň postižení na stupnici Expanded Disability Status Scale (EDSS) 2. Po vysloveném podezření na demyelinizační onemocnění bylo provedeno MRI mozku a krční míchy, kde byla popsána vícečetná mozková ložiska s diseminací v čase i prostoru, dále plaka vychytávající gadolinium v oblasti temporálního rohu postranní komory vlevo; infratentoriální prostor a krční mícha byly bez ložisek (tedy obraz s tzv. radiologicky nepříznivými faktory) – obr. 1. V návaznosti na MRI nález byla provedena lumbální punkce s obrazem lehké proteinocytologické asociace s cytologicky převažující aktivací plazmatických buněk, dále bylo nalezeno celkem 13 oligoklonálních IgG pásů (oligoclonal bands, OCB) – vzorec typu II, jinak byla vyloučena neuroinfekce. S ohledem na anamnézu byl proveden i základní revmatologický a trombofilní screening, kde byly vyloučeny systémový lupus erythematodes a systémová sklerodermie. V kooperaci s hematology bylo zároveň vyvráceno i podezření na antifosfolipidový syndrom. S ohledem na zvažovanou diagnózu autoimunitní demyelinizace CNS charakteru roztroušené sklerózy byly podány celkem 3 g metylprednisolonu rozdělené do tří dávek v průběhu tří dnů.
Následně byla pacientka odeslána k vyšetření do Centra pro demyelinizační onemocnění FN Olomouc, v klinickém obraze byly přítomny již pouze iritační pyramidové jevy na horních končetinách a hypestezie II.–IV. prstu na PDK – EDSS 1,5, v rámci diferenciální diagnostiky jsme doplnili ještě vyšetření protilátek proti MOG (myelinový oligodendrocytární protein) a AQP‑4 (akvaporin 4) – s negativním výsledkem. Stejně tak vyšetření zrakových evokovaných potenciálů a vyšetření pomocí optické koherentní tomografie neprokázaly patologický nález. S přihlédnutím ke skutečnosti, že došlo ke splnění diagnostických kritérií, byla pacientce stanovena diagnóza klinicky definitivní roztroušené sklerózy s průkazem radiologicky nepříznivých faktorů a bylo indikováno zahájení HET. S ohledem na preferenci pacientky jsme zvolili subkutánní ofatumumab (pacientka preferovala aplikaci doma, se současným snížením četnosti návštěv RS centra, dále se jí zamlouval i interval aplikací a příznivý bezpečnostní profil).
Aktuálně je pacientka léčena již téměř tři roky, během kterých neprodělala ani jeden relaps, nálezy na MRI z let 2023 a 2024 zůstávají beze změn. Nežádoucí účinky popisovala pouze po první injekční aplikaci, kdy pociťovala asi čtyři hodiny trvající chřipkové příznaky s výbornou reakcí na ibuprofen, doposud neudávala významné zvýšení četnosti závažnějších infekcí, vyjma lehce zvýšené frekvence nachlazení. Kontrolní laboratorní parametry nevykázaly významný pokles počtu lymfocytů ani signifikantní pokles hodnot celkových IgG a IgM protilátek. Při poslední kontrole v září roku 2024 zůstává v klinickém obraze pouze přítomnost iritačních pyramidových jevů na horních končetinách – se skóre EDSS 1, přičemž je pacientka nadále velmi výrazně fyzicky aktivní jako lektorka skupinových lekcí jógy a zároveň začíná uvažovat o graviditě.
Závěr
Časně nasazená HET brání rozvoji disability; redukuje riziko roční míry relapsů a efektivita časného zahájení terapie je detekovatelná dlouhodobě. Tímto způsobem může být ve vysokém procentu případů dosahováno požadovaného stadia nepřítomnosti aktivity onemocnění (NEDA-3). Využití této terapie signifikantně snižuje pravděpodobnost vytvoření nových lézí na magnetické rezonanci. Tyto jednotlivé faktory významně snižují riziko přechodu do sekundárně progresivní formy, a to při bezpečnostním profilu srovnatelném s léky nízké a střední účinnosti.
MUDr. Dalibor Zimek
Centrum pro demyelinizační onemocnění FN Olomouc
Zdravotníků 248/7, 779 00 Olomouc
e-mail: dalibor.zimek@fnol.cz
Literatura
[1] Segal BM. Multiple sclerosis. Clinical Immunology. Principles and practice. Elsevier eBooks 2019, 5. vydání: 891–902.e1.
[2] International Multiple Sclerosis Genetics C & Wellcome Trust Case Control Consortium 2. Genetic risk and a primary role for cell‑mediated immune mechanisms in multiple sclerosis. Nature 2011; 476: 214–219.
[3] International Multiple Sclerosis Genetics Consortium, Hafler DA, Compston A, et al. Risk alleles for multiple sclerosis identified by a genomewide study. N Engl J Med 2007; 357: 851–862.
[4] Marrie RA. Environmental risk factors in multiple sclerosis aetiology. Lancet Neurol 2004; 3: 709–718.
[5] Guerrero BL, Sicotte NL. Microglia in Multiple Sclerosis: Friend or Foe? Front Immunol 2020; 11: 374.
[6] Dendrou CA, Fugger L, Friese MA. Immunopathology of multiple sclerosis. Nat Rev Immunol 2015; 15: 545–558.
[7] Chalmer TA, Kalincik T, Laursen B, et al. Treatment escalation leads to fewer relapses compared with switching to another moderately effective therapy. J Neurol 2019; 266: 306–315.
[8] He A, Merkel B, Brown JWL, et al. Timing of high‑efficacy therapy for multiple sclerosis: a retrospective observational cohort study. Lancet Neurol 2020; 19: 307–316.
[9] Laffaldano P, Lucisano G, Caputo F, et al. Long‑term disability trajectories in relapsing multiple sclerosis patients treated with early intensive or escalation treatment strategies. Ther Adv Neurol Disord 2021; 14: 1–10.
[10] Brown JWL, Coles A, Horakova D, et al. Association of initial disease‑modifying therapy with later conversion to secondary progressive multiple sclerosis. JAMA 2019; 321: 175–187.
[11] Cree BAC, Hartung HP, Barnett M. New drugs for multiple sclerosis: new treatment algorithms. Curr Opin Neurol 2022; 35: 262–270.
[12] Kesimpta (ofatumumab). Úhradové podmínky. SÚKL – Přehled. Dostupné na: https://prehledy.sukl.cz/prehled_leciv.html#/leciva/0250537
[13] Mavenclad (kladribin). Úhradové podmínky. SÚKL – Přehled. Dostupné na. https://prehledy.sukl.cz/prehled_leciv.html#/leciva/0222417
[14] Ocrevus (okrelizumab). Úhradové podmínky. SÚKL – Přehled. Dostupné na: https://prehledy.sukl.cz/prehled_leciv.html#/leciva/0222682