Infekce respiračním syncytiálním virem u dětí v prvním roce života (Česká republika, 2017–2022)
Souhrn
Pazdiora P, Šanca O. Infekce respiračním syncytiálním virem u dětí v prvním roce života (Česká republika, 2017–2022). Remedia 2024; 34: 432–438.
Vzhledem k nedostatku údajů o frekvenci a závažnosti infekce vyvolané respiračním syncytiálním virem (RSV) v České republice u dětí ve věku do 1 roku byla provedena analýza dostupných dat o hospitalizaci a odhad rizika hospitalizace v jednotlivých věkových skupinách. K analýzám byla použita data z Národního registru hrazených zdravotních služeb a Národního registru hospitalizací. V období 2017–2022 bylo evidováno celkem 4 356 hospitalizací s diagnózami J12.1, J20.5, J21.0, v jednotlivých letech jich bylo zjištěno 172–1 445, nahlášeno bylo 22 úmrtí, tj. 0,5 %. Infekce RSV jsou uváděny jako příčina hospitalizace v ČR ve všech věkových skupinách, nejvyšší riziko bylo ve sledovaném období odhadnuto pro děti ve věku do 6 měsíců. Pasivní surveillance na základě existujících registrů může být považována v současnosti za dostatečný podklad pro cílená specifická opatření v nejmladších věkových skupinách.
Klíčová slova: respirační syncytiální virus – hospitalizace – úmrtí – nedonošené děti – profylaxe.
Summary
Pazdiora P, Sanca O. Respiratory syncytial virus infection among infants in the first year of life (Czech Republic, 2017–2022). Remedia 2024; 34: 432–438.
Given the paucity of data concerning the frequency and severity of respiratory syncytial virus (RSV) infections in the Czech Republic among infants in the first year of life, analysis of the available data about hospitalizations was performed and risk of hospitalization was estimated in individual age groups. Data from the National registry of healthcare services covered by insurance and the National registry of hospitalizations were used. Between 2017 and 2022, 4,356 hospitalizations with diagnoses J12.1, J20.5, J21.0 were registered, of which 172 to 1,445 concerned the individual years; 22 deaths, corresponding to 0.5% of patients, were recorded. RSV infections are mentioned as the causes for hospitalization in the Czech Republic across all age groups, with the highest estimated risk for infants younger than 6 months. Passive surveillance based on the existing registries may currently be considered a sufficient starting point for specific targeted measures in the youngest age groups.
Key words: respiratory syncytial virus – hospitalization – deaths – preterm infants – prophylaxis.
Úvod
Respirační syncytiální virus (RSV) je obalený jednovláknový RNA virus patřící do rodu Orthopneumovirus z čeledi Pneumoviridae, rozlišují se dva subtypy: RSV‑A a RSV‑B. Další klasifikace není zatím celosvětově sjednocena [1–3].
RSV patří mezi nejčastější původce respiračních onemocnění u dětí, vyvolává u nich lehká onemocnění horních cest dýchacích až závažná postižení dolních cest dýchacích (DCD), jako jsou bronchiolitida či pneumonie, kde se etiologicky uplatňuje až v 60–80 %, resp. 40 % [4,5]. Příznaky se pohybují od mírných (rýma, ucpání nosu, kašel) až po závažné projevy těžké infekce (tachypnoe, prodloužené exspirium, hypoxie, letargie aj.), které mohou vést k hospitalizacím a úmrtím. Komplikované průběhy končí na jednotkách intenzivní péče, vyžadují mechanickou ventilaci [6,7]. Závažnost klinických projevů je ovlivněna především věkem – těžkými průběhy infekce jsou nejvíce ohroženy nedonošené děti a nejmladší děti (zejména ve věku do 6 měsíců) [5,8,9]. Vysoká frekvence onemocnění výrazně zatěžuje i ambulantní lékaře; celkově jsou tyto infekce v dětském věku příčinou významných zdravotních i ekonomických dopadů [4,5,10].
Na základě nejrozsáhlejší analýzy publikovaných studií bylo odhadnuto, že v roce 2019 ve světě proběhlo u dětí ve věku do 5 let 33 milionu akutních onemocnění DCD vyvolaných RSV, z nich 101 400 skončilo úmrtím. Z 3,6 milionu onemocnění, která si vyžádala hospitalizaci, zemřelo 26 300 dětí. V rámci těchto analýz bylo odhadnuto, že u dětí ve věku do 6 měsíců v tomto roce proběhlo 6,6 milionu akutních onemocnění DCD, z nich skončilo úmrtím 45 700. Zdravotní stav vyžadoval hospitalizaci 1,4 milionu dětí, 13 300 na onemocnění během ní zemřelo – tato data jednoznačně potvrzují vysokou závažnost infekce v prvních měsících života [11]. Přestože jsou infekce RSV považovány za celosvětovou zdravotnickou prioritu, byla dosud jedinou možností specifické prevence imunizace monoklonálními protilátkami, tj. palivizumabem (Synagis). Indikace jeho podání je vzhledem k vysoké ceně poměrně zúžená, takže je podáván v jednotlivých zemích přibližně 2 % nově narozených dětí [12]. Specifická terapie bohužel dosud také neexistuje, existují jen omezené důkazy o prospěšnosti léčby ribavirinem pro vysoce rizikové skupiny dětí [13].
Vzhledem k tomu, že infekce RSV nelze klinicky odlišit od ostatních respiračních virových infekcí, je nutná jejich laboratorní diagnostika.
Výskyt infekcí vyvolaných RSV má typický sezonní charakter. Na základě surveillance v 27 zemích světa a publikací z let 1990–2017 byl popsán sezonní výskyt epidemií, které začínají na jižní polokouli a následně se v září až prosinci vyskytují na severní polokouli [14]. Podle dlouhodobé surveillance v 13 evropských zemích v letech 2010–2019 dochází k nárůstu výskytu onemocnění v zimním období v závislosti na teplotách a relativní vlhkosti. Sezonní výskyt infekcí RSV trvá zhruba 8–18 týdnů, výskyt ve východní části kontinentu je posunut asi o 4 týdny za západní Evropou [15]. Pravidelnost sezonního výskytu byla celosvětově významně ovlivněna nespecifickými opatřeními během pandemie covidu‑19 [8,16].
Současný rychlý vývoj vakcín a monoklonálních protilátek proti této infekci zvýrazňuje potřebu spolehlivé a komplexní surveillance [17].
Údaje o incidenci a závažnosti této infekce v dětském věku jsou zatím v České republice (ČR) velmi sporadické [18,19]. Cílem naší studie bylo zmapovat u dětí ve věku do 1 roku riziko hospitalizace a úmrtí v letech 2017–2022 s důrazem na diagnózy mající vztah k RSV.
Materiál a metody
K analýzám byla použita data z Národního registru hrazených zdravotních služeb a Národního registru hospitalizací, která jsou spravována Ústavem zdravotnických informací a statistiky (ÚZIS). Analyzovány byly počty hospitalizovaných pro infekci RSV podle věku se zaměřením na věkovou skupinu dětí do 1 roku za roky 2017–2022 s diagnózami J12.1: pneumonie způsobená RSV, J20.5: akutní bronchitida způsobená RSV, J21.0: bronchiolitida způsobená RSV.
Případy podléhající hlášení
Statistickou jednotkou je ukončený pobyt hospitalizovaného na oddělení. Povinným hlášením se stává každá ukončená hospitalizace pacienta (tuzemce i cizince) na jednom lůžkovém oddělení poskytovatele lůžkové péče bez ohledu na způsob přijetí a ukončení (propuštění, překlad, úmrtí). Povinnost hlásit má každý poskytovatel lůžkové (akutní intenzivní, akutní standardní, následné, dlouhodobé) a jednodenní péče, u něhož došlo k ukončení lůžkové péče pacienta.
 Základní diagnóza je definována jako stav diagnostikovaný (vyhodnocený po všech vyšetřeních) při ukončení pobytu na oddělení, který byl primárně odpovědný za potřebu hospitalizace (tj. léčby nebo vyšetřování) na daném oddělení. Existuje‑li více než jeden takový primární stav, má se vybrat ten, který se považuje za nejvíce zodpovědný za čerpání zdrojů (prostředků). Pokud se nedospělo k diagnóze, má se jako základní stav vybrat hlavní příznak, patologický nález nebo obtíž.
Základní diagnóza je definována jako stav diagnostikovaný (vyhodnocený po všech vyšetřeních) při ukončení pobytu na oddělení, který byl primárně odpovědný za potřebu hospitalizace (tj. léčby nebo vyšetřování) na daném oddělení. Existuje‑li více než jeden takový primární stav, má se vybrat ten, který se považuje za nejvíce zodpovědný za čerpání zdrojů (prostředků). Pokud se nedospělo k diagnóze, má se jako základní stav vybrat hlavní příznak, patologický nález nebo obtíž.
Jako základní onemocnění nelze kódovat ta onemocnění a stavy, které nastaly v průběhu hospitalizace. Na prvním místě se podle MKN‑10 uvede diagnóza onemocnění, které nejvíce ohrožuje zdraví či život nemocného, pokud již není uvedena jako základní diagnóza a byla léčena společně se základní diagnózou. Dále se uvádějí kódy dalších onemocnění, která komplikují, tj. ovlivňují či odůvodňují frekvenci, trvání, objem a strukturu poskytnuté a vykázané péče. Maximálně je možno uvést čtyři další diagnózy, data se průběžně aktualizují na základě jejich přenosu z jednotlivých zdravotních pojišťoven [18,20].
Na základě získaných dat z registrů k 14. 9. 2023 byla provedena deskriptivní analýza uvedených diagnóz na pozici základní a vedlejší (bez rozlišování opakovaných infekcí), dále analýza těchto diagnóz u hospitalizovaných donošených a nedonošených dětí, u dětí, které měly před začátkem hospitalizace aplikovánu minimálně jednu dávku palivizumabu (výkon 0210114, 0210115). Ke kalkulaci odhadů rizika hospitalizace byly použity počty obyvatel ČR získané z Českého statistického úřadu. Údaje o počtech donošených (≥ 37. týden těhotenství) a nedonošených dětí (< 37. týden těhotenství) narozených v letech 2017–2022 byly získány z ÚZIS. Pro statistické testování byl použit chí-kvadrát test na hladině významnosti 5 %.
Výsledky
 V období 2017–2022 bylo hospitalizováno s nejméně jednou diagnózou infekce RSV 4 356 dětí ve věku do 1 roku (15 z nich mělo dvě různé diagnózy této infekce), riziko hospitalizace bylo odhadnuto na 656,26/100 000 a rok. Celkový počet sledovaných diagnóz mezi základními a vedlejšími příčinami hospitalizace byl 4 371.
V období 2017–2022 bylo hospitalizováno s nejméně jednou diagnózou infekce RSV 4 356 dětí ve věku do 1 roku (15 z nich mělo dvě různé diagnózy této infekce), riziko hospitalizace bylo odhadnuto na 656,26/100 000 a rok. Celkový počet sledovaných diagnóz mezi základními a vedlejšími příčinami hospitalizace byl 4 371.
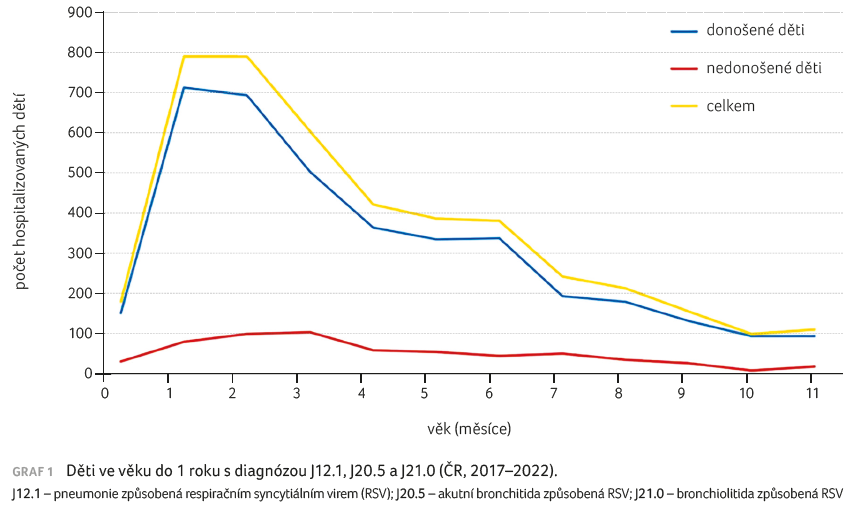
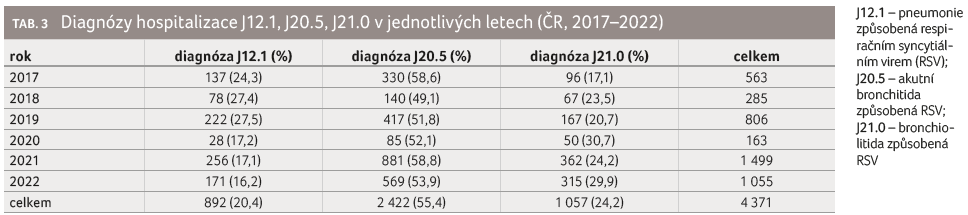
Riziko hospitalizace v jednotlivých letech kolísalo mezi 156,29 (rok 2020) až 1 294,12 v roce 2021; děti ve věku do 6 měsíců tvořily z celkového počtu hospitalizovaných dětí do 1 roku 72,7 % (tab. 1). Nejvyšší počet hospitalizací byl udáván ve věku 1–3 měsíce (graf 1). Sezonní výskyt evidovaných hospitalizací znázorňuje graf 2, i z něho je zřejmý rozdíl epidemiologické situace v jednotlivých letech, ale i kolísání rizika hospitalizace v měsících roku.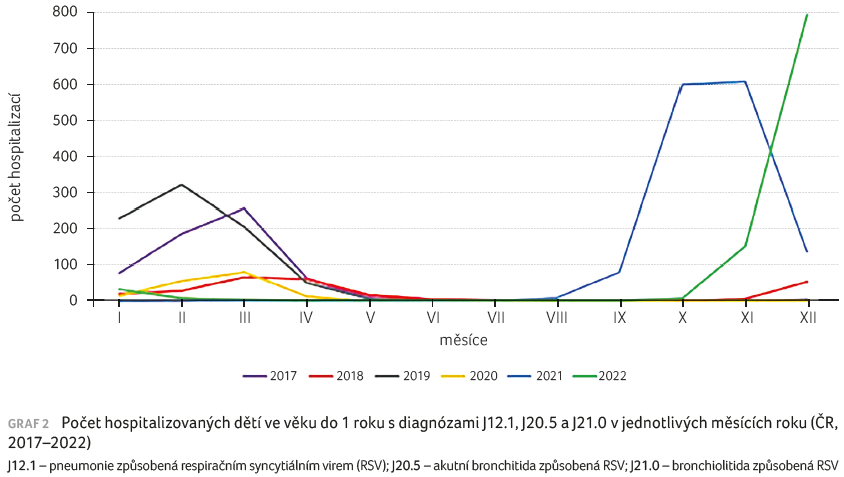
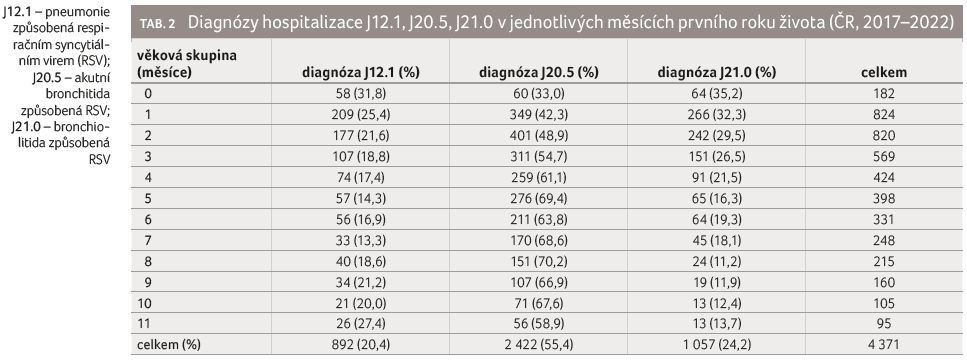
Celkový počet diagnóz mezi základními a vedlejšími příčinami hospitalizace byl 4 371 (u celkového součtu se jedná o diagnózy na pozici základní a vedlejší; z toho důvodu může být jeden pacient započten vícekrát). Zastoupení sledovaných diagnóz během prvního roku života je znázorněno v tabulce 2. Ve sledovaných letech se významně měnila proporce analyzovaných diagnóz (tab. 3), celkově nejčastěji byla hlášena bronchitida (v 55,4 %).
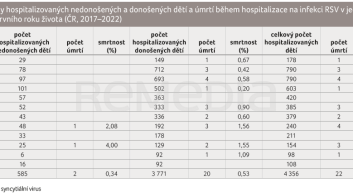
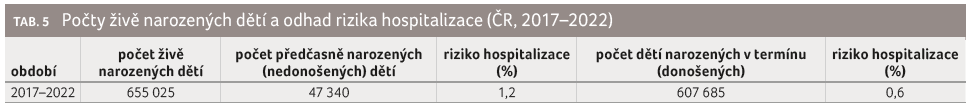
 V souboru 4 356 hospitalizovaných dětí ve věku do 1 roku bylo nahlášeno 22 úmrtí (0,5 %) – smrtnost se ve sledovaných letech pohybovala mezi 0,3–0,6 %. V období 2017–2022 bylo hospitalizováno 3 771 donošených a 585 nedonošených dětí (13,4 %). Počty úmrtí a smrtnost v jednotlivých měsících věku 1. roku života udává tabulka 4; rozdíl rizika úmrtí pro nedonošené a donošené během hospitalizace nebyl statisticky významný (x2 = 0,08; p = 0,7757). V uvedeném období se celkově živě narodilo v ČR 655 025 dětí. Z celkového počtu bylo 47 340 (7,2 %) dětí narozeno před 37. týdnem těhotenství; riziko hospitalizace pro tyto děti bylo odhadnuto na 1,2 %. Pro děti donošené bylo riziko hospitalizace během 1. roku života kalkulováno na 0,6 %; x2 = 251,61; p = 0,0000 (tab. 5). Údaj o aplikaci palivizumabu byl zaznamenán celkově u 22 (0,5 %) hospitalizovaných dětí, z toho 12 bylo nedonošených.
V souboru 4 356 hospitalizovaných dětí ve věku do 1 roku bylo nahlášeno 22 úmrtí (0,5 %) – smrtnost se ve sledovaných letech pohybovala mezi 0,3–0,6 %. V období 2017–2022 bylo hospitalizováno 3 771 donošených a 585 nedonošených dětí (13,4 %). Počty úmrtí a smrtnost v jednotlivých měsících věku 1. roku života udává tabulka 4; rozdíl rizika úmrtí pro nedonošené a donošené během hospitalizace nebyl statisticky významný (x2 = 0,08; p = 0,7757). V uvedeném období se celkově živě narodilo v ČR 655 025 dětí. Z celkového počtu bylo 47 340 (7,2 %) dětí narozeno před 37. týdnem těhotenství; riziko hospitalizace pro tyto děti bylo odhadnuto na 1,2 %. Pro děti donošené bylo riziko hospitalizace během 1. roku života kalkulováno na 0,6 %; x2 = 251,61; p = 0,0000 (tab. 5). Údaj o aplikaci palivizumabu byl zaznamenán celkově u 22 (0,5 %) hospitalizovaných dětí, z toho 12 bylo nedonošených.
Diskuse
 V návaznosti na naši předchozí studii [18] jsme se zaměřili na podrobnější analýzu hospitalizací a úmrtí u dětí ve věku do 1 roku, tj. ve věkové skupině nejvyšší frekvence a závažnosti infekce vyvolané RSV. Jako zdroj celostátních dat jsme využili aktualizovaný informační systém o hospitalizacích, doplnili ho dostupnými údaji o aplikacích palivizumabu, dosaženém věku dítěte (v měsících) v době hospitalizace a počtech nedonošených dětí, které se narodily v ČR v letech 2017–2022. I přes řadu limitací lze dostupné registry v současnosti považovat za významné a zatím jediné výchozí podklady pro hodnocení závažnosti infekcí vyvolaných RSV.
V návaznosti na naši předchozí studii [18] jsme se zaměřili na podrobnější analýzu hospitalizací a úmrtí u dětí ve věku do 1 roku, tj. ve věkové skupině nejvyšší frekvence a závažnosti infekce vyvolané RSV. Jako zdroj celostátních dat jsme využili aktualizovaný informační systém o hospitalizacích, doplnili ho dostupnými údaji o aplikacích palivizumabu, dosaženém věku dítěte (v měsících) v době hospitalizace a počtech nedonošených dětí, které se narodily v ČR v letech 2017–2022. I přes řadu limitací lze dostupné registry v současnosti považovat za významné a zatím jediné výchozí podklady pro hodnocení závažnosti infekcí vyvolaných RSV.
Data získaná za šestileté období zahrnují i údaje z období pandemie infekce covidu‑19. Nejrůznější nefarmaceutická preventivní opatření proti této infekci ovlivnila výskyt řady onemocnění včetně infekcí vyvolaných RSV v dětském věku. Podobně jako v jiných zemích i v ČR došlo k významnému snížení počtu podchycených onemocnění u dětí v sezoně 2020/2021, současně byl zachycen „kompenzační“ nárůst v sezonách 2021/2022 a 2022/2023 [16,21–24].
Celosvětově je odhadováno, že na základě akutních infekcí DCD vyvolaných RSV dochází přibližně u 9,7 %, resp. 10,9 % dětí ve věku do 5 let k hospitalizaci s významnými rozdíly mezi vyspělými a rozvojovými zeměmi [11,25]. V rámci analýzy dat z 58 zemí bylo odhadnuto, že hospitalizace dětí do 1 roku tvoří 45 % všech hospitalizací pro infekci RSV ve věku do 5 let, v dánské studii tyto děti tvořily 77 % hospitalizovaných [26,27].
 Na základě naší analýzy počtu hospitalizací v ČR lze odhadovat riziko hospitalizace na 100 000 dětí a rok pro děti ve věku do 6 měsíců na 953,97; pro děti do 1 roku 656,26 – námi odhadnuté riziko je vesměs nižší než uváděné v literatuře. Na základě proporcionální analýzy vycházející z laboratorního průkazu infekce bylo riziko hospitalizace pro ČR odhadnuto pro rok 2019 u dětí ve věku do 1 roku na 47/100 000 obyvatel [27]. Údaje pro jednotlivé země jsou však nejen v odhadech uváděných v této publikaci výrazně vyšší. Ve starší publikaci shrnující riziko hospitalizace ve Spojených státech amerických v letech 2000–2004 bylo riziko propočteno na 300/100 000 u dětí ve věku do 5 let, 1 700/100 000 u dětí ve věku do 6 měsíců [5]. Novější analýza studií z let 2000–2020 udává riziko hospitalizace pro děti ve věku do 6 měsíců 1 160–5 650/100 000, do 1 roku od 840 do 4 080/100 000 [28]. Prospektivní studie monitorující gestační věk hospitalizovaných dětí v letech 2000–2005 v jednotlivých měsících života ukázala rozdílné výsledky v závislosti na tomto věku; nejvyšší riziko bylo propočteno pro děti narozené před 30. gestačním týdnem (1 870/100 000) a u dětí jednoměsíčních (2 590/100 000) [10]. Na základě šestiletého sledování v Kanadě v letech 2009–2015 bylo nejvyšší riziko hospitalizace propočteno pro jednoměsíční děti na 2 960/100 000 a děti narozené před 28. gestačním týdnem na 2 320/100 000 [29]. Retrospektivní španělská studie analyzující hospitalizace s bronchiolitidami vyvolanými RSV u dětí ve věku do 5 let v letech 1997–2011 odhadla nejvyšší riziko hospitalizace pro děti do 1 roku – 4 137/100 000 [9]. Dánská studie zaměřená na děti ve věku do 5 let v letech 2010–2015 odhadla toto riziko u dětí ve věku do 6 měsíců na 4 590/100 000, u dětí do 1 roku na 2 940/100 000. Nejčastější diagnózou byla pneumonie [26]. Obě studie ukázaly i významné rozdíly v počtu onemocnění s hospitalizací v jednotlivých letech a regionech. Při sledování dětí ve věku do 5 let v metodologicky obdobné naší studii bylo retrospektivně odhadnuto riziko hospitalizace v Polsku během období 2010–2020 pro děti do 1 roku na 1 132/100 000; nejčastěji byla zastoupena diagnóza J12.1 [30]. Retrospektivní data o kódech hospitalizace z šesti zemí (Dánsko, Anglie, Finsko, Norsko, Nizozemsko a Skotsko) v letech 2006–2018 umožnila odhadnout riziko hospitalizace v jednotlivých věkových skupinách, nejvyšší – více než 4 000/100 000 – bylo zjištěno u dětí ve věku do 2 měsíců [31].
Na základě naší analýzy počtu hospitalizací v ČR lze odhadovat riziko hospitalizace na 100 000 dětí a rok pro děti ve věku do 6 měsíců na 953,97; pro děti do 1 roku 656,26 – námi odhadnuté riziko je vesměs nižší než uváděné v literatuře. Na základě proporcionální analýzy vycházející z laboratorního průkazu infekce bylo riziko hospitalizace pro ČR odhadnuto pro rok 2019 u dětí ve věku do 1 roku na 47/100 000 obyvatel [27]. Údaje pro jednotlivé země jsou však nejen v odhadech uváděných v této publikaci výrazně vyšší. Ve starší publikaci shrnující riziko hospitalizace ve Spojených státech amerických v letech 2000–2004 bylo riziko propočteno na 300/100 000 u dětí ve věku do 5 let, 1 700/100 000 u dětí ve věku do 6 měsíců [5]. Novější analýza studií z let 2000–2020 udává riziko hospitalizace pro děti ve věku do 6 měsíců 1 160–5 650/100 000, do 1 roku od 840 do 4 080/100 000 [28]. Prospektivní studie monitorující gestační věk hospitalizovaných dětí v letech 2000–2005 v jednotlivých měsících života ukázala rozdílné výsledky v závislosti na tomto věku; nejvyšší riziko bylo propočteno pro děti narozené před 30. gestačním týdnem (1 870/100 000) a u dětí jednoměsíčních (2 590/100 000) [10]. Na základě šestiletého sledování v Kanadě v letech 2009–2015 bylo nejvyšší riziko hospitalizace propočteno pro jednoměsíční děti na 2 960/100 000 a děti narozené před 28. gestačním týdnem na 2 320/100 000 [29]. Retrospektivní španělská studie analyzující hospitalizace s bronchiolitidami vyvolanými RSV u dětí ve věku do 5 let v letech 1997–2011 odhadla nejvyšší riziko hospitalizace pro děti do 1 roku – 4 137/100 000 [9]. Dánská studie zaměřená na děti ve věku do 5 let v letech 2010–2015 odhadla toto riziko u dětí ve věku do 6 měsíců na 4 590/100 000, u dětí do 1 roku na 2 940/100 000. Nejčastější diagnózou byla pneumonie [26]. Obě studie ukázaly i významné rozdíly v počtu onemocnění s hospitalizací v jednotlivých letech a regionech. Při sledování dětí ve věku do 5 let v metodologicky obdobné naší studii bylo retrospektivně odhadnuto riziko hospitalizace v Polsku během období 2010–2020 pro děti do 1 roku na 1 132/100 000; nejčastěji byla zastoupena diagnóza J12.1 [30]. Retrospektivní data o kódech hospitalizace z šesti zemí (Dánsko, Anglie, Finsko, Norsko, Nizozemsko a Skotsko) v letech 2006–2018 umožnila odhadnout riziko hospitalizace v jednotlivých věkových skupinách, nejvyšší – více než 4 000/100 000 – bylo zjištěno u dětí ve věku do 2 měsíců [31].
 Důležitým zdrojem informací je odhad počtu hospitalizací v Evropské unii u dětí ve věkové skupině do 5 let. Podle tohoto systematického odhadu zpracovaného před pandemií covidu‑19 je ročně s infekcí RSV hospitalizováno v průměru 245 244 dětí v tomto věku (1 006/100 000), v ČR 5 666. Na základě tohoto odhadu bylo propočteno, že riziko hospitalizací v naší republice je ve věkové skupině 0–2 měsíce 7 390/100 000, ve věkové skupině 3–5 měsíců 4 100/100 000 [32]. I tato odhadnutá čísla nepřímo potvrzují pravděpodobně výrazně podhodnocené údaje vzniklé na základě našeho monitorování kódovaných diagnóz hospitalizací s infekcí RSV. Na druhé straně jsou naše výsledky z hlediska trendu rizika v prvních měsících života podobné zahraničním údajům. Důležitá je i zjištěná odlišná věková křivka pro děti donošené a nedonošené; časnější nástup rizika hospitalizace donošených dětí mj. pravděpodobně souvisí s větším počtem kontaktů v prvních týdnech života, než je tomu u předčasně narozených dětí [33,34].
Důležitým zdrojem informací je odhad počtu hospitalizací v Evropské unii u dětí ve věkové skupině do 5 let. Podle tohoto systematického odhadu zpracovaného před pandemií covidu‑19 je ročně s infekcí RSV hospitalizováno v průměru 245 244 dětí v tomto věku (1 006/100 000), v ČR 5 666. Na základě tohoto odhadu bylo propočteno, že riziko hospitalizací v naší republice je ve věkové skupině 0–2 měsíce 7 390/100 000, ve věkové skupině 3–5 měsíců 4 100/100 000 [32]. I tato odhadnutá čísla nepřímo potvrzují pravděpodobně výrazně podhodnocené údaje vzniklé na základě našeho monitorování kódovaných diagnóz hospitalizací s infekcí RSV. Na druhé straně jsou naše výsledky z hlediska trendu rizika v prvních měsících života podobné zahraničním údajům. Důležitá je i zjištěná odlišná věková křivka pro děti donošené a nedonošené; časnější nástup rizika hospitalizace donošených dětí mj. pravděpodobně souvisí s větším počtem kontaktů v prvních týdnech života, než je tomu u předčasně narozených dětí [33,34].
Nejčastější příčinou hospitalizace v důsledku infekcí vyvolaných RSV bývá zejména v nejnižších věkových skupinách bronchiolitida a pneumonie. Bronchiolitida vyvolaná RSV je v USA nejčastější příčinou hospitalizace dětí ve věku do 1 roku [35]. V našem souboru byla u dětí hospitalizovaných v 1. roce života zastoupena v 24,2 %, podíl této diagnózy byl nejvyšší v prvních 4 měsících života, dále se postupně snižoval podle věku. Příčin časté hospitalizace je celá řada a zejména v 1. roce života se nedá vysvětlit pouze preexistujícím zdravotním stavem či věkem. Celá řada patofyziologických charakteristik dýchacích cest novorozenců a kojenců vede k větší zranitelnosti a náchylnosti k rozvoji respirační insuficience než u dospělých osob. Odhaduje se, že až 79 % hospitalizovaných dětí v tomto věku byly zdravé či donošené děti, o něco nižší podíl je uváděn z hlediska rizika příjmu na jednotky intenzivní péče či rizika mechanické ventilace [10,34–36]. Už existující rizikové faktory jsou zjišťovány pouze u 22–32 % příjmů s nejvýznamnějším podílem nedonošenosti [36]. I z toho vyplývá, že současná specifická preventivní opatření pro většinovou zdravou část dětské populace jsou nedostatečná [5]. Tento závěr nepřímo plyne i z multicentrické studie v pěti evropských zemích v letech 2017–2020. Bylo v ní potvrzeno, že 1 z 56 donošených dětí je během prvního roku života hospitalizováno s infekcí RSV [37].
Značný rozptyl výsledků jednotlivých studií a z toho vyplývajících odhadů rizik hospitalizace a úmrtí nejen u dětí, ale i u dospělých je významně ovlivněn mj. geografickými rozdíly, dobou sledování, metodami surveillance a definicemi případů [31,38–41].
V ČR podobně jako v dalších zemích se již řadu let používá pro prevenci infekcí RSV palivizumab – indikace v různých státech jsou rozdílné a průběžně se mění [42–45]. Poslední rozhodnutí o používání a proplácení tohoto přípravku zdravotními pojišťovnami v ČR bylo schváleno Státním ústavem pro kontrolu léčiv v roce 2016, indikace jsou vytvořeny na základě kombinací gestačního věku, porodní hmotnosti, určených závažných diagnóz a rizikových kontaktů během hospitalizace – tč. jde o šest skupin [46]. Aktuální doporučení České neonatologické společnosti a Společnosti dětské pneumologie ČLS JEP rozšiřuje rozsah indikací a zavádí aplikaci přípravku podle aktuální epidemiologické situace ve výskytu infekcí RSV [47]. Podíl dětí, kterým je tato profylaxe aplikována, se pohybuje kolem 2 % [12], v ČR je ročně podána asi 1 000 dětí ve věku do 2 let. I naše výsledky nepřímo potvrzují redukci počtu úmrtí během hospitalizace u dětí, kterým byla aplikována minimálně jedna dávka palivizumabu. Zjištěný sezonní výskyt hospitalizací potvrzuje výrazné rozdíly v epidemiologické situaci v jednotlivých letech. Zatímco dosud byla stanovena z hlediska profylaxe napevno sezona infekcí vyvolaných RSV na období listopad až březen, je z tohoto hlediska plastičtější přístup nového doporučení jistě odborně správnější [47] a v plném souladu s našimi údaji. Je však nutné si uvědomit, že nárůst počtu hospitalizací probíhá obdobně jako u chřipky zhruba 10–14 dnů po nárůstu počtu ambulantních forem onemocnění a že je nutné se zaměřit na častější průkaz jejich etiologie i u těchto klinicky méně závažných forem onemocnění.
Ve sledovaném období bylo zaznamenáno u dětí ve věku do 1 roku v souvislosti s infekcí RSV v ČR 22 úmrtí během hospitalizace, tj. smrtnost 0,5 %. Nejvyšší smrtnost byla zjištěna u dětí ve věkové skupině 6–11 měsíců (0,8 %). Při analýze úmrtí u hospitalizovaných ve vyspělých zemích ve 26 studiích z let 1995–2001 byla propočtena úmrtnost u dětí ve věku do 1 roku 7,2–66,0/100 000 [48]. Podle starších celosvětových dat jsou dopady infekce RSV významně rozdílné i na základě hospodářské vyspělosti – odhadovaná smrtnost v důsledku těžkého onemocnění DCD souvisejícího s infekcí RSV u dětí ve věkové skupině do 5 let v průmyslových zemích se pohybuje kolem 0,3 %, v rozvojových zemích dosahuje 2,1 % [49].
V letech 1999–2018 v USA ročně v souvislosti s infekcí RSV umíralo 96 dětí ve věku do 1 roku – úmrtnost na tuto infekci byla v této věkové skupině pětkrát vyšší než na chřipku [50]. Během dlouhodobého sledování hospitalizovaných dánských dětí bylo zaznamenáno pět úmrtí u dětí ve věkové skupině do 5 let, což odpovídá smrtnosti 0,04 %; k úmrtím došlo ve věku od 1 do 9,8 měsíce, dvě z dětí se narodily před 28. gestačním týdnem [26]. Během patnáctiletého období bylo zjištěno ve Španělsku v souvislosti s RSV bronchiolitidou 446 úmrtí během hospitalizace dětí ve věku do 5 let, z nichž 355 (79,6 %) bylo diagnostikováno u dětí v 1. roce života – smrtnost byla propočtena na 0,15 %. U 25 % zemřelých dětí byla zjištěna definovaná komorbidita [9]. Přestože riziko hospitalizace bylo významně vyšší pro chlapce, smrtnost se u obou pohlaví nelišila. V polské studii hospitalizovaných dětí ve věkové skupině do 5 let bylo zaznamenáno 45 úmrtí (0,08 %) [30]. V naší studii děti do 6 měsíců tvořily 72,7 % z celkového počtu hospitalizovaných dětí ve věku do 1 roku, úmrtí v této věkové skupině tvořila 54,5 % z celkového počtu úmrtí.
Naše studie má řadu limitací. Správnost diagnóz a jejich hlášení nebyly sjednoceny a kontrolovány. Celostátní databáze nezahrnuje údaje o laboratorním potvrzení jednotlivých případů, nelze tedy potvrdit provádění ani načasování této diagnostiky. Na druhé straně velikost souboru a doba sledování jsou nesporným přínosem této studie.
Současný rychlý rozvoj specifické prevence infekcí vyvolaných RSV vyžaduje sjednocení metod surveillance, které by na jedné straně umožnily porovnání mezi jednotlivými státy, na druhé straně především pomohly při odhadech zdravotnické a ekonomické zátěže těmito infekcemi v jednotlivých zemích. Důležité je získat co nejkvalitnější data ještě před zahájením plošných specifických opatření, aby mohla být časem hodnocena i jejich efektivita. Do budoucna však není pasivní surveillance vycházející z dostupných registrů dostatečná, musí být proto doplněna aktivní komunitní a nemocniční surveillance [51].
Závěry
Absolutní počty oficiálně evidovaných hospitalizací dětí a tím i odhady rizika hospitalizace s uvedenými diagnózami infekce RSV jsou v České republice nižší než v ostatních zemích s obdobnou ekonomickou úrovní. Údaje o smrtnosti této infekce u hospitalizovaných dětí jsou vyšší než v těchto zemích. Tento údaj, i když nepochybně zkreslený celkově nízkým počtem evidovaných hospitalizací, je pádným argumentem pro prohloubení specifické prevence této infekce v prvních měsících a letech života. Nové možnosti aktivní a pasivní imunizace proti infekci RSV jsou významným prostředkem ke snížení morbidity a mortality v souvislosti s akutní infekcí, ale i prevencí jejích následků v podobě chronických respiračních onemocnění.
Z uvedených dat vyplývá, že je třeba zajistit jednotný systém hlášení těchto infekcí, zkvalitnit laboratorní diagnostiku a současně sjednotit způsob a kvalitu kódování u diagnóz hospitalizací s infekcí RSV.
Původní práce byla podpořena v rámci programu Cooperatio.
Publikaci „Pazdiora P, Šanca O. Infekce respiračním syncytiálním virem (RSV) u dětí v prvním roce života (Česká republika, 2017–2022). Epidemiol Mikrobiol Imunol 2024; 73(2): 67–75.“ přetiskujeme s drobnými formálními úpravami se svolením autorů a vedení periodika.
Prof. MUDr. Petr Pazdiora, CSc.
Ústav epidemiologie, Lékařská fakulta v Plzni, UK
ul. Dr. E. Beneše 13, 301 00 Plzeň
e-mail: pazdiora@fnplzen.cz
Literatura
[1] Chen J, Qiu X, Avadhanula V, et al. Novel and extendable genotyping system for human respiratory syncytial virus based on whole‑genome sequence analysis. Influenza Other Respir Viruses 2022; 16: 492–500
[2] Tabatabai J, Ihling CM, Rehbein RM, et al. Molecular epidemiology of respiratory syncytial virus in hospitalised children in Heidelberg, Southern Germany, 2014–2017. Infect Genet Evol 2022; 98: 105209
[3] Tabor DE, Fernandes F, Langedijk AC, et al. INFORM‑RSV Study Group. Global Molecular Epidemiology of Respiratory Syncytial Virus from the 2017–2018 INFORM‑RSV Study. J Clin Microbiol 2020; 59: e01828–20
[4] Hall CB, Long CE, Schnabel KC. Respiratory syncytial virus infections in previously healthy working adults. Clin Infect Dis 2001; 33: 792–796
[5] Hall CB, Weinberg GA, Iwane MK, et al. The burden of respiratory syncytial virus infection in young children. N Engl J Med 2009; 360: 588–598
[6] Jain H, Schweitzer JW, Justice NA. Respiratory Syncytial Virus Infection. 2023 Jun 20. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023. PMID: 29083623
[7] Nguyen‑Van‑Tam JS, OʼLeary M, Martin ET, et al. Burden of respiratory syncytial virus infection in older and high‑risk adults: a systematic review and meta‑analysis of the evidence from developed countries. Eur Respir Rev 2022; 31: 220105
[8] ECDC. Intensified circulation of respiratory syncytial virus (RSV) and associated hospital burden in the EU/EEA, Risk assessment, 12 Dec 2022
[9] Gil‑Prieto R, Gonzalez‑Escalada A, Marín‑García P, et al. Respiratory syncytial virus bronchiolitis in children up to 5 years of age in Spain: epidemiology and comorbidities: an observational study. Medicine (Baltimore) 2015; 94: e831
[10] Hall CB, Weinberg GA, Blumkin AK, et al. Respiratory syncytial virus‑associated hospitalizations among children less than 24 months of age. Pediatrics 2013; 132: e341–348
[11] Li Y, Wang X, Blau DM, et al. RESCEU investigators. Global, regional, and national disease burden estimates of acute lower respiratory infections due to respiratory syncytial virus in children younger than 5 years in 2019: a systematic analysis. Lancet 2022; 399: 2047–2064
[12] MedImmune. Synagis Prescribing Information. Dostupné na: https://www.synagis.com/synagis.pdf [navštíveno 10/2021]
[13] Barr R, Green CA, Sande CJ, et al. Respiratory syncytial virus: diagnosis, prevention and management. Ther Adv Infect Dis 2019; 6: 2049936119865798
[14] Obando‑Pacheco P, Justicia‑Grande AJ, Rivero‑Calle I, et al. Respiratory Syncytial Virus Seasonality: A Global Overview. J Infect Dis 2018; 217: 1356–1364
[15] Li Y, Wang X, Broberg EK, et al. European RSV Surveillance Network. Seasonality of respiratory syncytial virus and its association with meteorological factors in 13 European countries, week 40 2010 to week 39 2019. Euro Surveill 2022; 27: 2100619
[16] Bardsley M, Morbey RA, Hughes HE, et al. Epidemiology of respiratory syncytial virus in children younger than 5 years in England during the COVID‑19 pandemic, measured by laboratory, clinical, and syndromic surveillance: a retrospective observational study. Lancet Infect Dis 2023; 23: 56–66
[17] Verwey C, Madhi SA. Review and Update of Active and Passive Immunization Against Respiratory Syncytial Virus. BioDrugs 2023; 37: 295–309
[18] Pazdiora P, Šanca O, Dušek L. Infekce RSV v ČR – analýza hospitalizací a úmrtí v letech 2017–2022. Epidemiol Mikrobiol Imunol 2024; 73: 21–29.
[19] Prymula R, Pazdiora P, Dušek L. Infekce RSV v ČR – analýza hospitalizací v letech 2017–2021. Vakcinologie 2023; 17: 6–14
[20] ÚZIS ČR. Národní registr hospitalizovaných. Závazné pokyny. Verze NZIS 020_20140701; 26 s
[21] Hubáček P, Smíšková D. Infekce vyvolané respiračními syncytiálními viry – epidemiologie, klinický obraz, diagnostika, možnosti prevence a léčby. Ces‑Slov Pediat 2023; 78(Suppl 1): S13–19
[22] Chuang YC, Lin KP, Wang LA, et al. The Impact of the COVID‑19 Pandemic on Respiratory Syncytial Virus Infection: A Narrative Review. Infect Drug Resist 2023; 16: 661–675
[23] Principi N, Autore G, Ramundo G, et al. Epidemiology of Respiratory Infections during the COVID‑19 Pandemic. Viruses 2023; 15: 1160
[24] Pruccoli G, Castagno E, Raffaldi I, et al. The Importance of RSV Epidemiological Surveillance: A Multicenter Observational Study of RSV Infection during the COVID‑19 Pandemic. Viruses 2023; 15: 280
[25] Shi T, McAllister DA, OʼBrien KL, et al. RSV Global Epidemiology Network. Global, regional, and national disease burden estimates of acute lower respiratory infections due to respiratory syncytial virus in young children in 2015: a systematic review and modelling study. Lancet 2017; 390: 946–958
[26] Jepsen MT, Trebbien R, Emborg HD, et al. Incidence and seasonality of respiratory syncytial virus hospitalisations in young children in Denmark, 2010 to 2015. Euro Surveill 2018; 23: 17–00163
[27] Li Y, Johnson EK, Shi T, et al. National burden estimates of hospitalisations for acute lower respiratory infections due to respiratory syncytial virus in young children in 2019 among 58 countries: a modelling study. Lancet Respir Med 2021; 9: 175–185
[28] McLaughlin JM, Khan F, Schmitt HJ, et al. Respiratory Syncytial Virus‑Associated Hospitalization Rates among US Infants: A Systematic Review and Meta‑Analysis. J Infect Dis 2022; 225: 1100–1111
[29] Buchan SA, Chung H, To T, et al. Estimating the Incidence of First RSV Hospitalization in Children Born in Ontario, Canada. J Pediatric Infect Dis Soc 2023; 12: 421–430
[30] Rząd M, Kanecki K, Lewtak K, et al. Human Respiratory Syncytial Virus Infections among Hospitalized Children in Poland during 2010–2020: Study Based on the National Hospital Registry. J Clin Med 2022; 11: 6451
[31] Johannesen CK, van Wijhe M, Tong S, et al. RESCEU Investigators. Age‑Specific Estimates of Respiratory Syncytial Virus‑Associated Hospitalizations in 6 European Countries: A Time Series Analysis. J Infect Dis 2022; 226(Suppl 1): S29–S37
[32] Del Riccio M, Spreeuwenberg P, Osei‑Yeboah R, et al. RESCEU investigators. Defining the Burden of Disease of RSV in the European Union: estimates of RSV‑associated hospitalisations in children under 5 years of age. A systematic review and modelling study. J Infect Dis 2023; 29: jiad188
[33] PATH. Advancing Maternal Immunization. Advancing RSV Maternal Immunization: A Gap Analysis Report. July 2018. Dostupné na: https://www.path.org/resources/ advancing‑rsv‑maternal‑immunization‑gap‑analysis‑report/
[34] Rha B, Curns AT, Lively JY, et al. Respiratory Syncytial Virus‑Associated Hospitalizations Among Young Children: 2015–2016. Pediatrics 2020; 146: e20193611
[35] Baraldi E, Checcucci Lisi G, Costantino C, et al. RSV disease in infants and young children: Can we see a brighter future? Hum Vaccin Immunother 2022; 18: 2079322
[36] Arriola CS, Kim L, Langley G, et al. Estimated Burden of Community‑Onset Respiratory Syncytial Virus‑Associated Hospitalizations Among Children Aged <2 Years in the United States, 2014–2015. J Pediatric Infect Dis Soc 2020; 9: 587–595
[37] Wildenbeest JG, Billard MN, Zuurbier RP, et al. RESCEU Investigators. The burden of respiratory syncytial virus in healthy term‑born infants in Europe: a prospective birth cohort study. Lancet Respir Med 2023; 11: 341–353
[38] Duan Y, Jiang M, Huang Q, et al. Incidence, hospitalization, and mortality in children aged 5 years and younger with respiratory syncytial virus‑related diseases: A systematic review and meta‑analysis. Influenza other Respir Viruses 2023; 17: e13145
[39] McLaughlin JM, Khan F, Begier E, et al. Rates of Medically Attended RSV Among US Adults: A Systematic Review and Meta‑analysis. Open Forum Infect Dis 2022; 9: ofac300
[40] Nowalk MP, DʼAgostino H, Dauer K, et al. Estimating the burden of adult hospitalized RSV infection including special populations. Vaccine 2022; 40: 4121–4127
[41] Rozenbaum MH, Judy J, Tran D, et al. Low Levels of RSV Testing Among Adults Hospitalized for Lower Respiratory Tract Infection in the United States. Infect Dis Ther 2023; 12: 677–685
[42] Esposito S, Abu Raya B, Baraldi E, et al. RSV Prevention in All Infants: Which Is the Most Preferable Strategy? Front Immunol 2022; 13: 880368
[43] Reeves RM, van Wijhe M, Lehtonen T, et al. RESCEU Investigators. A Systematic Review of European Clinical Practice Guidelines for Respiratory Syncytial Virus Prophylaxis. J Infect Dis 2022; 226(Suppl 1): S110–S116
[44] Sun M, Lai H, Na F, et al. Monoclonal Antibody for the Prevention of Respiratory Syncytial Virus in Infants and Children: A Systematic Review and Network Meta‑analysis. JAMA Netw Open 2023; 6: e230023
[45] Wang X, Li Y, Shi T, et al. Global Disease Burden of Respiratory Syncytial Virus in Preterm Children in 2019: A Systematic Review and Individual Participant Data Meta‑Analysis Protocol. J Infect Dis 2022; 226(Suppl 1): S135–S141
[46] Státní ústav pro kontrolu léčiv. Správní řízení: SUKLS22022/2016; https://www.sukl.cz
[47] Straňák Z. Doporučení České neonatologické společnosti ČLS JEP a Společnosti dětské pneumologie pro imunoprofylaxi závažných forem RSV infekce. Čes‑Slov Neonat 2023; 29: 77–78
[48] Cong B, Dighero I, Zhang T, et al. Understanding the age spectrum of respiratory syncytial virus associated hospitalisation and mortality burden based on statistical modelling methods: a systematic analysis. BMC Med 2023; 21: 224
[49] Nair H, Nokes DJ, Gessner BD, et al. Global burden of acute lower respiratory infections due to respiratory syncytial virus in young children: a systematic review and meta‑analysis. Lancet 2010; 375: 1545–1555
[50] Hansen CL, Chaves SS, Demont C, et al. Mortality Associated With Influenza and Respiratory Syncytial Virus in the US, 1999–2018. JAMA Network Open 2022; 5: e220527
[51] Teirlinck AC, Broberg EK, Stuwitz Berg A, et al. Recommendations for respiratory syncytial virus surveillance at the national level. Eur Respir J 2021; 58: 2003766
Akutní peribronchitida způsobená respiračním syncytiálním virem
MUDr. Miroslav Kubiska
Klinika infekčních nemocí a cestovní medicíny FN Plzeň
Respirační syncytiální virus (RSV) je dlouhodobě považován za jednu z nejčastějších příčin hospitalizací pro infekce dolních cest dýchacích v České republice. Je proto důležité mít na paměti, že není k dispozici žádná cílená farmakoterapie a léčba spočívá především v symptomatické terapii včetně častých komplikací řešených v rámci jednotek intenzivní péče.
Kazuistika prezentuje častou problematiku onemocnění RSV i u dětí bez rizikové osobní anamnézy odkázaných pouze na symptomatickou terapii. Je proto důležité klást důraz na osvětu o závažnosti infekce RSV u kojenců, a to nejen těch předčasně narozených či s dalšími vrozenými onemocněními, neboť RSV představuje riziko pro všechny kojence.
Popis případu
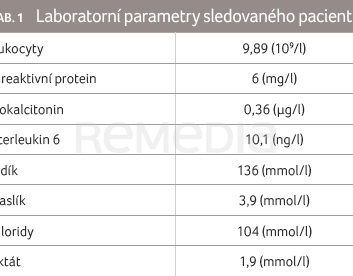 Desetiměsíční chlapec ze sledované gravidity pro gestační diabetes mellitus, bez jiné rizikové osobní anamnézy, byl přivezen záchrannou službou pro tři dny progredující kašel, febrilie a zhoršování perorálního příjmu. Laboratorní nález byl s nízkými parametry zánětu a normálním vnitřním prostředím (tab. 1).
Desetiměsíční chlapec ze sledované gravidity pro gestační diabetes mellitus, bez jiné rizikové osobní anamnézy, byl přivezen záchrannou službou pro tři dny progredující kašel, febrilie a zhoršování perorálního příjmu. Laboratorní nález byl s nízkými parametry zánětu a normálním vnitřním prostředím (tab. 1).
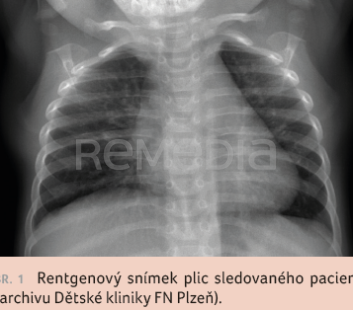 Rentgen plic prokázal těžkou peribronchitidu s ložiskovými infiltracemi bilaterálně a drobný pleurální výpotek (obr. 1). Na základě mikrobiologických vyšetření byla prokázána infekce RSV metodou PCR z horních cest dýchacích. Ostatní mikrobiologický screening byl bez patologického nálezu. Na intenzivní mukolytické a bronchodilatační terapii a při dechové rehabilitaci nastalo postupné zlepšení stavu. Po celou dobu byl pacient kardiopulmonálně kompenzovaný. Po přechodné parenterální rehydratační terapii došlo k obnovení plného perorálního příjmu. Od druhého dne hospitalizace byl chlapec afebrilní. Antibiotická terapie nebyla indikována. Pátý den hospitalizace byl pacient propuštěn zpět do péče praktického lékaře pro děti a dorost.
Rentgen plic prokázal těžkou peribronchitidu s ložiskovými infiltracemi bilaterálně a drobný pleurální výpotek (obr. 1). Na základě mikrobiologických vyšetření byla prokázána infekce RSV metodou PCR z horních cest dýchacích. Ostatní mikrobiologický screening byl bez patologického nálezu. Na intenzivní mukolytické a bronchodilatační terapii a při dechové rehabilitaci nastalo postupné zlepšení stavu. Po celou dobu byl pacient kardiopulmonálně kompenzovaný. Po přechodné parenterální rehydratační terapii došlo k obnovení plného perorálního příjmu. Od druhého dne hospitalizace byl chlapec afebrilní. Antibiotická terapie nebyla indikována. Pátý den hospitalizace byl pacient propuštěn zpět do péče praktického lékaře pro děti a dorost.