Iptakopan snižuje proteinurii u pacientů s IgA nefropatií
Nová data z předem specifikované analýzy studie fáze III APPLAUSE‑IgAN ukazují klinicky a statisticky významné zmírnění proteinurie při léčbě iptakopanem v porovnání s placebem u pacientů s IgA nefropatií (IgAN). Léčba cílí na systém komplementu u pacientů s IgAN, jehož aktivace je klíčovým faktorem rozvoje glomerulárního zánětu u tohoto onemocnění [1–4].
IgA nefropatie je heterogenní progresivní vzácná choroba ledvin a nejčastěji se vyskytující glomerulonefritida. Je jednou z příčin chronického onemocnění ledvin, které představuje celosvětový zdravotní problém [5]. Systematické review z roku 2011 uvádí, že každoročně je na celém světě nově diagnostikováno přibližně 25 případů IgAN na jeden milion obyvatel [6]. Skutečný počet pacientů s touto diagnózou bude však pravděpodobně mnohem vyšší, jak např. na základě údajů z národního registru biopsií vysvětluje v komentáři níže profesor Tesař [7]. Podle výsledků recentní britské studie je u 50 % pacientů s IgAN s přetrvávající proteinurií do 11,4 roku zaznamenáno úmrtí nebo selhání ledvin s nutností udržovací dialýzy a/nebo transplantace ledvin [8]. Jsou tedy třeba účinné cílené terapie IgAN, které mohou pomoci zpomalit progresi selhání ledvin nebo jí zabránit [5,9,10].
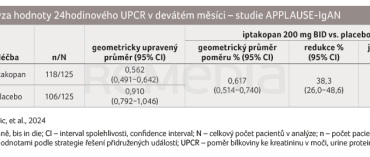 Podle výsledků analýzy studie APPLAUSE‑IgAN pacienti s IgAN léčení iptakopanem – perorálním inhibitorem faktoru B alternativní cesty aktivace komplementu – dosáhli 38,3% redukce proteinurie (měřeno 24hodinovým poměrem bílkoviny ke kreatininu v moči [UPCR]; p < 0,0001) po devíti měsících ve srovnání s placebem přidávaným k podpůrné péči (tab. 1) [1]. Snížení proteinurie je stále více uznávaným zástupným markerem korelujícím s progresí chronické nefropatie a používá se jako cílový ukazatel v klinických studiích zaměřených na IgAN pro podporu urychleného schvalování léčby [11]. Studie také ukázala, že iptakopan byl dobře snášen, s příznivým bezpečnostním profilem v souladu s dříve hlášenými údaji [1,12]. Výsledky byly prezentovány v dubnu letošního roku na Světovém nefrologickém kongresu (World Nephrology Congress, WCN) v Buenos Aires [1].
Podle výsledků analýzy studie APPLAUSE‑IgAN pacienti s IgAN léčení iptakopanem – perorálním inhibitorem faktoru B alternativní cesty aktivace komplementu – dosáhli 38,3% redukce proteinurie (měřeno 24hodinovým poměrem bílkoviny ke kreatininu v moči [UPCR]; p < 0,0001) po devíti měsících ve srovnání s placebem přidávaným k podpůrné péči (tab. 1) [1]. Snížení proteinurie je stále více uznávaným zástupným markerem korelujícím s progresí chronické nefropatie a používá se jako cílový ukazatel v klinických studiích zaměřených na IgAN pro podporu urychleného schvalování léčby [11]. Studie také ukázala, že iptakopan byl dobře snášen, s příznivým bezpečnostním profilem v souladu s dříve hlášenými údaji [1,12]. Výsledky byly prezentovány v dubnu letošního roku na Světovém nefrologickém kongresu (World Nephrology Congress, WCN) v Buenos Aires [1].
V případě IgAN se může v ledvinách nadměrně aktivovat část imunitního systému označovaná jako alternativní cesta komplementu, což způsobí zánětlivou reakci vedoucí k progresivnímu poškození ledvin a postupné ztrátě jejich funkce. Ztráta funkce ledvin spolu s potenciálními nežádoucími účinky dosud dostupné léčby IgAN – vysokodávkovanými systémovými kortikosteroidy – významně ovlivňuje kvalitu života pacientů. Iptakopan představuje první potenciální léčbu IgAN, která se specificky zaměřuje na alternativní cestu komplementu.
Předem specifikovaná analýza zahrnovala 250 pacientů pro hodnocení účinnosti a 443 pacientů pro hodnocení bezpečnosti [1]. Studie APPLAUSE‑IgAN pokračuje ve dvojitě zaslepeném režimu, v rámci WCN tedy byly představeny pouze dílčí výsledky průběžné analýzy [13,14]. Dne 24. srpna 2024 americký Úřad pro kontrolu potravin a léčiv (FDA) vyhověl žádosti společnosti Novartis o urychlené schválení a iptakopan je ve Spojených státech amerických pro pacienty dostupný ve zvláštním režimu [15]. Dosažení primárního cílového ukazatele – zpomalení progrese IgAN měřením ročního poklesu celkové odhadované glomerulární filtrace (estimated glomerular filtration rate, eGFR) za 24 měsíců – se očekává po dokončení studie v roce 2025 [13,14].
Studie APPLAUSE‑IgAN
APPLAUSE‑IgAN (NCT04578834) je multicentrická randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie fáze III s paralelními skupinami, která hodnotí účinnost a bezpečnost perorálně podávaného iptakopanu v dávce 200 mg dvakrát denně u souboru 518 dospělých pacientů s primární IgAN [13,14].
Dva primární cílové ukazatele pro průběžnou a konečnou analýzu představují redukci proteinurie po devíti měsících měřené pomocí UPCR a celkový pokles eGFR za 24 měsíců [13,14]. V době závěrečné analýzy budou rovněž hodnoceny následující sekundární cílové ukazatele: podíl účastníků, kteří dosáhli UPCR < 1 g/g, aniž by byli léčeni kortikosteroidy/imunosupresivy nebo jinými nově schválenými léčivými přípravky nebo zahájili novou aktivní terapii IgAN nebo zahájili substituční terapii ledvin (kidney replacement therapy, KRT); čas od randomizace do prvního výskytu složeného cílového ukazatele selhání ledvin (dosažení buď trvalého ≥ 30% poklesu eGFR ve srovnání s výchozí hodnotou, nebo trvalé eGFR < 15 ml/min/1,73 m2 nebo nutnost léčby náhradou funkce ledvin – dialýzou nebo transplantací, nebo úmrtí z důvodu selhání ledvin); změna na škále únavy měřená dotazníkem Functional Assessment Of Chronic Illness Therapy‑Fatigue (FACIT‑F) od výchozí hodnoty do devíti měsíců [13,14].
Populace hlavní studie zahrnovala pacienty s eGFR ≥ 30 ml/min/1,73 m2 a UPCR ≥ 1 g/g na počátku sledování [13,14]. Kromě toho byla také zařazena do tzv. exploratorní kohorty menší skupina pacientů s těžkou poruchou funkce ledvin (eGFR 20–30 ml/min/1,73 m2) z důvodu zjištění dalších informací, avšak tyto výsledky nejsou hodnoceny v hlavních analýzách účinnosti [13,14].
Literatura
[1] Perkovic V, Kollins D, Renfurm R, et al. Efficacy and Safety of Iptacopan in Patients with IgA Nephropathy: Interim Results from the Phase 3 APPLAUSE‑IgAN Study. Presented at the World Congress of Nephrology (WCN); April 15, 2024; Buenos Aires, Argentina; WCN24‑1506.
[2] https://www.novartis.com/news/media‑releases/new‑novartis‑fabhalta‑iptacopan‑data‑show‑clinically‑meaningful‑and‑statistically‑significant‑proteinuria‑reduction‑383‑versus‑placebo‑patients‑iga‑nephropathy‑igan
[3] Rizk DV, Maillard N, Julian BA, et al. The Emerging Role of Complement Proteins as a Target for Therapy of IgA Nephropathy. Front Immunol 2019; 10: 504.
[4] Medjeral‑Thomas NR, OʼShaughnessy MM. Complement in IgA Nephropathy: The Role of Complement in the Pathogenesis, Diagnosis, and Future Management of IgA Nephropathy. Adv Chronic Kidney Dis 2020; 27: 111–119.
[5] Kidney Disease: Improving Global Outcomes (KDIGO) 2021 Clinical Practice Guideline for the Management of Glomerular Diseases. Kidney Int 2021; 100: S1–S276.
[6] McGrogan A, Franssen CF, de Vries CS. The Incidence of Primary Glomerulonephritis Worldwide: A Systematic Review of the Literature. Nephrol Dial Transplant 2011; 26: 414–430.
[7] Maixnerova D, Jancova E, Skibova J, et al. Nationwide biopsy survey of renal diseases in the Czech Republic during the years 1994–2011. J Nephrol 2015; 28: 39–49.
[8] Pitcher D, Braddon F, Hendry B, et al. Long‑Term Outcomes in IgA Nephropathy. Clin J Am Soc Nephrol 2023; 18: 727–738.
[9] Boyd JK, Cheung CK, Molyneux K, et al. An Update on the Pathogenesis and Treatment of IgA Nephropathy. Kidney Int 2012; 81: 833–843.
[10] Xie J, Kiryluk K, Wang W, et al. Predicting Progression of IgA Nephropathy: New Clinical Progression Risk Score. PLoS ONE 2012; 7: e38904.
[11] Thompson A, Carroll K, Inker LA, et al. Proteinuria Reduction as a Surrogate End Point in Trials of IgA Nephropathy. Clin J Am Soc Nephrol 2019; 14: 469–481.
[12] Zhang H, Rizk DV, Perkovic V, et al. Results of a Randomized Double‑Blind Placebo‑Controlled Phase 2 Study Propose Iptacopan as an Alternative Complement Pathway Inhibitor for IgA Nephropathy. Kidney Int 2024; 105: 189–199.
[13] Rizk DV, Rovin BH, Zhang H, et al. Targeting the Alternative Complement Pathway with Iptacopan to Treat IgA Nephropathy: Design and Rationale of the APPLAUSE‑IgAN Study. Kidney Int Rep 2023; 8: 968–979.
[14] APPLAUSE-IgAN. NCT04578834. A Multi‑Center, Randomized, Double‑Blind, Placebo‑Controlled, Parallel Group, Phase III Study to Evaluate the Efficacy and Safety of LNP023 in Primary IgA Nephropathy Patients. Dostupné na: https://clinicaltrials.gov/ct2/show/NCT04578834 [navštíveno 4/2024].
[15] Novartis receives FDA accelerated approval for Fabhalta® (globenewswire.com).