Novinky a pokroky v léčbě nemalobuněčného karcinomu plic z ESMO 2024
Letošní kongres ESMO (European Society for Medical Oncology) 2024, který se konal 13.–17. září v Barceloně, přinesl řadu sdělení prezentujících pokroky na poli onkologické léčby. Pozornost jsme zaměřili na nemalobuněčný karcinom plic (non‑small cell lung carcinoma, NSCLC) a přinášíme vám výběr z posterových sdělení.
Časná stadia onemocnění
Pětiletá data DFS pro adjuvantní léčbu atezolizumabem u časného stadia NSCLC
Studie IMpower010 [1] prokázala u pacientů po adjuvantní chemoterapii s resekovaným NSCLC stadia II–IIIA přínos atezolizumabu pro přežití bez onemocnění (disease‑free survival, DFS) oproti nejlepší podpůrné péči (best supportive care, BSC), obzvláště v podskupině pacientů, jejichž nádory exprimovaly na nádorových buňkách PD‑L1 (ligand 1 receptoru programované buněčné smrti), což vedlo ke schválení adjuvantního atezolizumabu v této indikaci.
Enriqueta Felip a kol. prezentovaly výsledky explorativní analýzy více než pětiletého sledování populace pacientů s NSCLC stadia II–IIIA s expresí PD‑L1 na ≥ 50 % nádorových buněk, kde se přínos v DFS nadále promítá do klinicky významného trendu celkového přežití (overall survival, OS) [2].
Celkem 1 280 pacientů výkonnostního stavu (performance status, PS) dle ECOG (Eastern Cooperative Oncology Group) 0/1 po resekci NSCLC stadia IB–IIIA dostalo jeden až čtyři cykly chemoterapie. Následně bylo 1 005 pacientů randomizováno v poměru 1 : 1 k léčbě atezolizumabem 1 200 mg každé tři týdny (16 cyklů) nebo k BSC. Prezentovaná analýza sledovala populaci pacientů s NSCLC stadia II–IIIA s expresí PD‑L1 na ≥ 50 % nádorových buněk (n = 209), u nichž nedošlo během pěti let k rekurenci onemocnění nebo k úmrtí. Přínos OS u atezolizumabu oproti BSC byl patrný napříč klíčovými podskupinami bez ohledu na histologii, postižení uzlin a stadium onemocnění. Víc pacientů, u nichž bylo hodnotitelné pětileté DFS (n = 169), bylo ve skupině s atezolizumabem (n = 48/81; 59,3 %) než ve skupině BSC (n = 35/88; 39,8 %). Více než 15% rozdíl v míře pětiletého DFS mezi léčebnými rameny byl patrný v podskupinách pacientů rozdělených dle věku na mladší 65 let (61,2 % vs. 40,4 %), ve věku 65 let a starší (56,3 % vs. 38,9 %), pohlaví (muži 61,5 % vs. 48,4 %; ženy 50,0 % vs. 19,2 %)‚ ECOG PS 0 (61,8 % vs. 44,4 %), u stadia NSCLC IIIA (62,2 % vs. 30,4 %), uzlinového postižení stadia N1 (71,0 % vs. 51,3 %), N2 (53,6 % vs. 24,2 %) a v případě neskvamózní histologie (60,4 % vs. 32,7 %).
Pembrolizumab v neoadjuvantní a adjuvantní léčbě časného stadia NSCLC – analýza podskupin
Neoadjuvantní léčba pembrolizumabem v kombinaci s chemoterapií následovaná adjuvantní terapií pembrolizumabem demonstrovala u pacientů s resekovatelným NSCLC v klinické studii fáze III KEYNOTE‑671 významný přínos oproti samotné neoadjuvantní chemoterapii. Zaznamenáno bylo zlepšení přežití bez události (event‑free survival, EFS) i OS.
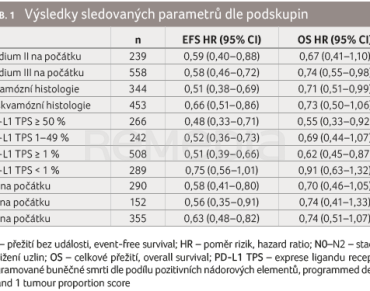 Marina C. Garassino prezentovala výsledky druhé interim analýzy klíčových podskupin pacientů [3]. Vhodní pacienti s resekabilním onemocněním stadia II, IIIA nebo IIIB (N2) byli randomizováni v poměru 1 : 1 k podání čtyř cyklů pembrolizumabu 200 mg nebo placeba + chemoterapie na bázi cisplatiny, po nichž následoval chirurgický zákrok a v adjuvanci pembrolizumab nebo placebo až do dalších třinácti cyklů. Primárními cílovými ukazateli byly EFS a OS. Randomizace byla stratifikována podle stadia onemocnění (II vs. III), exprese PD‑L1 dle podílu pozitivních nádorových elementů (programmed death‑ligand 1 tumour proportion score, PD‑L1 TPS < 50 % vs. ≥ 50 %), histologie (skvamózní vs. neskvamózní) a regionu (východní Asie vs. nevýchodní Asie).
Marina C. Garassino prezentovala výsledky druhé interim analýzy klíčových podskupin pacientů [3]. Vhodní pacienti s resekabilním onemocněním stadia II, IIIA nebo IIIB (N2) byli randomizováni v poměru 1 : 1 k podání čtyř cyklů pembrolizumabu 200 mg nebo placeba + chemoterapie na bázi cisplatiny, po nichž následoval chirurgický zákrok a v adjuvanci pembrolizumab nebo placebo až do dalších třinácti cyklů. Primárními cílovými ukazateli byly EFS a OS. Randomizace byla stratifikována podle stadia onemocnění (II vs. III), exprese PD‑L1 dle podílu pozitivních nádorových elementů (programmed death‑ligand 1 tumour proportion score, PD‑L1 TPS < 50 % vs. ≥ 50 %), histologie (skvamózní vs. neskvamózní) a regionu (východní Asie vs. nevýchodní Asie).
Medián sledování do druhé interim analýzy činil 36,6 měsíce (rozmezí 18,8–62,0). Randomizováno bylo 797 pacientů, v rameni s pembrolizumabem 397 a v placebovém 400. Poměr rizik (hazard ratio, HR) pro EFS i pro OS ve všech hodnocených podskupinách jasně favorizoval rameno s pembrolizumabem (tab. 1). Výsledky analýz dat z doby zahájení adjuvantní terapie naznačují, že adjuvantní terapie v tomto nastavení představuje klinický přínos. Mezi pacienty, kteří zahájili adjuvantní terapii, byly HR (95% interval spolehlivosti [CI]) pro EFS a OS od zahájení adjuvantní terapie 0,55 (0,42–0,72; n = 548) a 0,71 (0,49–1,03; n = 557).
Metastatické onemocnění
Sugemalimab spolu s chemoterapií jako prvoliniová léčba metastatického NSCLC?
Čtyřletá data ze studie GEMSTONE‑302 se sugemalimabem prezentovali Caicun Zhou a kol. [4]. Sugemalimab spolu s chemoterapií založenou na platině významně prodloužil OS i PFS u sledovaných pacientů s metastatickým NSCLC.
GEMSTONE‑302 je randomizovaná, dvojitě zaslepená studie fáze III, která hodnotí léčbu sugemalimabem oproti placebu u dosud neléčených pacientů s metastatickým onemocněním stadia IV. Pacienti byli randomizováni v poměru 2 : 1 k podávání 1 200 mg sugemalimabu (n = 320) nebo placeba (n = 159) každé tři týdny spolu s chemoterapií (karboplatina + paklitaxel u skvamózního NSCLC, karboplatina + pemetrexed u neskvamózního NSCLC). Po čtyřech cyklech následovala udržovací léčba (sugemalimab/placebo u skvamózního NSCLC, sugemalimab/placebo + pemetrexed u neskvamózního NSCLC) v rozsahu až 35 cyklů.
Jaké výsledky přinesla studie? Medián sledování od randomizace činil 43 měsíců. Ve skupině s léčbou sugemalimabem bylo dosaženo mediánu OS 25,2 měsíce oproti 16,9 měsíce v placebové skupině (HR 0,68; 95% CI 0,54–0,85) s odhadem OS 32,1 % vs. 17,3 %. Medián PFS hodnocený zkoušejícím byl 9,0 měsíce ve skupině se sugemalimabem oproti 4,9 měsíce při podávání placeba (HR 0,49; 95% CI 0,39–0,60). Setrvalý přínos léčby byl pozorován ve všech podskupinách zahrnujících odlišné histologické typy nádoru i míru exprese PD‑L1. Bezpečnostní profil léčby byl konzistentní s předchozími výsledky hodnocení.
Tato dlouhodobá data nadále podporují použití režimu sugemalimab + chemoterapie jako standardní léčbu první linie u metastatického NSCLC.
Naděje pro pacienty s metastatickým onemocněním s mutací KRASG12C a PD‑L1 TPS ≥ 50 %?
Prezentace Patrika Cobba představila návrh uspořádání klinické studie fáze III s MK‑1084, selektivním inhibitorem KRASG12C [5]. KRAS je jedním z nejčastěji mutovaných onkogenů u lidských nádorů a mutace KRASG12C se vyskytuje přibližně u 13 % pacientů s NSCLC. Plánovaná randomizovaná, dvojitě zaslepená studie fáze III (NCT06345729) bude hodnotit léčbu kombinací pembrolizumab (anti‑PD‑L1 léčba) + MK‑1084 nebo placebo u pacientů s dříve neléčeným metastatickým NSCLC s mutací KRASG12C a PD‑L1 TPS ≥ 50 %.
Zařazeni budou dospělí pacienti (ve věku ≥ 18 let) s histologicky nebo cytologicky potvrzeným NSCLC stadia IV s potvrzenou mutací KRASG12C a PD‑L1 TPS ≥ 50 % ve výkonnostním stavu ECOG PS 0 nebo 1. Pacienti budou randomizováni v poměru 1 : 1 k léčbě pembrolizumabem v dávce 200 mg každé tři týdny + 100 mg MK‑1084 nebo placebo perorálně každý den. Léčba bude pokračovat do progrese onemocnění, nepřijatelné toxicity, ukončení léčby nebo do maximálního povoleného počtu cyklů (až 35 cyklů pro pembrolizumab; bez omezení pro MK‑1084). Randomizace bude stratifikována podle ECOG PS (0 vs. 1), přítomnosti mozkových metastáz (ano vs. ne) a předchozí imunoterapie v neoadjuvantní/adjuvantní léčbě (ano vs. ne). Primárními cílovými ukazateli jsou PFS a OS. Sekundární cílové ukazatele zahrnují míru celkové odpovědi (overall response rate, ORR), trvání odpovědi (duration of response, DoR) podle RECIST (Response Evaluation Criteria in Solid Tumour) verze 1.1 a bezpečnost léčby. Do studie jsou nyní aktivně zařazováni pacienti.
Adagrasib – další lék pro léčbu první linie pokročilého NSCLC s mutací KRASG12C
Další léčivo pro terapii pokročilého NSCLC s mutací KRASG12C představila Marina C. Garassino a kol. [6]. Adagrasib selektivně a ireverzibilně inhibuje KRASG12C a vykazuje příznivé vlastnosti včetně dlouhého biologického poločasu (23 hodin), farmakokinetiky závislé na dávce a penetrace do mozku. Zdá se, že adagrasib zvyšuje citlivost k imunoterapii anti‑PD‑(L)1 tím, že obnovuje imunitní mikroprostředí nádoru. V části studie KRYSTAL‑7 fáze II (NCT04613596) prokázala kombinace adagrasibu a pembrolizumabu povzbudivou účinnost u pacientů s dosud neléčeným NSCLC mutovaným KRASG12C, zejména u pacientů s PD‑L1 TPS ≥ 50 %. Objektivní odezva dosáhla 63 %, míra kontroly onemocnění 84 % a 12měsíční PFS 60,8 %.
Na základě těchto předběžných údajů byla zahájena studie fáze III srovnávající v první linii adagrasib (400 mg dvakrát denně do progrese onemocnění) plus pembrolizumab (200 mg každé tři týdny až 35 cyklů) oproti samotnému pembrolizumabu u pacientů s neresekovatelným lokálně pokročilým nebo metastatickým KRASG12C mutovaným NSCLC (skvamózní nebo neskvamózní) a PD‑L1 TPS ≥ 50 %.
Pacienti randomizovaní v poměru 1 : 1 budou stratifikováni dle anamnézy léčby mozkových metastáz (ano vs. ne), regionu a výkonnostního stavu ECOG (0 versus 1). Primárními cílovými ukazateli jsou zvoleny PFS a OS. Sledovány budou dále bezpečnost a snášenlivost léčby, odpověď nádoru, farmakokinetika adagrasibu a kvalita života související se zdravím (health‑related quality of life, HRQoL).
Tyrozinkinázový inhibitor pro léčbu první linie u lokálně pokročilého nebo metastatického NSCLC s aktivující mutací HER2
Aktivující mutace receptoru 2 lidského epidermálního růstového faktoru (HER2) jsou zodpovědné za přibližně 2–4 % NSCLC, nicméně v současné době není schválena k použití žádná terapie cílená v první linii na HER2 u pacientů s tímto lokálně pokročilým nebo metastatickým onemocněním.
Antonio Passaro představil klinické hodnocení SOHO‑02 sledující studijní léčivo BAY 2927088 v porovnání se standardní péčí v první linii léčby lokálně pokročilého nebo metastatického NSCLC s prokázanou aktivační mutací HER2 [7].
Studijní lék BAY 2927088 představuje perorální reverzibilní inhibitor tyrozinkinázy, který se zaměřuje na HER2 a mutantní receptor epidermálního růstového faktoru. V dosud uskutečněné studii SOHO‑1 prokázal protinádorovou aktivitu a zvládnutelný bezpečnostní profil u dříve léčených pacientů s NSCLC s aktivující mutací HER2.
Studie SOHO‑02 hodnotí jeho účinnost a bezpečnost jako prvoliniové terapie. Tato otevřená randomizovaná multicentrická studie fáze III zahrne dospělé pacienty ve věku ≥ 18 let s dokumentovaným lokálně pokročilým nebo metastatickým neskvamózním NSCLC, dokumentovanou aktivační mutací v tyrozinkinázové doméně HER2 v nádorové tkáni a ECOG PS 0 nebo 1. Celkem 278 pacientů bude randomizováno k léčbě studijní medikací BAY 2927088 (20 mg dvakrát denně perorálně) nebo ke standardní péči (pembrolizumab v kombinaci s chemoterapií na bázi platiny a pemetrexed) podávané v 21denních cyklech. Primárním cílem je vyhodnotit efekt léčby na parametr PFS. Sekundárními cílovými ukazateli jsou OS, ORR a DoR. Sledovány budou bezpečnost a snášenlivost léčby a HRQoL v porovnání se standardní léčbou.
Datopotamab deruxtecan u pacientů s pokročilým neskvamózním NSCLC s mozkovými metastázami
Metastázy do mozku jsou u pacientů s NSCLC běžné a jsou spojeny se špatnou prognózou. Klinická studie fáze III TROPION‑Lung01 (NCT04656652) prokázala v populaci již léčených pacientů s pokročilým NSCLC statisticky významné zlepšení PFS při léčbě datopotamab deruxtecanem oproti docetaxelu [8]. Účinnost se odvíjela od skvamózní histologie.
Elvire Pons‑Tostivint představila výsledky post hoc analýzy pacientů s neskvamózním NSCLC dle přítomnosti/nepřítomnosti mozkových metastáz na počátku léčby. Pacienti byli randomizováni v poměru 1 : 1 k podávání datopotamab deruxtecanu 6 mg/kg nebo docetaxelu 75 mg/m2 každé tři týdny. Ze 468 pacientů se skvamózním NSCLC jich 84 mělo mozkové metastázy (43 randomizováno k datopotamab deruxtecanu a 41 k docetaxelu). Medián sledování byl 12,9 měsíce, resp. 12,7 měsíce. Léčba datopotamab deruxtecanem prodloužila PFS oproti docetaxelu bez ohledu na přítomnost mozkových metastáz. Medián PFS ve skupině s metastázami dosáhl 4,9 měsíce vs. 3,6 měsíce; HR 0,59 (95% CI 0,35–1,00) a 5,7 měsíce vs. 3,7 měsíce ve skupině bez metastáz; HR 0,64 (95% CI 0,50–0,81). Stejně tak byla ve skupině datopotamab deruxtecanu vyšší ORR – 30 % (13/43) vs. 12 % (5/41) ve skupině s metastázami a 31 % (60/191) vs. 13 % (25/193) v podskupině bez metastáz. Ve skupině s datopotamab deruxtecanem bylo oproti docetaxelu zaznamenáno méně závažných (grade ≥ 3) nežádoucích účinků souvisejících s léčbou a potřeba redukce dávky či ukončení terapie, opět bez ohledu na status přítomnosti mozkových metastáz.
Sigvotatug vedotin u dříve léčených pacientů s NSCLC
Exprese integrinu beta‑6 (IB6) koreluje u řady nádorů, včetně NSCLC, se špatnými výsledky. Více než 90 % NSCLC IB6 exprimuje. Sigvotatug vedotin (dříve známý jako SGN‑B6A) je konjugát protilátky a léčiva řízený IB6, který prokázal povzbuzující aktivitu u intenzivně předléčených pacientů s NSCLC a jinými solidními nádory. Druhé a následné linie léčby nabízejí u pacientů progredujících po léčbě inhibitory PD‑(L)1 po chemoterapii na bázi platiny a/nebo cílené terapii jen omezený přínos.
Solange Peters představil Be6A Lung‑01, otevřené klinické hodnocení fáze III (NCT06012435) studující účinnost a bezpečnost sigvotatug vedotinu ve srovnání s docetaxelem u pacientů s lokálně pokročilým neresekovatelným nebo metastatickým neskvamózním NSCLC [9]. U pacientů musí být doložena progrese onemocnění během léčby nebo po léčbě inhibitory PD‑(L)1, po chemoterapii na bázi platiny nebo cíleném léčebném režimu (režimech) dle známých genomických alterací. Pacienti nesmějí jako předchozí léčbu dostat přípravky cílící na mikrotubuly a ne více než jednu předchozí linii cytotoxické chemoterapie. Randomizováno by mělo být zhruba 600 pacientů ECOG PS 0 nebo 1 v poměru 1 : 1 k léčbě sigvotatug vedotinem 1,8 mg/kg dle AiBW (adjusted ideal body weight) podávaným intravenózně v 28denním cyklu ve dnech 1 a 15 nebo k léčbě docetaxelem 75 mg/m2 podávaným intravenózně v 21denním cyklu v den 1. Randomizace je stratifikována na základě ECOG PS, genomických alterací a regionů. Primárními cílovými ukazateli jsou OS a ORR dle nezávislého zaslepeného hodnocení (Blinded Independent Central Review, BICR). Klíčovými sekundárními ukazateli jsou PFS podle BICR, ORR a PFS dle hodnotitele, DoR dle BICR a hodnotitele, bezpečnost léčby a výsledky hlášené pacientem (patient‑reported outcomes, PROs).
Literatura
[1] Felip E, Altorki N, Zhou C, et al. Adjuvant atezolizumab after adjuvant chemotherapy in resected stage IB–IIIA non‑small‑cell lung cancer (IMpower010): a randomised, multicentre, open‑label, phase 3 trial. Lancet 2021; 398: 1344–1357.
[2] Felip E, Vallieres E, Gologordko O, et al. IMpower010: Characterisation of patients (pts) with stage II‑IIIA PD‑L1 TC≥50% NSCLC who were disease‑free at 5 years (5yDF) in a phase III study of atezolizumab (atezo) vs best supportive care (BSC) after resection and adjuvant (adj) chemotherapy (chemo). Presentation Nr. 1212P.
[3] Gao S, Liberman M, Spicer JD, et al. Neoadjuvant pembrolizumab (pembro) or placebo (pbo) plus chemotherapy and adjuvant pembro or pbo for early stage NSCLC: Subgroup analyses of the phase III KEYNOTE‑671 study. Presentation Nr. 1210P.
[4] Zhou C, Wang Z, Sun M, et al. Four‑year outcomes from GEMSTONE‑302 study: First‑line sugemalimab plus platinum‑based chemotherapy in metastatic non‑small cell lung cancer (NSCLC). Presentation Nr. 1318P.
[5] Cobb PW, Hochmair M, Schuler MH, et al. Phase III study of pembrolizumab plus MK‑1084 vs pembrolizumab plus placebo as first‑line treatment for metastatic non‑small cell lung cancer (NSCLC) with a KRAS G12C mutation and PD‑L1 tumour proportion score (TPS) ≥50%: MK‑1084‑004. Presentation Nr. 1392TiP.
[6] Garassino MC, Jänne PA, Barlesi F, et al. A phase III study of first‑line adagrasib plus pembrolizumab versus pembrolizumab alone in patients with advanced NSCLC with KRASG12C mutation. Presentation Nr. 1394TiP.
[7] Passaro A, Brase JC, Xu J, et al. A randomized phase III trial evaluating oral BAY 2927088, compared with standard of care, as first‑line treatment of locally advanced or metastatic NSCLC harboring HER2‑activating mutations (SOHO‑02). Presentation Nr. 1395TiP.
[8] Pons‑Tostivint E, Okamoto I, Sands J, et al. Datopotamab deruxtecan (Dato‑DXd) vs docetaxel (DTX) in patients (pts) with advanced nonsquamous (NSQ) non‑small cell lung cancer (NSCLC) with brain metastases (mets): Results from TROPION‑Lung01. Presentation Nr. 1312P.
[9] Peters S, De Cerqueira Mathias CM, Cheng ML, et al. Be6A Lung‑01, a phase III study of sigvotatug vedotin (SV), an investigational antibody‑drug conjugate (ADC) versus docetaxel in patients (pts) with previously treated non‑small cell lung cancer (NSCLC). Presentation Nr. 1398TiP.