Psoriáza a psoriatická artritida léčené bimekizumabem
Souhrn
Jandová M. Psoriáza a psoriatická artritida léčené bimekizumabem. Remedia 2024; 34: 477–479.
Psoriáza je systémové zánětlivé neinfekční autoimunitní onemocnění postihující především kůži, nehty a klouby. Bývá často asociováno s dalšími chorobami. Má chronický průběh s pestrým klinickým obrazem, opakovanými exacerbacemi a významným ovlivněním kvality života. Léčba psoriázy se odvíjí od závažnosti onemocnění, věku nemocného i přítomnosti komorbidit. Biologická léčba znamená významný pokrok v terapii pro pacienty se závažným průběhem nemoci. Vědecký výzkum se zaměřuje na patofyziologii nemoci a cílí nové přípravky na podstatu onemocnění a probíhající patologické děje. Regulační osa IL‑23/IL‑17 má klíčovou roli nejen při vzniku poškozujícího zánětu u pacientů s psoriázou.
Klíčová slova: psoriáza – psoriatická artritida – regulační osa IL‑23/IL‑17 – bimekizumab.
Summary
Jandova M. Psoriasis and psoriatic arthritis treated by bimekizumab. Remedia 2024; 34: 477–479.
Psoriasis is a systemic, inflammatory, non‑infectious, autoimmune disease affecting mainly the skin, nails and joints. It is often associated with other diseases. It has a chronic course with a varied clinical picture, repeated exacerbations and a significant effect on the quality of life. Treatment of psoriasis is influenced by the severity of the disease, the age of the patient and the presence of comorbidities. Biological therapy represents a significant advance in therapy for patients with a severe course of the disease. Scientific research focuses on the pathophysiology of the disease and targets new products on the nature of the disease and ongoing pathological processes. The regulatory axis IL23/IL17 plays a key role not only in the development of damaging inflammation in patients with psoriasis.
Key words: psoriasis – psoriatic arthritis – regulatory axis IL23/IL17 – bimekizumab.
Úvod
Psoriáza je systémové zánětlivé neinfekční autoimunitní onemocnění, které postihuje především kůži, nehty a klouby a bývá často asociováno s dalšími chorobami [1].
Interleukiny (IL) 17A a 17F představují dva nejvíce homologní cytokiny, které sdílejí podobné regulace. Jsou produkovány aktivovanými Th17 lymfocyty ve formě homodimerů (IL‑17A, IL‑17F) nebo heterodimeru (IL‑17A/F). Všechny tyto formy jsou biologicky aktivní, jejich prostřednictvím T lymfocyty regulují zánětlivé reakce organismu [2]. Duální inhibice těchto prozánětlivých cytokinů vede k potlačení kožního zánětu a klinických příznaků spojených s psoriázou.
Bimekizumab je humanizovaná monoklonální protilátka IgG₁, která inhibuje signalizaci zprostředkovanou IL‑17A/17F. Je indikován k léčbě středně těžké až těžké formy ložiskové psoriázy u dospělých, kteří jsou kandidáty na systémovou léčbu. Doporučené dávkování u těchto nemocných je 320 mg subkutánně (s.c., 2× 160mg předplněná stříkačka/pero) v týdnech 0, 4, 8, 12 a 16 a dále v intervalu osmi týdnů. Pokud po 16 týdnech léčby nedojde ke zlepšení kožního nálezu, je doporučeno zvážit ukončení terapie [3]. U pacientů s hmotností vyšší než 120 kg, u nichž nebylo dosaženo kompletní odpovědi v týdnu 16, je doporučeno zkrácení aplikačního intervalu na čtyři týdny [3].
Celkem byly provedeny čtyři studie fáze III s cílem porovnat podávání bimekizumabu s placebem a ustekinumabem (BE VIVID), s placebem (BE READY), s adalimumabem (BE SURE) a se secukinumabem (BE RADIANT). Výsledky klinického hodnocení fáze III potvrdily vysokou míru účinnosti bimekizumabu pozorovanou v předchozích studiích a superioritu bimekizumabu oproti porovnávaným přípravkům [4]. Ve všech studiích fáze III byl bimekizumab dobře tolerován, s bezpečnostním profilem podobným ostatním biologikům, s výjimkou vyšší frekvence výskytu orální kandidózy [4,5].
Kazuistika
Pacient ve věku 68 let je na Klinice nemocí kožních a pohlavních FN Hradec Králové sledován pro psoriázu od roku 2011. Tímto onemocněním trpí již od roku 1981, od roku 1993 také psoriatickou artritidou. Kromě psoriázy má nemocný v anamnéze arteriální hypertenzi, ischemickou chorobu srdeční, opakovaně prodělal infarkty myokardu včetně provedení koronárního bypassu v roce 2017. Dále byly u pacienta diagnostikovány hyperlipidemie, hypertrofie prostaty, chronická hepatopatie, muž je obézní a postupně se u něj rozvinul depresivní syndrom. V rodině se psoriáza nevyskytuje, alergiemi nemocný netrpí. Od roku 2018 je v plném invalidním důchodu pro kardiologickou diagnózu, předtím byl v částečném invalidním důchodu pro psoriatickou artritidu. Jinak pracoval jako traktorista. Od 20 let kouří 10–15 cigaret denně, pije pravidelně dvě piva týdně.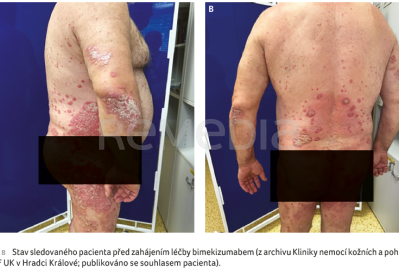
Pacient užívá bohatou medikaci: kombinace perindopril/amlodipin/indapamid, kyselina acetylsalicylová/glycin, zolpidem, ivabradin, omeprazol, analgetika dle potřeby (tramadol/paracetamol), potravinové doplňky (hepatoprotektiva a další látky), kombinace rutin/kyselina askorbová. Je sledován v revmatologické poradně, na urologii, neurologii a rehabilitaci, bohužel však v různých městech a institucích. Zpočátku byl léčen fototerapií, poté v roce 1993 pro kloubní obtíže nízkodávkovaným metotrexátem. Efekt na kůži i klouby byl dobrý, nicméně došlo k elevaci hodnot jaterních testů. V roce 2011 dostal nemocný acitretin v kombinaci s fototerapií, kdy nastalo výrazné zhoršení psoriázy, které si vyžádalo přechodnou léčbu systémovým kortikoidem. Na naší klinice jsme se vrátili k léčbě metotrexátem v dávce 15 mg týdně, avšak skóre PASI (Psoriasis Area and Severity Index) bylo 35,7, BSA (Body Surface Area) 86 při tělesné hmotnosti 119 kg, klouby bolely stále. Zahájili jsme léčbu adalimumabem v dávce 40 mg s.c./14 dnů v kombinaci s metotrexátem v dávce 7,5–15 mg/týden. Hodnota PASI se pohybovala od 3,6 do 10,6 s jasným zhoršováním při infektech. V květnu 2018 bylo PASI 12, léčba metotrexátem byla ukončena a byla zahájena léčba ixekizumabem v dávce 80 mg s.c./4 týdny s výborným efektem (8/2018 PASI 0). V říjnu 2021 se zdravotní stav zkomplikoval akutní meningoencefalitidou po prodělaném zánětu středouší způsobeném virem varicella zoster. Poté ještě pacient v únoru 2022 prodělal další infarkt myokardu. Léčba ixekizumabem byla přerušena, ale ke zhoršení psoriázy nedošlo (PASI 1,2). V dubnu 2023 si muž začal stěžovat na hučení v uších, mžitky před očima a bolest zad, hodnota PASI 4. Při kontrole v červnu 2023 pacient uvedl, že sám užívá metotrexát nahodile, např. 4 dny 8 tablet. Metotrexát byl však naposledy předepsán na kožní klinice v roce 2018.
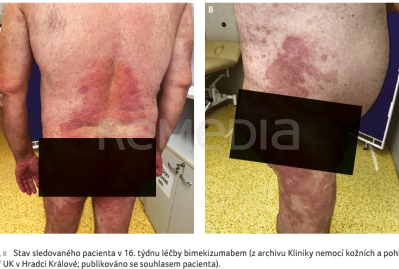 Pro obtížnou komunikaci a spolupráci s pacientem jsme v prosinci 2023 zvolili další biologikum s frekvencí podání jednou za 12 týdnů a s možností aplikace na klinice (tildrakizumab 200 mg), PASI bylo 20. Efekt po šesti měsících léčby ale nebyl žádný, PASI dosáhlo 28. Proto jsme provedli další změnu léčby na bimekizumab v dávce 320 mg s.c./8 týdnů (obr. 1A, B). Při kontrole po měsíci bylo PASI 8, DLQI (Dermatology Life Quality Index) 0, klouby bolely méně. Po dalších třech měsících bylo PASI 0, DLQI 0 (obr. 2A, B). Pacient si však stěžoval na hmotnostní úbytek 12 kg a potíže s polykáním, pro které byl již vyšetřen na ORL. Pro velmi suspektní orální kandidózu byl přeléčen flukonazolem v dávce 150 mg 1‑0‑0 perorálně po dobu tří dnů, kdy došlo k rychlému ústupu udávaných obtíží.
Pro obtížnou komunikaci a spolupráci s pacientem jsme v prosinci 2023 zvolili další biologikum s frekvencí podání jednou za 12 týdnů a s možností aplikace na klinice (tildrakizumab 200 mg), PASI bylo 20. Efekt po šesti měsících léčby ale nebyl žádný, PASI dosáhlo 28. Proto jsme provedli další změnu léčby na bimekizumab v dávce 320 mg s.c./8 týdnů (obr. 1A, B). Při kontrole po měsíci bylo PASI 8, DLQI (Dermatology Life Quality Index) 0, klouby bolely méně. Po dalších třech měsících bylo PASI 0, DLQI 0 (obr. 2A, B). Pacient si však stěžoval na hmotnostní úbytek 12 kg a potíže s polykáním, pro které byl již vyšetřen na ORL. Pro velmi suspektní orální kandidózu byl přeléčen flukonazolem v dávce 150 mg 1‑0‑0 perorálně po dobu tří dnů, kdy došlo k rychlému ústupu udávaných obtíží.
Diskuse
Biologika inhibující dráhu Th17 lymfocytů jsou schválena pro léčbu ložiskové psoriázy, psoriatické artritidy a ankylozující spondylitidy. Tato skupina biologických léků zahrnuje inhibitory IL‑17 (secukinumab, ixekizumab, brodalumab, bimekizumab) a inhibitory IL‑12/23 (IL‑12/23p40 – ustekinumab, IL‑23p19 – guselkumab).
Interleukin 17 je nezbytný v obraně hostitele proti mukokutánní kandidóze, indukuje chemotaxi neutrofilů a antimikrobiální peptidovou aktivitu [6,7]. Pacienti s vrozenými defekty imunity IL‑17 vykazují závažnou a chronickou kandidózu na kůži a sliznicích [8–10]. Mukokutánní kandidóza jako komplikace léčby inhibitory IL‑17 byla popsána v několika klinických studiích [11–13]. Kandidóza byla hlášena u 6,5 % pacientů léčených brodalumabem [14], u 4,7 % pacientů léčených secukinumabem [15], u 3,6 % pacientů léčených ixekizumabem [16] a u 15 % pacientů při léčbě bimekizumabem [17]. Léčba inhibitory IL‑17 je tedy spojena se zvýšeným rizikem výskytu orofaryngeální, jícnové a kožní kandidózy.
Závěr
Na Klinice nemocí kožních a pohlavních FN Hradec Králové používáme bimekizumab v léčbě pacientů s psoriázou od května 2023. Takto léčených máme nyní 13 nemocných. Osobně mám v péči tři z těchto pacientů, kteří zároveň trpí psoriatickou artritidou. U všech kožní obtíže rychle ustoupily a tento stav remise trvá nadále. Rovněž uvedení pacienti popisují určitou míru ústupu bolesti kloubů. U všech léčených se však v průběhu terapie objevila orální kandidóza, která si vyžádala systémovou léčbu antimykotikem. U žádného ze sledovaných pacientů nebyla tato komplikace důvodem k přerušení léčby nebo k žádosti o výměnu přípravku.
MUDr. Marie Jandová, Ph.D.
Klinika nemocí kožních a pohlavních FN a LF UK v Hradci Králové
Sokolská 581, 500 05 Hradec Králové
e-mail: marie.jandova@fnhk.cz
Literatura
[1] Takeshita J, Grewal S, Langan SM, et al. Psoriasis and comorbid diseases: Epidemiology. J Am Acad Dermatol 2017; 76: 377–390.
[2] Chamg SH, Dong C. A novel heterodimeric cytokine consisting of IL‑17 and IL‑17F regulates inflammatory responses. Cell Res 2007; 17: 535–440.
[3] SPC Bimzelx. Dostupné na: https://www.ema.europa.eu/cs/documents/product‑information/bimzelx‑epar‑product‑information_cs.pdf
[4] Freitas E, Blauvelt A, Torres T. Bimekuzumab fot the Treatment of Psoriasis. Drugs 2021; 81: 1751–1762.
[5] Reich K, Warren RB, Lebwohl M, et al. Bimekizumab versus Secukinumab in Plaque Psoriasis. N Engl J Med 2021; 385: 142–152.
[6] Netea MG, Brown GD, Kullberg BJ, et al. An integrated model of the recognition of Candida albicans by the innate immune system. Nat Rev Microbiol 2008; 6: 67–78.
[7] Netea MG, Joosten LA, van der Meer JW, et al. Immune defence against Candida fungal infections. Nat Rev Immunol 2015; 15: 630–642.
[8] Puel A, Cypowyj S, Bustamante J, et al. Chronic mucocutaneous candidiasis in humans with inborn errors of interleukin‑17 immunity. Science 2011; 332: 65–68.
[9] van de Veerdonk FL, Plantinga TS, Hoischen A, et al. STAT1 mutations in autosomal dominant chronic mucocutaneous candidiasis. N Engl J Med 2011; 365: 54–61.
[10] Okada S, Puel A, Casanova JL, et al. Chronic mucocutaneous candidiasis disease associated with inborn errors of IL‑17 immunity. Clin Transl Immunology 2016; 5: e114.
[11] van de Kerkhof PC, Griffiths CE, Reich K, et al. Secukinumab long‑term safety experience: A pooled analysis of 10 phase II and III clinical studies in patients with moderate to severe plaque psoriasis. J Am Acad Dermatol 2016; 75: 83–98 e4.
[12] Lebwohl M, Strober B, Menter A, et al. Phase 3 studies comparing brodalumab with ustekinumab in psoriasis. N Engl J Med 2015; 373: 1318–1328.
[13] Mease P, Roussou E, Burmester GR, et al. Safety of ixekizumab in patients with psoriatic arthritis: results from a pooled analysis of three clinical trials. Arthritis Care Res (Hoboken) 2019; 71: 367–378.
[14] Lebwohl M, Strober B, Menter A, et al. Phase 3 studies comparing brodalumab with ustekinumab in psoriasis. N Engl J Med 2015; 373: 1318–1328.
[15] Langley RG, Elewski BE, Lebwohl M, et al. Secukinumab in plaque psoriasis – results of two phase 3 trials. N Engl J Med 2014; 371: 326–338.
[16] Gordon KB, Colombel JF, Hardin DS. Phase 3 Trials of Ixekizumab in Moderate‑to‑Severe Plaque Psoriasis. N Engl J Med 2016; 375: 2102.
[17] Reich K, Papp KA, Blauvelt A, et al. Bimekizumab versus ustekinumab for the treatment of moderate to severe plaque psoriasis (BE VIVID): efficacy and safety from a 52‑week, multicentre, double‑blind, active comparator and placebo controlled phase 3 trial. Lancet 2021; 397: 487–498.