Revoluce v řešení zánětu u PsA a axSpA pomocí duální inhibice IL-17A a IL-17F
Vídeň hostila ve dnech 12.–15. června 2024 každoroční kongres Evropské aliance revmatologických společností (EULAR 2024). Prezentovány byly aktuální výsledky klinických hodnocení i nové odborné pohledy. S rozšiřujícími se možnostmi léčby je stále větší důraz kladen na fenotyp onemocnění a charakteristiky pacienta, které by měly být podkladem pro výběr terapie u konkrétního nemocného. Sympozium společnosti UCB se zaměřilo na duální inhibici interleukinů 17A/F v terapii psoriatické artritidy (PsA) a axiální spondyloartritidy (axSpA) a na léčbu bimekizumabem (BKZ).
Management zánětu u psoriatické artritidy a axiální spondyloartritidy: role interleukinů 17A a 17F
Sympoziu předsedal profesor Iain McInnes (Glasgow, Spojené království), který se rovněž ujal prvního sdělení. V úvodu se zamyslel nad vývojem léčby v posledních letech. Imunitně zprostředkovaná zánětlivá onemocnění jsou klinicky různorodá. Ačkoliv jsou v současnosti stále nevyléčitelná, terapeutické armamentarium se v posledních dvou desetiletích výrazně změnilo. Od aplikace širokospektrálních imunitních modulátorů jsme přešli k používání vysoce specifických účinných látek na molekulárním podkladě. S dostupností řady léčivých přípravků nyní roste potřeba tzv. ušít léčbu pacientovi na míru.
Profesor McInnes považuje za výrazný pokrok v managementu onemocnění v posledních letech požadavek striktní kontroly zánětu. Ukazuje se totiž, že nejlepších výsledků je dosaženo právě v případě jeho kompletní kontroly [1]. Za klíčové prvky považuje časnou diagnózu a stanovení vhodné intervence; určení cíle léčby, tj. dosažení remise nebo minimální aktivity onemocnění (minimal disease activity, MDA).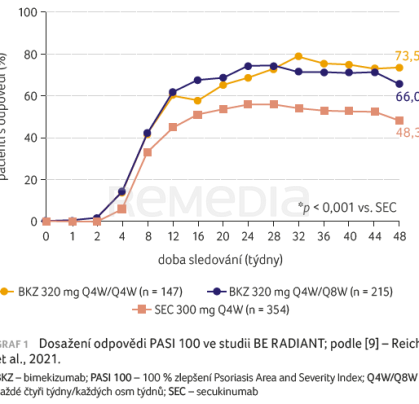
Doporučení pro léčbu axSpA [2] i PsA [3] stanovují kontrolu zánětu jako primární cíl. Cílem terapie je kontrola symptomatologie, prevence progrese strukturálního postižení a maximální možná kvalita života pacienta související se zdravím. K dosažení těchto cílů je důležitá právě kontrola/potlačení zánětu. Tak lze dosáhnout remise. Opoždění může vést k omezení dosažení MDA a k horší kvalitě života navzdory terapii.
Pacienti, kteří dosáhnou MDA v průběhu prvního roku léčby, mají nižší pravděpodobnost progrese strukturálního postižení [4]. Naopak přítomnost zánětu je prediktorem nevratné strukturální progrese v dalších letech [5]. Bylo doloženo, že vyšší zánětlivá zátěž je u pacientů s PsA a axSpA rovněž spojena s vyšším kardiovaskulárním rizikem [6,7].
Se záměrem kontrolovat zánět je třeba identifikovat a monitorovat cíle léčby a terapii podle potřeby upravit. V klinické praxi by měla být využívána validovaná měření aktivity onemocnění i hodnocení relevantních extramuskuloskeletálních manifestací a provázet rozhodnutí o léčbě. Tzv. léčba k cíli (treat‑to‑target) s měřením aktivity onemocnění a následnou úpravou terapie zlepšuje výsledky. Přednášející zdůraznil propojení potřeb a cílů lékaře a pacienta.
Prof. McInnes se dále zaměřil na duální inhibici interleukinů (IL) 17A a 17F. Jedná se o odlišný mechanismus účinku?
PsA a axSpA jsou zánětlivá onemocnění zprostředovaná působením IL‑17A a IL‑17F. Na podkladě environmentálních a genetických faktorů dochází k aktivaci imunitního systému a buněk produkujících rodinu IL‑17. Následné zánětlivé pochody se podílejí na rozvoji periferních artritid, axiálního postižení, entezitid, psoriázy či daktylitid. Biologické chování IL‑17A a IL‑17F se překrývá. IL‑17A a IL‑17F tvoří homodimery a heterodimery a využívají stejný receptorový komplex. Oba jsou exprimovány v místech zánětu u PsA, axSpA, psoriázy a hidradenitis suppurativa. Jsou produkovány řadou lymfocytů a jejich tvorba je závislá na těchto drahách.
Interleukin 17A je klíčovou hnací silou zánětu a je hlavním terapeutickým cílem monoklonálních protilátek proti IL‑17. BKZ je prvním biologickým přípravkem, který vedle inhibice IL‑17A selektivně blokuje také IL‑17F. S vysokou afinitou se váže na oba členy rodiny IL‑17. Mechanismus účinku vychází z hypotézy, že vzhledem k překrývající se biologii těchto dvou cytokinů by duální neutralizace IL‑17A/F mohla poskytnout větší hloubku klinické odpovědi u onemocnění zprostředkovaných IL‑17 oproti samotné inhibici IL‑17A [8]. Různí členové rodiny IL‑17 a jejich inhibice mohou ovlivnit konkrétní klinické veličiny. Klinická hodnocení BE RADIANT u pacientů s psoriázou doložila, že duální inhibice IL‑17A/F pomocí BKZ vedla k výraznější odpovědi na léčbu (vyčištění kůže) než samotná inhibice IL‑17A secukinumabem (graf 1) [9]. Vysoký podíl pacientů, kteří v otevřené extenzi přešli z BKZ na terapii secukinumabem, si zachoval i nadále odpověď na léčbu se zjevnou klinickou výhodou (graf 2) [10].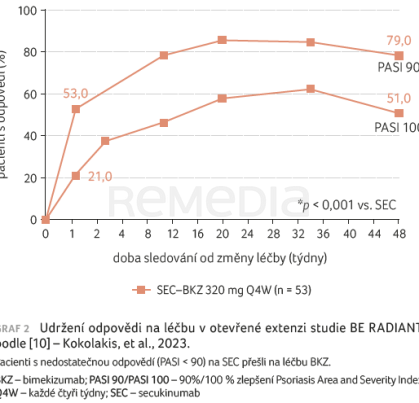
Profesor McInnes shrnul, že optimální management PsA a axSpA spočívá v dosažení kompletní kontroly zánětu hodnocené jako dosažení stavu remise nebo MDA. Časná a přesná kontrola zánětu zlepšuje léčebné výsledky a kvalitu života, pozdržuje strukturální progresi a redukuje riziko komorbidit, jako jsou kardiovaskulární onemocnění. S cílem dosáhnout maximální kontroly zánětu vyvstává potřeba identifikovat možné léčebné cíle. BKZ je humanizovaná monoklonální protilátka, která selektivně inhibuje IL‑17A a IL‑17F. Tento mechanismus účinku, duální inhibice, může vést k výraznějšímu potlačení zánětu a je definován jako nový cíl s velkým terapeutickým potenciálem.
Management psoriatické artritidy prostřednictvím kontroly zánětu
Profesorka Maria Antonietta D’Agostino (Řím, Itálie) se zaměřila na léčbu PsA. V úvodu připomněla, že hlavním hlediskem, které řídí rozhodnutí o léčbě, jsou muskuloskeletální i extramuskuloskeletální projevy onemocnění. V diagnostice je třeba mít na paměti kontinuum psoriázy–PsA. Psoriáza předchází revmatickým manifestacím u 70 % pacientů a u zhruba 30 % pacientů s psoriázou se rozvine PsA. Přednášející vyzdvihla potřebu umět definovat pacienty s psoriázou, kteří jsou ve vysokém riziku rozvoje PsA, a pokročit v porozumění podstatě PsA s cílem definovat imunitní, environmentální a molekulární subklinické jevy, které předcházejí počátku PsA.
Co může být příčinou obtížné časné diagnostiky PsA v klinické praxi? Mezi rutinní vyšetření v klinické praxi patří laboratorní testy a rentgenové zobrazení. Za efektivní techniku k identifikaci a rozlišení běžných typů zánětlivých artritid považuje přednášející ultrazvukové vyšetření. To může pomoci lépe vykreslit zánětlivý fenotyp artritidy a vizualizovat patofyziologické změny na subklinické úrovni (entezitidy, synovitidy, tenosynovitidy, kostní eroze či depozita krystalů) [11].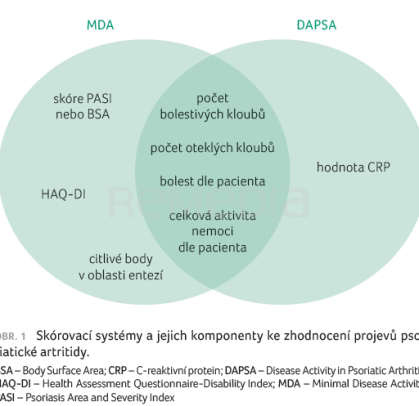
Psoriatická artritida je komplexní onemocnění zahrnující muskuloskeletální manifestace (artritida, entezitida, axiální postižení, daktylitida) i extraskeletální projevy (psoriáza, psoriatické postižení nehtů, uveitida, zánětlivé onemocnění střev [IBD]). Pro časnou a přesnou diagnostiku je proto zásadní právě možnost vizualizace. Jednotlivé muskuloskeletální manifestace mohou ovlivnit management PsA a poslední guidelines EULAR [3] doporučují výběr terapie právě podle fenotypu onemocnění. Přednášející objasnila, že oligoartritida postihuje až 70 % pacientů s PsA. Může postihnout jakýkoliv kloub a zahrnout i daktylitidu, u 15 % pacientů jsou zasaženy párové klouby. Entezitida se vyskytuje až u 60 % pacientů s PsA, nejčastěji se jedná o oblast paty.
Profesorka D’Agostino proto upozornila, že potlačení zánětu by mělo být hlavním cílem léčby PsA napříč jejími doménami. Snahou je dosažení remise či MDA. Jak již bylo řečeno, nejlepších výsledků léčby je dosahováno právě při minimalizaci zánětu, resp. jeho plnou kontrolou. Aktivita onemocnění a jeho jednotlivé projevy by měly být pravidelně hodnoceny. Pro klinickou praxi jsou doporučovány kompozitní skórovací systémy MDA a DAPSA (Disease Activity in Psoriatic Arthritis), které mohou pomoci komplexně zhodnotit projevy onemocnění (obr. 1).
Dosažení MDA a zlepšení DAPSA jsou spojeny se zvýšením kvality života pacientů, zlepšením fyzických funkcí a s redukcí progrese strukturálního postižení. Většina zavedených novějších léčebných modalit cílí na všechny aktivní domény nemoci (tab. 1) [12]. Doporučení EULAR 2023 berou při výběru terapie v úvahu jak muskuloskeletální manifestace onemocnění, tak extramuskuloskeletální projevy. V případě artritidy nereagující na léčbu konvenčními syntetickými chorobu modifikujícími antirevmatickými léky (csDMARDs) nebo při entezitidě či axiálním postižení nereagujících na nesteroidní antirevmatika je možné jednoduše přejít k biologické léčbě, popř. inhibitorům Janus kináz (JAK) již ve druhém kroku. Biologické (bDMARDs) i cílené syntetické DMARDs (tsDMARDs) prokázaly v klinických hodnoceních velmi dobrou účinnost v ovlivnění postižení kloubů.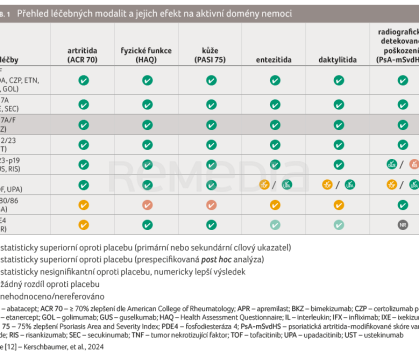
Bimekizumab v léčbě PsA
Bimekizumab byl v terapii PsA hodnocen u různých typů pacientů. Studie BE OPTIMAL [13] zařadila pacienty tzv. naivní k biologické terapii, studie BE COMPLETE [14] pacienty, u nichž selhala anti‑TNF terapie. Ve studii BE OPTIMAL vedla léčba BKZ k rychlé a setrvalé kontrole onemocnění. Konzistentní odpověď na léčbu hodnocenou MDA byla zaznamenána bez ohledu na konkomitantní terapii metotrexátem [15]. Přednášející vyzdvihla rychlý nástup účinku, který byl zaznamenán již ve čtvrtém týdnu léčby. BKZ prokázal účinnost a bezpečnost léčby napříč populacemi (u pacientů bez předchozí biologické léčby i po jejím selhání), v hlavních muskuloskeletálních doménách PsA – u artritidy (dle ACR 50), psoriázy kůže (PASI 100) i nehtů (mNAPSI 0), entezitidy (LEI 0), daktylitidy (LDI 0) i v případě funkcí hodnocených pacienty (HQI‑DI MCID). Terapie BKZ u biologicky naivních pacientů byla spojena s inhibicí strukturální progrese. U 89,3 % léčených pacientů nebyla v týdnu 52 zaznamenána žádná radiografická progrese [16].
Bezpečnostní profil léčby, považovaný obecně za dobře tolerovaný, se nelišil od předchozích klinických hodnocení, mezi nejčastější nežádoucí účinky zaznamenané během léčby BKZ patří nazofaryngitidy, infekce SARS‑CoV‑2 (vzhledem k probíhající pandemii), infekce horních cest dýchacích a pro přípravky cílící na IL‑17 typické rovněž orální kandidózy [17].
Přednášející shrnula, že u vysokého podílu pacientů s psoriázou se rozvine PsA. V terapii je hlavním úkolem kontrola zánětu. Pro hodnocení remise či LDA jsou doporučeny skórovací systémy DAPSA a MDA. Nadějným léčivem v managementu PsA a jejích rozmanitých manifestací se jeví BKZ. Výsledky studií fáze III demonstrovaly při této léčbě rychlou, hlubokou a setrvalou kontrolu zánětu napříč různými projevy onemocnění jak u biologicky naivních pacientů, tak u pacientů, u nichž anti‑TNF léčba selhala.
Management axiální spondyloartritidy prostřednictvím kontroly zánětu
S třetí prezentací zaměřenou na management axSpA vystoupil profesor Martin Rudwaleit (Bielefeld, Německo). V úvodu připomněl, že management axSpA vedený snahou o kontrolu zánětu lze považovat za převratnou myšlenku, která ještě před dvaceti lety nebyla známa. Biologická léčba byla ve svých počátcích považována za drahou terapii bolestí zad. Až v průběhu dalších let jsme se naučili, že zánět a jeho kontrola hrají v managementu (nejen) axSpA zásadní úlohu.
Aktuální léčebná doporučení [2] vyzdvihují význam kontroly zánětu a individualizaci terapie. K monitoraci aktivity onemocnění a jako určité vodítko pro volbu cíle je doporučeno skóre ASDAS (Ankylosing Spondylitis Disease Activity Score). Intenzifikace léčby by měla být zvážena po selhání konvenční terapie u pacientů s permanentně vysokou aktivitou onemocnění (ASDAS ≥ 2,1). V případě indikace bDMARD/tsDMARD je doporučeno zahájit léčbu inhibitorem TNF, inhibitorem IL‑17 nebo inhibitorem JAK. Léčebná volba se odvíjí od extramuskuloskeletálních projevů; u rekurentní uveitidy/IBD jsou upřednostňovány inhibitory TNF, v případě dominantní psoriázy inhibitory IL‑17. Pokud není po 12 a více týdnech léčby bDMARD/tsDMARD změna ASDAS ≥ 1,1, je třeba znovu zhodnotit stanovenou diagnózu axSpA a přítomnost komorbidit. Při potvrzení aktivní axSpA je doporučen přechod na jiné bDMARD nebo inhibitor JAK.
Zánět je řídícím faktorem progrese [18], jeho časná kontrola je proto důležitá s cílem vyhnout se strukturální progresi. Profesor Rudwaleit upozornil, že roli hraje zánět doložený zobrazením na magnetické rezonanci (MRI), hodnotami C‑reaktivního proteinu (CRP) i pozitivita antigenu HLA‑B27. Naproti tomu skóre BASDAI (Bath Ankylosing Spondylitis Disease Activity Index), jež odráží symptomy onemocnění, nikoliv nutně zánět, nemá v tomto směru výpovědní hodnotu. Extramuskuloskeletální projevy onemocnění jsou častější u ankylozující spondylitidy než u PsA a často jejich výskyt předchází propuknutí kloubního onemocnění. Nutnost zkrátit dobu od prvního příznaku k diagnóze u SpA podporují doklady o časnějším výskytu uveitidy u pacientů s axSpA při opoždění diagnózy axSpA [19].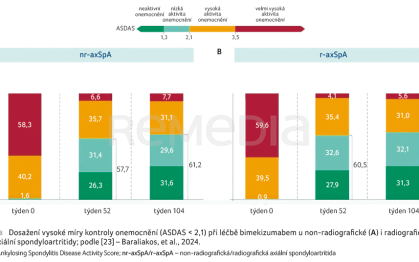
Přednášející připomněl, že remise není v běžné klinické praxi dosahováno s takovou frekvencí, jaká by byla žádoucí. Pouze zhruba 20 % pacientů se přiblíží hodnotám ASDAS definujícím remisi. Recentní práce z reálné klinické praxe doložila, že LDA dle hodnot ASDAS bylo dosaženo asi u 40 % léčených. Z řady prací vyplývá, že ženy obecně uvádějí více symptomů, ženské pohlaví je proto asociováno s nižší mírou dosažení LDA (bez ohledu na typ léčby) [20].
Biologická DMARDs i tsDMARDs prokázala v klinických hodnoceních svoji účinnost. Armamentarium léčiv indikovaných pro terapii pacientů s axSpA se v posledních desetiletích významně rozšířilo. Profesor Rudwaleit upozornil, že přímá (head‑to‑head) srovnání chybějí, nelze tedy říci, že jedno léčivo je lepší než druhé.
Selhání biologické terapie ovlivňuje řada faktorů. Může být zachyceno na podkladě objektivní aktivity a manifestace onemocnění při prohlídce u lékaře, prostřednictvím zvýšených hodnot CRP, jako zánětlivé léze na MRI nebo prostřednictvím výstupů hlášených pacienty (PROs). I zde může vznikat nesoulad mezi výsledky objektivního měření a pocity pacienta, např. přetrvávající bolest bez evidence zánětu. Pacientovo vnímání mohou ovlivnit i věk, míra vzdělanosti, pohlaví, komorbidity či ne/dostatek spánku.
Bimekizumab v terapii axSpA
V další části prezentace představil přednášející nový přípravek, který je možné využít v léčbě pacientů s axSpA – bimekizumab. K jeho schválení došlo v Evropě v roce 2023 na podkladě výsledků klinického hodnocení fáze IIb BE AGILE [21] a fáze III BE MOBILE 1 a 2 [22].
Bimekizumab prokázal rychlou a hlubokou míru kontroly onemocnění (ASDAS < 2,1) napříč spektrem pacientů trpících axSpA (radiografické [r‑axSpA] i non‑radiografické [nr‑axSpA] formy onemocnění) a data z dvouleté extenze potvrzují jeho setrvalou účinnost (graf 3A, B) [23].
Ještě dlouhodobější data poskytla extenze studie fáze II [24]. Po pěti letech dosahuje LDA stále 71,1 % pacientů (graf 4). Poolovaná data pacientů biologicky naivních i těch, u nichž selhala anti‑TNF terapie, rovněž dokládají vysokou míru odpovědí; po jednom roce léčby mírně vyšší u nemocných bez zkušenosti s anti‑TNF léčbou (62,0 %) oproti již dříve léčeným (54,1 %) [25].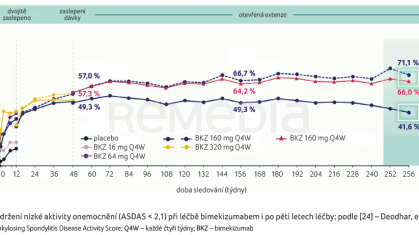
Bimekizumab poskytuje setrvalou účinnost u pacientů s r‑axSpA i nr‑axSpA [23]. Objektivní známky zánětu byly pro nr‑axSpA hodnoceny jako remise na MRI dle SPARCC SIJ (skóre Spondyloarthritis Research Consortium of Canada sakroiliakálních kloubů). Remise již v týdnu 16 dosáhlo 57,1 % pacientů, v týdnu 52, resp. 104 si ji udrželo 65,4 %, resp. 57,7 % pacientů [26]. Sledována byla rovněž bolest páteře (celková i noční) a u obou vedla terapie BKZ k setrvalému zlepšení po dobu 104 týdnů [27]. Profesor Rudwaleit dále prezentoval výsledky sledující vývoj entezitidy u pacientů léčených BKZ. Zhruba 50 % pacientů s r‑axSpA i nr‑axSpA dosáhlo vymizení entezitid (skóre MASES = 0) v týdnu 16 a tento efekt zůstal zachován i v týdnu 52 a 104 [23,28]. S dobrou účinností léčby je spojeno také výrazné zlepšení kvality života pacientů (dle ASQoL). Co se týče bezpečnosti léčby BKZ, obdobně jako v případě PsA i zde byly nejčastěji zaznamenanými nežádoucími účinky nazofaryngitida, infekce SARS‑CoV‑2, infekce horních cest dýchacích a orální kandidózy řešené obvykle topickou léčbou [29]. Bezpečnostní profil léčby je považován za příznivý. Poolovaná data z klinických hodnocení rovněž doložila nízkou incidenci uveitid při léčbě BKZ. V celém souboru pacientů léčených BKZ 160 mg každé čtyři týdny pak zůstala míra výskytu uveitid nízká (1,2/100 pacientoroků) [30].
Take home message
Optimální management PsA a axSpA by měl být veden časnou kontrolou zánětu, vymezením přísných léčebných cílů (stav remise či LDA), průběžným sledováním aktivity onemocnění a relevantních extramuskuloskeletálních manifestací jako určujícími faktory pro výběr terapie. Bimekizumab je prvním lékem, který selektivně inhibuje vedle IL‑17A také IL‑17F a nabízí tak možnost kontroly zánětu. V nových doporučených postupech je považován za nový mechanismus účinku. Výsledky klinického hodnocení fáze II a III s BKZ demonstrovaly rychlou, hlubokou a setrvalou kontrolu zánětu jak u PsA, tak u axSpa při příznivém bezpečnostním profilu léčby.
Literatura
[1] McInnes IB, Gravallese EM. Immune‑mediated inflammatory disease therapeutics: past, present and future. Nat Rev Immunol 2021; 21: 680–686.
[2] Ramiro S, Nikiphorou E, Sepriano A, et al. ASAS‑EULAR recommendations for the management of axial spondyloarthritis: 2022 update. Ann Rheum Dis 2023; 82: 19–34.
[3] Gossec L, Kerschbaumer A, Ferreira RJO, et al. EULAR recommendations for the management of psoriatic arthritis with pharmacological therapies: 2023 update. Ann Rheum Dis 2024; 83: 706–719.
[4] Schneeberger EE, Citera G, Nash P, et al. Comparison of disease activity index for psoriatic arthritis (DAPSA) and minimal disease activity (MDA) targets for patients with psoriatic arthritis: A post hoc analysis of data from phase 3 tofacitinib studies. Semin Arthritis Rheum 2023: 58: 152134.
[5] Dougados M, Sepriano A, Molto A, et al. Sacroiliac radiographic progression in recent onset axial spondyloarthritis: the 5‑year data of the DESIR cohort. Ann Rheum Dis 2017; 76: 1823–1828.
[6] Meng H, Lam SH, So H, Tam LS. Incidence and risk factors of major cardiovascular events in rheumatoid arthritis and psoriatic arthritis: A population‑based cohort study. Semin Arthritis Rheum 2024: 65: 152416.
[7] Shi LH, Lam SH, So H, et al. High inflammatory burden predicts cardiovascular events in patients with axial spondyloarthritis: a long‑term follow‑up study. Ther Adv Musculoskelet Dis 2022: 14: 1759720X221122401.
[8] Adams R, Maroof A, Baker T, et al. Bimekizumab, a Novel Humanized IgG1 Antibody That Neutralizes Both IL‑17A and IL‑17F. Front Immunol 2020; 11: 1894.
[9] Reich K, Warren RB, Lebwohl M, et al. Bimekizumab versus Secukinumab in Plaque Psoriasis. N Engl J Med 2021; 385: 142–152.
[10] Kokolakis G, Warren RB, Strober B, et al. Bimekizumab efficacy and safety in patients with moderate‑to‑severe plaque psoriasis who switched from adalimumab, ustekinumab or secukinumab: results from phase III/IIIb trials. Br J Dermatol 2023; 188: 330–340.
[11] Kaeley GS, Bakewell C, Deodhar A. The importance of ultrasound in identifying and differentiating patients with early inflammatory arthritis: a narrative review. Arthritis Res Ther 2020; 22: 1.
[12] Kerschbaumer A, Smole JS, O’Ferreira RJ, et al. Efficacy and safety of pharmacological treatment of psoriatic arthritis: a systematic literature research informing the 2023 update of the EULAR recommendations for the management of psoriatic arthritis. Ann Rheum Dis 2024; 83: 760–774.
[13] McInnes I, Asahina A, Coates LC, et al. Bimekizumab in patients with psoriatic arthritis, naive to biologic treatment: a randomised, double‑blind, placebo‑controlled, phase 3 trial (BE OPTIMAL). Lancet 2023; 401: 25–37.
[14] Merola JF, Landewé R, McInnes IB, et al. Bimekizumab in patients with active psoriatic arthritis and previous inadequate response or intolerance to tumour necrosis factor‑α inhibitors: a randomised, double‑blind, placebo‑controlled, phase 3 trial (BE COMPLETE). Lancet 2023; 401: 38–48.
[15] McInnes I, Mease PJ, Tanaka Y, et al. Bimekizumab efficacy and safety in biologig DMARD‑naive patients with psoriatic arthritis was consistent with or without methotrexate: 52‑week results from the phase 3 active‑reference study BE OPTIMAL. Ann Rheum Dis 2023; 82: 1133–1134.
[16] Ritchlin C, Coates LC, McInnes IB, et al. Bimekizumab treatment in biologic DMARD‑naïve patients with active psoriatic arthritis: 52‑week efficacy and safety results from the phase III, randomised, placebo‑controlled, active reference BE OPTIMAL study. Ann Rheum Dis 2023; 82: 1404–1414.
[17] Mease PJ, Poddubnyy D, Orbai AM, et al. Long‑term Safety and Tolerability of Bimekizumab in Patients with Axial Spondyloarthritis and Psoriatic Arthritis: Results from Pooled Phase 2b/3 Studies. Arthritis Rheumatol 2023; 75(suppl 9): Abstract 0511.
[18] Dougados M, Sepriano A, Molto A, et al. Sacroiliac radiographic progression in recent onset axial spondyloarthritis: the 5‑year data of the DESIR cohort. Ann Rheum Dis 2017; 76: 1823–1828.
[19] Michelena X, Zhao SS, Marco‑Pascual C, et al. Diagnostic delay is associated with uveitis and inflammatory bowel disease in AS: a study of extra‑musculoskeletal manifestations in SpA. Rheumatology (Oxford) 2024; 63: 430–435.
[20] Poddubnyy D, Sieper J, Akar S, et al. Females with Non‑Radiographic but Not with Radiographic Axial Spondyloarthritis Are Less Likely to Achieve Inactive Disease State Than Males: Results from a Multicountry Prospective Observational Study. Arthritis Rheumatol 2022; 74(Suppl. 9): Abstr. Nr. 1614.
[21] Baraliakos X, Deodhar A, Dougados M, et al. Safety and Efficacy of Bimekizumab in Patients With Active Ankylosing Spondylitis: Three‑Year Results From a Phase IIb Randomized Controlled Trial and Its Open‑Label Extension Study. Arthritis Rheumatol 2022; 74: 1943–1958.
[22] van der Heijde, Dougados A, Baraliakos X, et al. Efficacy and safety of bimekizumab in axial spondyloarthritis: results of two parallel phase 3 randomised controlled trials. Ann Rheum Dis 2023; 82: 515–526.
[23] Baraliakos X, Deodhar A, van der Heijde D, et al. Long‑term sustained efficacy and safety of bimekizumab across the full spectrum of axial spondyloarthritis: 2‑year results from two phase 3 studies. EULAR 2024: Poster 0806.
[24] Deodhar A, Navarro‑Compán V, Poddubnyy D, et al. Long‑Term Safety and Efficacy of Bimekizumab in Patients with Active Ankylosing Spondylitis: 5‑Year Results from a Phase 2b Study and Its Open‑Label Extension. Arthritis Rheumatol 2023; 75(Suppl 9): Abstr. Nr. 0519.
[25] Magrey M, van de Sande M, Breban M, et al. Bimekizumab Achieved Sustained Improvements in Efficacy Outcomes in Patients with Axial Spondyloarthritis, Regardless of Prior TNF Inhibitor Treatment: Week 52 Pooled Results from Two Phase 3 Studies. Arthritis Rheumatol 2023; 75(Suppl 9): Abstr. Nr. 0525.
[26] Baraliakos X, Deodhar A, van der Heijde D, et al. Bimekizumab treatment in patients with active axial spondyloarthritis: 52‑week efficacy and safety from the randomised parallel phase 3 BE MOBILE 1 and BE MOBILE 2 studies. Ann Rheum Dis 2024; 83: 199–213.
[27] Marzo‑Ortega H. EULAR 2024, Poster 0805.
[28] Ramiro S, Poddubnyy D, López‑Medina C. Resolution of enthesitis and peripheral arthritis with bimekizumab in patients with axial spondyloarthritis: week 52 results from the BE MOBILE 1 a BE MOBILE 2 phase 3 studies. Ann Rheum Dis 2023; 82(Suppl 1): 358–359.
[29] Mease PJ. Arthritis Rheumatol 2022; 74(suppl 9): 2.
[30] Rudwaleit M, Brown M, van Gaalen FA, et al. Low uveitis rates in patients with axial spondyloathritis treated with bimekizumab: pooled results from phase 2B/3 trials. Ann Rheum Dis 2023; 82(Suppl 1): 614–615.