Včasná diagnostika a léčba sekundární progrese roztroušené sklerózy
V rámci edukačního semináře Prime Time – Život v hlavní roli určeného pro lékaře z RS center prezentoval svůj příspěvek zaměřený na změny v léčbě sekundárně progresivní roztroušené sklerózy MUDr. Jan Kočica, Ph.D., (Neurologická klinika FN Brno a LF MU). Jak přednášející sdělil v úvodu, vysoce účinná terapie umožňuje upravovat léčbu pacientů, kteří při stávající léčbě progredují, s cílem oddálit sekundární progresi onemocnění. Avšak i pro pacienty v této fázi roztroušené sklerózy již existuje dostupná léčba.
„Nacházíme se na rozcestí a nový kurz nám určuje vysoce účinná terapie (high efficacy therapy, HET). Na konferenci ECTRIMS 2023 otevřel profesor Stephen Hauser velké téma – dvě různé trajektorie pacientů s roztroušenou sklerózou (RS). První se týká nemocných, kteří neměli možnost být léčeni HET, průběh jejich onemocnění byl plný relapsů a v určité fázi se stav těchto nemocných horšil i bez relapsů. U pacientů druhé trajektorie, kteří jsou léčeni vysoce efektivní medikací, se předpokládalo, že budou bez relapsů a bez progrese. Nicméně i u nich dochází k pozvolné progresi,“ uvedl téma MUDr. Kočica [1].
Mechanismy akumulace disability
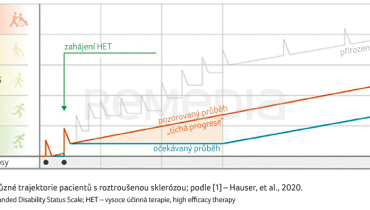 Fenomén pozvolné progrese disability byl popsán ve studii s pacienty léčenými natalizumabem, kteří mírně progredovali i přes průkaz minimální aktivity onemocnění [2]. Tento fenomén lze sledovat také v rámci studií OPERA I a II, přičemž pacienti léčení jak okrelizumabem, tak interferonem beta vykazovali akumulaci disability bez ohledu na přítomnost relapsů [1]. Tento jev byl popsán jako progrese nezávislá na relapsech (progression independent of relapse activity, PIRA) a kumulace reziduální aktivity po relapsech – zhoršení závislé na relapsech (relapse‑associated worsening, RAW), graf 1.
Fenomén pozvolné progrese disability byl popsán ve studii s pacienty léčenými natalizumabem, kteří mírně progredovali i přes průkaz minimální aktivity onemocnění [2]. Tento fenomén lze sledovat také v rámci studií OPERA I a II, přičemž pacienti léčení jak okrelizumabem, tak interferonem beta vykazovali akumulaci disability bez ohledu na přítomnost relapsů [1]. Tento jev byl popsán jako progrese nezávislá na relapsech (progression independent of relapse activity, PIRA) a kumulace reziduální aktivity po relapsech – zhoršení závislé na relapsech (relapse‑associated worsening, RAW), graf 1.
V roce 2022 byly publikovány dvě významné práce. Profesor Lublin s kolegy tvrdí, že PIRA je hlavním mechanismem akumulace disability u všech forem RS [3]. Další velká studie ukazuje, že PIRA jako známka chronického zánětu a neurodegenerace může být patrna již ve velmi raném stadiu RS a progresi lze chápat jako kontinuum změn [4]. „Dokonce se ukazuje, že disabilita byla patrna ještě před stanovením diagnózy roztroušené sklerózy,“ upozornil doktor Kočica. Podle výsledků studie, která využila jako zdroj dat kohortu pacientů z italského registru, je PIRA patrná již ve stadiu klinicky izolovaného syndromu [5].
Výsledky další kohortové studie naznačují, že u pacientů s RS je přítomnost PIRA po první demyelinizační příhodě poměrně častá a signalizuje nepříznivou dlouhodobou prognózu [6].
Co je sekundární progrese?
Ve světle poznatků, že RS progreduje od samého začátku, je nutné definovat sekundární progresi (SP‑RS), do níž se dostávají především pacienti, kteří nebyli léčeni HET. Johannes Lorscheider se spolupracovníky se pokusili vypracovat objektivní definici SP‑RS pomocí dat 17 356 pacientů z mezinárodní databáze MSBase. Nejprve na základě kombinace klinické progrese definované změnou skóre Expanded Disability Status Scale (EDSS) a funkčních podsystémů sestavili 576 různých definic přechodu do SP‑RS. Následně vybrali kohortu 200 pacientů, u kterých byla nezávisle třemi neurology na základě jejich klinického hodnocení určena konverze do SP‑RS (zde byla shoda ve 48 případech).
Na základě porovnání výsledků pak určili definici s největší přesností shody:
- progrese disability o 1 stupeň skóre EDSS u pacientů s EDSS ≤ 5,5 nebo o 0,5 stupně u pacientů s EDSS ≥ 6,0 (bez přítomnosti relapsu),
- minimální EDSS 4,0,
- postižení v pyramidovém funkčním systému minimálně stupně 2,
- potvrzená progrese za tři měsíce (včetně konfirmace postižení pyramidového funkčního systému).
Konsenzus diagnózy sekundární progrese s nezávislými hodnotiteli je 87 %, ale definuje pacienty jako SP‑RS o tři roky dříve. Tato definice má potenciál užití zejména v klinických studiích [7].
Proč se obáváme sekundární progrese?
Konverze do sekundární progrese má špatnou prognózu, přičemž 50–70 % pacientů bez léčby progreduje do SP‑RS po 15–25 letech, ale až 40 % pacientů progreduje během 6–10 let od prvních projevů nemoci. Více než 90 % pacientů vyžaduje do tří let od konverze do SP‑RS pomoc při chůzi, až 80 % pacientů má alespoň lehký kognitivní deficit, kumulují se u nich deprese, bolest, únava a poruchy sfinkterů [8]. Značně limitován je i efekt stávajících léčebných možností.
Nejčastější klinické projevy sekundární progrese
Nejvýznamnější roli u pacientů v sekundární progresi hrají poruchy chůze a spasticita, protože chůze nejvíce ovlivňuje skóre EDSS. Sekundární progresi není nikdo schopen jednoznačně predikovat a diagnóza SP‑RS se stanovuje retrospektivně i s přihlédnutím k sebeposouzení pacientem.
K dalším klinickým symptomům patří poruchy kognitivních funkcí, deprese a úzkost, poruchy polykání, bolest (končetinová neuropatická), patologická únava, sfinkterové potíže, sexuální dysfunkce. „Pro verifikaci těchto potíží můžeme využít celou řadu validovaných dotazníků. Skóre EDSS nemusí být úplně ideálním parametrem kvantifikace postižení, protože plně neodráží kognitivní funkce ani poruchy zraku, které mohou být u pacientů výrazné a mohou v čase progredovat. Sekundární progrese je spjata s mnoha dalšími komorbiditami, pacienti často mají bolesti zad, hypertenzi, diabetes mellitus nebo cévní rizika, a navíc mohou mít další kognitivní deficit, který není nutně vázán na roztroušenou sklerózu,“ upozornil MUDr. Kočica.
Jak vyšší skóre EDSS a pro RS charakteristické potíže, tak komorbidity jsou důvodem úvah o paliativní, případně multidisciplinární péči, respektive o zařazení pacienta do specifických léčebných programů mimo neurologii.
Aktivní forma sekundární progrese
Aktivní forma sekundární progrese byla definována jako výskyt klinických relapsů anebo radiografické progrese na magnetické rezonanci: výskyt nových/zvětšujících se T2 lézí nebo gadolinium enhancujících lézí v předchozích pěti letech [9].
 Lublinova definice (tab. 1) [10] se promítla do úhradových kritérií pro léčbu siponimodem. Kritéria ještě následně upravil (zjednodušil) profesor Ziemssen [11].
Lublinova definice (tab. 1) [10] se promítla do úhradových kritérií pro léčbu siponimodem. Kritéria ještě následně upravil (zjednodušil) profesor Ziemssen [11].
Celosvětová data o SP‑RS
K dispozici je vícero studií, které popisují konverzi z relabující‑remitující RS (RR‑RS) do SP‑RS. Starší práce (2002) prokazuje, že neléčení pacienti v 90 % přejdou do 25 let do sekundární progrese [12]. Podle další studie s neléčenými pacienty konvertuje 62 % nemocných z RR‑RS do SP‑RS do věku 75 let. Průměrný věk při prvních projevech SP‑RS byl 45 let [13]. Každý čtvrtý léčený pacient ve věku mezi 37–45 lety přechází do 10 let do sekundárně progresivní fáze [14]. Poměrně recentní studie (s 11 926 pacienty) ukazuje, že medián doby do přestupu do sekundární progrese je 32,4 roku od prvních projevů RS [15].
Rizikové faktory konverze do SP‑RS
K ovlivnitelným faktorům spojeným s časnějším nástupem SP‑RS patří kouření, obezita, cévní komorbidity, diabetes mellitus a nízká koncentrace vitaminu D.
Neovlivnitelnými rizikovými faktory jsou vysoký objem T2 hyperintenzních lézí, vysoký počet T1 hypointenzních lézí, kortikální léze, léze v mozkovém kmeni, spinální léze a významná atrofie míchy (zejména horní krční) a talamu při stanovení diagnózy RS. S časnějším nástupem SP‑RS je spojeno mužské pohlaví, vyšší věk v době prvních příznaků RS, neúplné zotavení z první ataky (RAW), vysoká četnost relapsů po nástupu RS a polyfokální klinická manifestace včetně klinických příznaků postižení míchy [16].
Významným rizikovým faktorem je pozdní nasazení HET v přítomnosti nepříznivých prognostických faktorů, což potvrzují recentní studie [17,18].
Nedávno uveřejněná multicentrická observační kohortová studie s 10 692 pacienty s RR‑RS prokázala, že časná PIRA vede k 1,5krát vyššímu kumulativnímu riziku konverze do SP‑RS. Každá ataka s přetrvávajícím deficitem (RAW) vede k 2,5násobnému riziku konverze do SP‑RS. Studie však neprokázala snížení rizika konverze pro časnou PIRA při brzkém zahájení léčby, ale prokázala snížení rizika konverze o 10 % v případě RAW při brzkém zahájení léčby. HET redukuje (alespoň o 10 %) riziko konverze do SP‑RS i bez ovlivnění PIRA [19].
Do studie, která byla prezentována na konferenci ACTRIMS/ECTRIMS 2023 v Miláně, bylo zařazeno 2 237 pacientů s RR‑RS (ze 72 874 osob vybraných z registrů), nejčetněji léčených natalizumabem, fingolimodem, okrelizumabem a ofatumumabem, méně často kladribinem a jeden nemocný léčený alemtuzumabem, přičemž 59,2 % nemocných mělo stále stejnou HET po dobu (pokračujícího) desetiletého sledování. K výsledkům této studie patřil poznatek, že koncepty NEDA (no evidence of disease activity) ani MEDA (minimal evidence of disease activity) nejsou dobrými prediktory konverze do SP‑RS, zatímco PIRA a RAW ano.
Při včasném zahájení HET dospělo do SP‑RS za 10 let 8 % pacientů. Polovina pacientů s PIRA nebo RAW v prvních dvou letech léčby dospěla do SP‑RS do 10 let. Rizikovými faktory byly mužské pohlaví a EDSS ≥ 3 při zahájení HET [20].
Které biomarkery lze použít k rozpoznání pomalé progrese či chronické fáze?
Už bylo zmíněno, že EDSS nemusí být dostatečně senzitivním markerem. V novějších studiích se zohledňuje:
- test rychlosti chůze (test chůze na 25 stop, Timed‑25 Foot Walk, 25FWT),
- měření kognitivních funkcí (Single Digit Modalities Test, SDMT; baterie Paced Auditory Serial Addition Test, PASAT apod.), test jemné motoriky horních končetin (Nine‑Hole Peg Test, 9HPT),
- nálezy na magnetické rezonanci (MRI): pomalu se rozšiřující léze (slowly expanding lesions, SEL), léze s paramagnetickým lemem (paramagnetic rim lesions, PRL); přítomnost obou typů lézí je významným nepříznivým faktorem,
- nález na optické koherentní tomografii (OCT), progresivní ztráty vrstvy nervových vláken sítnice (retinal nerve fiber layer, RNFL),
- v poslední době i koncentrace lehkých řetězců neurofilament a zvýšená koncentrace gliálního fibrilárního acidického proteinu (glial fibrillary acidic protein, GFAP).
Jak komunikovat s pacientem o konverzi do SP‑RS?
Od prvního podezření na SP‑RS uplynou až čtyři roky do potvrzení sekundární progrese, což představuje pro vyšší desítky procent pacientů období nejistoty. Podle německo‑italské studie nebylo více než 40 % recentně diagnostikovaných pacientů informováno o své nemoci [21].
Zdravotníci se setkávají s obtížemi při diagnostice pro absenci obecně přijaté definice, pro heterogenní projevy SP‑RS, pro nejasné klinické rysy a absenci zobrazovacích nebo sérových biomarkerů.
„Pacientovi je nutné už od stanovení diagnózy roztroušené sklerózy říkat, že existuje progrese onemocnění, a to i v nepřítomnosti relapsů a od počátku choroby,“ doporučil MUDr. Kočica.
Léčba v sekundární progresi
V současnosti probíhá řada studií, ale v roce 2024 ještě neexistuje léčba na „neaktivní“ formu sekundární progrese. Fampridin představuje symptomatickou léčbu ke zlepšení chůze.
V České republice je schválen a hrazen léčivý přípravek siponimod (Mayzent). Jde o selektivní modulátor sfingosin‑1‑fosfátových receptorů S1P1 a S1P5, který brání výstupu aktivovaných T lymfocytů z lymfatických uzlin a jejich vstupu do centrálního nervového systému, kde spouštějí kaskádu dějů vedoucích nejen k neurodegeneraci.
Stávající úhradová kritéria siponimodu (indikační omezení úhrady podle SÚKL)
- vstupní hodnota EDSS 4,0–6,5,
- prokázaná progrese disability o minimálně 1 stupeň EDSS u pacientů se vstupní hodnotou EDSS do 5,5 či o 0,5 stupně u pacientů se vstupní hodnotou EDSS nad 5,5 stupně,
- minimální doba trvání progrese disability šest měsíců nezávisle na relapsech,
- aktivní onemocnění s prokázanými relapsy (v průběhu předchozích dvou let před zahájením léčby siponimodem) nebo se zánětlivou aktivitou na MRI mozku (tj. gadolinium enhancující T1 léze nebo nová nebo zvětšující se T2 léze),
- při přetrvávající klinické aktivitě onemocnění (více než jeden relaps) je možné přehodnotit průběh nemoci a pacienta převést na léčbu jinou léčivou látkou eskalační linie léčby RR‑RS, která nebyla použita v předchozí léčebné linii,
- léčba není dále hrazena při ztrátě schopnosti chůze, tedy dosažení hodnoty EDSS 7,0 stupně a více.
Siponimod má podporu v pětiletých datech [22]. Je schopen snížit akumulaci disability o 29 % oproti placebu, což znamená, že za každé dva roky léčby siponimodem došlo k oddálení progrese o více než jeden rok. Siponimod je v současnosti jediným léčivým přípravkem schváleným pro léčbu aktivní formy SP‑RS.
Take home messages
- Včasné nasazení vysoce účinné léčby (HET) snižuje obecně na relapsech závislou progresi (RAW) a oddaluje tak přechod do sekundární progrese.
- Progrese, zejména na relapsech nezávislá (PIRA), je vůdčím problémem pacientů s RS (bez ohledu na jejich fázi onemocnění):
- je trvalou součástí onemocnění, kterou je třeba sledovat,
- EDSS nemusí ke sledování stačit a je vhodné využít i jiných dotazníků či testů k pravidelnému sledování,
- je třeba progresi tlumočit i pacientům.
- Přesun pacientů do sekundární progrese (SP‑RS) je nejspíše součástí onemocnění a je třeba na změnu reagovat co nejdříve, pakliže jsou navíc přítomny známky aktivity:
- klinicky relevantní relapsy (tedy známky potenciálně ovlivnitelné RAW),
- progrese na MRI.
- Siponimod má data (i pětiletá), která dokazují, že zpomaluje progresi v rámci aktivní sekundární progrese.
Literatura
[1] Hauser SL, Cree BAC. Treatment of Multiple Sclerosis: A Review. Am J Med 2020; 133: 1380–1390.e2.
[2] Kappos L, Butzkueven H, Wiendl H, et al. Tysabri Observational Program (TOP) Investigators. Greater sensitivity to multiple sclerosis disability worsening and progression events using a roving versus a fixed reference value in a prospective cohort study. Mult Scler 2018; 24: 963973.
[3] Lublin FD, Häring DA, Ganjgahi H, et al. How patients with multiple sclerosis acquire disability. Brain 2022; 145: 3147–3161.
[4] Kuhlmann T, Moccia M, Coetzee T, et al. Multiple sclerosis progression: time fora new mechanism‑driven framework. Lancet Neurol 2023; 22: 78–88.
[5] Portaccio E, Bellinvia A, Fonderico M, et al. Progression is independent of relapse activity in early multiple sclerosis: a real‑life cohort study. Brain 2022; 145: 2796–2805.
[6] Tur C, Carbonell‑Mirabent P, Cobo‑Calvo A, et al. Association of Early Progression Independent of Relapse Activity With Long‑term Disability After a First Demyelinating Event in Multiple Sclerosis. JAMA Neurol 2023; 80: 151–160.
[7] Lorscheider J, Buzzard K, Jokubaitis V, et al. Defining secondary progressive multiple sclerosis. Brain 2016; 139: 2395–2405.
[8] Kappos L, Wolinsky JS, Giovannoni G, et al. Contribution of Relapse‑Independent Progression vs Relapse‑Associated Worsening to Overall Confirmed Disability Accumulation in Typical Relapsing Multiple Sclerosis in a Pooled Analysis of 2 Randomized Clinical Trials. JAMA Neurol 2020; 77: 1132–1140.
[9] Mathey G, Ancel T, Garot T, et al. Clinical and radiological activity of secondary progressive multiple sclerosis in a population‑based cohort. Eur J Neurol 2021; 28: 2238–2248.
[10] Lublin FD, Coetzee T, Cohen JA, et al. The 2013 clinical course descriptors for multiple sclerosis: A clarification. Neurology 2020; 94: 1088–1092.
[11] Ziemssen T, Bhan V, Chataway J, et al. Secondary Progressive Multiple sclerosis: Review of Clinical Characteristics, Definition, Prognostic Tool, and Disease Modifying Therapies. Neurol Neuroimmunol Neuroinflamm 2022; 10: e200064.
[12] Rice G. The natural history of secondary progressive multiple sclerosis: observations from the London study group. Mult Scler J 2002; 8: 81–82.
[13] Tutuncu M, Tang J, Zeid NA, et al. Onset of progressive phase is an age‑dependent clinical milestone in multiple sclerosis. Mult Scler J 2013; 19: 188–198.
[14] Bsteh G, Ehling R, Lutterotti A, et al. Long term clinical prognostic factors in relapsing‑remitting multiple sclerosis: insights from a 10‑year observational study. PLoS One 2016; 11: e0158978.
[15] Graf J, Leussink VI, Soncin G, et al. Relapse‑independent multiple sclerosis progression under natalizumab. Brain Commun 2021; 3: fcab229.
[16] Larochelle C, Uphaus T, Prat A, Zipp F. Secondary progression in multiple sclerosis: neuronal exhaustion or distinct pathology? Trends Neurosci 2016; 39: 325–339.
[17] Brown JWL, Coles A, Horakova D, et al. Association of Initial Disease‑Modifying Therapy With Later Conversion to Secondary Progressive Multiple Sclerosis. JAMA 2019; 321: 175–187.
[18] Cobo‑Calvo A, Tur C, Otero‑Romero S, et al. Association of Very Early Treatment Initiation With the Risk of Long‑term Disability in Patients With a First Demyelinating Event. Neurology 2023; 101: e1280–e1292.
[19] Dzau W, Sharmin S, Patti F, et al. Risk of secondary progressive multiple sclerosis after early worsening of disability. J Neurol Neurosurg Psychiatry 2023; 94: 984–991.
[20] Cohen M, Rollot F, Debouverie M, et al. Silent Progression Despite Early Highly Active Treatment in MS. The SPAM Study. 9th Joint ECTRIMS‑ACTRIMS meeting, Oct 2023, Milan, Italy. Dostupné na: https://www.crc‑sep‑nice.com/fr/education‑therapeutique/actualites/id‑57‑ectrims‑msmilan2023
[21] Solari A, Giovannetti AM, Giordano A, et al.Conversion to secondary progressive multiple sclerosis: patient awareness and needs. Results from an online survey in Italy and Germany. Front Neurol 2019; 10: 916.
[22] Giovannoni G, Kappos L, Fox RJ, et al. Sustained reduction of disability and cognitive decline with long‑term siponimod treatment in patients with active SPMS: EXPAND data up to 5 years. Poster presented at: 8th Joint ACTRIMS‑ECTRIMS Congress; September 11–13, 2020; MS Virtual 2020. P0238.