Castlemanova choroba není benigní onemocnění
S Castlemanovou chorobou se mohou setkat lékaři všech specializací, kteří řeší příčinu tzv. uzlinového syndromu. Unicentrická forma tohoto progresivního lymfoproliferativního onemocnění postihuje jednu lymfatickou uzlinu nebo skupinu uzlin, multicentrická více skupin uzlin. Závažnost idiopatické multicentrické Castlemanovy choroby se obecně podceňuje, ale jak ukazují mortalitní data, jde o vážné a bez léčby progredující až fatální onemocnění.
Castlemanova choroba je progresivní lymfoproliferativní onemocnění. Unicentrická forma (UCD) postihuje jednu lymfatickou uzlinu nebo jednu skupinu uzlin nejčastěji v oblasti břicha a krku a obvykle se léčí chirurgickou excizí [1–3]. U 10–13 % pacientů je UCD neresekovatelná nebo po excizi dojde k recidivě a zde by měla být léčena jako multicentrická forma (MCD) [2,4]. Multicentrická forma postihuje více skupin lymfatických uzlin nejčastěji v oblasti krku, mediastina, axily a břicha. Častěji bývá provázena symptomy, včetně zánětlivých a B symptomů (teplota nad 38 °C, noční pocení, hmotnostní úbytek více než 10 % za 6 měsíců). Nesprávná léčba MCD je běžná a vede k progresi onemocnění [2].
Typy Castlemanovy choroby ve vztahu k celkovému přežití
Typ Castlemanovy choroby určuje celkovou míru přežití [3]. U MCD je doložena vyšší úmrtnost než u mnoha běžných druhů onkologických onemocnění postihujících měkké tkáně a lymfomů, včetně kolorektálního karcinomu ve stadiu II, karcinomu prsu ve stadiu III a progresivního non‑Hodgkinova lymfomu [5]. Idiopatická MCD (iMCD) zahrnuje více než 50 % případů MCD, nemá vztah k infekci virem lidské imunodeficience/lidským herpesvirem 8 (HIV/HHV‑8) a pacienti s touto formou reagují na léčbu odlišně [2]. Non‑idiopatická MCD bývá sekundární k infekci HIV/HHV‑8 a léčí se v rámci syndromu POEMS (Polyneuropathy, Organomegaly, Endocrinopathy, Monoclonal Gammopathy, and Skin changes) [1].
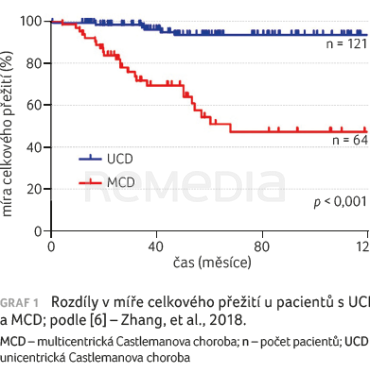 Pacienti s MCD v dlouhodobém horizontu vždy vykazovali nižší celkové přežití [6]. Retrospektivní analýza 185 HIV negativních pacientů s Castlemanovou chorobou odhalila, že pacienti s MCD mají významně horší prognózu. Pětileté celkové přežití u pacientů s UCD bylo 93,6 % ve srovnání s 51,2 % u pacientů s MCD (p < 0,001), graf 1 [6]. Starší studie zahrnovaly i pacienty s iMCD do celé skupiny MCD kvůli absenci testování na HIV/HHV‑8.
Pacienti s MCD v dlouhodobém horizontu vždy vykazovali nižší celkové přežití [6]. Retrospektivní analýza 185 HIV negativních pacientů s Castlemanovou chorobou odhalila, že pacienti s MCD mají významně horší prognózu. Pětileté celkové přežití u pacientů s UCD bylo 93,6 % ve srovnání s 51,2 % u pacientů s MCD (p < 0,001), graf 1 [6]. Starší studie zahrnovaly i pacienty s iMCD do celé skupiny MCD kvůli absenci testování na HIV/HHV‑8.
Důvodem tohoto stavu je především to, že donedávna pro iMCD neexistovala žádná diagnostická kritéria ani léčebné možnosti. Idiopatická MCD je vzácné onemocnění s roční incidencí ve Spojených státech amerických nižší než 1 000 pacientů [7]. Jde o komplexní onemocnění s mnoha podtypy a různorodým klinickým obrazem. Současný výzkum iMCD je založen na výsledcích několika publikovaných systematických studií. Nedostatek údajů z reálné praxe však ztěžuje přístup k informacím o léčebných odpovědích u pacientů mimo klinické studie [7]. Nepodávání léčby či její pozdní zahájení nebo nesprávná terapie přispívaly v minulosti ke špatným klinickým výsledkům [2].
Obtíže při diagnostice iMCD
Diagnostika iMCD je obtížná z důvodu symptomů překrývajících se s jinými malignitami a infekcemi. Mezi iMCD, jinými malignitami, autoimunitními a infekčními chorobami existuje významný klinický, histologický a imunologický přesah [8]. Zásadní je správný diagnostický postup, včetně excize celé lymfatické uzliny/uzlin pro histopatologické vyšetření [7,9]. Projevy iMCD se mohou lišit a variovat od mírných celkových flu‑like symptomů až po život ohrožující cytokinovou bouři, selhání orgánů a smrt [7,8,10].
Časté klinické příznaky iMCD
Pro redukci mortality je nezbytná okamžitá diagnóza a léčba. Stanovení diagnózy je často opožděno, protože se jedná o vzácné onemocnění s nejasnými klinickými příznaky [11].
Systematický přehled, který zahrnul 128 pacientů s potvrzenou iMCD, analyzoval běžné klinické příznaky a identifikoval časté projevy [10]:
- Generalizovanou lymfadenopatii mělo 100 % pacientů.
- Flu‑like syndrom – febrilie se vyskytly u 26–52 % pacientů.
- Noční pocení bylo pozorováno u 10–62 % pacientů.
- Nezamýšlený úbytek hmotnosti udávalo 16–72 % pacientů.
- Edém, ascites a anasarka se vyskytly u 23–78 % pacientů.
- Hepato‑ a/nebo splenomegalie byly diagnostikovány u 33–78 % pacientů.
Život ohrožující příznaky iMCD
Mezi život ohrožující příznaky tohoto onemocnění patří [2,7, 8,10,12,13]:
- anasarka a pancytopenie,
- neurologické příznaky: kóma, křeče, cévní mozkové příhody,
- multiorgánové selhání.
Nedávná analýza 31 pacientů s iMCD ukázala progresi u všech neléčených nemocných s nezávažnou iMCD (8 z 8). V případě iMCD existuje trojnásobně zvýšené riziko přítomnosti malignity, především lymfomu.
Příznaky iMCD jsou spojeny s nadprodukcí interleukinu 6
Dysregulovaná nepřetržitá produkce interleukinu 6 (IL‑6) hraje patologickou roli (kromě jiných onemocnění) také u iMCD [14,15].
- Hypergamaglobulinemie: nadměrná stimulace B lymfocytů vede k proliferaci plazmatických buněk, které produkují protilátky odpovědné za nadprodukci protilátek [14,15].
- Renální dysfunkce: proliferace mezangiálních buněk a nadprodukce matrix jsou charakteristické rysy glomerulárních onemocnění a IL‑6 byl identifikován v depozitech matrix [15].
- Malignita: IL‑6 působí jako růstový faktor pro hybridomové a myelomové buňky.
- Angiogeneze a osteoporóza: stromální buňky kostní dřeně produkují IL‑6, jenž stimuluje receptorový aktivátor ligandu NFkB (RANKL), který je nezbytný pro diferenciaci a aktivaci osteoklastů. Tyto pochody vedou ke kostní resorpci a osteoporóze. Interleukin 6 také indukuje produkci vaskulárního endotelového růstového faktoru (VEGF), což má za následek angiogenezi a zvýšenou vaskulární permeabilitu – patologické znaky onkologických a zánětlivých lézí v synoviálních tkáních revmatoidní artritidy [15].
- Ztráta imunitní suprese: specifické efektorové Th17 lymfocyty eliminují extracelulární patogeny a IL‑6 indukovaná dominance Th17 lymfocytů nad regulačními T lymfocyty může být zodpovědná za narušení imunitní tolerance, která se podílí na rozvoji autoimunitních a zánětlivých onemocnění [15].
- Akutní fáze zánětlivé reakce: IL‑6 stimuluje hepatocyty k produkci proteinů akutní fáze, jež představují C‑reaktivní protein, sérový amyloid A, fibrinogen, hepcidin a alfa1 antichymotrypsin, a snižuje produkci fibronektinu, albuminu a transferinu [15].
- Trombocytóza: IL‑6 stimuluje megakaryocyty k produkci krevních destiček. To v důsledku vede k trombocytóze.
- Tvorba multipotenciálních kolonií: IL‑6 aktivuje hematopoetické kmenové buňky, což vede k tvorbě multipotenciálních kolonií.
Léčebný algoritmus pro iMCD
Pro nedostačené povědomí lékařů o iMCD vytvořila mezinárodní skupina odborníků Castleman Disease Collaborative Network (CDCN) léčebný algoritmus založený na nejnovějších důkazech o iMCD (na základech medicíny založené na důkazech, EBM) [7,16]. Kategorie důkazů a konsenzů byly navrženy podle kategorií National Comprehensive Cancer Network (NCCN).
Zde uvádíme jen stručný výtah, protože některé léčivé přípravky, jež mají registraci amerického Úřadu pro kontrolu potravin a léčiv (FDA), v Evropské unii schválení v indikaci léčby iMCD postrádají.
Pro dysregulaci produkce IL‑6 u iMCD je doporučena anti‑IL‑6 terapie jako léčba první volby. Siltuximab je doporučen jako první linie léčby mírné i závažné iMCD (síla důkazů 1A). Nedoporučuje se převedení na jinou anti‑IL‑6 monoklonální protilátku, pokud pacient nereaguje na siltuximab.
Tocilizumab není schválen pro léčbu iMCD, nicméně jeho podání bylo sledováno v zemích, kde siltuximab není dostupný (důkaz kategorie 2A).
Rituximab se doporučuje jako druhá linie po selhání terapie anti-IL‑6 a může být kombinován s kortikosteroidy a/nebo s imunomodulačními/imunosupresivními látkami. Může to být alternativní možnost pro některé mírné formy iMCD bez výrazné symptomatologie způsobené nadprodukcí IL‑6. Rituximab však obvykle neposkytuje dlouhodobou kontrolu iMCD a relapsy jsou běžné [17].
U pacientů se závažnou iMCD s nedostatečnou odpovědí na terapii anti-IL‑6 lze vyzkoušet kombinovanou chemoterapii. Kortikosteroidy jsou užitečnou doplňkovou terapií a dávku lze upravit podle závažnosti onemocnění, ale nedoporučují se jako samostatná léčba iMCD [16].
Benefity cílené léčby iMCD
Historické studie a nedávná analýza pacientů s iMCD léčených tradiční a necílenou terapií ukazují průměrné pětileté přežití 65 % [11,18]. Naproti tomu nedávná dlouhodobá studie u pacientů s iMCD léčených cílenou léčbou anti‑IL‑6 prokázala pětileté přežití u 96,4 % nemocných [11]. Pacienti s iMCD léčení anti‑IL‑6 monoklonální protilátkou vykazují delší přežití i delší dobu do progrese onemocnění [11,18].
Pouhé pozorování (watch and wait), které se historicky používalo u pacientů s nezávažnou formou onemocnění, poskytuje nulovou míru dosažení kompletní odpovědi (complete response, CR) u iMCD [2,18]. Chemoterapie nebo léčba kortikosteroidy poskytly 16% podíl CR. Monoterapie kortikosteroidy není doporučena pro léčbu iMCD, ale může být užitečnou doplňkovou terapií [7,18]. Bylo prokázáno, že režimy obsahující rituximab mají 20–33% podíl CR, včetně údajů z nedávné studie z Číny. U většiny pacientů s iMCD se však rituximab jako terapie první volby nedoporučuje [2,7,17]. Terapie anti‑IL‑6 monoklonální protilátkou je doporučena jako první linie u pacientů s mírnou i závažnou iMCD a vykazuje u 43 % nemocných CR a u 85 % osob CR/stabilizaci onemocnění [7,11]. Nedávná analýza výsledků 31 pacientů ukázala progresi u všech neléčených nemocných s nezávažnou iMCD (8 z 8) a prodloužené přežití bez progrese (PFS) u nemocných léčených anti‑IL‑6 terapií [2].
Proč se zlepšily klinické výsledky u iMCD
Byly zveřejněny pokyny pro diagnostiku a léčbu Castlemanovy choroby [7], včetně zařazení anti‑IL‑6 přípravků na první místo v léčebném algoritmu [2,11]. Vzácným onemocněním včetně iMCD je obecně věnováno více pozornosti a podpory [19]. Roste počet publikovaných studií a je k dispozici více dat z reálné praxe [11]. V neposlední řadě se rovněž zlepšila diagnostika onemocnění, a to včetně upřesnění kritérií léčebné odpovědi [20].
Literatura
[1] Fajgenbaum DC. Novel insights and therapeutic approaches in idiopathic multicentric Castleman disease. Blood 2018; 132: 2323–2330.
[2] Yu L, Tu M, Cortes J, et al. Clinical and pathological characteristics of HIV‑ and HHV‑8‑negative Castleman disease. Blood 2017; 129: 1658–1668.
[3] Kaur H, Xiang Z, Kunthur A, Mehta P. Castleman Disease. Federal practitioner: for the health care professionals of the VA, DoD, and PHS 2015; 32(Suppl 7): 41s–46s.
[4] Mohan M, Meek JC, Meek ME, et al. Treatment of unresectable unicentric Castleman Disease with therapeutic embolization. Blood 2018; 132(Suppl 1): 2415.
[5] NCCN. Clinical Practice Guidelines in Oncology: B‑Cell Lymphomas, 2019. Dostupné na: https://www.nccn.org
[6] Zhang X, Rao H, Xu X, et al. Clinical characteristics and outcomes of Castleman disease: A multicenter study of 185 Chinese patients. Cancer Sci 2018; 109: 199–206.
[7] van Rhee F, Voorhees P, Dispenzieri A, et al. International, evidence‑based consensus treatment guidelines for idiopathic multicentric Castleman disease. Blood 2018; 132: 2115–2124.
[8] Fajgenbaum DC, Uldrick TS, Bagg A. International, evidence‑based consensus diagnostic criteria for HHV‑8–negative/idiopathic multicentric Castleman disease. Blood 2017; 129: 1646–1657.
[9] Navrátil M. Uzlinový syndrom, praktické poznámky k diferenciální diagnostice a diagnostickému postupu. Interní Med 2003; 1: 27.
[10] Liu AY, Nabel CS, Finkelman BS, et al. Idiopathic multicentric Castlemanʼs disease: a systematic literature review. Lancet Haematol 2016; 3: e163–e175.
[11] Sitenga J, Aird G, Ahmed A, Silberstein PT. Impact of siltuximab on patient‑related outcomes in multicentric Castlemanʼs disease. Patient Relat Outcome Meas 2018; 9: 35–41.
[12] van Rhee F, Stone K, Szmania S, et al. Castleman disease in the 21st century: An update on diagnosis, assessment, and therapy. Clin Adv Hematol Oncol 2010; 8: 486–498.
[13] El‑Osta HE, Kurzrock R. Castlemanʼs disease: from basic mechanisms to molecular therapeutics. Oncologist 2011; 16: 497–511.
[14] Yoshizaki K, Murayama S, Ito H, Koga T. The role of interleukin‑6 in Castleman disease. Hematol Oncol Clin North Am 2018; 32: 23–26.
[15] Tanaka T, Kishimoto T. The biology and medical implications of interleukin‑6. Cancer Immunol Res 2014; 2: 288–294.
[16] Castleman Disease Collaborative Network: iMCD Treatment Targets. Dostupné na: https://cdcn.org/physicians‑researchers/imcd‑treatment‑targets [navštíveno 12/2019].
[17] Dong Y, Zhang L, Nong L, et al. Effectiveness of rituximab‑containing treatment regimens in idiopathic multicentric Castleman disease. Ann Hematol 2018; 97: 1641–1647.
[18] Dispenzieri A, Armitage JO, Loe MJ, et al. The clinical spectrum of Castlemanʼs disease. Am J Hematol 2012; 87: 997–1002.
[19] Fajgenbaum DC, Ruth JR, Kelleher D, Rubenstein AH. The collaborative network approach: a new framework to accelerate Castlemanʼs disease and other rare disease research. Lancet Haematol 2016; 3: e150–152.
[20] Pierson SK, Katz L, Nabel CS, et al. Quantitative Changes in Serum Proteins Including CXCL13 Are Early Indicators of Response to Anti‑IL6 Therapy in Idiopathic Multicentric Castleman Disease. Blood 2019; 134(Suppl 1): 3599.
Státní ústav pro kontrolu léčiv rozhodl o úhradě léčby siltuximabem (Sylvant) v indikaci multicentrické Castlemanovy choroby.
SÚKL stanovil přípravku v silách 100 mg a 400 mg úhradu ze zdravotního pojištění a zařadil jej do skupiny v zásadě terapeuticky zaměnitelných léčivých přípravků s obsahem léčivé látky siltuximab pro léčbu pacientů se symptomatickou idiopatickou multicentrickou Castlemanovou chorobou. Siltuximab je hrazen v terapii dospělých pacientů s multicentrickou formou Castlemanovy choroby, kteří jsou negativní na virus lidské imunodeficience (HIV) a lidský herpesvirus 8 (HHV‑8). Léčba je hrazena do selhání léčby nebo do nepřijatelné toxicity.
Preskripce s úhradou je omezena na specializovaná pracoviště.
Zdroj: SÚKL č. j. sukl216902/2024 ze dne 28. 8. 2024; https://www.sukl.cz