Denosumab v léčbě osteoporózy – účinek na kortikální kost
Denosumab je nový přípravek určený k léčbě osteoporózy, plně humánní monoklonální protilátka IgG2, která se specificky a s vysokou afinitou váže na RANK ligand, čímž zabraňuje formaci osteoklastů, inhibuje jejich funkci a zkracuje jejich přežívání. Zavedení denosumabu do klinické praxe představuje významný předěl v léčbě osteoporózy. Zásadní význam pro integritu skeletu má kortikální kost a pevnost kortikální kosti je rozhodujícím faktorem vzniku zlomeniny. V následujícím přehledu dosud publikovaných klinických studií se budeme zabývat především účinkem denosumabu na kortikální kost.
Úvod
Osteoporóza představuje významný medicínský i společenský problém – je považována za jedno z nejvíce invalidizujících a finančně náročných onemocnění v Evropě.Léčivem s unikátním mechanismem účinku určeným k léčbě osteoporózy je denosumab. V předkládaném přehledu se budeme zabývat především účinkem denosumabu na kortikální kost.
Mikroskopická anatomie kostní tkáně
K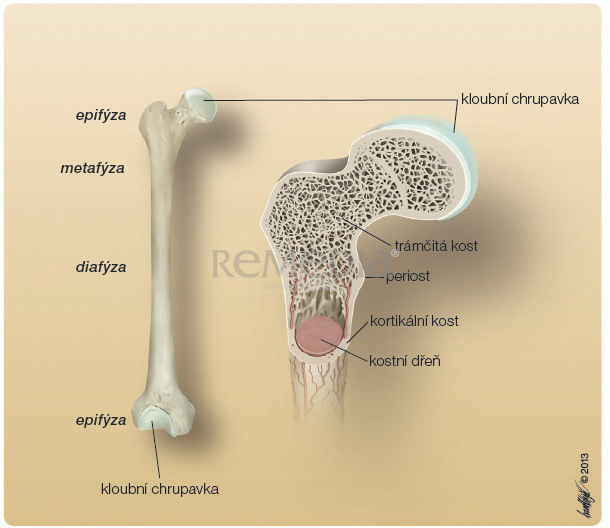 ostní tkáň se mikroskopicky dělí na tkáň kompaktní (kortikální) a trabekulární (trámčitou, houbovitou, spongiózní). Vnější část kosti je představována silnou a hutnou kortikální kostí. V diafyzární části vytváří kortikální kost dřeňovou dutinu. Směrem k metafýze a epifýze se kortikální kost ztenčuje a obklopuje tenké, vzájemně propletené kalcifikované trámce – kost trámčitou (obr. 1). Proximální a distální partie dřeňové dutiny jsou tím uzavřeny v trámčité kostní tkáni. Trabekulární kost je oproti kosti kortikální podstatně metabolicky aktivnější, kompaktní tkáň má především mechanickou a ochrannou funkci.
ostní tkáň se mikroskopicky dělí na tkáň kompaktní (kortikální) a trabekulární (trámčitou, houbovitou, spongiózní). Vnější část kosti je představována silnou a hutnou kortikální kostí. V diafyzární části vytváří kortikální kost dřeňovou dutinu. Směrem k metafýze a epifýze se kortikální kost ztenčuje a obklopuje tenké, vzájemně propletené kalcifikované trámce – kost trámčitou (obr. 1). Proximální a distální partie dřeňové dutiny jsou tím uzavřeny v trámčité kostní tkáni. Trabekulární kost je oproti kosti kortikální podstatně metabolicky aktivnější, kompaktní tkáň má především mechanickou a ochrannou funkci.
Trabekulární kost
Trabekulární kost je složena buď z nepravidelných houbovitých uspořádaných trámců (trabekul), nebo jsou trabekuly uspořádány v určitých směrech. Kortikální a trámčitá kost obsahují stejné buňky a stejnou matrix, ale liší se strukturou a funkcí: 80–90 % objemu kompaktní kostní tkáně je kalcifikováno, zatímco trabekulární tkáň je kalcifikována z pouhých 20 %. Zbývajících 80 % trabekulární kostní tkáně obsahuje kostní dřeň, krevní cévy a pojivovou tkáň. Trámčitá kost představuje pouhých 15–20 % hmotnosti skeletu. Vzhledem ke své struktuře má však podstatně větší povrch než kost kortikální (poměr 80 : 20). Trabekulární kost je ve srovnání s kostí kortikální metabolicky mnohem aktivnější, zatímco kompaktní tkáň zastává mechanickou a ochrannou funkci [1]. Trámčitá kost se nachází v oblasti metafýz a epifýz dlouhých kostí a obklopuje tak proximální a distální partie dřeňové dutiny. Pravidelné uspořádání kostních trámců (tzv. architektonika trabekulární kosti) je závislé na křivkách, v nichž se uplatňuje tlak na kost. Trabekuly tím zajišťují maximální odolnost kostní tkáně při minimálním množství materiálu [2].
Kortikální kost
Kortikální kost představuje zhruba 80–85 % celkové hmotnosti skeletu. Dle mikroskopické stavby lze strukturu kompaktní kosti dále dělit na vláknitou nebo lamelózní. Vláknitá kostní tkáň se tvoří ve vývojovém období a trvale se udržuje u nižších obratlovců a v některých kostech malých savců. U člověka se nachází v místech úponů některých vazů a šlach, ve švech lebečních kostí a v pouzdře nitroušního labyrintu. Vláknitá kost sestává z navzájem se spojujících trámců, mezi nimiž se nacházejí kostní buňky.
U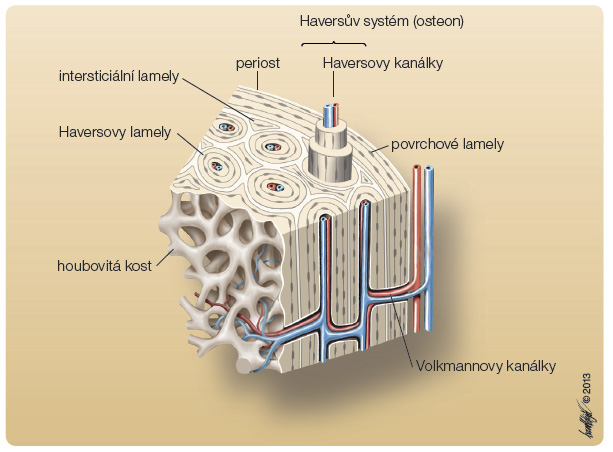 člověka je v prvním roce života postupně nahrazována kostí lamelózní [2, 3], která se skládá z několika vrstev zevních lamel spojených amorfní základní substancí. Lamely jsou pravidelně koncentricky uspořádány v závislosti na průběhu cév nebo tvoří soustředné vrstvy na povrchu kosti. Lze je rozdělit na lamely Haversovy, lamely intersticiální a lamely povrchové. Haversovy lamely tvoří koncentrické vrstvy, jejichž středem longitudinálně probíhají Haversovy kanálky, které obsahují cévy a nervy. Haversovy kanálky komunikují s kanálky Volkmannovými. Koncentricky uspořádané lamely s centrálním Haversovým kanálkem tvoří Haversův systém neboli osteon, který představuje základní strukturální stavební jednotku kortikální kosti (basic structural unit – BSU), obr. 2. Mezi Haversovými systémy jsou malé dutinky (lakuny) s kostními buňkami – osteocyty [2].
člověka je v prvním roce života postupně nahrazována kostí lamelózní [2, 3], která se skládá z několika vrstev zevních lamel spojených amorfní základní substancí. Lamely jsou pravidelně koncentricky uspořádány v závislosti na průběhu cév nebo tvoří soustředné vrstvy na povrchu kosti. Lze je rozdělit na lamely Haversovy, lamely intersticiální a lamely povrchové. Haversovy lamely tvoří koncentrické vrstvy, jejichž středem longitudinálně probíhají Haversovy kanálky, které obsahují cévy a nervy. Haversovy kanálky komunikují s kanálky Volkmannovými. Koncentricky uspořádané lamely s centrálním Haversovým kanálkem tvoří Haversův systém neboli osteon, který představuje základní strukturální stavební jednotku kortikální kosti (basic structural unit – BSU), obr. 2. Mezi Haversovými systémy jsou malé dutinky (lakuny) s kostními buňkami – osteocyty [2].
Intersticiální lamely vyplňují prostory mezi jednotlivými osteony. Jedná se o zbytky původních Haversových soustav, které byly odstraněny vrůstáním cév, okolo nichž se vytvořily nové Haversovy lamely. Povrchové lamely se nacházejí na povrchu kosti. Vznikají apoziční tvorbou kostní tkáně v periost. Silná a hutná kortikální kost tvoří především vnější část skeletu. V diafyzární části vytváří kortikální kost dřeňovou dutinu. Směrem k metafýze a epifýze se kortikální kost ztenčuje a obklopuje tenké, vzájemně propletené kalcifikované trámce – kost trámčitou. Z periostálního a endostálního povrchu vnikají kolmo do kosti Volkmannovy kanálky, v nichž probíhají cévy a nervy. Volkmannovými kanálky vstupují do kosti periostální cévy, které vzájemně anastomózují a zajišťují krevní zásobení kostní tkáně [2].
Vyšetření hodnotící kvalitu kostí
Poměr kortikální ku trabekulární kosti se různí dle lokalizace: v obratlích je tento poměr 5 : 95 %, v krčku femuru 75 : 25 %, v radiu 95 : 5 %. Rutinně prováděné zobrazovací vyšetření denzity kostního minerálu (bone mineral density, BMD), konkrétně dvouenergetická absorpční denzitometrie (DXA, dual-energy X-ray absorptiometry), je planimetrickou metodou a nerozlišuje mezi trabekulární a kortikální kostí.
Mezi metody schopné odlišit kortikální a trabekulární tkáň patří kvantitativní výpočetní tomografie (QCT, quantitative computed tomography) a mikroCT. Periferní kvantitativní výpočetní tomografie (pQCT) umožňuje analýzu kortikální i trámčité kosti v dané oblasti končetiny, jakož i zhodnocení parametrů, jako jsou BMD, obsah kostního minerálu, kortikální obvod či tloušťka. Pomocí pQCT lze též stanovit tzv. moment setrvačnosti (moment of inertia), který hodnotí pevnost v ohybu a jehož zvýšení značí zlepšení biomechanické vlastnosti kosti. MikroCT je metoda nově používaná in vitro při analýze bioptických vzorků kostní tkáně, kdy je pomocí dvourozměrných projekcí rekonstruován virtuální trojrozměrný model kostní tkáně a tím je možné hodnotit její mikroskopickou strukturu.
V období mezi 20.–80. rokem života ztrácí člověk až polovinu své kostní hmoty. Relativní ztráta kostní hmoty s věkem je markantnější v trabekulární kosti, protože ta má vyšší poměr povrch/objem. Absolutní úbytek kostní hmoty je však vyšší v kortikální kosti, což významně přispívá k poklesu mechanické odolnosti kostní tkáně [4, 5].
Studie z posledního desetiletí prokazují, že kortikální kost má zásadní význam pro integritu skeletu a pevnost kortikální kosti je rozhodujícím faktorem pro vznik zlomeniny [6]. S přibývajícím věkem dochází k úbytku kortikální hmoty, zejména v důsledku jejího ztenčení a nárůstu porozity kortikální kosti [6–8]. U postmenopauzálních žen představují mimoobratlové zlomeniny v oblastech skeletu s převahou kortikální kosti 80 % všech zlomenin. Postmenopauzální ženy s vyšší postavou mají zvýšené riziko zlomeniny v důsledku tenčí vrstvy kortikální kosti a zvýšené porozity kortikální tkáně [9].
Léčivé přípravky v terapii osteoporózy
Léčivé přípravky registrované pro terapii osteoporózy lze rozdělit na osteoformační (osteoanabolické) a antiresorpční (antikatabolické).
Osteoanabolické přípravky indukují nárůst množství kostní hmoty, čímž stoupá převaha kostní novotvorby nad osteoresorpcí. Osteoanabolické přípravky zahrnují parathormon a teriparatid. Stroncium ranelátu se přičítá duální mechanismus účinku (efekt antiresorpční i formační).
 Mezi antikatabolické přípravky patří bisfosfonáty (alendronát, risedronát, ibandronát, zoledronát), selektivní modulátory estrogenních receptorů (SERM; raloxifen), kalcitonin a denosumab. Antikatabolické přípravky snižují kostní remodelaci, prodlužují životnost kostních strukturálních jednotek, čímž se prodlužuje doba, během níž dochází k akumulaci kostního minerálu, a tím stoupá kostní
Mezi antikatabolické přípravky patří bisfosfonáty (alendronát, risedronát, ibandronát, zoledronát), selektivní modulátory estrogenních receptorů (SERM; raloxifen), kalcitonin a denosumab. Antikatabolické přípravky snižují kostní remodelaci, prodlužují životnost kostních strukturálních jednotek, čímž se prodlužuje doba, během níž dochází k akumulaci kostního minerálu, a tím stoupá kostní
mineralizace.
Bisfosfonáty, které jsou hlavn ími reprezentanty antikatabolických přípravků, snižují dozrávání a počet osteoklastů a vedou k jejich apoptóze, tlumí též kostní formaci a jsou celoživotně deponovány v kostní matrix.
ími reprezentanty antikatabolických přípravků, snižují dozrávání a počet osteoklastů a vedou k jejich apoptóze, tlumí též kostní formaci a jsou celoživotně deponovány v kostní matrix.
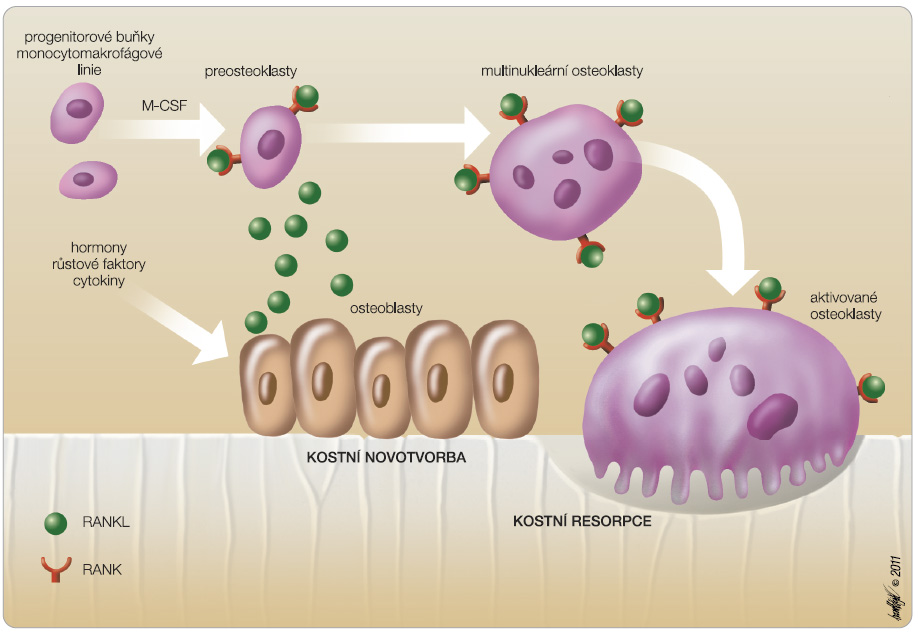
Významný předěl v léčbě osteoporózy představuje zavedení denosumabu. Je to plně humánní monoklonální protilátka IgG2, která má vysokou afinitu k RANKL (ligand receptoru aktivujícího nukleární faktor kappa-B), čímž inhibuje diferenciaci osteoklastů, jejich funkci a přežívání (obr. 3, 4). Po podání denosumabu dochází k poklesu kostní resorpce, k nárůstu BMD a ke snížení rizika vzniku fraktur obratlových i mimoobratlových [11–22]. Oproti působení bisfosfonátů má denosumab na kost reverzibilní účinek, neboť je degradován a není ukládán v organismu.
Vzhledem k významu kortikální kosti pro mechanickou odolnost skeletu je nutné hodnotit v tomto kontextu též účinnost antiosteoporotické léčby, zejména pak léčby antikatabolické. Pomocí metody mikroCT bylo kupříkladu prokázáno, že podávání risedronátu ženám s osteoporózou signifikantně zabraňuje nárůstu kortikální porozity v porovnání s placebem [10]. Významný vliv na kortikální kost byl prokázán u léčby denosumabem. Jeho účinky na skelet byly hodnoceny v experimentu a též v dvojitě zaslepených, placebem kontrolovaných, randomizovaných studiích fáze I–III [11, 12, 22].
Preklinické a klinické hodnocení denosumabu
Experimentální studie
V experimentu byl denosumab podáván opicím rodu Cynomolgus [23, 24]. Subkutánní aplikace denosumabu ovar-
ektomovaným opicím jedenkrát měsíčně po dobu 16 měsíců vedla ve srovnání s kontrolní skupinou, které byla podávána neúčinná látka, k poklesu kostní remodelace, vzestupu plošné BMD v bederní páteři, kyčli, krčku femuru a distálním radiu, k nárůstu objemu kortikální kosti v oblasti středního radia a tibie a rovněž tak ke vzestupu mechanické odolnosti krčku femuru a bederních obratlů [23]. Histomorfometrickým vyšetřením bioptických vzorků skeletu těchto opic byla potvrzena vyšší kostní remodelace u ovar-
ektomovaných zvířat. Podávání denosumabu vedlo k poklesu kostní remodelace, poklesu erodovanané plochy v trámčité kosti a rovněž tak k poklesu kortikální porozity. Tyto parametry souvisely s nárůstem BMD a mechanické odolnosti kostní tkáně [24]. Hypotézy, zda lze výsledky z experimentálních studií předpokládat i v humánní medicíně, musí vždy potvrdit klinické studie.
Klinická hodnocení fáze II a III
Ve dvojitě zaslepené pilotní studii fáze II bylo 247 postmenopauzálních žen randomizováno k léčbě denosumabem (60 mg s.c. každých 6 měsíců), alendronátem (70 mg p.o. týdně) nebo placebem. Morfologické změny v oblasti distálního radia a distální tibie byly po 12 měsících hodnoceny pQCT. V placebové větvi došlo k poklesu celkové, kortikální a trabekulární BMD a rovněž tak ke ztenčení kortikální kosti v oblasti distálního radia (-2,1 % až -0,8 %). Podávání alendronátu zabránilo poklesu hodnot uvedených parametrů (-0,6 % až 2,4 %; p = 0,051 až < 0,001 vs. placebo), zatímco denosumab zabránil poklesu, a dokonce vedl ke zlepšení sledovaných hodnot (0,3 % až 3,4 %; p < 0,001 vs. placebo). Denosumab oproti alendronátu významněji ovlivnil změny celkové a kortikální BMD (p < 0,024). Obdobný nález byl pozorován v oblasti tibie. Moment setrvačnosti byl rovněž vyšší po léčbě denosumabem ve srovnání s léčbou alendronátem (p < 0,001). Nebyl zjištěn rozdíl ve výskytu nežádoucích účinků [25].
Dvojitě zaslepená, placebem kontrolovaná studie fáze III s názvem DEFEND (Denosumab Evaluation for Preserving Bone Density) hodnotila vliv dvouletého podávání denosumabu (60 mg s.c. každých 6 měsíců) na BMD a kostní obrat u 332 postmenopauzálních žen s nízkou BMD. Metodou QCT byly též v oblasti distálního radia hodnoceny změny volumetrické kostní denzity, volumetrický obsah kostního minerálu, tloušťka kortikální kosti, její objem a obvod, a též polární moment setrvačnosti, který je ukazatelem mechanické odolnosti kosti. Denosumab po 24 měsících významně zvýšil BMD v oblasti bederní páteře (6,5 vs. -0,6 %; p < 0,0001) a významně zvýšil BMD v kyčli, distálním radiu a též celotělovou BMD. Metoda QCT prokázala u pacientek léčených denosumabem oproti placebu zvýšení volumetrické BMD i volumetrického obsahu kostního minerálu kortikální kosti v oblasti distálního radia (p < 0,001), nárůst tloušťky kortikální kosti, rovněž tak se zlepšil polární moment setrvačnosti (+6,6 %; p < 0,0001). Došlo též ke zlepšení strukturálních parametrů v oblasti kyčle. Ukazatele kostního obratu byly po léčbě denosumabem výrazně sníženy [21, 26].
Nejrozsáhlejším a nejvýznamnějším klinickým hodnocením s denosumabem byla dvojitě zaslepená, placebem kontrolovaná studie FREEDOM (Fracture Reduction Evaluation of Denosumab in Osteoporosis every 6 Months) [27], která hodnotila vliv denosumabu na výskyt nových fraktur. Zařazeno bylo 7868 žen. Studii dokončilo 6478 pacientek (82 %). Tříleté podávání denosumabu (60 mg s.c. každých 6 měsíců) postmenopauzálním osteoporotickým ženám vedlo v porovnání s placebem k 68% poklesu rizika zlomenin obratlů (p < 0,0001) a 20% poklesu rizika mimoobratlových zlomenin (p = 0,011), riziko zlomenin kyčle bylo sníženo o 40 % (p = 0,036). BMD bederní páteře se po podávání denosumabu zvýšila za tři roky o 9 % a v kyčli představoval tento nárůst 6 % (p < 0,0001). Výskyt nežádoucích příhod byl v obou skupinách (denosumab vs. placebo) obdobný. Denosumab tedy jednoznačně snížil riziko vzniku obratlových i mimoobratlových zlomenin při vynikajícím bezpečnostním profilu [27].
V rámci studie FREEDOM bylo též provedeno hodnocení vlivu denosumabu na kostní denzitu a mechanickou odolnost trámčité a kortikální tkáně v oblasti radia [28]. BMD radia, obsah kostního minerálu a polární moment setrvačnosti byly vyšetřeny v prespecifikovaných podstudiích za použití DXA (placebo, n = 209; denosumab, n = 232) nebo QCT (placebo, n = 48; denosumab, n = 62). Prespecifikovaná analýza vyhodnotila výskyt zlomenin zápěstí u všech účastnic studie FREEDOM, zatímco v post hoc analýze byly hodnoceny ženy s vyšším rizikem zlomeniny (T-skóre BMD krčku femuru ≤ -2,5 SD – směrodatná odchylka; placebo, n = 1406; denosumab, n = 1384). Denosumab signifikantně zvýšil BMD (vyhodnoceno metodou DXA) a volumetrickou BMD, obsah kostního minerálu a polární moment setrvačnosti (hodnoceno QCT) v porovnání s placebem v kortikální i trámčité kosti radia (p < 0,05). Výskyt zlomeniny zápěstí byl po 36 měsících léčby 2,9 % v placebové skupině a 2,5 % u pacientek léčených denosumabem (pokles relativního rizika o 16 %; p = 0,21). U žen s vyšším rizikem zlomeniny (T-skóre BMD krčku femuru ≤ -2,5 SD) denosumab významně snížil výskyt fraktury zápěstí (placebo – 4,0 %; denosumab – 2,4 %; pokles relativního rizika o 40 %; pokles absolutního rizika o 1,6 %; p = 0,03).
Z uvedených výsledků vyplývá, že denosumab oproti placebu významně zlepšuje BMD, množství a kvalitu trámčité a kortikální tkáně v oblasti radia [28]. U žen s vyšším rizikem zlomeniny denosumab snižuje riziko vzniku fraktur zápěstí [28].
Ve studii FREEDOM byla rovněž hodnocena metodou QCT volumetrická BMD v oblasti bederní páteře, kyčle a krčku femuru při vstupním vyšetření a po 12, 24 a 36 měsících [29]. Jednalo se o podskupinu 209 žen. Signifikantní nárůst plošné a volumetrické BMD ve všech hodnocených oblastech byl patrný jak v průběhu času u pacientek léčených denosumabem, tak v porovnání s placebem. Po 36 měsících léčby denosumabem činil rozdíl volumetrické BMD v bederní páteři, kyčli a krčku femuru oproti placebu 21,8 %, 7,8 %, a 5,9 % (p ≤ 0,0001). V porovnání s placebem byl patrný nárůst obsahu kostního minerálu v kyčli (p < 0,0001), který souvisel s významným zvýšením obsahu kostního minerálu v kortikální kosti (p < 0,0001). Uvedené výsledky studie FREEDOM ukazují na pozitivní účinek denosumabu na kortikální i trámčitou kostní tkáň [29].
V rámci studie FREEDOM byla provedena též podstudie se 441 účastnicemi, v níž byla hodnocena plošná BMD metodou DXA, a to v oblasti bederní páteře, kyčle, krčku femuru, trochanteru a dolní třetiny radia; též byla vyhodnocena celotělová denzita. Signifikantní nárůst BMD po podání denosumabu byl patrný již po jednom měsíci v bederní páteři, kyčli a trochanteru (vždy p < 0,005 vs. placebo a vstupní hodnoty). BMD progresivně narůstala ve všech hodnocených místech po 12, 24 a 36 měsících (vždy p < 0,005 vs. placebo a vstupní hodnoty). Tyto výsledky ukázaly, že denosumab zvyšuje významně a rychle kostní denzitu ve všech oblastech skeletu, ať už s převahou trámčité, či kortikální kostní tkáně [29, 30].
Bezpečnostní profil denosumabu
Bezpečnostní profil denosumabu byl hodnocen ve všech provedených klinických studiích. Nebyl zjištěn vyšší výskyt nežádoucích příhod ve srovnání s ostatní antiresorpční léčbou. Navzdory skutečnosti, že denosumab zasahuje do systému tumor nekrotizujícího faktoru (tumor necrosis factor – TNF), neprokázaly výsledky studií ovlivnění imunitních procesů v lidském organismu ani zvýšený výskyt novotvarů. U pacientů léčených denosumabem je výskyt infekčních komplikací srovnatelný s kontrolní skupinou [12, 22]. U léčených pacientů nebyla prokázána ani tvorba protilátek proti denosumabu [12, 22].
Závěr
Dosavadní klinické studie ukazují na pozitivní účinek denosumabu na kostní tkáň: pokles kostní resorpce, zabránění dalšímu ztenčování a porotizace kortikální kosti a nárůst BMD v kortikálním i trabekulárním kompartmentu. Důsledkem těchto změn je zvýšení mechanické odolnosti kostní tkáně a z toho plynoucí pokles rizika vzniku obratlových i mimoobratlových zlomenin. Denosumab představuje zcela nový a perspektivní způsob terapie osteoporózy – biologickou léčbu. Subkutánní aplikace jednou za 6 měsíců je pro pacienty výhodná. Bezpečnostní profil denosumabu je výborný, dosud nebyl zjištěn vyšší výskyt nežádoucích příhod ve srovnání s ostatní antiresorpční léčbou.
Seznam použité literatury
- [2] Dempster DW. Anatomy and functions of the adult skeleton. In FAVUS, MJ. (Ed.) Primer on Metabolic Bone Diseases and Disorders of Mineral Metabolism. 6th ed. Washington DC: American Society for Bone and Mineral Research (ASBMR), 2006, p. 7–11.
- [3] Kovacs CS. Skeletal physiology: Fetus and neonate. In FAVUS, MJ. (Ed.) Primer on Metabolic Bone Diseases and Disorders of Mineral Metabolism. 6th ed. Washington DC: American Society for Bone and Mineral Research (ASBMR), 2006, p. 50–55.
- [4] Gordon CL, Halton JM, Atkinson SA, Webber CE. The contributions of growth and puberty to peak bone mass. Growth, Development, Aging 1991; 55: 257–262.
- [5] Seeman E. Advances in the study of osteoporosis in men. In Meunier PJ., (Ed). Osteoporosis: Diagnosis and Management. Martin Dunitz, London, 1998, p. 211–232.
- [6] Zebaze RM, Ghasem-Zadeh A, Bohte A, et al. Intracortical remodelling and porosity in the distal radius and post-mortem femurs of women: a cross-sectional study. Lancet 2010; 375: 1729–1736.
- [7] Seeman E. Structural basis of growth-related gain and age-related loss of bone strength. Rheumatology 2008; 47 (Suppl 4): iv2–8.
- [8] Filardi S, Zebaze RM, Duan Y, et al. Femoral neck fragility in women has its structural and biomechanical basis established by periosteal modeling during growth and endocortical remodeling during aging. Osteoporos Int 2004; 15: 103–107.
- [9] Bjørnerem A, Bui Q, Ghasem-Zadeh A, et al. Fracture risk and height: An association partly accounted for by cortical porosity of relatively thinner cortices. 2013 Mar 20. doi: 10.1002/jbmr.1934. [Epub ahead of print]
- [10] Borah B, Dufresne T, Nurre J, et al. Risedronate reduces intracortical porosity in women with osteoporosis. J Bone Miner Res 2010; 25: 41–47.
- [11] Lewiecki EM. Managing osteoporosis: challenges and strategies. Cleve Clin J Med 2009; 76: 457–466.
- [12] Lewiecki EM. Denosumab – an emerging treatment for postmenopausal osteoporosis. Expert Opin Biol Ther 2010; 10: 467–476.
- [13] Hsu H, Lacey DL, Dunstan CR, et al. Tumor necrosis factor receptor family member RANK mediates osteoclast differentiation and activation induced by osteoprotegerin ligand. Proc Natl Acad Sci U S A 1999; 96: 3540–3545.
- [14] Khosla S. Minireview: the OPG/RANKL/RANK system. Endocrinology 2001; 142: 5050–5055.
- [15] Fata JE, Kong YY, Li J, et al. The osteoclast differentiation factor osteoprotegerin ligand is essential for mammary gland development. Cell 2000; 103: 41–50.
- [16] Boyle WJ, Simonet S, Lacey DL. Osteoclast differentiation and activation. Nature 2003; 423: 337–342.
- [17] Anderson DM, Maraskovsky E, Billingsley WL, et al. A homologue of the TNF receptor and its ligand enhance T-cell growth and dendritic-cell function. Nature 1997; 390: 175–179.
- [18] Bekker PJ, Holloway DL, Rasmussen AS, et al. Single-dose placebo-controlled study of AMG 162, a fully human monoclonal antibody to RANKL, in postmenopausal women. J Bone Miner Res 2004; 19: 1059–1066.
- [19] McClung MR, Lewiecki EM, Cohen SB, et al. Denosumab in postmenopausal women with low bone mineral density. N Engl J Med 2006; 354: 821–831.
- [20] Yasuda H, Shima N, Nakagawa N, et al. Osteoclast differentiation factor is a ligand for osteoprotegerin/oscteoclastogenesis inhibitory factor and is identical to TRANCE/RANKL. Proc Natl Acad Sci U S A 1998; 95: 3597–3602.
- [21] Bone HG, Bolognese MA, Yuen CK, et al. Effects of denosumab on bone mineral density and bone turnover in postmenopausal women. J Clin Endocrinol Metab 2008; 93: 2149–2157.
- [22] Charopoulos I, Orme S, Giannoudis PV. The role of efficacy of denosumab in the treatment of osteoporosis: an update. Expert Opin Drug Saf 2011; 10: 205–217.
- [23] Ominsky MS, Stouch B, Schroeder J, et al. Denosumab, a fully human RANKL antibody, reduced bone turnover markers and increased trabecular and cortical bone mass, density, and strength in ovariectomized cynomolgus monkeys. Bone 2011; 49: 162–173.
- [24] Kostenuik PJ, Smith SY, Jolette J, et al. Decreased bone remodeling and porosity are associated with improved bone strength in ovariectomized cynomolgus monkeys treated with denosumab, a fully human RANKL antibody. Bone 2011; 49: 151–161.
- [25] Seeman E, Delmas PD, Hanley DA, et al. Microarchitectural deterioration of cortical and trabecular bone: differing effects of denosumab and alendronate. J Bone Miner Res 2010; 25: 1886–1894.
- [26] Genant HK, Engelke K, Hanley DA, et al. Denosumab improves density and strength parameters as measured by QCT of the radius in postmenopausal women with low bone mineral density. Bone 2010; 47: 131–139.
- [27] Cummings SR, San Martin J, McClung MR, et al. FREEDOM Trial. Denosumab for prevention of fractures in postmenopausal women with osteoporosis. N Engl J Med 2009; 361: 756–765.
- [28] Simon JA, Recknor C, Moffett AH Jr, et al. Impact of denosumab on the peripheral skeleton of postmenopausal women with osteoporosis: bone density, mass, and strength of the radius, and wrist fracture. Menopause 2013; 20: 130–137.
- [29] McClung MR, Zanchetta JR, Høiseth A, et al. Denosumab Densitometric Changes Assessed by Quantitative Computed Tomography at the Spine and Hip in Postmenopausal Women With Osteoporosis. J Clin Densitom 2013; 16: 250–256.
- [30] Bolognese MA, Teglbjærg CS, Zanchetta JR, et al. Denosumab Significantly Increases DXA BMD at Both Trabecular and Cortical Sites: Results From the FREEDOM Study. J Clin Densitom 2013; 16: 147–153.