Guselkumab v léčbě psoriatické artritidy
Souhrn:
Pavelka K. Guselkumab v léčbě psoriatické artritidy. Remedia 2021; 31: 588–595.
Psoriatická artritida (PsA) je závažné chronické zánětlivé, autoimunitně podmíněné onemocnění, které postihuje kloubní systém, kůži a má i celou řadu extraskeletálních manifestací. Přelom v léčbě PsA znamenaly inhibitory tumor nekrotizujícího faktoru alfa (TNFα) a interleukinu (IL) 17, které však mají řadu limitací jak v oblasti účinnosti, tak především bezpečnosti. Guselkumab představuje biologický lék blokující podjednotku p19 IL‑23. Na základě úspěšných studií fáze III klinického zkoušení byl registrován pro léčbu psoriázy. Předmětem přehledové práce je prezentace dvou studií fáze III klinického zkoušení u PsA pod názvem DISCOVER‑1 a DISCOVER‑2. Studie zahrnovaly pacienty s aktivní PsA jak dosud neléčené biologiky (tvz. naivní), tak se selháním anti‑TNFα terapie. Ve sledováních bylo dosaženo primárního cílového ukazatele v podobě odpovědi ACR20 v týdnu 24. Kromě robustního klinického účinku, který zahrnoval symptomatický efekt na klouby a perikloubní tkáně (daktylitida, entezitida), došlo i k výraznému zmírnění kožního syndromu. Tolerance léku byla přijatelná, nevyskytly se žádné malignity, oportunní infekce, tuberkulóza ani idiopatické střevní záněty. Závažné infekce se vyskytly pouze mírně častěji, stejně tak elevace hodnot transamináz. Celkový profil léku v poměru prospěchu a rizika je vysoce pozitivní.
Summary:
Pavelka K. Guselkumab in the treatment of psoriatic arthritis. Remedia 2021; 31: 588–595.
Psoriatic arthritis (PsA) is a severe chronic inflammatory autoimmune disease that affects joints, skin and has several extraskeletal manifestations. Inhibitors of tumor necrosis factor alpha (TNFα) and interleukin (IL) 17 represented a breakthrough in the therapy of PsA. However, they have many limitations both in the area of efficacy and especially of safety. Guselkumab is a biologic drug blocking the p19 subunit of IL‑23. Based on successful phase III clinical studies, it was approved for the treatment of psoriasis. The subject of this review is an assessment of two phase III clinical trials of patients with PsA named DISCOVER‑1 and DISCOVER‑2. Studies included patients with active PsA, both naïve to biologic therapy and with a failure of anti‑TNFα therapy. The primary endpoint in the form of ACR20 response in week 24 was achieved. Aside from robust clinical efficacy that involved symptomatic effect on joints and periarticular tissue (dactylitis, enthesitis), an amelioration of the skin syndrome was also reached. The drug tolerance was acceptable; no malignancies, opportune infections, tuberculosis, or idiopathic bowel inflammations manifested. Severe infections occurred only a few times, as well as elevations of transaminase levels. Overall drug profile is highly favorable, considering the risk/benefit ratio.
Key words: psoriatic arthritis, biologic therapy, guselkumab.
Úvod
Psoriatická artritida (PsA) je chronické zánětlivé, imunitně podmíněné progresivní onemocnění, které postihuje muskuloskeletální systém, kůži a nehty a má i řadu extraskeletálních manifestací v podobě postižení gastrointestinálního traktu (ulcerózní kolitida a Crohnova nemoc) a očí (uveitida). Psoriatická artritida může být rovněž asociována s řadou komorbidit, z nich nejdůležitější jsou kardiovaskulární, psychiatrické a metabolické [1]. Aktivní PsA může vyvolávat výraznou disabilitu, zhoršení kvality života a zvyšuje i mortalitu [2]. Výskyt PsA v populaci se udává s četností 0,04-1 %.
Psoriatická artritida představuje výrazně heterogenní onemocnění s řadou subtypů nemoci a je řazena do skupiny tzv. spondyloartritid (SpA). Podle klasifikace ASAS (Assessment of SpondyloArthritis international Society) splňuje většina subtypů PsA kritéria pro periferní SpA, avšak jeden subtyp se pro axiální SpA a projevy na páteři blíží ankylozující spondylitidě [3].
Základními pilíři léčby PsA jsou přesná a časná diagnostika, vyhodnocení aktivity PsA, výběr vhodného léku a uplatňování strategie tzv. léčby k cíli [4].
Terapie PsA by měla být komplexní
a skládat se z přístupu nefarmakologického
a farmakologického. Armamentarium chorobu modifikujících
antirevmatických léků (disease modifying antirheumatic drugs,
DMARDs) pro léčbu PsA se značně rozšířilo a tvoří je
celá řada přípravků rozdílného původu a mechanismu
účinku (tab. 1) [5]. Používají se stále tzv. konvenční
syntetické DMARDs (csDMARDs), k nimž řadíme metotrexát,
sulfasalazin a leflunomid, dále biologické DMARDs (bDMARDs),
které blokují různé cytokiny (tumor nekrotizující faktor alfa
[TNFα], interleukin [IL] 12/23 a IL 17). Novou
skupinu pak tvoří tzv. cílené syntetické DMARDs (tsDMARDs), kam
patří inhibitory fosfodiesterázy 4 (PDE4) a inhibitory
Janusových kináz (JAK). Všechny tyto léky byly schváleny
na základě úspěšně provedených a publikovaných
studií, kdy většinou byly v krátkodobé periodě srovnávány
s placebem, nicméně přímé srovnávací studie nebyly
většinou provedeny. Z tohoto důvodu je důležité, že jsou
k dispozici algoritmy léčby - např.
doporučení EULAR (European League Against Rheumatism) nebo GRAPPA
(Group for Research and Assessment of Psoriasis and Psoriatic
Arthritis) -, které poskytují
lékařům určitá vodítka pro běžnou klinickou praxi [5,6].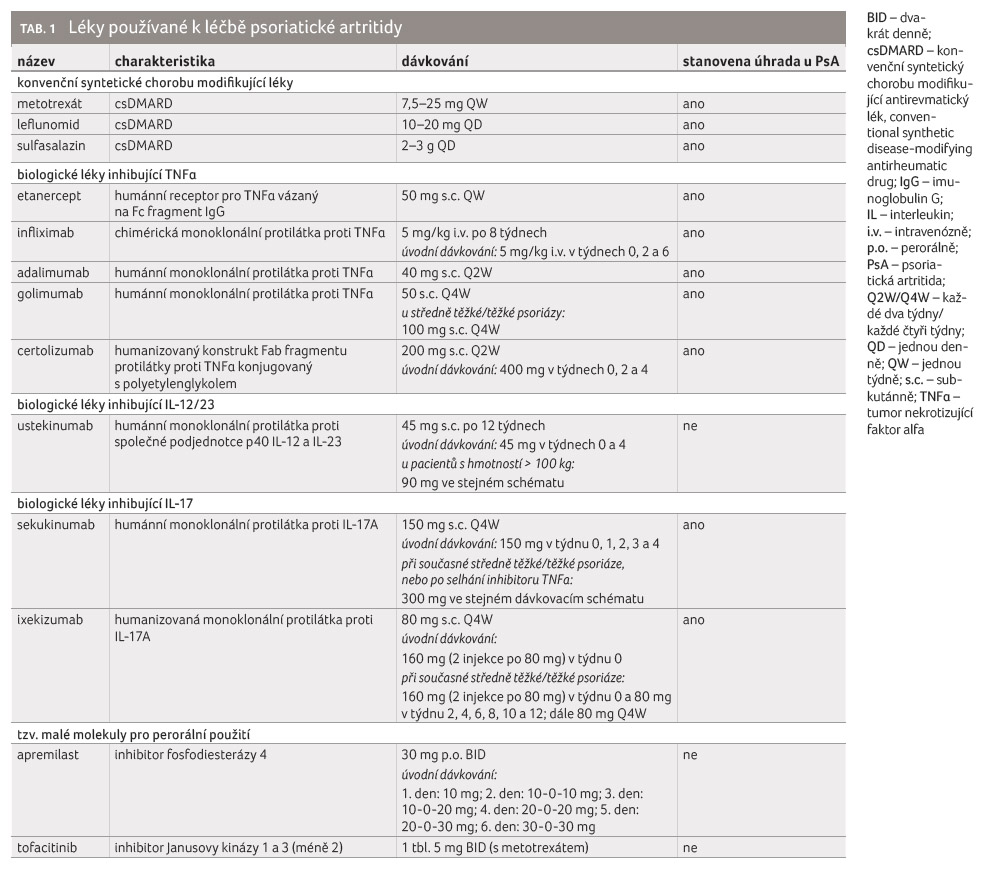
Prvními registrovanými bDMARDs pro léčbu PsA byly blokátory TNFα, které znamenaly revoluci v léčbě tohoto onemocnění. Na rozdíl od csDMARDs totiž ovlivňují prakticky celé spektrum skeletálních i extraskeletálních projevů PsA. Inhibitory TNF však mají komplikovaný bezpečnostní profil, především s ohledem na infekce [7]. V případě inhibitorů IL 17 je uvedeno varování o možné exacerbaci idiopatických střevních zánětů společně se zvýšeným rizikem rozvoje infekce [8].
Guselkumab
Na základě výsledků
preklinických modelů a klinických studií bylo zjištěno, že
cesta IL 23/Th17 (pomocné T lymfocyty) má zásadní význam
pro vývoj jak kožních, tak skeletálních projevů PsA [9].
Interleukin 23 představuje heterodimer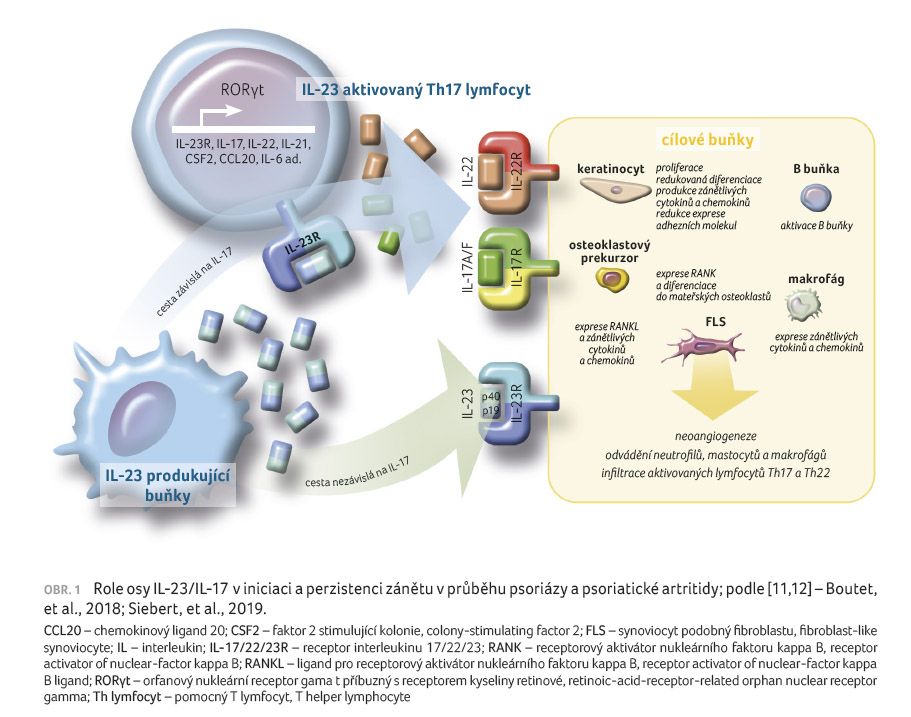 složený ze dvou
podjednotek: p19 a p40. Podjednotka p40 je společná pro IL 12
a IL 23. Ačkoliv IL 12 a IL 23 mají
společnou podjednotku p40, disponují rovněž specifickými
podjednotkami (p35 pro IL 12 a p19 pro IL 23). Zatímco
IL 23 byl identifikován jako zásadní faktor autoimunitně
podmíněného kožního zánětu, IL 12 pravděpodobně spíše
zvyšuje obranu proti autoimunitnímu zánětu a vyčerpání
T lymfocytů [10]. Selektivní blokáda podjednotek p19/p40
IL 23 a ušetření IL 12 prokázaly robustní efekt
u psoriázy. Byla potvrzena výrazná nadřazená (tzv.
upstream) pozice tohoto komplexu cytokinů v zánětlivé
hierarchii celého spektra psoriatické nemoci (obr. 1)
[11,12]. Guselkumab je humánní protilátka vázající se
na podjednotku p19 IL 23 s vysokou afinitou
a specificitou (obr. 2) [13,14]. Lék prokázal svoji
výraznou protizánětlivou aktivitu ve studiích s psoriázou
[15,16]. Guselkumab byl dále zkoušen v indikaci léčby PsA
ve s
složený ze dvou
podjednotek: p19 a p40. Podjednotka p40 je společná pro IL 12
a IL 23. Ačkoliv IL 12 a IL 23 mají
společnou podjednotku p40, disponují rovněž specifickými
podjednotkami (p35 pro IL 12 a p19 pro IL 23). Zatímco
IL 23 byl identifikován jako zásadní faktor autoimunitně
podmíněného kožního zánětu, IL 12 pravděpodobně spíše
zvyšuje obranu proti autoimunitnímu zánětu a vyčerpání
T lymfocytů [10]. Selektivní blokáda podjednotek p19/p40
IL 23 a ušetření IL 12 prokázaly robustní efekt
u psoriázy. Byla potvrzena výrazná nadřazená (tzv.
upstream) pozice tohoto komplexu cytokinů v zánětlivé
hierarchii celého spektra psoriatické nemoci (obr. 1)
[11,12]. Guselkumab je humánní protilátka vázající se
na podjednotku p19 IL 23 s vysokou afinitou
a specificitou (obr. 2) [13,14]. Lék prokázal svoji
výraznou protizánětlivou aktivitu ve studiích s psoriázou
[15,16]. Guselkumab byl dále zkoušen v indikaci léčby PsA
ve s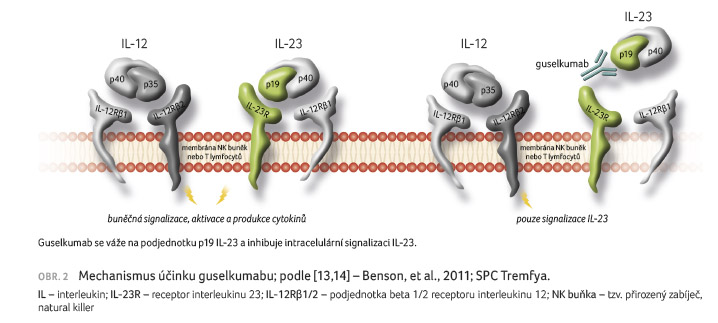 tudii fáze II klinického zkoušení. Byl podáván
v dávce 100 mg s.c. v týdnu 0, 4 a dále
každých 8 týdnů. Cíle bylo dosaženo u všech ukazatelů
účinnosti, tzn. příznaků kloubních, fyzické funkce, psoriázy,
entezitidy, daktylitidy a kvality života závislé na zdraví
[17]. Protizánětlivý účinek byl dále dokumentován poklesem
hodnot biomarkerů, jako jsou sérové koncentrace Il 17A,
IL 17F a C reaktivního proteinu (CRP), v porovnání
se zdravými kontrolami v týdnu 16. Tyto změny biomarkerů
korelovaly s odpovědí ACR20 (20% zlepšení podle American
College of Rheumatology) a PASI 75 (75% zlepšení podle
Psoriasis Area and Severity Index).
tudii fáze II klinického zkoušení. Byl podáván
v dávce 100 mg s.c. v týdnu 0, 4 a dále
každých 8 týdnů. Cíle bylo dosaženo u všech ukazatelů
účinnosti, tzn. příznaků kloubních, fyzické funkce, psoriázy,
entezitidy, daktylitidy a kvality života závislé na zdraví
[17]. Protizánětlivý účinek byl dále dokumentován poklesem
hodnot biomarkerů, jako jsou sérové koncentrace Il 17A,
IL 17F a C reaktivního proteinu (CRP), v porovnání
se zdravými kontrolami v týdnu 16. Tyto změny biomarkerů
korelovaly s odpovědí ACR20 (20% zlepšení podle American
College of Rheumatology) a PASI 75 (75% zlepšení podle
Psoriasis Area and Severity Index).
Guselkumab v léčbě PsA
v klinických studiích fáze III
DISCOVER 2
Proběhly dvě pivotní registrační studie s guselkumabem v indikaci PsA. DISCOVER 2 byla randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie provedená ve 13 zemích na všech kontinentech [18]. Do sledování byli zařazeni pacienti s PsA, kteří dosud nebyli léčeni biologiky a navzdory prováděné standardní léčbě měli aktivní onemocnění. Aktivita byla definována následujícími ukazateli: nejméně pět oteklých kloubů, pět citlivých kloubů a CRP ≥ 6 mg/l. Pacienti byli randomizováni do tří skupin, z nichž první dostávala subkutánně guselkumab v dávce 100 mg každé čtyři týdny, druhá skupina guselkumab 100 mg v týden 0, 4 a poté každých osm týdnů a třetí skupina placebo. Primárním cílovým ukazatelem byla odpověď ACR20 v týdnu 24.
Výsledky
Do studie bylo zařazeno 739
pacientů, z nichž 716 dokončilo léčbu do 24. týdne.
Skupiny byly na začátku léčby vyrovnané. Průměrný věk
činil 45-46 let, trvání nemoci
v průměru 5,5 roku. Pacienti měli na začátku
léčby 12 oteklých kloubů, hodnotu na škále bolesti
od 0 do 10 kolem 6, CRP 12 mg/l a průměrnou
hodnotu PASI 9-10. Metotrexát užívalo
57-63 % pacientů v průměrné
dávce zhruba 15 mg týdně, 20 % užívalo glukokortikoidy.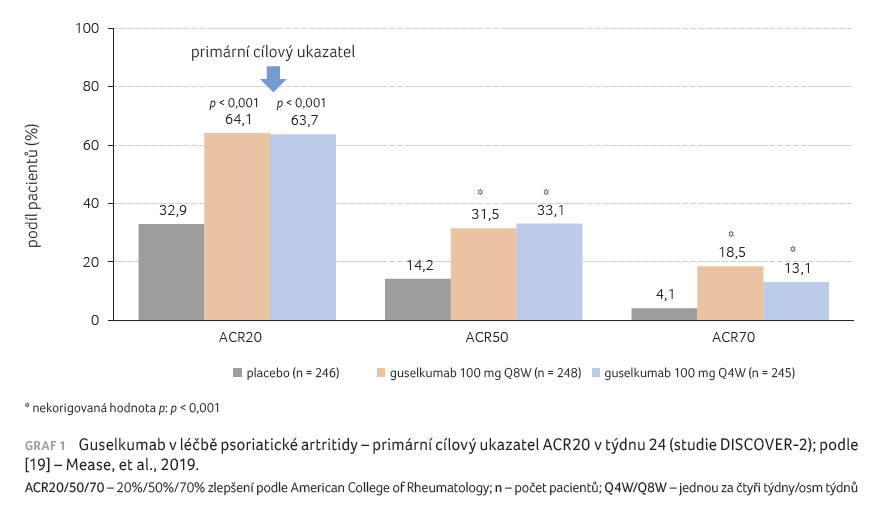
Primární kritérium bylo splněno,
když v týdnu 24 docílilo odpovědi ACR20 ve skupině
s guselkumabem podávaným každé čtyři týdny 64 %
pacientů (95% interval spolehlivosti [CI] 57-70)
a ve skupině s guselkumabem podávaným každých osm
týdnů také 64 % pacientů (95% CI 58-70),
ve skupině s placebem pak 33 % osob (95% CI 27-39),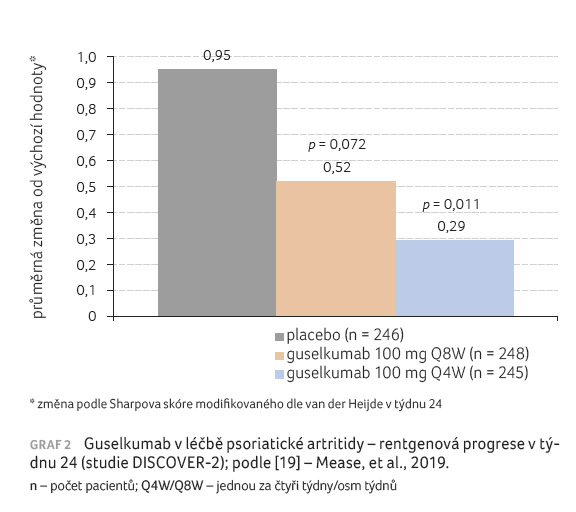 graf 1 [19]. Rozdíl v odpovědi mezi oběma dávkami
guselkumabu a placebem byl signifikantní již ve čtvrtém
týdnu a dále se zvětšoval do týdne 24. PASI 75 bylo
docíleno v 78-79 % při podávání
guselkumabu a ve 23 % při podávání placeba.
Signifikantních rozdílů mezi skupinami s guselkumabem
a placebem bylo dosaženo i u všech sekundárních
cílových ukazatelů, a to včetně hodnocení daktylitid
a entezitid. Pacienti léčení guselkumabem
v intervalu čtyř týdnů měli rovněž signifikantně nižší
rentgenovou progresi než pacienti v placebové skupině
(p < 0,011), graf 2 [19]. U skupiny
léčené guselkumabem v intervalu osmi týdnů byl rozdíl
v rentgenové progresi oproti placebu nesignifikantní
(p < 0,072). K hodnocení rentgenové
progrese bylo pro PsA použito Sharpovo skóre modifikované dle van
der Heijde.
graf 1 [19]. Rozdíl v odpovědi mezi oběma dávkami
guselkumabu a placebem byl signifikantní již ve čtvrtém
týdnu a dále se zvětšoval do týdne 24. PASI 75 bylo
docíleno v 78-79 % při podávání
guselkumabu a ve 23 % při podávání placeba.
Signifikantních rozdílů mezi skupinami s guselkumabem
a placebem bylo dosaženo i u všech sekundárních
cílových ukazatelů, a to včetně hodnocení daktylitid
a entezitid. Pacienti léčení guselkumabem
v intervalu čtyř týdnů měli rovněž signifikantně nižší
rentgenovou progresi než pacienti v placebové skupině
(p < 0,011), graf 2 [19]. U skupiny
léčené guselkumabem v intervalu osmi týdnů byl rozdíl
v rentgenové progresi oproti placebu nesignifikantní
(p < 0,072). K hodnocení rentgenové
progrese bylo pro PsA použito Sharpovo skóre modifikované dle van
der Heijde.
V současné době jsou již dostupná data po 52 týdnech léčby. Celkový terapeutický efekt zůstal plně zachován [20].
Bezpečnost
Výskyt nežádoucích účinků v obou skupinách léčených guselkumabem byl srovnatelný s placebem (46 % vs. 46 % vs. 41 %). Závažné nežádoucí účinky se vyskytly ve 3 % ve skupině s guselkumabem podávaným po čtyřech týdnech, v 1 % ve skupině s guselkumabem podávaným po osmi týdnech a ve 3 % ve skupině s placebem. Nejčastějšími nežádoucími účinky (minimálně výskyt 3 %) byly infekce respiračního traktu a elevace hodnot transamináz. Závažné infekce se vyskytly u tří pacientů (1 %) ve skupině s guselkumabem po čtyřech týdnech, u jednoho pacienta (< 1 %) ve skupině s guselkumabem po osmi týdnech a v jednom případě u placeba (< 1 %). Nevyskytly se žádné případy oportunních infekcí, tuberkulózy a kandidové infekce ani vzniku nebo exacerbace idiopatického střevního zánětu. V jedné skupině léčených guselkumabem byl zaznamenán výskyt karcinomu, rovněž tak v jedné skupině léčených placebem. Nebyly zachyceny častější neutropenie 3.-4. stupně. Elevace hodnot transamináz se objevily častěji (konkrétně alaninaminotransferáza) ve skupině léčené guselkumabem po čtyřech týdnech (10 %) a guselkumabem po osmi týdnech (6 %) ve srovnání s placebem. Výskyt elevace hodnot aminotransferáz stupně 2 a 3 dle klasifikace NCI CTCAE (National Cancer Institute Common Terminology Criteria for Adverse Events) však byl nízký a pouze mírně vyšší než po placebu. U žádného pacienta nedošlo ke klinicky významnému zvýšení hodnot bilirubinu. Bezpečnostní analýza prodloužení studie do 52. týdne nezjistila žádné nové bezpečnostní signály.
DISCOVER 1
DISCOVER 1 byla randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie u nemocných s PsA, kteří dosud nebyli léčeni biologickou léčbou nebo již byli dříve léčeni anti TNFα terapií. Aktivita onemocnění byla definována jako tři oteklé a tři citlivé klouby a CRP ≥ 3 mg/l. Ze srovnání se studií DISCOVER 2 vyplývá, že šlo o pacienty s nižší aktivitou onemocnění. Asi 30 % pacientů bylo dříve léčeno anti TNFα přípravky. Vstupní kritéria zahrnovala rovněž selhávání standardní léčby včetně nejméně čtyřměsíční terapie apremilastem. Primárním cílovým ukazatelem byla odpověď ACR20 v týdnu 24 [21].
Výsledky
Do studie bylo zařazeno celkem
381 pacientů, kteří byli randomizováni do skupiny léčené
guselkumabem po čtyřech týdnech, do skupiny léčené
guselkumabem po osmi týdnech a do skupiny s placebem.
Skupiny byly vyrovnané s nevýznamnými numerickými odchylkami
v některých ukazatelích na začátku léčby. Průměrný
věk pacientů činil 47-49 let, trvání
PsA 6,6-7,2 roku. Počet oteklých kloubů
byl v průměru 8,6-10,1, bolest
hodnocená na škále 0-10 se
pohybovala kolem 6, hodnoty CRP 6-8 mg/l,
PASI 7,7-9,5. Na začátku studie
užívalo přibližně 65 % pacientů csDMARD, přičemž v 55 %
se jednalo o metotrexát, v průměrné dávce zhruba 16 mg
týdně. Perorální glukokortikoidy užívalo 13-16 %
pacientů. V anamnéze užívalo anti TNFα přípravek
30-32 % osob, avšak dva anti TNFα
přípravky pouze asi 5 % osob.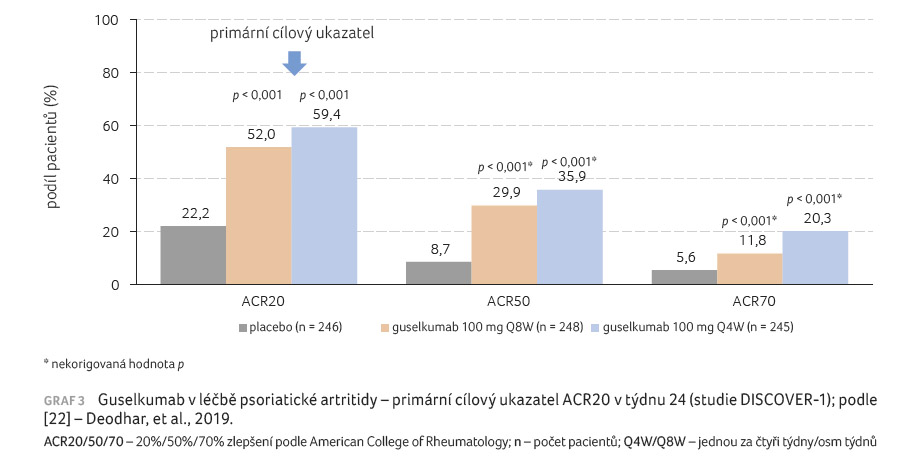
Primární kritérium bylo splněno, když odpovědi ACR20 v týdnu 24 dosáhlo 59 % pacientů ve skupině s guselkumabem po čtyřech týdnech, 52 % pacientů ve skupině léčené guselkumabem po osmi týdnech a 22 % v placebové skupině (graf 3) [22]. Procentuální rozdíl proti placebu byl 37 % (95% CI 26-48; p < 0,0001) ve skupině s guselkumabem po čtyřech týdnech a 30 % ve skupině s guselkumabem po osmi týdnech (95% CI 19-41; p < 0,0001). Výsledky byly konzistentní i při předdefinované analýze podskupin (podle pohlaví, rasy, trvání nemoci, počtu oteklých kloubů a podle komedikace v průběhu studie). Nebyl zaznamenán signifikantní rozdíl u skupiny užívající na začátku studie metotrexát a u skupiny bez metotrexátu. Rovněž nebyl zjištěn rozdíl v účinnosti guselkumabu oproti placebu mezi skupinou v minulosti léčenou anti TNFα (58 %, 56 %, 18 %) a u skupiny bez předchozí léčby anti TNFα (60 %, 50 %, 24 %). Odlišnost v účinnosti guselkumabu oproti placebu byla u obou skupin signifikantní od osmého týdne sledování. Statisticky významných rozdílů mezi oběma skupinami s guselkumabem a placebem bylo dosaženo také u všech sekundárních cílových ukazatelů včetně silnějších kritérií (ACR50, ACR70). Minimální aktivity PsA bylo dosaženo ve 30 % ve skupině s guselkumabem aplikovaným po čtyřech týdnech, ve 23 % ve skupině s guselkumabem po osmi týdnech a v 11 % u placeba. Odpověď PASI 75 činila v těchto skupinách 86 %, 76 % a v případě placeba 14 %. Procentuální rozdíl ve skupině s guselkumabem po čtyřech týdnech byl 73 %, ve skupině s guselkumabem po osmi týdnech 62 %. Signifikantní rozdíly léčby guselkumabem ve srovnání s placebem byly zjištěny i při hodnocení funkce a kvality života (skóre Health Assessment Questionnaire [HAQ] a 36 Item Short Form Survey [SF36]) a rovněž při hodnocení ovlivnění daktylitidy a entezitidy.
Nově byla prezentována souborná analýza studií DISCOVER 1 a DISCOVER 2 hodnotící pacienty, kteří měli na začátku sledování sakroiliitidu. Studie prokázala příznivé ovlivnění bolestí v zádech u obou skupin léčených guselkumabem oproti placebu při použití skóre Bath Ankylosing Spondylitis Disease Activity Index (BASDAI) a Ankylosing Spondylitis Disease Activity Score (ASDAS) [23].
Bezpečnost
Ve studii nebyl zjištěn žádný rozdíl ve výskytu nežádoucích účinků mezi oběma skupinami léčenými guselkumabem (56 % a 54 %) ve srovnání s placebem (60 %). Závažné nežádoucí účinky vedoucí k přerušení léčby byly vzácné bez rozdílu skupin (1 %, 2 %, 2 %). Závažné infekce se nevyskytly v žádném případě u pacientů léčených guselkumabem. Nežádoucí účinky s frekvencí vyšší než 5 % představovaly běžné infekce horního dýchacího traktu a zvýšení hodnot aminotransferáz, které bylo mírně častější ve skupině léčené guselkumabem než placebem. Nebyly zjištěny žádné oportunní infekce ani tuberkulóza. Jeden pacient vyvinul nezávažnou kožní mykózu. Ve studii nebyly zaznamenány žádné nové případy idiopatických střevních zánětů. U jednoho pacienta léčeného guselkumabem byly zaznamenány suicidiální tendence, byl však pro deprese léčen již před zahájením studijní léčby.
Diskuse
Studie DISCOVER 1 a DISCOVER 2 prokázaly, že selektivní inhibitor IL 23 guselkumab přináší robustní zmírnění příznaků psoriatické nemoci. Splňuje jednoznačně dnešní požadavky na chorobu modifikující lék, tzn. efektivně potlačuje kloubní symptomy, zlepšuje funkci a tím i kvalitu života související se zdravím a zpomaluje rentgenovou progresi. Tyto příznaky se týkají především PsA a jsou společné s revmatoidní artritidou. Nicméně PsA se liší od revmatoidní artritidy též větším postižením perikloubních tkání (entezitida, daktylitida), u části nemocných postižením páteře sakroiliitidou a spondylitidou a postižením kůže. Guselkumab prokázal komplexní účinek, když účinně ovlivňoval jak entezitidy a daktylitidy, tak kožní syndrom.
Bezpečnostní profil guselkumabu se jeví jako příznivý. Nebyly pozorovány žádné rozdíly ve výskytu nežádoucích účinků mezi dávkami guselkumabu po čtyřech týdnech a po osmi týdnech a dále mezi pacienty bez anti TNFα léčby v minulosti a s anti TNFα léčbou v anamnéze. Bezpečnostní profil ve studiích s PsA byl podobný jako u studií s psoriázou a nepřinesl žádné nové signály [15,16]. Ve studiích nebyly zjištěny žádné případy oportunních infekcí, aktivní tuberkulózy nebo idiopatických střevních zánětů, rovněž žádné nové signály týkající se závažných infekcí, malignit, závažných kardiovaskulárních onemocnění ani suicidiálních tendencí.
Terapeutický potenciál guselkumabu vyjádřený jako poměr účinnosti a bezpečnosti je velmi pozitivní. Může to být vysvětlitelné i mechanismem účinku, tzn. selektivní inhibicí IL 23, přičemž monoklonální protilátka je namířena proti podjednotce p19 IL 23. Inhibice vzestupné (upstream) signalizace IL 23 snižuje sestupně (downstream) produkci prozánětlivých cytokinů, jako jsou TNFα nebo celá rodina IL 17. Další hypotéza hovoří o tom, že blokáda IL 23 ovlivňuje transdiferenciaci lymfocytů Th17 na regulační a Th1 lymfocyty a přerušuje cesty Th17, které přispívají k chronickému zánětu včetně PsA a psoriázy [24].
Mechanismus účinku guselkumabu se rovněž liší od ustekinumabu, který ovlivňuje podjednotku p40 sdílenou IL 23 a IL 12. Bylo také zjištěno, že IL 12 může mít protektivní roli proti zánětu, a to inhibicí T lymfocytů v zánětlivých psoriatických kožních lézích [25].
Lze již diskutovat, jaké bude postavení guselkumabu v algoritmu léčby PsA. V guidelines EULAR 2020 se biologické léčby týká doporučení číslo 6, které uvádí, že u pacientů s periferní artritidou a nedostatečnou odpovědí na alespoň jeden csDMARD by měla být léčba bDMARD zahájena [5]. Pokud je relevantní kožní postižení, je možné dát přednost inhibitoru IL 17 nebo IL 12/23.
V doporučeních z roku 2015 bylo uvedeno, že při volbě bDMARD mají být preferovány inhibitory TNFα. V nových guidelines již není při doporučení volby prvního bDMARD žádná preference mezi anti TNFα, anti IL 17 a anti IL 12/23. Důvodem je fakt, že dlouhodobé studie s inhibitory IL 17 sekukinumabem a ixekizumabem prokázaly velmi dobrou účinnost a bezpečnost při léčbě skeletálních manifestací PsA a v head to head klinickém sledování léčby ixekizumabem oproti adalimumabu také větší vliv na zmírnění kožního syndromu [26,27]. Při aplikaci inhibitoru IL 12/23 ustekinumabu se projevila menší účinnost na kloubní syndrom, nadějné jsou výsledky čistých inhibitorů IL 23 (guselkumab, risankizumab, tildrakizumab) v léčbě psoriázy a čeká se na další výsledky při užití inhibitorů IL 23 v léčbě PsA. Dá se říci, že guselkumab v klinických studiích DISCOVER 1 a DISCOVER 2 nadějné předpoklady splnil.
Závěr
Guselkumab je specifický inhibitor podjednotky p19 IL 23, který prokázal v klinických studiích fáze III velmi dobrý efekt na celé spektrum projevů psoriatické nemoci. Jeho bezpečnostní profil je dobrý, což vede k závěru, že guselkumab splňuje příznivý poměr účinnosti a rizika a může být přínosem pro pacienty s aktivní PsA s nedostatečným efektem standardní léčby a po selhání terapie csDMARD.
Článek vznikl s podporou společnosti Janssen Cilag s.r.o.
Seznam použité literatury
- [2] Gudu T, Gossec C. Quality of life in psoriatic arthritis. Expert Rev Clin Immunol 2018; 14: 405−417.
- [3] Rudwaleit M, van der Heijde D, Landewé R, et al. Development of ASAS for axial spondyloarthritis, validation of final section. Ann Rheum Dis 2009; 68: 777−783.
- [4] Smolen J, Braun J, Dougados M. Treating axial spondyloarthritis, including ankylosing spondylitis, especially psoriatic arthritis to target. Recommendations of an international TASK force. Ann Rheum Dis 2018; 77: 3−17.
- [5] Gossec L, Baraliakos X, Kerschbaumer A, et al. EULAR recommendations for the management of psoriatic arthritis with pharmacological therapies: 2019 update. Ann Rheum Dis 2020; 79: 700−712.
- [6] Coates LC, Kavanaugh A, Mease PJ, et al. Group for research and assessment of psoriasis and psoriatic arthritis. Arthritis Rheumatol 2016; 68: 1061−1071.
- [7] Girolomoni G, Altomare G, Ayala F. Safety of anti‑TNF alfa agents in the treatment of psoriasis and psoriatic arthritis. Immunopharmacol Immunotoxicol 2012; 34: 548−560.
- [8] Deodhar A, Mease PJ, Mc Innes, et al. Long‑term safety of secukinumab in patients with moderate severe plaque psoriasis, psoriatic arthritis and ankylosing spondylitis: integrated pooled clinical trial and post‑marketing surveillances data. Arthritis Res Ther 2019; 21: 111−121.
- [9] Suzuki E, Mellins ED, Gerschwin ME, et al. The IL‑23/IL‑17 axis on psoriatic arthritis. Autoimmune Rev 2014; 13: 496−502.
- [10] Schurich A, Raine C, Morris V, et al. T cell related chronic inflammation: implications of immunodeficiency and therapeutic blockade. Rheumatology (Oxford) 2018; 57: 246−254.
- [11] Boutet M‑A, Nerviani A, Gallo Afflitto G, Pitzalis C. Role of the IL‑23/IL‑17 Axis in Psoriasis and Psoriatic Arthritis: The Clinical Importance of Its Divergence in Skin and Joints. Int J Mol Sci 2018; 19: 530.
- [12] Siebert S, Millar NL, McInnes IB. Why did IL‑23p19 inhibition fail in AS: a tale of tissues, trials or translation? Ann Rheum Dis 2019; 78: 1015−1018.
- [13] Benson JM, Peritt D, Scallon BJ, et al. Discovery and mechanism of ustekinumab: a human monoclonal antibody targeting interleukin‑12 and interleukin‑23 for treatment of immune‑mediated disorders. MAbs 2011; 3: 535–545.
- [14] SPC Tremfya. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/tremfya‑epar‑product‑information_cs.pdf
- [15] Reich K, Papp KA, Armstrong AW, et al. Safety of guselkumab in patients with moderate to severe psoriasis treated through 100 weeks a pooled analysis from the randomized VOYAGE 1 and VOYAGE 2 studies. Br J Dermatol 2019; 180: 1039−1049.
- [16] Griffiths CEM, Papp KA, Song M, et al. Maintenance of response with up to 4 years of continuous guselkumab treatment: Results from the VOYAGE 1 phase 3 trial. Skin 2019; 3: 202(Abstr).
- [17] Deodhar A, Gotlieb AB, Boencke WH. Efficacy and safety of guselcumab in patients with active psoriatic arthritis: a randomized, double‑blind, placebo‑controlled study, phase II study. Lancet 2018; 391: 2213−2224.
- [18] Mease PJ, Rahman P, Gotlieb A, et al. Guselkumab in biologic‑naive patients with active psoriatic arthritis (DISCOVER‑2): a double blind, randomised, placebo‑controlled phase 3 trial. Lancet 2020; 395: 1126−1136.
- [19] Mease PJ, Rahman P, Gottlieb AB, et al. Guselkumab, an Anti‑interleukin‑23p19 Monoclonal Antibody, in Biologic‑naïve Patients with Active Psoriatic Arthritis: Week 24 Results of the Phase 3, Randomized, Double‑blind, Placebo‑controlled Study. Presented at the American College of Rheumatology (ACR) Congress, 8−13 November 2019, Atlanta, USA. Abstract L13.
- [20] McInnes IB, Rahman P, Gottlieb AB, et al. Efficacy and Safety of Guselkumab, an Interleukin‑23p19‑Specific Monoclonal Antibody, Through One Year in Biologic‑Naive Patients With Psoriatic Arthritis. Arthritis Rheumatol 2021; 73: 604−616.
- [21] Deodhar A, Helliwell PS, Boencke WH, et al. Guselkumab in patients with active psoriatic arthritis who were biologic naive or had previously received TNF alfa inhibitor treatment (DISCOVER‑1): a double‑blind, randomised, placebo‑controlled phase 3 trial. Lancet 2020; 395: 1115−1125.
- [22] Deodhar A, Helliwell P, Boencke WH, et al. Guselkumab, an Anti‑interleukin‑23p19 Monoclonal Antibody, in Patients with Active Psoriatic Arthritis Who Were Biologic‑Naïve or Prior TNFα Inhibitor‑Treated: Week 24 Results of a Phase 3, Randomized, Double‑blind, Placebo‑controlled Study. Presented at the American College of Rheumatology (ACR) Congress, 8−13 November 2019, Atlanta, USA. Oral presentation 807.
- [23] Helliwell P, Gladman D, Poddubnyy D, et al. Efficacy of guselkumab, a monoclonal antibody that specifically binds to the p19 subunit of IL‑23, on endpoints related to axial involvement in patients with active PsA with imaging – confirmed sacroiliitis. Week‑24 results from two phase 3, randomized, double‑blind, placebo‑controlled studies. Ann Rheum Dis 2020; 79(Suppl 1): OP0054(Abstr).
- [24] Tato CM, Cua DJ. Reconciling id, ego, and superego within interleukin‑23. Immunol Rev 2008; 226: 103−111.
- [25] Kulig P, Musiol S, Freiberger SN, et al. IL‑12 protects from psoriasiform skin inflammation. Nat Commun 2016; 7: 134−166.
- [26] Marzo‑Ortega H, Sieper J, Kivitz A, et al. 5‑year efficacy and safety of secukinumab in patients with ankylosing spondylitis: end‑of‑study results from the phase 3 MEASURE 2 trial. Rheumatology 2020; 2: e339−e346.
- [27] Deodhar A, Poddubnyy D, Pacheco‑Tena C, et al. Efficacy and safety of ixekizumab in the treatment of radiographic axial spondyloarthritis: sixteen‑week results from a phase III randomized, double‑blind, placebo‑controlled trial in patients with prior inadequate response to or intolerance of tumor necrosis factor inhibitors. Arthritis Rheum 2019; 71: 599−611.