Index FIB-4 v diagnostice jaterní fibrózy a úskalí jeho vyhodnocení
Souhrn
Šmíd V. Index FIB‑4 v diagnostice jaterní fibrózy a úskalí jeho vyhodnocení. Remedia 2024; 34: 386–391.
Diagnostika jaterních chorob sestává ze dvou kroků: určení příčiny jaterního poškození a stanovení jeho pokročilosti, čímž se myslí zejména vyloučení přítomnosti pokročilé jaterní fibrózy. Pro tyto účely nelze využít jednotlivé rutinní laboratorní parametry ani běžnou abdominální sonografii, která uspokojivou senzitivitu vykazuje až u velmi pokročilých strukturálních změn jater při cirhóze. Zlatým standardem v diagnostice jaterní fibrózy je v současné době hodnocení tuhosti jaterní tkáně pomocí jaterní elastografie. Její dostupnost je však v běžné praxi omezená, a proto tato metoda není vhodná ke screeningu rozsáhlých skupin pacientů, kteří jsou v riziku rozvoje či přítomnosti jaterní fibrózy (diabetici, pacienti s obezitou, metabolickým syndromem, nadměrnou konzumací alkoholu apod.). Z tohoto důvodu jsou do rutinní praxe zaváděny tzv. neinvazivní skórovací indexy využívající kombinaci většinou běžně dostupných klinických dat a laboratorních parametrů. Pravděpodobně nejvíce využívaným je index FIB‑4, jehož použití v rutinní praxi doporučují téměř všechny odborné organizace. Jeho stanovení je rychlé, nepřináší zvýšené náklady (kalkuluje se z rutinně dostupných dat: věk, hodnoty AST, ALT, trombocyty) a dokáže s uspokojivou přesností primárně vyloučit přítomnost pokročilé jaterní choroby. Jeho hlavní nevýhodou je relativně vyšší podíl falešně pozitivních výsledků, o čemž mj. pojednává také následující text.
Klíčová slova: Fibrosis‑4 index – FIB‑4 – jaterní cirhóza – jaterní fibróza – neinvazivní testy jaterní fibrózy – MASLD.
Summary
Smid V. FIB‑4 Index in the diagnosis of liver fibrosis and the pitfalls of its evaluation. Remedia 2024; 34: 386–391.
Evaluation of liver disease consists of two steps in general: finding out why the liver is damaged and establishing the severity of its damage, especially ruling out an advanced liver cirrhosis. Neither routine laboratory parameters, nor a common abdominal utrasonography (achieving an acceptable sensitivity for very advanced structural cirrhotic changes only) are useful in this context. Liver elastography, quantifying the liver stiffness, represents a current gold standard in the evaluation of liver cirrhosis. Its availability, however, is limited in everyday clinical practice, making it unsuitable for screening of large patient groups at risk of this condition (diabetics, obese patients, metabolic syndrome sufferers, excessive alcohol users etc.). Thus, so called non‑invasive scoring systems are being introduced in clinical practice, using combinations of easily available clinical data and laboratory parameters. FIB‑4 is probably the most popular one, being recommended by virtually all expert organizations. The calculation of FIB‑4 is fast, cheap (using routine information such as age, AST and ALT levels, thrombocyte count) and capable of excluding an advanced liver disease with reasonable accuracy. Its main drawback consists of relatively high percentage of false positive results – a problem discussed in detail below.
Key words: fibrosis‑4 Index – FIB‑4 – liver cirrhosis – liver fibrosis – non‑invasive test for liver fibrosis – MASLD.
Úvod
V současné době čelíme významnému nárůstu incidence jaterních chorob, které řadíme mezi celosvětově nejčastější příčiny úmrtí vůbec [1], a vzrůstající trend trvá již mnoho desetiletí [2]. Na této nepříznivé situaci má zásadní podíl metabolicky asociovaná steatotická choroba jater (MASLD, dříve NAFLD), která představuje vůbec nejčastější chronické onemocnění jater současnosti. Její prevalence strmě stoupá [2,3] a podle recentních dat postihuje více než 30 % dospělé populace ekonomicky vyspělých zemí [4]. Jejím rozvojem jsou nejvíce ohroženi pacienti s diabetes mellitus 2. typu (DM2) a/nebo obezitou, mezi nimiž prevalence MASLD dosahuje více než 65 %. Většina aktuálních doporučení upozorňuje na nutnost identifikace rizikových pacientů z pohledu možného vzniku či přítomnosti MASLD (tzv. at‑risk patients). Například v populaci diabetiků 2. typu a obézních osob se prevalence jaterní steatózy pohybuje kolem 70–75 %, jaterní fibróza se vyskytuje u téměř 20 % z nich [5]. Situace v České republice je podobná [6].
Jaterní steatóza je počátečním stadiem velké části chronických jaterních onemocnění včetně MASLD či alkoholové choroby jater. V dnešní době již steatózu nepovažujeme za benigní stav. Je úzce spjata s rizikem rozvoje kardiometabolických a onkologických rizik. Z pohledu celkové a zejména jaterní morbidity a mortality je pak klíčový rozvoj nekroinflamatorních změn a vznik jaterní fibrózy, která představuje jediný histolopatologický nález nezávisle spjatý s dlouhodobým celkovým přežitím, nutností jaterní transplantace a s morbiditou z jaterních příčin [7].
Diagnostika jaterní fibrózy a neinvazivní testy
Diagnostika jaterní steatózy se opírá převážně o sonografické vyšetření jater, avšak pro detekci jaterní fibrózy má velmi nízkou senzitivitu. Zlatým standardem je v současné době jaterní elastografie [8]. Její dostupnost je však stále relativně omezená, a proto ji nelze využít v rámci plošného testování rozsáhlých kohort pacientů, jakými jsou např. diabetici nebo pacienti s nadváhou a obezitou. Aktuální doporučené postupy Evropské asociace pro studium jater (EASL) [9], Americké asociace pro studium jaterních onemocnění (AASLD) [10,11] i České hepatologické společnosti [12] doporučují jako první krok v diagnostice jaterní fibrózy kalkulovat tzv. neinvazivní skóre (indexy), nejčastěji index FIB‑4 (zahrnující veličiny věk, hodnoty alaninaminotransferázy [ALT], aspartátaminotransferázy [AST] a trombocytů) [13,14]. Jako alternativu lze použít další neinvazivní testy, zejména NAFLD Fibrosis Score (věk, index tělesné hmotnosti [BMI], DM2, ALT, AST, trombocyty, albumin) [15]. Mezi další patří např. skóre APRI (AST a trombocyty), BARD (ALT, AST, BMI, DM2) nebo ELF™ test (komerční kit).

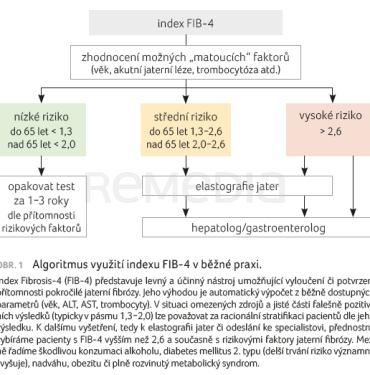 Pomocí FIB‑4, resp. jeho dvou mezních hodnot, jsme schopni vyloučit nebo potvrdit přítomnost pokročilé jaterní fibrózy. Pokud je hodnota nižší než 1,3, je pravděpodobnost přítomnosti fibrózy nízká. Pokud se hodnota FIB‑4 nachází v pásmu 1,3–2,6, je vhodné doplnit elastografii jater. Pacienty s hodnotami FIB‑4 převyšujícími 2,6 a/nebo s elastograficky prokázanými pokročilejšími formami jaterní fibrózy bychom měli odeslat ke specialistovi (obr. 1). Za významné klady FIB‑4 lze považovat nízké náklady, snadnou kalkulaci, širokou dostupnost a uspokojivou senzitivitu [16]. Při výběru nejvhodnějšího neinvazivního testu mohla představovat výhodu také skladba vstupních proměnných, které jsou zcela rutinně stanovovány i při běžných preventivních vyšetřeních. Ve srovnání s např. NAFLD Fibrosis Score, které obsahuje také BMI, lze výsledek FIB‑4 získat automaticky, aniž by musel zdravotnický personál vložit jakýkoliv nerutinně (nelaboratorně) stanovovaný parametr (hmotnost a výška pro výpočet BMI). Shoda v rámci výše uvedených doporučených postupů zásadní měrou dopomohla k zařazení FIB‑4 do výsledkového listu mnoha českých laboratoří, které tento index během posledního roku začaly rutinně stanovovat. FIB‑4 tak mohou nalézt ve výsledkovém listu lékaři řady odborností. Je proto žádoucí upozornit na správnou interpretaci získaných výsledků a na jejich možné ovlivnění celou řadou faktorů.
Pomocí FIB‑4, resp. jeho dvou mezních hodnot, jsme schopni vyloučit nebo potvrdit přítomnost pokročilé jaterní fibrózy. Pokud je hodnota nižší než 1,3, je pravděpodobnost přítomnosti fibrózy nízká. Pokud se hodnota FIB‑4 nachází v pásmu 1,3–2,6, je vhodné doplnit elastografii jater. Pacienty s hodnotami FIB‑4 převyšujícími 2,6 a/nebo s elastograficky prokázanými pokročilejšími formami jaterní fibrózy bychom měli odeslat ke specialistovi (obr. 1). Za významné klady FIB‑4 lze považovat nízké náklady, snadnou kalkulaci, širokou dostupnost a uspokojivou senzitivitu [16]. Při výběru nejvhodnějšího neinvazivního testu mohla představovat výhodu také skladba vstupních proměnných, které jsou zcela rutinně stanovovány i při běžných preventivních vyšetřeních. Ve srovnání s např. NAFLD Fibrosis Score, které obsahuje také BMI, lze výsledek FIB‑4 získat automaticky, aniž by musel zdravotnický personál vložit jakýkoliv nerutinně (nelaboratorně) stanovovaný parametr (hmotnost a výška pro výpočet BMI). Shoda v rámci výše uvedených doporučených postupů zásadní měrou dopomohla k zařazení FIB‑4 do výsledkového listu mnoha českých laboratoří, které tento index během posledního roku začaly rutinně stanovovat. FIB‑4 tak mohou nalézt ve výsledkovém listu lékaři řady odborností. Je proto žádoucí upozornit na správnou interpretaci získaných výsledků a na jejich možné ovlivnění celou řadou faktorů.
Faktory nepříznivě ovlivňující výsledek FIB‑4
Jako každý diagnostický nástroj také neinvazivní skórovací indexy mají svoji specificitu a senzitivitu, tedy parametry, které ve svém důsledku určují podíl falešně pozitivních a falešně negativních výsledků. Hned v úvodu je nutné čtenáře upozornit, že všechny používané metody včetně těch, které považujeme za zlatý standard v diagnostice jaterní fibrózy, zdaleka nedosahují hodnot senzitivity a specificity nad 90 %. Existují práce poukazující na výraznou nepřesnost jaterní biopsie v diagnostice jaterní cirhózy [17]. To potvrzují výsledky práce zabývající se párovými biopsiemi prováděnými u téhož pacienta s MASLD během jednoho odběru, které poukázaly na skutečnost, že se takové dvě biopsie liší v tíži jaterní fibrózy až o dva stupně [18]. Stejně tak délka získaného vzorku a jeho fragmentace mají zásadní vliv na získaný výsledek [19]. Nejinak je tomu u metod založených na hodnocení tuhosti jaterní tkáně, mezi něž nejčastěji patří tranzientní elastografie (FibroScanÒ), point shear wave elastografie a 2D shear wave elastografie. Pokud budeme diskutovat jejich senzitivitu a specificitu, dosahují obvykle hodnot kolem 0,75–0,85 v detekci pokročilé fibrózy (F3, F4) [20,21]. Tedy hodnot, jichž nezřídka dosahují také neinvazivní skórovací indexy [22].
Jak vyplývá z podstaty vzorce pro výpočet FIB‑4, za klíčové faktory ovlivňující jeho senzitivitu a specificitu lze primárně považovat věk, aktivitu jaterních aminotransferáz a koncentraci trombocytů.
Věk
FIB‑4 byl primárně studován v kohortách věkového rozptylu 35–65 let. Mnohé práce poukázaly na skutečnost, že FIB‑4 nemá uspokojivou senzitivitu a specificitu v detekci jaterní fibrózy zejména u pacientů starších 65 let, což vede mj. k vysoké míře falešně pozitivních výsledků [23]. Stejně tak u pacientů mladších 35 let [24]. Signifikantní snížení počtu falešně pozitivních výsledků lze docílit změnou mezních (cut‑off) hodnot. Za obvyklou hranici se považuje 2,0 (namísto 1,3), u níž současně nedochází k nepříznivému ovlivnění senzitivity, která zůstává na uspokojivých 77 % [24]. Japonská multicentrická studie stanovila věkově specifické hranice pro diagnostiku jaterní fibrózy pomocí FIB‑4. Ve věku 50–59 let jsou mezní hodnoty 1,24 a 1,96, ve věku 60–69 let pak 1,88 a 2,67 a pro jedince starší 70 let stanovila mezní hodnoty na 1,95 a 2,67 [25]. Obecně lze shrnout, že vysokou specificitu poskytuje výsledek menší než 1,3 (vyloučení přítomnosti jaterní fibrózy), naproti tomu vysokou senzitivitu dává výsledek vyšší než 3,25 (vysoká pravděpodobnost jaterní fibrózy) [21]. Rozsáhlá metaanalýza popisující diagnostickou hodnotu indexu FIB‑4 v kohortě pacientů s hepatitidou B stanovila jako nejvhodnější mezní hodnotu pro detekci významné fibrózy rozpětí 2,9–3,6, kdy v tomto rozsahu byla hodnota AUROC 0,96 [26].
Aktivita jaterních enzymů ALT a AST
Aktivita jaterních enzymů hraje při interpretaci výsledku FIB‑4 důležitou roli. Je nezbytné vždy znát klinické pozadí a vyloučit akutně probíhající jaterní lézi (včetně např. polékového poškození jater – drug‑induced liver injury, DILI). ALT je relativně hepatospecifický, resp. jeho zvýšená aktivita je specifičtější ve srovnání s aktivitou AST, která může být naopak relativně často zvýšena z extrahepatálních příčin. Mezi možné příčiny zvýšené aktivity AST patří poškození svalů, úraz, polohové trauma, revmatická a svalová onemocnění (např. myozitidy, rhabdomyolýza apod.), intenzivní cvičení, renální selhání či kardiovaskulární onemocnění [27].
Trombocyty
Trombocyty ve vzorci FIB‑4 figurují jako jmenovatel, chcete‑li, dělitel, proto jejich zvýšená koncentrace významně snižuje hodnotu FIB‑4. Naopak vyšší hodnoty FIB‑4 získáme u pacientů s trombocytopenií (< 150 × 109/l). Ta představuje nejčastější hematologickou abnormalitu u pacientů s pokročilou jaterní fibrózou a cirhózou, je tedy ukazatelem pokročilého onemocnění zejména ve vztahu k přítomnosti portální hypertenze. Podkladem tohoto stavu jsou tři hlavní patofyziologické mechanismy: snížená produkce trombopoetinu, zvýšená sekvestrace a destrukce trombocytů převážně ve slezině a játrech, která je způsobena nespecificky vlivem střižných sil, fibrinolýzou a bakteriální translokací. U autoimunitních chorob jater se na vzniku trombocytopenie podílí také imunologicky mediovaná destrukce tzv. protidestičkovými imunoglobuliny. K trombocytopenii však vedou také stavy přímo nesouvisející s rozvojem jaterní fibrózy, jakými jsou poruchy krvetvorby způsobené různými faktory (chemoterapeutika, hematoonkologická onemocnění), útlum krvetvorby v důsledku karence stopových prvků (např. vitaminu B12), kostní onemocnění (primární i sekundární).
Trombocytóza (> 400 × 109/l) není pro jaterní choroby typická. U pacientů, u nichž hodnotíme výsledek FIB‑4 a pátráme po přítomnosti pokročilé jaterní choroby, je proto namístě opatrnost u jedinců, kteří mají v anamnéze faktory vedoucí k trombocytóze: myeloproliferativní onemocnění a malignity (lymfomy, karcinomy plic, tlustého střeva ad.), nespecifické střevní záněty (typicky Crohnova nemoc), reaktivní trombocytóza způsobená vlivem infekce a zánětu, systémového onemocnění (Wegenerova nemoc, revmatoidní artritida ad.). Obtížné hodnocení získaného výsledku FIB‑4 je také u pacientů po splenektomii, při vrozených poruchách krvetvorby či krvácivosti (sideropenie) a vzácných onemocněních spojených se splenomegalií (Evansův syndrom ad.). U těchto pacientů je nutné výsledek FIB‑4 kombinovat ideálně s jinými neinvazivními testy před samotnou úvahou o provedení jaterní elastografie.
Úskalí hodnocení FIB‑4 a skrytý přesah jeho výpovědní hodnoty
FIB‑4 zcela jistě není ideálním a bezchybným nástrojem pro detekci pokročilého jaterního onemocnění (jaterní fibrózy a cirhózy). Přináší však nesporné výhody. Lze jej používat zcela rutinně bez nutnosti dalšího vstupu, je levný, široce dostupný, dobře validovaný a má uspokojivou specificitu. Problém představuje nízká senzitivita, kterou lze ovlivnit zvýšením mezních hodnot (cut‑off values) u pacientů starších 65 let (nebo mladších 35 let). Získaný výsledek nelze interpretovat bez znalosti klinického pozadí a vyžaduje expertizu. Výsledek konfrontujeme s koncentrací trombocytů u konkrétního pacienta (viz odstavec Trombocyty). Se znalostí faktu, že FIB‑4 přináší významnou část falešně pozitivních výsledků (typicky v pásmu 1,3–2,0), lze za vhodné považovat stratifikaci pacientů s vyšším FIB‑4 do skupin na základě rizika přítomnosti pokročilé jaterní choroby. Současně s ním hodnotíme také anamnézu a celkový klinický kontext. Následující postup, tedy odeslání k provedení jaterní elastografie, by měl též zohledňovat místní zdroje. Za nejrizikovější pacienty, tedy ty, které bychom měli odesílat prioritně, lze považovat jedince s výsledkem FIB‑4 vyšším než 2,6, kteří mají současně rizikové faktory přítomnosti a vzniku jaterní fibrózy. Mezi ty řadíme především DM2 (delší trvání riziko významně zvyšuje), nadváhu, obezitu, metabolický syndrom či škodlivou konzumaci alkoholu. Pro nízkorizikovou populaci lze obecně shrnout, že neinvazivní testy jaterní fibrózy by měly být použity primárně k vyloučení její přítomnosti než k jejímu průkazu.
Výsledek indexu FIB‑4 nerozhoduje pouze o dalším směrování pacienta, ale umožňuje v běžné praxi také stratifikaci řady rizik a do jisté míry predikuje jeho prognózu [28]. Předně jde o klinické příhody spojené s rizikem úmrtí ze všech příčin (all‑cause mortality), vzniku závažných kardiovaskulárních příhod, vzniku hepatocelulárního karcinomu (HCC) a rozvoje chronického onemocnění ledvin. Tento úzký vztah potvrdila retrospektivní analýza pacientů s MASLD zařazených do longitudinální neintervenční studie (TARGET‑NASH) [29]. Hodnota FIB‑4 je nezávisle spojena s rizikem rozvoje kardiovaskulárních onemocnění [30]. I proto je žádoucí, aby patologická hodnota FIB‑4 byla brána v úvahu při hodnocení celkového rizika v rámci primární péče. Pokud jde o rizika vzniku chronického jaterního onemocnění, klinický význam FIB‑4 dokládá také skutečnost, že jej EASL v rámci svých doporučených postupů zařadil mezi klíčové rizikové faktory asociované s vyšším rizikem vzniku HCC (FIB‑4 > 3,25). Dalšími faktory jsou vyšší věk, zvýšená tuhost jater (dle elastografie), obezita a kouření [9].
Závěr
Po mnoha desetiletích charakterizovaných absencí nových rutinně stanovovaných diagnostických metod v hepatologii přináší FIB‑4 užitečný nástroj umožňující široký screening rozsáhlých kohort pacientů. FIB‑4 nezvyšuje náklady, lze jej kalkulovat zcela automaticky, a nepředstavuje tak ani zvýšenou časovou zátěž zdravotnického personálu. S vědomím alarmujícího nárůstu počtu pacientů s významným rizikem vzniku jaterní fibrózy (zejména dg. MASLD) je opodstatněné, ne‑li přímo nutné, mít podobný diagnostický nástroj v paletě rutinně stanovovaných parametrů. Jeho hlavní nevýhodou je však relativně vyšší podíl falešně pozitivních výsledků. Interpretace proto klade důraz na klinickou expertizu a komplexní zhodnocení nálezů konkrétního pacienta. V situaci omezených zdrojů (nedostupnost jaterní elastografie a hepatologických/gastroenterologických ambulancí) lze doporučit stratifikaci pacientů dle získaného výsledku a přítomnosti rizikových faktorů jaterní fibrózy. Na základě tohoto klíče by jedinci s hodnotami FIB‑4 > 2,6 a s více rizikovými faktory měli být odesíláni k vyšetření prioritně.
Práce byla podpořena granty MZČR RVO‑VFN00064165 a AZV‑NU23‑01‑00288.
MUDr. Václav Šmíd, Ph.D.
IV. interní klinika – klinika gastroenterologie a hepatologie 1. LF UK a VFN
U Nemocnice 499/2, 128 08 Praha 2
e-mail: vaclav.smid@lf1.cuni.cz
Literatura
[1] Asrani SK, Devarbhavi H, Eaton J, Kamath PS. Burden of liver diseases in the world. J Hepatol 2019; 70: 151–171.
[2] Allen AM, Therneau TM, Larson JJ, et al. Nonalcoholic fatty liver disease incidence and impact on metabolic burden and death: A 20 year‑community study. Hepatology 2018; 67: 1726–1736.
[3] Younossi Z, Tacke F, Arrese M, et al. Global Perspectives on Nonalcoholic Fatty Liver Disease and Nonalcoholic Steatohepatitis. Hepatology 2019; 69: 2672–2682.
[4] Riazi K, Azhari H, Charette JH, et al. The prevalence and incidence of NAFLD worldwide: a systematic review and meta‑analysis. Lancet Gastroenterol Hepatol 2022; 7: 851–861.
[5] Younossi ZM, Golabi P, de Avila L, et al. The global epidemiology of NAFLD and NASH in patients with type 2 diabetes: A systematic review and meta‑analysis. J Hepatol 2019; 71: 793–801.
[6] Dvorak K, Hainer R, Petrtyl J, et al. The prevalence of nonalcoholic liver steatosis in patients with type 2 diabetes mellitus in the Czech Republic. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2015; 159: 442–448.
[7] Angulo P, Kleiner DE, Dam‑Larsen S, et al. Liver Fibrosis, but No Other Histologic Features, Is Associated With Long‑term Outcomes of Patients With Nonalcoholic Fatty Liver Disease. Gastroenterology 2015; 149: 389–37 e10.
[8] Dietrich CF, Bamber J, Berzigotti A, et al. EFSUMB Guidelines and Recommendations on the Clinical Use of Liver Ultrasound Elastography, Update 2017 (Long Version). Ultraschall Med 2017; 38: e16–e47.
[9] European Association for the Study of the Liver, Diabetes EAftSo, Obesity EAftSo. EASL‑EASD‑EASO Clinical Practice Guidelines on the management of metabolic dysfunction‑associated steatotic liver disease (MASLD). J Hepatol 2024; doi:10.1016/j.jhep.2024.04.031.
[10] Chalasani N, Younossi Z, Lavine JE, et al. The diagnosis and management of nonalcoholic fatty liver disease: Practice guidance from the American Association for the Study of Liver Diseases. Hepatology 2018; 67: 328–357.
[11] Rinella ME, Neuschwander‑Tetri BA, Siddiqui MS, et al. AASLD Practice Guidance on the clinical assessment and management of nonalcoholic fatty liver disease. Hepatology 2023; 77: 1797–1835.
[12] Bruha R, Dvorak K, Fejfar T, et al. Doporučený postup České hepatologické společnosti ČLS JEP pro diagnostiku a léčbu Nealkoholové tukové choroby jater (NAFLD). Gastroent Hepatol 2020; 74: 103–110.
[13] Sterling RK, Lissen E, Clumeck N, et al. Development of a simple noninvasive index to predict significant fibrosis in patients with HIV/HCV coinfection. Hepatology 2006; 43: 1317–1325.
[14] Vallet‑Pichard A, Mallet V, Nalpas B, et al. FIB‑4: an inexpensive and accurate marker of fibrosis in HCV infection. comparison with liver biopsy and fibrotest. Hepatology 2007; 46: 32–36.
[15] Angulo P, Hui JM, Marchesini G, et al. The NAFLD fibrosis score: a noninvasive system that identifies liver fibrosis in patients with NAFLD. Hepatology 2007; 45: 846–854.
[16] Jung J, Loomba RR, Imajo K, et al. MRE combined with FIB‑4 (MEFIB) index in detection of candidates for pharmacological treatment of NASH‑related fibrosis. Gut 2021; 70: 1946–1953.
[17] Afdhal NH, Nunes D. Evaluation of liver fibrosis: a concise review. Am J Gastroenterol 2004; 99: 1160–1174.
[18] Ratziu V, Charlotte F, Heurtier A, et al. Sampling variability of liver biopsy in nonalcoholic fatty liver disease. Gastroenterology 2005; 128: 1898–1906.
[19] Poynard T, Halfon P, Castera L, et al. Variability of the area under the receiver operating characteristic curves in the diagnostic evaluation of liver fibrosis markers: impact of biopsy length and fragmentation. Aliment Pharmacol Ther 2007; 25: 733–739.
[20] Barr RG, Wilson SR, Rubens D, et al. Update to the Society of Radiologists in Ultrasound Liver Elastography Consensus Statement. Radiology 2020; 296: 263–274.
[21] European Association for the Study of the Liver. Electronic address eee, Clinical Practice Guideline P, Chair, representative EGB, Panel m. EASL Clinical Practice Guidelines on non‑invasive tests for evaluation of liver disease severity and prognosis – 2021 update. J Hepatol 2021; 75: 659–689.
[22] Bonnard P, Sombie R, Lescure FX, et al. Comparison of elastography, serum marker scores, and histology for the assessment of liver fibrosis in hepatitis B virus (HBV)‑infected patients in Burkina Faso. Am J Trop Med Hyg 2010; 82: 454–458.
[23] Graupera I, Thiele M, Serra‑Burriel M, et al. Low Accuracy of FIB‑4 and NAFLD Fibrosis Scores for Screening for Liver Fibrosis in the Population. Clin Gastroenterol Hepatol 2022; 20: 2567–2576 e6.
[24] McPherson S, Hardy T, Dufour JF, et al. Age as a Confounding Factor for the Accurate Non‑Invasive Diagnosis of Advanced NAFLD Fibrosis. Am J Gastroenterol 2017; 112: 740–751.
[25] Ishiba H, Sumida Y, Tanaka S, et al. The novel cutoff points for the FIB4 index categorized by age increase the diagnostic accuracy in NAFLD: a multi‑center study. J Gastroenterol 2018; 53: 1216–1224.
[26] Li Y, Chen Y, Zhao Y. The diagnostic value of the FIB‑4 index for staging hepatitis B‑related fibrosis: a meta‑analysis. PLoS One 2014; 9: e105728.
[27] Newsome PN, Cramb R, Davison SM, et al. Guidelines on the management of abnormal liver blood tests. Gut 2018; 67: 6–19.
[28] Xu XL, Jiang LS, Wu CS, et al. The role of fibrosis index FIB‑4 in predicting liver fibrosis stage and clinical prognosis: A diagnostic or screening tool? J Formos Med Assoc 2022; 121: 454–466.
[29] Sanyal AJ, Munoz B, Cusi K, et al. Validation of a Clinical Risk‑based Classification System in a Large Nonalcoholic Fatty Liver Disease Real‑world Cohort. Clin Gastroenterol Hepatol 2023; 21: 2889–2900 e10.
[30] Schonmann Y, Yeshua H, Bentov I, Zelber‑Sagi S. Liver fibrosis marker is an independent predictor of cardiovascular morbidity and mortality in the general population. Dig Liver Dis 2021; 53: 79–85.