Nový prandiální analog inzulinu FIAsp – rychle působící inzulin aspart a jeho využití v praxi
Souhrn:
Zlepšení kompenzace diabetu snižuje u pacientů riziko vývoje obávaných komplikací, jak je již opakovaně zdokumentováno. Dosažení doporučených hodnot kompenzace diabetu je spojeno mj. s léčbou postprandiální hyperglykemie, což je velmi náročný úkol při léčbě diabetes mellitus 1. i 2. typu. Po období léčby humánním inzulinem se objevila v léčbě diabetu prandiálně podaná krátkodobě působící analoga, která sice rychlejší absorpcí dosáhla rychlejšího nástupu účinku a kratší doby působení, ale dosud nereplikují profil sekrece endogenního inzulinu zdravých osob. Nový rychlejší aspart – Faster Insulin Aspart, FIAsp – je inzulin aspart, jehož roztok je obohacen o dvě pomocné látky – niacinamid, který je odpovědný za zrychlený přestup do krevního řečiště endoteliálními buňkami kapilár, a arginin, který udržuje roztok stabilní. Článek se zabývá výsledky klinických hodnocení tohoto nového ultrakrátce působícího analoga, které je možno přenést do klinické praxe ke zlepšení kvality nejen léčby diabetu, ale také kvality života pacientů s touto nemocí.
Key words: diabetes mellitus, faster aspart, FIAsp, postprandial glycaemia, flexibility.
Summary:
As thoroughly documented, improving diabetes compensation lowers the risk of developing adverse complications in patients. Good control of glycaemia means to achieve the recommended level of postprandial glycaemia as well. It is the most challenging aspect of the treatment of both type 1 and 2 diabetes mellitus. After the era of treatment with human insulin, contemporary prandial insulin analogs with more favorable properties have been used – more rapid absorption, earlier onset of action, a shorter duration of action. Nevertheless, those still do not reproduce the secretion profile of endogenous insulin in healthy individuals. New faster insulin aspart – FIAsp − is enriched with two compounds – niacin amid augments the permeation rate across capillary endothelial cells and arginin serves as a stabilizing agent. The article summarizes the important outcomes of clinical trials with faster aspart and the possibilities to translate the results into clinical practice to improve the quality of diabetes treatment and the quality of life for people with diabetes mellitus.
Úvod
Rozvoj současné diabetologie s sebou přináší do portfolia léčby diabetes mellitus 1. typu (DM1T) i diabetes mellitus 2. typu (DM2T) stále nové léky. Mnoho pacientů s diabetem potřebuje pro dosažení uspokojivé kompenzace léčbu inzulinem, pro diabetika 1. typu je inzulin životní nezbytností. Přínos dobré kompenzace je nezpochybnitelný a od počátku onemocnění je na její dosažení kladen důraz z důvodu snížení výskytu a zpomalení progrese obávaných chronických komplikací diabetu [1,2].
Základním cílem léčby inzulinem je napodobit fyziologickou sekreci inzulinu tak, aby léčba nahradila bazální i postprandiální sekreci inzulinu. Od 20. let minulého století se léčba inzulinem vyvíjela a schopnost napodobit fyziologické profily, dosáhnout uspokojivé glykemie, minimalizovat vedlejší účinky a zvýšit komfort léčby se zlepšila [3]. Ale přesto jsou známy výsledky klinických i observačních studií, kdy průměrné glykemie zůstávají vysoké a hypoglykemie je stále častým problémem pro téměř každého diabetika 1. typu a pro mnoho diabetiků 2. typu [4,5]. Incidence hypoglykemie a obava z ní přispívají k suboptimální adherenci k léčbě inzulinem, dalšími limitujícími faktory jsou potřeba selfmonitoringu, kterou stále i v současné době představuje využívání glukometrů, potřeba opakované edukace pacienta a komplexnost inzulinových režimů [6,7].
Možnosti léčby postprandiální hyperglykemie
Limity v léčbě vysoké postprandiální glykemie (PPG) jsou dány mnoha faktory, které jsou jak předvídatelné, tak nepředvídatelné − nutrice, faktory fyziologické a nefyziologické (tab. 1) [8]. Všechny tyto faktory umí zdravá beta buňka modulovat a přizpůsobovat sekreci inzulinu [9]. V případě DM1T a DM2T nelze tyto glukózo dependentní odpovědi napodobit exogenním subkutánně podaným inzulinem, i když se zlepšenými farmakokinetickými a farmakodynamickými vlastnostmi.
Patofyziologie plazmatického profilu
u DM1T se odvíjí od destrukce beta buněk, která obvykle
progreduje do téměř úplné deficience inzulinu [10]. Podání
exogenního inzulinu musí splnit všechny potřeby, nahradit
endogenní inzulin, a to nejlépe bez signifikantního rizika
hypoglykemie, což je velmi těžký úkol. U DM2T je určení
poruchy sekrece inzulinu komplikováno významně sníženou
citlivostí k inzulinu ve stavu bazálním i po jídle.
Publikované studie o plazmatických profilech inzulinu vedou
k závěrům, že sekrece inzulinu po jídle stoupá velmi
pomalu, takže při progresi choroby, pokud není dostačující
první fáze sekrece inzulinu při již přítomném deficitu beta
buněk, je pro ovlivnění PPG potřeba náhrady, a to například
právě ultrarychlým krátce působícím inzulinem, který tuto
fázi sekrece nahradí [11,12].
Farmakokinetické a farmakodynamické vlastnosti současných rychle působících prandiálních analog inzulinu jsou výhodnější oproti vývojově starším humánním inzulinům co do časnějšího nástupu účinku, kratší doby působení a rychlejší absorpce. Jejich vlastnosti významně zlepšily flexibilitu inzulinových režimů s možností docílit i dobré kompenzace diabetu, která je stále vyjadřována hodnotou glykovaného hemoglobinu (HbA1c). Ve srovnání s léčbou humánními inzuliny se snížilo riziko vzniku hypoglykemií. Ale i přes tento pokrok v léčbě jsou prandiální analoga inzulinu pomalejší než vlastní endogenní inzulin u zdravého člověka. Možnosti, jak korigovat vzestup PPG, jsou stále limitované, pokud jsou inzulinová analoga podána těsně před jídlem nebo po něm [13]. Pro účinnost inzulinů je důležité dodržování doporučeného časového intervalu mezi aplikací inzulinu a jídlem, což je stále velmi významný lidský faktor pro využití farmakokinetických a farmakodynamických vlastností jak humánních krátce působících inzulinů, tak současných krátkodobě působících analog (lispro, aspart, glulisin). Jak prokázala data z observačních studií, většina pacientů toto doporučení neakceptuje a nedodržuje [14,15].
Vývoj v diabetologii se proto nezastavil ani v oblasti nových krátkodobě působících inzulinových analog, která mají znamenat onen žádaný přínos − co nejrychlejší absorpcí s časným účinkem po subkutánním podání či použití v inzulinové pumpě korigovat PPG a tím současně také docílit částečné inhibice endogenní produkce glukózy v játrech [16,17].
Ultrakrátce působící inzulinový analog FIAsp
Na konci roku 2017 byl uveden do klinické praxe nový tzv. ultrakrátce působící inzulinový analog FIAsp (faster insulin aspart), tedy rychle působící inzulin aspart obohacený o dvě pomocné látky: L arginin, který slouží jako stabilizátor roztoku, a dále o niacinamid (vitamin B3), který je odpovědný za zrychlení absorpce rychle působícího inzulinu aspart. Přidáním těchto komponent se docílilo urychlení formace monomerů v podkoží a zrychlení přestupu endoteliálními buňkami kapilár do krevního řečiště [18].
Pro otestování účinku nového
inzulinu byly prováděny preklinické a klinické studie
u diabetiků 1. typu, při nichž byl FIAsp podáván
subkutánně i cestou inzulinové pumpy, byly provedeny i studie
u diabetiků 2. typu se subkutánním podáním. Sdružená
analýza šesti z těchto studií [19] se zaměřila na srovnání
farmakokinetického a farmakodynamického profilu FIAsp proti
standardnímu aspartu (IAsp), studie byly provedeny u dospělých
osob s DM1T. FIAsp pronikl do krevního oběhu přibližně
o 4 minuty dříve, doba dosažení 50% maximální koncentrace
byla u přípravku FIAsp asi o 9 minut kratší. Výsledkem
časného dosažení sérových koncentrací FIAsp je tedy při
dvakrát rychlejším nástupu účinku v prvních 30 minutách
expozice FIAsp dvakrát větší a jeho hypoglykemizující
účinek o 74 % vyšší ve srovnání se standardním
aspartem (graf 1A, B).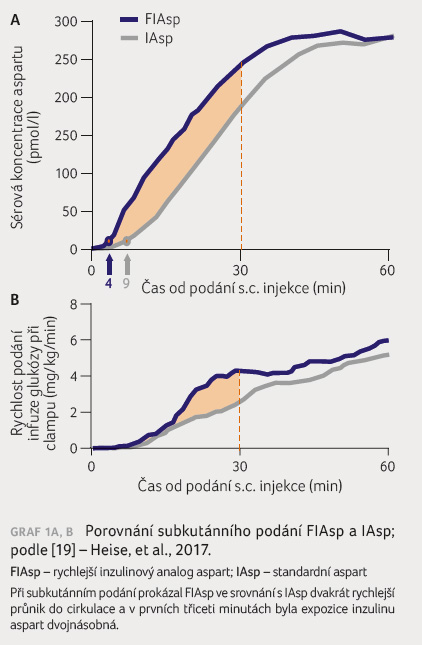
Obdobně bylo sledováno odeznívání účinku, kdy při využití clampu bylo prokázáno, že došlo k časnějšímu poklesu inzulinemie a k odeznívání hypoglykemizujícího účinku, pozdní účinek na snížení glykemie byl o 10 % nižší pro FIAsp, čas k dosažení 50% maximálního účinku byl o 14 minut kratší pro FIAsp proti IAsp, což snižuje riziko vzniku postprandiální hypoglykemie (graf 2).
Součástí uvedení inzulinu
FIAsp do klinické praxe byl ONSET – program
klinických studií, které ještě stále probíhají a nejsou
uzavřené. Potvrzením předchozích údajů jsou výsledky studie
ONSET 1, ze které plynou pro praxi důležité výstupy. Studie
popsala výsledky léčby diabetiků 1. typu, kteří byli
rozděleni do tří studijních ramen a léčeni buď IAsp
podaným s jídlem, nebo aplikací FIAsp ve stejnou dobu
a ve třetí větvi byl FIAsp podáván 20 minut po jídle
[20]. Cílem studie bylo vyhodnocení nejen superiority
FIAsp, ale také jeho non inferiority.
Hodnota HbA1c byla snížena v obou léčených
skupinách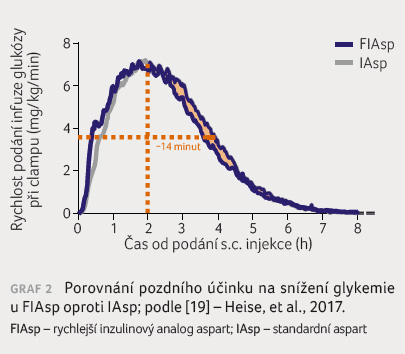 a non inferiorita k IAsp byla potvrzena jak
pro aplikaci FIAsp před jídlem, tak po jídle. Rozdíl
ve výsledcích léčby (ETD, estimated treatment difference)
FIAsp IAsp podávaných v době jídla představoval –0,15 %
(95% CI –0,23; –0,07) a po jídle –0,04 %
(95% CI –0,04; 0,12); aplikace FIAsp před jídlem statisticky
více snížila hodnotu HbA1c proti IAsp (p = 0,0003)
[20]. Jak tedy potvrdila statistika, pacienti, kteří aplikovali
FIAsp před jídlem, měli významně nižší hodnotu HbA1c
proti léčeným IAsp, při aplikaci FIAsp 20 minut po jídle
byly hodnoty HbA1c podobné jako při preprandiálním
podávání IAsp, aniž došlo k významně zvýšenému výskytu
těžkých či potvrzených hypoglykemií. Při podání FIAsp
po jídle při použití v rámci testu jídlem (meal test)
se PPG ve druhé hodině od začátku jídla nelišila
statisticky signifikantně od hodnot pacientů, kteří si
aplikovali FIAsp před jídlem. Zvýšení PPG za první hodinu
po jídle bylo při podání FIASp 20 minut po jídle
signifikantně nižší než při podání IAsp před jídlem, rozdíl
byl pro FIAsp 0,93 mmol/mol. Byla prokázána superiorita
FIASp proti IAsp při meal testu pro PPG za dvě hodiny.
a non inferiorita k IAsp byla potvrzena jak
pro aplikaci FIAsp před jídlem, tak po jídle. Rozdíl
ve výsledcích léčby (ETD, estimated treatment difference)
FIAsp IAsp podávaných v době jídla představoval –0,15 %
(95% CI –0,23; –0,07) a po jídle –0,04 %
(95% CI –0,04; 0,12); aplikace FIAsp před jídlem statisticky
více snížila hodnotu HbA1c proti IAsp (p = 0,0003)
[20]. Jak tedy potvrdila statistika, pacienti, kteří aplikovali
FIAsp před jídlem, měli významně nižší hodnotu HbA1c
proti léčeným IAsp, při aplikaci FIAsp 20 minut po jídle
byly hodnoty HbA1c podobné jako při preprandiálním
podávání IAsp, aniž došlo k významně zvýšenému výskytu
těžkých či potvrzených hypoglykemií. Při podání FIAsp
po jídle při použití v rámci testu jídlem (meal test)
se PPG ve druhé hodině od začátku jídla nelišila
statisticky signifikantně od hodnot pacientů, kteří si
aplikovali FIAsp před jídlem. Zvýšení PPG za první hodinu
po jídle bylo při podání FIASp 20 minut po jídle
signifikantně nižší než při podání IAsp před jídlem, rozdíl
byl pro FIAsp 0,93 mmol/mol. Byla prokázána superiorita
FIASp proti IAsp při meal testu pro PPG za dvě hodiny.
Ve studii ONSET 2 byli léčeni pacienti s DM2T, kde byla srovnávána léčba FIAsp proti IAsp při léčbě intenzifikovaným režimem s použitím per. V této studii byla prokázána superiorita FIAsp proti IAsp pro PPG v první hodině při meal testu, nebyl prokázán statisticky signifikantní rozdíl pro PPG ve druhé hodině po aplikaci těchto inzulinů [21].
V klinické randomizované studii
publikované v roce 2017 [22] bylo zařazeno 48 pacientů
s DM1T, kteří byli léčeni inzulinovou pumpou (CSII,
continuous subcutaneous insulin infusion) s podáním FIAsp
proti IAsp v dávce 0,15 IU/kg jako bolus s podporou
bazální dávky inzulinu rychlostí 0,02 U/kg/h s použitím
clampové metody. Při použití inzulinu FIAsp byly farmakokinetické
a farmakodynamické profily posunuty doleva ve srovnání
s těmi pro IAsp (graf 3).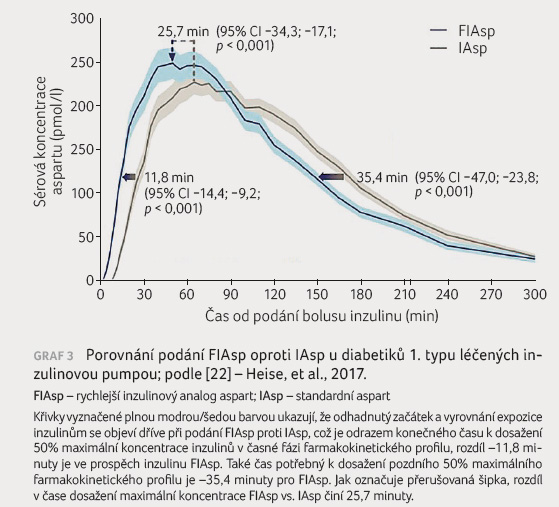
U zdravých osob indukuje časná endogenní sekrece inzulinu jako odpověď na jídlo rychlou supresi produkce glukózy játry, což hraje velkou roli v kontrole PPG. Tudíž koncepce CSII u pacientů s diabetem je závislá na okamžitém účinku inzulinu podaného jako bolus k jídlu a zároveň na možnosti individuálně adaptovat bazální dávku inzulinu.
Diskuse
Pokrok v diabetologii směřuje k vývoji modifikovaných inzulinů, které se mají co nejvíce přiblížit vlastnostem endogenního inzulinu. Dříve používaná rychleji působící analoga zcela „nekopírují“ fyziologický profil sekrece inzulinu zdravých osob, proto výsledky z klinických studií demonstrovaly potřebu podávat je 15−20 minut před zahájením jídla. I přes poučení máme data např. z dále zmíněného registru amerických diabetiků 1. typu, ale mám také již bohaté zkušenosti ze své denní praxe, že pacienti aplikují inzulin bezprostředně před jídlem, nebo si dávku zcela zapomenou aplikovat.
Autoři, kteří předložili data z amerického registru diabetiků 1. typu (T1 Exchange Clinic Registry Participants), vyhodnotili zvyklosti u 4 768 osob, jež popsaly časování podání inzulinu před jídlem: 21 % popsalo aplikaci několik minut před jídlem, 44 % bezprostředně před jídlem, 10 % během jídla a 24 % po jídle. Připomínám, že v době výzkumu nebyl dostupný inzulin FIAsp. Při srovnání hodnot HbA1c měli ti pacienti, kteří aplikovali inzulin bezprostředně před jídlem, signifikantně nižší hodnotu HbA1c ve srovnání s těmi, kteří aplikovali inzulin během jídla nebo po jídle. Pacienti, kteří aplikovali inzulin během jídla či po jídle, měli větší pravděpodobnost, že zapomenou aplikovat jednu nebo více dávek prandiálního inzulinu za týden oproti těm, kteří aplikovali inzulin před jídlem [23].
Obdobně studie z roku 2017 [24] analyzovala dobu podání bolusového inzulinu u diabetiků 2. typu z 12 zemí. Z celkového počtu respondérů jich popsalo podávání bolusového inzulinu před jídlem 58 % (n = 864; kohorta před jídlem), 24 % (n = 354; kohorta po jídle) aplikuje inzulin během jídla nebo po jídle a 18 % (n = 265) před jídlem, během jídla či po něm (tzv. smíšená kohorta). Při vyhodnocení vztahu k hodnotám HbA1c byla smíšená kohorta vyřazena a bylo vyhodnoceno 1 218 respondérů. Většina respondérů v kohortě po jídle (40 %) měla hodnotu HbA1c ≥ 9 % (74,9 mmol/mol) proti kohortě před jídlem (29 %). Závěrem autoři konstatují, že asi 24 % respondérů nikdy nedodrželo doporučení pro správné časování inzulinu.
Léčba postprandiální hyperglykemie je velmi důležitá, neboť je spojena s rizikem vývoje mikrovaskulárních a makrovaskulárních komplikací diabetu [1,2]. Pro praxi je vhodné všem pacientům doporučit dle Souhrnu údajů o přípravku podávat FIAsp subkutánně v čase jídla (nejdříve 2 minuty před začátkem jídla) s možností podání nejdéle do 20 minut od začátku jídla [25]. Je li to nezbytné, pak je potřeba podat FIAsp co nejdříve po jídle, což platí pouze pro diabetiky 1. typu, neboť aplikace FIAsp po jídle nebyla dosud zkoumána u diabetiků 2. typu.
Z těchto doporučení pak pro denní praxi diabetika 1. typu vyplývá výhoda léčby inzulinem FIAsp – větší flexibilita pro podání inzulinu ve vztahu k načasování jídla, a to s ohledem na lepší účinek na PPG, ale také to může příznivě ovlivnit riziko pozdních postprandiálních hypoglykemií. Tento inzulin může být vhodný pro pacienty s nepravidelnými jídelními zvyky, kteří měli hypoglykemie, když si aplikovali svůj krátkodobě působící analog těsně před jídlem. To platí také pro pacienty, kteří využívají CSII a byli zvyklí si podat svůj krátkodobě působící analog jako bolus také těsně před jídlem, což nebylo vždy optimální dle farmakokinetických vlastností těchto inzulinů. Jak prokázala výše uvedená studie, zde se FIASp ukázal jako výhodnější. FIAsp proti IAsp poskytuje rychlejší začátek a vyšší časnou expozici a účinek na snížení glykemie, proto by mohl při použití v inzulinové pumpě prezentovat pokles směrem k lepší kontrole PPG a rovněž mít potenciál i pro využití v mnoha pumpách či při podávání v systémech využívajících tzv. uzavřenou smyčku (closed loop system). U diabetiků 2. typu může být FIAsp výhodný u pacientů např. s kognitivními poruchami, kdy není možno se spolehnout na jeho správnou samostatnou aplikaci.
V nedávné době proběhla změna barevného označení inzulinových per FIASp, aby nedocházelo k záměně s inzulinovým přípravkem Tresiba, který ale není v naší zemi používán. Na inzulinovém peru je nyní kombinace žlutého a červeného barevného značení [25].
Závěr
Nový rychle působící inzulin aspart má vlastnosti, jež se více blíží fyziologickému profilu endogenní sekrece inzulinu. Jeho prokázaná schopnost rychleji snížit postprandiální glykemii proto může významně zlepšit kvalitu léčby dle vlivu na postprandiální glykemii, její flexibilitu a komfort pro pacienty. Pacienti mohou snadněji upravit postprandiální glykemii, a to při subkutánním podání i při použití v inzulinové pumpě. První praktické zkušenosti nasvědčují tomu, že přípravek zvyšuje kvalitu a pohodlí života diabetiků, což zlepšuje jejich adherenci k léčbě, a doufejme, že to povede také k dlouhodobé bezpečné a dobré kompenzaci jejich diabetu.
Seznam použité literatury
- [1] Diabetes Control and Complications Trial Research Group; Nathan DM, Genuth S, Lachin J, et al. The effect of intensive treatment of diabetes on the development and progression of long‑term complications in insulin‑dependent diabetes mellitus. N Engl J Med 1993; 329: 977–986.
- [2] Nathan DM, Cleary PA, Backlund JY, et al. Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications (DCCT/EDIC) Study Research Group. Intensive diabetes treatment and cardiovascular disease in patients with type 1 diabetes. N Engl J Med 2005; 353: 2643–2653.
- [3] Grunberger G. The need for better insulin therapy. Diabetes Obes Metab 2013; 15(Suppl 1): 1–5.
- [4] Riddle MC, Rosenstock J, Gerich J, Insulin Glargine Study Investigators. The treat‑to‑target trial: randomized addition of glargine or human NPH insulin to oral therapy of type 2 diabetic patients. Diabetes Care 2003; 26: 3080–3086.
- [5] Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications (DCCT/EDIC) Research Group, Nathan DM, Zinman B, et al. Modern‑day clinical course of type 1 diabetes mellitus after 30 years’ duration: the diabetes control and complications trial/epidemiology of diabetes interventions and complications and Pittsburgh epidemiology of diabetes complications experience (1983–2005). Arch Intern Med 2009; 169: 1307–1316.
- [6] Hartman I. Insulin analogs: impact on treatment success, satisfaction, quality of life, and adherence. Clin Med Res 2008; 6: 54–67.
- [7] National Institute for Health and Care Excellence (NICE). Diagnosis and management of type 1 diabetes in children, young people and adults. NICE clinical guideline 15. 2004 (last modified July 2014). 2004 Available from URL: https://www.nice.org.uk/guidance/cg15/resources/guidance‑type‑1‑diabetes‑pdf. Accessed 8 April 2015.
- [8] Home PD. Plasma insulin profiles after subcutaneous injection: how close can we get to physiology in people with diabetes? Diabetes Obes Metab 2015; 17: 1011–1020.
- [9] Porksen N, Juhl C, Hollingdal M, et al. Concordant induction of rapid in vivo pulsatile insulin secretion by recurrent punctuated glucose infusions. Am J Physiol Endocrinol Metab 2000; 278: E162–170.
- [10] Oram RA, Jones AG, Besser RE, et al. The majority of patients with long‑duration type 1 diabetes are insulin microsecretors and have functioning beta cells. Diabetologia 2014; 57: 187–191.
- [11] Kahn SE. The relative contributions of insulin resistance and beta‑cell dysfunction to the pathophysiology of Type 2 diabetes. Diabetologia 2003; 46: 13−19.
- [12] Kahn SE, Carr DB, Faulenbach MV, Utzschneider KM. An examination of beta‑cell function measures and their potential use for estimating beta‑cell mass. Diabetes Obes Metab 2008; 10(Suppl 4): 63–76.
- [13] Hermansen K, Bohl M, Schioldan AG. Insulin aspart in the management of diabetes mellitus:15 years of clinical experience Drugs 2016; 76: 41−74.
- [14] Lampe J, Penoyer DA, Hadesty S, et al. Timing is everything: results to an observational study of mealtime insulin practices. Clin Nurse Spec 2014; 28: 161–167.
- [15] Overmann H, Heinemann L. Injection‑meal interval: recommendations of diabetologists and how patients handle it. Diabetes Res Clin Pract 1999; 43: 137–142.
- [16] Heise T. Getting closer to physiologic insulin secretion.Clin Ther 2007; 29(Suppl D): S161–S165.
- [17] Heinemann L, Muchmore DB. Ultrafast‑acting insulins:state of the art. J Diabetes Sci Technol 2012; 6: 728−742.
- [18] Buckley ST, et al. Greater permeation rate of insulin aspart formulated with niacinamide. Diabetes 2015; 64(Suppl 1): Abstract 1024‑P.
- [19] Heise T, Pieber TR, Danne T, et al. A Pool Analysis of Clinical Pharmacology Trials Investigating the Pharmacokinetic and Pharmacodynamic Characteristics of Fast‑Acting Insulin Aspart in Adults with Type 1 Diabetes. Clin Pharmacokinet 2017; 56: 551−559.
- [20] Russel‑Jones D, Bode BW, De Block C, et al. Fast‑Acting insulin Aspart Improves Glycemic Control in Basal‑Bolus Treatment for Type 1 Diabetes: Results of a 26‑Week Multicenter, Active‑Controlled, Treat‑to‑Target, Randomized, Parallel‑Group Trial (onset 1). Diabetes Care 2017; 40: 943−950.
- [21] Bowering K, Case C, Harvey J, et al. Faster Aspart Versus Insulin Aspart as Part of Basal‑Bolus Regimen in Inadequately Controlled Type 2 Diabetes. The onset 2 Trial. Diabetes Care 2017; 40: 951−957.
- [22] Heise T, Zijlstra E, Nosek L, et al. Pharmacological properties of faster‑acting insulin aspart vs. insulin aspart with type 1 diabetes receiving continuous subcutaneous insulin infusion. A randomised, double‑blind, crossover trial. Diabetes Obes Metab 2017; 19: 208−215.
- [23] Datye AK, Boyle CT, Simmons J, et al. Timing of Meal Insulin and Its Relation to Adherence to Therapy in type 1 Diabetes. J Diabetes Sci Technol 2018; 12: 349–355.
- [24] Schaper NC, Nikolajsen A, Sandberg A, et al. Timing of Insulin Injections, Adherence, and Glycemic Control in a Multinational Sample of People with Type 2 Diabetes: A Cross‑Sectional. Analysis. Diabetes Ther 2017; 8: 1319−1329.
- [25] Souhrn údajů o přípravku FIAsp. Dostupné na: http://www.sukl.cz