Prostanoidy v léčbě plicní arteriální hypertenze
Plicní arteriální hypertenze (PAH) je potenciálně fatální onemocnění plicních arteriol. Klíčovou roli v patofyziologii onemocnění hraje porucha funkce cévního endotelu charakterizovaná nedostatečnou produkcí vazodilatátorů (NO, prostacyklin) a naopak nadměrnou produkcí vazokonstriktorů (endotelin, tromboxan). V léčbě PAH se kromě konvenční léčby uplatňuje tzv. specifická farmakoterapie (prostanoidy, antagonisté receptorů pro endotelin, inhibitory fosfodiesterázy 5) s účinky nejen vazodilatačními, ale rovněž antiproliferačními a antiagregačními. Prostanoidy (epoprostenol, treprostinil, iloprost a beraprost) tvoří již po dvě desetiletí jeden z podstatných základů léčby PAH. Jejich aplikace však není jednoduchá a bývá provázena řadou komplikací. Působení prostanoidů je zprostředkováno vazbou na membránové receptory a dále intracelulárně vazbou na transkripční faktory ze skupiny peroxizomálních receptorů (PPAR). Epoprostenol má velmi krátký biologický poločas, proto je nutno jej podávat cestou kontinuální intravenózní infuze. Představuje nejúčinnější způsob léčby u nejpokročilejších stadií PAH. Treprostinil je díky větší stabilitě podáván v podobě kontinuální podkožní infuze, lze jej také podávat intravenózně, inhalačně a pravděpodobně i per os. Iloprost je u pacientů s PAH aplikován inhalačně. Beraprost je dosud jediným schváleným perorálním analogem prostacyklinu. Jeho účinnost je však prokazatelná jen u méně závažných forem PAH.
Úvod
Plicní arteriální hypertenze (PAH) patří k nejzávažnějším onemocněním plicní cirkulace. Hemodynamicky je charakterizována v době diagnózy většinou již těžkou prekapilární plicní hypertenzí, která bez léčby obvykle rychle progreduje a postupně vede k pravostrannému srdečnímu selhání a ke smrti.
Do skupiny PAH je řazena vedle idiopatické a familiární PAH řada stavů, u nichž je PAH asociovaná např. se systémovými onemocněními pojiva, vrozenými zkratovými srdečními vadami, abúzem některých anorektik, chronickými jaterními onemocněními nebo infekcí HIV [1]. V jejich patogenezi se pravděpodobně uplatňují podobné patofyziologické mechanismy. Také terapeutické postupy jsou pro celou skupinu PAH obdobné.
Výskyt PAH ve světové populaci se odhaduje na několik milionů případů. Většina nemocných však stále uniká diagnóze. V Evropě, USA, Kanadě a v Japonsku se výskyt PAH odhaduje na několik set tisíc případů. Mezi pacienty s PAH tvoří 40–50 % idiopatická PAH, 6–10 % familiární PAH, zbytek představuje PAH asociovaná se známým vyvolávajícím stavem.
Na rozvoji PAH se podílí kombinace faktorů zevních a genetických, které vytvářejí podmínky pro vznik nemoci. Hlavní změny v oblasti plicní mikrocirkulace u pacientů s PAH zahrnují vazokonstrikci, cévní remodelaci a trombózu v důsledku relativní nadprodukce faktorů s účinky vazokonstrikčními, růstovými a trombogenními (endotelin, tromboxan, serotonin) nad faktory s účinky vazodilatačními, antiproliferačními a antitrombotickými (NO, vazoaktivní intestinální peptid, prostacyklin) v důsledku poruchy funkce cévního endotelu [2].
Role prostacyklinu v patofyziologii plicní hypertenze
Prostacyklin jako významný inhibitor vazokonstrikce, buněčné proliferace a funkce trombocytů má zásadní význam v patofyziologii plicní hypertenze.
Prostacyklin je hlavním produktem metabolismu kyseliny arachidonové v cévním endotelu a v buňkách hladkého svalu. Vzniká přes prostaglandin G2 a H2, který je konvertován pomocí prostacyklin syntázy.
U nemocných s idiopatickou PAH a také u pacientů s asociovanými formami PAH je dokumentováno snížení produkce prostaglandinu F1a. To svědčí o snížené syntéze prostacyklinu. Podobně je dokumentována u PAH snížená exprese prostacyklin syntázy v malých i větších plicních cévách.
Prostacyklin se váže na membránové receptory a dále intracelulárně interaguje s transkripčními faktory ze skupiny peroxizomálních receptorů (PPAR). V plicích existuje celkem 5 typů membránových receptorů pro prostanoidy (receptory IP, EP, TP, DT a FP). Nejsou homogenně distribuovány v plicních arteriích a vénách a zprostředkovávají působení prostanoidů na cévní tonus, funkci trombocytů a zánětlivé mechanismy pomocí rozdílných druhých poslů. Za vazodilatační účinky prostacyklinu je zodpovědný především receptor IP, jehož aktivace vede během několika minut ke zvýšení hladiny intracelulárního cAMP a k otevření draslíkových kanálů, k buněčné hyperpolarizaci a následně k vazodilataci. Rovněž protizánětlivé účinky prostacyklinu jsou zřejmě zprostředkovány přes IP receptor. U pacientů s PAH léčených parenterálními prostanoidy je postupem času celkem typicky pozorována tachyfylaxe. Jejím podkladem je internalizace IP receptorů v závislosti na délce léčby a koncentraci prostanoidu.
Ovlivnění signální cesty PPAR se u pacientů s PAH projeví především poklesem transkripční aktivity jednotlivých izoforem PPAR v důsledku snížené produkce prostacyklinu. To vede např. k buněčné proliferaci a rezistenci k apoptóze. Prostřednictvím receptorů PPAR je rovněž ovlivňována lokální zánětlivá reakce.
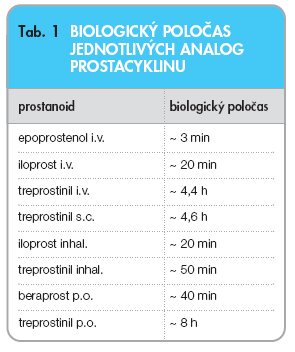
Biologický poločas prostacyklinu je velmi krátký, neboť je rychle konvertován na neaktivní stabilní metabolit 2,3-dinor-6-ketoprostaglandin F1a a cAMP je v plicích rozkládán působením fosfodiesteráz PDE3 a PDE4.
Lze shrnout, že u nemocných s PAH nalézáme poruchu v signální cestě prostacyklinu na různých etážích: v oblasti prostacyklin syntázy, na úrovni receptorů IP a PPAR a také v oblasti vyšší aktivity fosfodiesteráz. Výsledkem kombinace těchto změn jsou buňky hladkého svalu, mezibuněčné matrix a fibroblasty s abnormálním fenotypem, s tendencí k proliferaci a s rezistencí k apoptóze.
Principy léčby PAH
Prognóza neléčené PAH je značně závažná. Medián přežití při konvenční léčbě srdečního selhání (diuretika, kyslík) se udává 2,8 roku. Jeden rok přežívá 68 %, 2 roky 48 % a 3 roky 34 % nemocných. Nepříznivá prognóza je u většiny nemocných alespoň částečně ovlivnitelná chronickou antikoagulační léčbou a u pacientů se zachovalou vazoreaktivitou (pouze 5–10 % nemocných s PAH) podáním vysokých dávek vazodilatačních blokátorů kalciových kanálů.
Významným pokrokem v léčbě PAH bylo v devadesátých letech 20. století zavedení tzv. specifické léčby, která je indikována u pacientů s negativní vazoreaktivitou. Mezi specifická farmaka u PAH řadíme prostanoidy (epoprostenol, iloprost, treprostinil, beraprost), antagonisty endotelinových receptorů (bosentan, ambrisentan, sitaxsentan) a inhibitory fosfodiesterázy 5 (sildenafil), viz obr. 1. Tyto léky mají nejen účinky vazodilatační, ale rovněž antiproliferační a antiagregační. Specifická farmakoterapie má být zahájena bezprostředně po stanovení diagnózy. V méně pokročilých stadiích onemocnění se léčba zahajuje většinou bosentanem, alternativně sildenafilem a analogy prostacyklinu. Ve funkčním stadiu NYHA IV je základem terapie intravenózní prostacyklin. V řadě případů není odpověď na monoterapii optimální. Jednu z racionálních alternativ pak představuje kombinační léčba několika specifickými farmaky. V případě vyčerpání možností farmakoterapie přichází v úvahu atriální septostomie a transplantace plic [3].
Indikace léčby PAH musí být striktně individuální. Přesto je zatížena řadou mnohdy neočekávaných komplikací. Proto má být péče o pacienty s PAH zásadně soustředěna do expertních center s bohatou zkušeností s diagnostikou a terapií pacientů s chronickou plicní hypertenzí.
Epoprostenol
Epoprostenol je syntetický analog prostacyklinu. Ten byl objeven v roce 1976 jako látka s vazodilatačním a antiagregačním potenciálem. Vzhledem ke krátkému biologickému poločasu je nutno epoprostenol podávat formou dlouhodobé kontinuální infuze do centrálního žilního katétru (tab. 1). Roztok epoprostenolu je termolabilní. Při pokojové teplotě zůstává roztok stabilní 8 hodin, při chlazení sáčky s ledem 24 hodin.
Epoprostenol byl v léčbě plicní hypertenze poprvé užit v roce 1984 u 27leté pacientky s primární plicní hypertenzí (dnes označovaná jako idiopatická PAH) ve stadiu klidové dušnosti s cyanózou. Nemocná byla kandidátkou transplantace plic. Již krátkodobá léčba vedla ke snížení plicní cévní rezistence a ke zlepšení tolerance zátěže. Po 13 měsících kontinuální intravenózní léčby došlo k výraznému poklesu tlaku v plicnici, ke snížení plicní cévní rezistence a ke zvýšení srdečního výdeje. Pacientka byla schopna běžných denních aktivit.
První klíčová randomizovaná klinická studie s epoprostenolem v léčbě PAH byla publikována v roce 1996. Celkem 81 pacientů s pokročilou PAH v klinickém stadiu NYHA III a IV bylo léčeno epoprostenolem a konvenční léčbou nebo pouze konvenční léčbou. Po 12 týdnech sledování došlo ve skupině léčených epoprostenolem k prodloužení vzdálenosti při testu šestiminutovou chůzí o 31 m, zatímco ve skupině léčených pouze konvenční léčbou se vzdálenost zkrátila o 29 m. Ve skupině léčené epoprostenolem se rovněž zlepšily hemodynamické parametry a přežívání těchto pacientů bylo signifikantně lepší [4].
Obdobná studie s intravenózním epoprostenolem byla provedena u 111 pacientů s PAH při systémové sklerodermii bez významnější intersticiální plicní fibrózy [5]. U nemocných léčených epoprostenolem se ve srovnání s konvenční léčbou během 12 týdnů prodloužila vzdálenost při testu šestiminutovou chůzí. Mírně se zlepšily hemodynamické parametry. Mortalita nebyla ovlivněna.
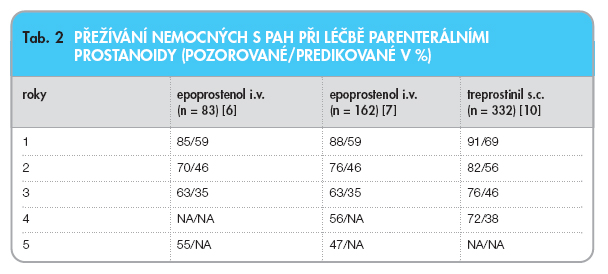
Efekt dlouhodobé léčby epoprostenolem je dokumentován ve dvou observačních studiích, které byly publikovány v roce 2002 (tab. 2).
Francouzští autoři sledovali po dobu více než 5 let osud 178 nemocných s idiopatickou PAH ve funkčním stadiu NYHA III a IV léčených intravenózním epoprostenolem [6]. Pozorovali významné zlepšení funkčních parametrů, určité zlepšení hemodynamiky a rovněž zlepšené přežívání ve srovnání s historickými kontrolami. Jeden rok přežilo 85 % nemocných, 5 let 55 % pacientů.
Se srovnatelnými výsledky přišli američtí autoři v observační studii, která sledovala 162 nemocných léčených chronicky epoprostenolem [7]. Nemocní byli pravidelně hemodynamicky vyšetřováni. Po 3 letech léčby se střední tlak v plicnici snížil maximálně o 10 %, významně se však zvýšil srdeční index. Práce rovněž demonstrovala význam časné terapeutické intervence: nemocní ve funkčním stadiu NYHA III měli příznivější prognózu než pacienti, u nichž byla léčba zahájena ve funkčním stadiu NYHA IV.
Iniciální dávka epoprostenolu se určí titrací přípravku za pečlivého monitorování pacienta. Dlouhodobá infuze se pak zahajuje dávkou, která je o 4 ng/kg/min nižší než maximální tolerovaná dávka. Pokud je maximální tolerovaná dávka nižší než 5 ng/kg/min, pak je počáteční terapeutická dávka polovinou maximální tolerované dávky. Epoprostenol se dávkuje malou přenosnou pumpou, kterou se musí nemocný naučit spolehlivě obsluhovat. Náhlé přerušení infuze způsobené poruchou pumpy může vést k prudkému zhoršení stavu nemocného v důsledku rebound fenoménu. Proto je nezbytné, aby měl pacient k dispozici rezervní přístroj.
Kvůli nebezpečí vzniku tachyfylaxe je nutno dávku epoprostenolu během chronické léčby postupně zvyšovat. Průměrná dávka na začátku léčby činí 4–8 ng/kg/min, po roce léčby asi 20 ng/kg/min. U řady nemocných dojde při dávce 20–40 ng/kg/min ke stabilizaci klinického stavu a kontinuální zvyšování dávek pak není nutné. Výjimečné však nejsou ani případy, kdy dávky epoprostenolu přesahují 100 ng/kg/min. Tyto dávky však mohou být spojeny s vysokým srdečním výdejem. Existují práce, které dokumentují možnost významně redukovat dávku epoprostenolu s cílem snížit vysoký srdeční výdej, aniž dojde k signifikantnímu vzestupu tenze v plicnici.
Vedle vlastních nežádoucích účinků epoprostenolu (bolesti čelistí, flush, bolesti hlavy, nauzea, hypotenze, tachykardie, bolesti na hrudi, trombocytopenie) jsou hlavním rizikem léčby lokální a systémové infekční komplikace v důsledku permanentního centrálního žilního katétru, a dále riziko poruchy infuzní pumpy. Lokální infekční komplikaci v oblasti centrálního žilního katétru lze ročně očekávat u každého nemocného s pravděpodobností 22–68 % a septickou komplikaci s pravděpodobností 0–39 %. Porucha pumpy nebo problémy s průchodností katétru se vyskytují průměrně 2–3krát během roku u každého pacienta.
Léčba epoprostenolem představuje nejkomplikovanější způsob farmakoterapie PAH. Vyžaduje úzkou spolupráci mezi pacientem, jeho rodinou a expertním centrem. Nezbytná je možnost kdykoli telefonicky konzultovat stav nemocného s ošetřujícím specialistou.
Epoprostenol je lékem volby u pacientů s nejpokročilejší PAH. Oddaluje signifikantně nutnost transplantace a u transplantovaných pacientů dříve léčených epoprostenolem je patrné delší přežívání.
Treprostinil
Treprostinil je tricyklický benzidinový analog prostacyklinu. Relativně dlouhý biologický poločas za pokojové teploty dovoluje jeho podání formou kontinuální podkožní infuze.
S treprostinilem byla uskutečněna největší randomizovaná, placebem kontrolovaná klinická studie u PAH [8]. Zahrnula celkem 470 nemocných s idiopatickou PAH, s PAH při systémových onemocněních pojiva a s PAH při vrozených zkratových srdečních vadách ve funkčním stadiu NYHA II–IV. Subkutánní infuze byla zahájena dávkou 1,25 ng/kg/min, která byla během 12 týdnů postupně zvyšována. Při srovnání léčené skupiny se skupinou užívající placebo byl rozdíl ve vzdálenosti při testu šestiminutovou chůzí na konci dvanáctého týdne významně závislý na velikosti dávky. Průměrně se vzdálenost prodloužila o 16 m, nejvíce však profitovali nemocní léčení vyšší dávkou treprostinilu (při dávce > 13,8 ng/kg/min byla vzdálenost dosažená na konci 12. týdne prodloužena o 36 m). Výraznější efekt byl patrný také u pacientů ve funkčním stadiu NYHA IV. U léčených nemocných se rovněž zlepšily hemodynamické parametry.
Nejčastějším nežádoucím účinkem subkutánně podávaného treprostinilu je lokální bolestivá reakce v místě podkožní infuze. Vyskytuje se až u 85 % léčených, především v prvních dnech po změně místa aplikace infuze.
O účinku dlouhodobé léčby subkutánním treprostinilem byly publikovány nedávno dvě práce. Langová se spolupracovníky sledovala průměrně 26,2 měsíce 99 nemocných s PAH a 23 pacientů s chronickou tromboembolickou plicní hypertenzí [9]. Během 3 let léčby se vzdálenost při testu šestiminutovou chůzí prodloužila z původních 305 m na 445 m. Průměrná dávka treprostinilu po 3 letech byla 40 ng/kg/min. Signifikantně se zlepšila funkční kapacita. Léčbu přerušilo pro závažné nežádoucí účinky 10,6 % nemocných. Barstová publikovala výsledky dlouhodobé léčby subkutánním treprostinilem u rozsáhlého souboru 860 pacientů (tab. 2) [10]. Průměrná dávka treprostinilu po roce léčby činila 26 ng/kg/min, po 2 letech 36 ng/kg/min a po 3–4 letech 42 ng/kg/min. Celkem 23 % nemocných léčbu přerušilo pro nežádoucí účinky, zejména v souvislosti s bolestí v místě aplikace.
V případě intolerance podkožního podání lze treprostinil podávat intravenózně. Ve srovnání s epoprostenolem odpadá nutnost chlazení infuzní soustavy a zejména riziko plynoucí z náhlého přerušení infuze. V literatuře je dokumentována možnost bezpečné tranzice z intravenózního epoprostenolu na intravenózní treprostinil.
Treprostinil se vzhledem ke své stabilitě jeví rovněž jako vhodný pro inhalační podání. K navození účinku postačují 4 inhalační aplikace denně. Tento způsob léčby PAH byl studován v randomizované klinické studii TRIUMPH (Treprostinil Sodium Inhalation Use for the Management of Pulmonary Arterial Hypertension). Celkem 234 nemocných s PAH, kteří byli léčeni perorálně podávaným sildenafilem nebo bosentanem, inhalovalo 4krát denně treprostinil nebo placebo po dobu 12 týdnů. U nemocných léčených kombinační léčbou se na konci dvanáctého týdne prodloužila vzdálenost při testu šestiminutovou chůzí do 1 hodiny po inhalaci o 20 m.
V současné době se studuje možnost perorální léčby treprostinilem.
Treprostinil je v USA registrován pro léčbu PAH ve stadiu NYHA II–IV, v Evropě pro léčbu idiopatické a familiární PAH ve stadiu NYHA III. Při podkožní aplikaci se jako iniciální dávka doporučuje 1,25 ng/kg/min. Počáteční terapeutická dávka je nejméně 10 ng/kg/min. Dále se titrace provádí podle dosaženého optimálního klinického efektu a minimálních nežádoucích účinků. Při intravenózním podání se účinná dávka titruje podobně jako u epoprostenolu. Předpokladem úspěchu léčby je zkušenost pracoviště s parenterální léčbou PAH.
Iloprost
Iloprost je stabilní analog prostacyklinu, který lze podávat inhalačně, intravenózně a per os. První zkušenosti s inhalační léčbou pocházejí z roku 1996. Inhalace iloprostu vede k výraznější akutní vazodilataci v plicním řečišti než inhalace NO. Účinek přetrvává 60–120 minut. Pro navození trvalého efektu na plicní cirkulaci je pak zapotřebí 6–12 inhalací denně. Inhalační léčba předpokládá takový charakter aerosolu, aby maximum léku dosáhlo úrovně alveolu. Optimální průměr kapének je proto 3,0–5,0 mm. Systémové účinky iloprostu jsou udávány jako zanedbatelné.
Evropská multicentrická, randomizovaná a placebem kontrolovaná studie AIR (Aerosolized Iloprost Randomized Study) zahrnula celkem 203 pacientů s idiopatickou PAH, dále pacienty s PAH při systémových onemocněních a s chronickou tromboembolickou plicní hypertenzí ve funkčním stadiu NYHA III a IV [11]. Ve skupině léčených pacientů s idiopatickou PAH, kteří inhalovali 6–9krát denně 2,5–5 mg iloprostu, došlo po 12 týdnech k signifikantnímu zlepšení tolerance zátěže a ke zlepšení hemodynamických parametrů. Tachyfylaxe nebyla pozorována. U nemocných s ostatními typy plicní hypertenze nebyl terapeutický efekt tak zřetelný. V otevřené pokračující fázi této studie bylo sledováno celkem 63 nemocných po dobu dvou let. Přežití ve sledovaném souboru (bylo zahrnuto i sledování během zaslepené fáze) činilo 85 % proti očekávaným 63 %.
Inhalace iloprostu představuje zajímavou alternativu aplikace prostacyklinu, jejíž předností je zejména minimalizace systémových účinků přípravku. V poslední době se ukazuje, že iloprost je především vhodným lékem do kombinačních schémat. V roce 2006 byla publikována práce, která sledovala účinek inhalačního iloprostu u 67 nemocných s PAH, kteří byli léčeni nejméně 3 měsíce bosentanem. U pacientů exponovaných kombinační léčbě se prodloužila vzdálenost při testu šestiminutovou chůzí o 26 m ve srovnání se skupinou léčenou pouze bosentanem, u řady pacientů se snížila třída NYHA, zlepšily se hemodynamické parametry a prodloužila se doba do klinického zhoršení.
Kontinuální intravenózní infuze iloprostu je u pacientů s PAH pravděpodobně stejně účinná jako léčba epoprostenolem, scházejí však větší zkušenosti. Perorální podání je limitováno rychlou degradací preparátu prostřednictvím b-oxidace ve stěně střeva a v játrech.
Iloprost je registrován v Evropě pro inhalační léčbu idiopatické a familiární PAH ve funkčním stadiu NYHA III, v USA pro léčbu PAH ve funkčním stadiu NYHA III a IV. Intravenózní aplikace iloprostu je schválena pouze na Novém Zélandu.
Beraprost
Beraprost je perorální stabilní analog prostacyklinu. Stability je dosaženo díky cyklopentabenzofuranylovému skeletu. Existuje několik nekontrolovaných studií, většinou z Japonska, které u pacientů s PAH dokládají příznivý účinek beraprostu na ovlivnění hemodynamiky a prognózy.
S beraprostem byla v Evropě provedena randomizovaná klinická studie ALPHABET (Arterial Pulmonary Hypertension and Beraprost European Trial) [12]. Zahrnula celkem 130 pacientů s PAH. Ve skupině léčené beraprostem (v průměrné dávce 80 mg 4krát denně ) došlo po 12 týdnech ke zlepšení tolerance zátěže hodnocené testem šestiminutovou chůzí, signifikantně však pouze v podskupině nemocných s idiopatickou PAH. Obdobné výsledky přinesla studie uskutečněná v USA [13]. Ta navíc sice prokázala prodloužení vzdálenosti dosažené při testu šestiminutovou chůzí i po 3 a 6 měsících léčby, efekt však již nebyl zřetelný po 9 a 12 měsících léčby.
Beraprost zůstane zřejmě rezervován především pro pacienty v časnějších stadiích onemocnění PAH. Byl schválen pro léčbu PAH v Japonsku a Koreji.
Závěr
Strategie léčby PAH vychází z aktuálního funkčního stavu nemocného a z výsledku vazodilatačního testu. Většina nemocných v době stanovení diagnózy je ve funkční třídě NYHA III a nesplňuje kritéria akutní vazoreaktivity. Tito nemocní jsou tedy kandidáty specifické farmakoterapie, jejíž podstatnou součást tvoří již po dvě desetiletí prostanoidy. Jejich podání s sebou sice většinou nese nutnost parenterální aplikace, která může být zatížena řadou komplikací, přesto zůstávají v nejtěžších stadiích onemocnění dokonce léčbou volby. Nenahraditelná role prostanoidů spočívá v potenciálu ovlivnit řadu mechanismů v patofyziologii PAH.
Vývoj nepochybně směřuje k hledání méně invazivních, a přesto vysoce účinných forem aplikace, k hledání vhodných strategií kombinační léčby s perorálními přípravky pro léčbu PAH a rovněž ke snaze individualizovat mnohdy komplikovanou a komplexní léčbu pro každého léčeného na základě analýzy metabolitů, biomarkerů a individuální hemodynamické odpovědi. Velkou výzvou však stále zůstává pozdní diagnóza u většiny nemocných a z toho plynoucí prognóza, která je i přes veškerou dostupnou farmakoterapii nepříznivá.
Seznam použité literatury
- [2] Farber HW, Loscalzo J. Pulmonary arterial hypertension – mechanism of disease. N Engl J Med 2004; 351: 1655–1665.
- [3] Badesch DB, Abman SH, Simonneau G, et al. Medical therapy for pulmonary arterial hypertension. Updated ACCP evidence-based clinical practice guidelines. Chest 2007; 131: 1917–1928.
- [4] Barst RJ, Rubin LJ, Long WA, et al. A comparison of continuous intravenous epoprostenol (prostacyclin) with conventional therapy for primary pulmonary hypertension. N Engl J Med 1996; 334: 296–301.
- [5] Badesch DB, Tapson VF, McGoon MD, et al. Continuous intravenous epoprostenol for pulmonary hypertension due to the scleroderma spectrum of disease: a randomized controlled trial. Ann Intern Med 2000; 132: 425–434.
- [6] Sitbon O, Humbert M, Nunes H, et al. Long-term intravenous epoprostenol infusion in primary pulmonary hypertension: prognostic factors and survival. J Am Coll Cardiol 2002; 40: 780–788.
- [7] McLaughlin VV, Shillington A, Rich S. Survival in primary pulmonary hypertension: the impact of epoprostenol therapy. Circulation 2002; 106: 1477–1482.
- [8] Simonneau G, Barst RJ, Galie N, et al. Continuous subcutaneous infusion of treprostinil, a prostacyclin analogue, in patients with pulmonary arterial hypertension: a double-blind, randomized, placebo-controlled trial. Am J Respir Crit Care Med 2002; 165: 800–804.
- [9] Lang I, Gomez-Sanchez M, Kneussl M, et al. Efficacy of long-term subcutaneous treprostinil sodium therapy in pulmonary hypertension. Chest 2006; 129: 1636–1643.
- [10] Barst RJ, Galie N, Naeije R, et al. Long-term outcome in pulmonary arterial hypertension patients treated with subcutaneous treprostinil. Eur Respir J 2006, 28: 1195–1203.
- [11] Olschewski H, Simonneau G, Galie N, et al. Inhaled iloprost in severe pulmonary hypertension. N Engl J Med 2002, 347: 322–329.
- [12] Galie N, Humbert M, Vachiery JL, et al. Effects of beraprost sodium, an oral prostacyclin analogue, in patients with pulmonary arterial hypertension: a randomized, double-blind, placebo-controlled trial. J Am Coll Cardiol 2002; 39: 1496–1502.
- [13] Barst RJ, McGoon MD, McLaughlin VV, et al. Beraprost therapy for pulmonary arterial hypertension. J Am Coll Cardiol 2003, 41: 2119–2125.