Účinnost bimekizumabu v léčbě psoriázy
Souhrn
Gibalová K. Účinnost bimekizumabu v léčbě psoriázy. Remedia 2023; 33: 246–249.
Psoriáza je chronické zánětlivé kožní onemocnění s významným dopadem na kvalitu života pacienta. Nemoc je často spojena s řadou komorbidit, jako jsou psoriatická artritida, deprese, kardiovaskulární onemocnění či nespecifické střevní záněty. V posledních letech bylo vyvinuto několik vysoce účinných biologických přípravků, které vedou k zásadnímu pokroku v léčbě psoriázy. Nový inhibitor IL‑17 je ve své třídě první monoklonální protilátkou, která cílí současně na IL‑17A a IL‑17F. Interleukin 17A je klasicky považován za biologicky nejaktivnější, avšak nedávné studie ukázaly, že hodnota IL‑17F je výrazně zvýšena v psoriatických ložiscích a v synoviálních buňkách u psoriatické artritidy. Na základě těchto zjištění se u pacientů otevírají nové léčebné možnosti, které potenciálně nabízejí lepší kontrolu nad onemocněním.
Klíčová slova: bimekizumab – psoriasis vulgaris – biologická terapie.
Summary
Gibalova K. Bimekizumab effectiveness in the treatment of psoriasis. Remedia 2023; 33: 246–249.
Psoriasis is a chronic inflammatory skin disease with a significant impact on the patient’s quality of life. Psoriasis is often associated with a number of comorbidities such as psoriatic arthritis, depression, cardiovascular disease or non‑specific intestinal inflammation. In recent years, several highly effective biologics have been developed, leading to major advances in the treatment of psoriasis. The new IL‑17 inhibitor is the first monoclonal antibody in its class to simultaneously target IL‑17A and IL‑17F. IL‑17A is classically considered the most biologically active, but recent studies have shown that IL‑17F is increased significantly in psoriatic foci and synovial cells in psoriatic arthritis. These findings open up new treatment options for patients, potentially offering better disease control.
Key words: bimekizumab – psoriasis vulgaris – biologic therapy.
Úvod
Psoriáza je neinfekční imunitně zprostředkované onemocnění kůže. Je jedním z nejčastějších chronických zánětlivých kožních onemocnění, s výskytem 2−3 % v rámci světové populace. Může se objevit v jakémkoliv věku a je charakterizováno rozvojem ostře ohraničených erytematózních ložisek se stříbrnými šupinami. Jako u jiných imunologicky zprostředkovaných onemocnění má i vznik psoriázy multifaktoriální etiologii. Kromě genetické predispozice se na vzniku podílejí také faktory prostředí. Častými spouštěči jsou stres, streptokoková infekce, mechanická traumatizace či některé druhy léků [1]. Zkoumání genetického pozadí psoriázy přineslo v posledních letech nové poznatky. Ukázalo se, že hlavní lokus náchylnosti k psoriáze (PSORS1) je na chromozomu 6p21. Další výzkumy prokázaly, že pacienti s psoriázou mají zvýšenou koncentraci prozánětlivých cytokinů, což podporuje chronický subklinický (asymptomatický) zánět spojený s komorbiditami, včetně psoriatické artritidy (PsA), kardiovaskulárních onemocnění, diabetes mellitus, obezity, zánětlivých střevních onemocnění a nealkoholového ztučnění jater [2,3].
Za poslední léta došlo k výraznému pokroku při pochopení základních patofyziologických mechanismů vzniku psoriázy. Ty zahrnují komplexní interakci mezi vrozeným a adaptivním imunitním systémem. Dlouho se za klíčový cytokin považoval tumor nekrotizující faktor alfa (TNFα), avšak nově se za jádro patogeneze psoriázy považuje osa interleukin (IL) 23/IL‑17A. Tumor nekrotizující faktor alfa hraje spíše pomocnou roli při podpoře zánětu prostřednictvím synergismu s IL‑17A a prostřednictvím vývoje a zrání myeloidních dendritických buněk. V počátečních fázích patogeneze psoriázy dochází u pacientů s genetickou predispozicí k aktivaci buněk imunitního systému neznámým antigenem. Aktivované plazmocytoidní dendritické buňky, keratinocyty, NK (tzv. natural killers) buňky a makrofágy produkují cytokiny (TNFα, interferon [IFN] γ, IFNα, IL‑1ß), které aktivují myeloidní dendritické buňky. Po jejich aktivaci dochází k produkci IL‑12 a IL‑23. Interleukin 12 indukuje diferenciaci naivních T buněk na Th1 buňky, přičemž IL‑23 má zásadní význam pro přežití a proliferaci buněk Th17 a Th22. Následně dochází k produkci dalších zánětlivých mediátorů (TNFα, IFNγ, IL‑17, IL‑22), což má za následek proliferaci keratinocytů, zvýšenou expresi angiogenních mediátorů a endoteliálních adhezních molekul a infiltraci imunitních buněk do kožních lézí. Signalizace IL‑23 je zprostředkována intracelulárně prostřednictvím Tyk2‑Jak2 a STAT3, což vede k transkripci klíčových mediátorů zánětu, jak ukazuje obrázek 1 [4−6].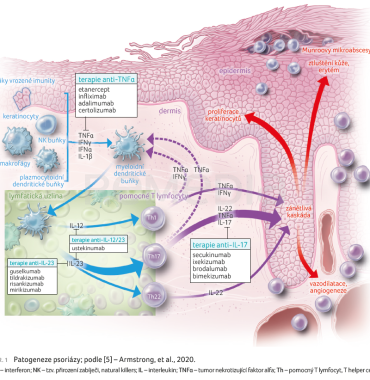
Význam IL‑17 v patogenezi psoriázy
Buňky Th17 pod stimulem IL‑23 indukují uvolňování velkého množství cytokinů rodiny IL‑17. Ačkoliv produkce IL‑17 je pro Th17 charakteristickým znakem, IL‑17 produkuje i několik dalších imunitních buněk, např. NK buňky, neutrofily, žírné buňky, γδ buňky, ILC (přirozené lymfoidní buňky) [4,7]. Rodina cytokinů IL‑17 zahrnuje šest členů: IL‑17A (běžně označovaný jako IL‑17), IL‑17B, IL‑17C, IL‑17D, IL‑17E (IL‑25) a IL‑17F. V rámci fyziologických pochodů imunitního systému se IL‑17 podílí na mukokutánní obraně proti intracelulárním a extracelulárním patogenům [8].
Při dysregulaci IL‑17 jsou hlavním cílem působení keratinocyty, endotelové buňky a buňky vrozené imunity. V keratinocytech IL‑17 stimuluje produkci antimikrobiálních peptidů, prozánětlivých cytokinů a chemokinů (IL‑1β, TNFα, IL‑6, IL‑17C, CXCL1, CXCL3, CXCL5, CXCL8 [IL‑8] a CCL20). V endoteliálních buňkách IL‑17 působí na podporu tkáňového zánětu prostřednictvím upregulace IL‑6, IL‑8 a ICAM‑1. Kromě toho může dysfunkce endotelu zprostředkovaná IL‑17 přispívat k rozvoji kardiovaskulárních komorbidit u psoriázy. V patogenezi psoriázy je nejvíce zapojen a nejlépe prostudován IL‑17A. Jeho inhibice vede k rychlému vymizení psoriázy. Z dalších významných členů rodiny IL‑17 je to IL‑17F. Nedávné studie poukázaly na velkou strukturní homologii (přibližně 50 %) mezi IL‑17A a IL‑17F, a předpokládají tak překrývající se mechanismus účinku. Dle nejnovějších poznatků je IL‑17F přibližně 100krát méně účinný než IL‑17A při indukci prozánětlivých cytokinů, avšak jeho význam spočívá právě ve zvýšeném množství nacházejícím se v psoriatických ložiscích. Interleukin 17A a 17F existují v dimerních izoformách (homodimery IL‑17A/A a IL‑17F/F a heterodimery IL‑17A/F). Každý dimer váže komplex receptorů IL‑17RA/IL‑17RC, a může tedy přenášet podobnou signalizaci a aktivovat cílové geny. Stále více důkazů poukazuje na ústřední roli IL‑17A i IL‑17F v základní imunopatogenezi psoriázy, a proto byl nedávno schválen bimekizumab, čtvrtý inhibitor IL‑17, který blokuje jak IL‑17A, tak IL‑17F (obr. 2) [9,10].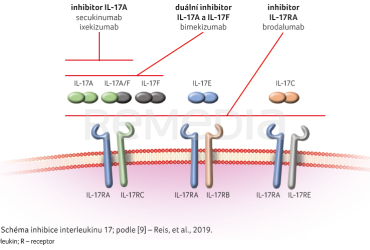
Mechanismus účinku bimekizumabu
Bimekizumab je humanizovaná monoklonální protilátka IgG1/κ, která se selektivně a s vysokou afinitou váže na cytokiny IL‑17A, IL‑17F a IL‑17A/F a blokuje jejich interakci s receptorovým komplexem IL‑17RA/IL‑17RC. Právě tato duální neutralizace ho odlišuje od mechanismu účinku jiných inhibitorů IL‑17. Izoformy A a F mají synergický účinek v patogenezi psoriázy, protože sdílejí stejný receptorový komplex (IL17RA a IL‑17RC), jehož prostřednictvím indukují analogickou expresi zánětlivých genů v keratinocytech.
Dosavadní výzkum se zaměřoval především na izoformu A a její receptor (IL‑17RA), na který cílí secukinumab a ixekizumab. Dalším zástupcem byl brodalumab, který inhibuje receptor pro IL‑17, z čeho vyplývá, že bimekizumab na základě svého unikátního složení blokuje víc cytokinů než secukinumab a ixekizumab, ale méně než brodalumab. Od toho se odvíjí také jeho bezpečnost a účinnost [11,12].
Indikace a dávkování
Bimekizumab je indikován k léčbě středně těžké až těžké ložiskové psoriázy u dospělých, kteří jsou kandidáty na systémovou léčbu. Doporučená dávka pro dospělé pacienty je 320 mg (podává se jako dvě subkutánní injekce po 160 mg) v týdnu 0, 4, 8, 12, 16 a poté každých osm týdnů. U pacientů, u nichž nedošlo ke zlepšení do 16 týdnů léčby, je třeba zvážit ukončení léčby. U pacientů starších 65 let není nutná úprava dávky. Avšak pacienti s hmotností vyšší než 120 kg, kteří nedosáhli v 16. týdnu úplného zhojení, mohou pokračovat dávkou 320 mg každé čtyři týdny po 16. týdnu.
Zvláštní pozornost vyžadují pacienti s anamnézou idiopatických střevních zánětů. Během studií byly hlášeny případy nového vzniku nebo exacerbace zánětlivého střevního onemocnění, a proto se bimekizumab nedoporučuje podávat pacientům s idiopatickými střevními záněty. Pokud se u pacienta objeví známky a příznaky zánětlivého střevního onemocnění nebo dojde k exacerbaci již existujícího zánětlivého střevního onemocnění, je třeba podávání bimekizumabu ukončit a zahájit odpovídající léčbu [12].
Výsledky klinických studií
Bezpečnost a účinnost bimekizumabu byly hodnoceny u 2 223 pacientů se středně těžkou až těžkou plakovou psoriázou ve čtyřech multicentrických randomizovaných studiích fáze III. Pacienti byli starší 18 let, měli skóre PASI (Psoriasis Area and Severity Index) ≥ 12 a BSA (Body Surface Area) ≥ 10 %, skóre IGA (Investigator’s Global Assessment) ≥ 3 na pětibodové stupnici a byli kandidáty na systémovou léčbu. Účinnost a bezpečnost bimekizumabu byly hodnoceny oproti placebu (BE READY), oproti ustekinumabu (BE VIVID), oproti adalimumabu (BE SURE) a oproti secukinumabu (BE RADIANT) [13].
Studie BE READY hodnotila celkem 435 pacientů po dobu 56 týdnů. Pacienti byli randomizováni k podávání bimekizumabu v dávce 320 mg každé čtyři týdny (Q4W; n = 349) nebo placeba. V 16. týdnu byly osoby léčené bimekizumabem, které dosáhly odpovědi PASI 90 (90% zlepšení dle indexu), přerozděleny k podávání bimekizumabu v dávce 320 mg Q4W, bimekizumabu 320 mg každých osm týdnů (Q8W) nebo placeba. Účinnost byla hodnocena v týdnech 1, 2, 4, 8, 12, 16 a Q4W až do týdne 52. V týdnu 16 dosáhlo PASI 90 a PASI 100 (100% zlepšení dle indexu) celkem 317 (91 %), resp. 238 (68 %) pacientů ve skupině s bimekizumabem, zatímco ve skupině s placebem dosáhl PASI 90 a PASI 100 pouze jeden (1 %) pacient. Podobně 323 (93 %) pacientů užívajících bimekizumab dosáhlo skóre IGA 0/1 ve srovnání s jedním (1 %) pacientem ve skupině s placebem. Kromě toho bylo ve skupině s bimekizumabem ve srovnání s placebem zaznamenáno statisticky významné zlepšení skóre Dermatologického indexu kvality života (DLQI) [14].
Studie BE VIVID hodnotila 567 pacientů po dobu 52 týdnů, přičemž pacienti byli randomizováni k podávání buď bimekizumabu 320 mg Q4W (n = 321), nebo ustekinumabu v dávce 45 mg pro pacienty s hmotností ≤ 100 kg a v dávce 90 mg pro pacienty s hmotností > 100 kg v týdnu 0, 4 a následně každých 12 týdnů (Q12W; n = 163) a placeba (n = 83). V 16. týdnu byli pacienti užívající placebo převedeni na bimekizumab v dávce 320 mg Q4W. V 16. týdnu byl podíl pacientů, kteří dosáhli odpovědi PASI 90, ve skupině s léčbou bimekizumabem významně vyšší než ve skupině s ustekinumabem a placebem (85 % vs. 50 % vs. 5 %). Podobné výsledky byly zaznamenány i pro odpovědi PASI 100 a IGA. Pacienti, kteří dostali bimekizumab, navíc vykázali rychlou odpověď ve čtvrtém týdnu ve srovnání s ustekinumabem a placebem. Klinická účinnost se ve skupině s bimekizumabem udržela až do 52. týdne. Navíc PASI 100 bylo v 52. týdnu pozorováno u 207 (65 %) pacientů dostávajících bimekizumab ve srovnání s 62 (38 %) pacienty v kohortě s ustekinumabem. Pacienti převedení na bimekizumab v 16. týdnu vykazovali v 52. týdnu podobné odpovědi ve všech výsledcích účinnosti jako pacienti dostávající bimekizumab od výchozího stavu [15].
Studie BE SURE hodnotila 478 pacientů po dobu 56 týdnů. Celkem bylo zařazeno 478 pacientů, kteří byli randomizováni k podávání bimekizumabu v dávce 320 mg Q4W (n = 158), bimekizumabu v dávce 320 mg Q4W do 16. týdne a poté Q8W (n = 161) nebo adalimumabu v dávce 40 mg každé dva týdny (Q2W) do 24. týdne a následně byli převedeni na bimekizumab 320 mg Q4W (n = 159). Ve čtvrtém týdnu bylo pozorováno statisticky významné zmírnění psoriázy ve skupině s bimekizumabem ve srovnání se skupinou s adalimumabem, kdy 244 (76,5 %) a 50 (31,4 %) pacientů dosáhlo PASI 75 (75% zlepšení dle indexu). V 16. týdnu dosáhlo odpovědi PASI 90 celkem 275 (86,2 %) subjektů léčených bimekizumabem ve srovnání se 75 (47,2 %) pacienty ze skupiny léčené adalimumabem. Nakonec byla odpověď PASI 90 pozorována u 134 (84,8 %) pacientů léčených bimekizumabem Q4W, u 133 (82,6 %) subjektů užívajících bimekizumab Q4W a poté Q8W a u 82 (81,8 %) pacientů, kteří v 56. týdnu přešli z adalimumabu na bimekizumab [16].
BE RADIANT porovnávala účinnost a bezpečnost bimekizumabu se secukinumabem ve 48týdenní studii fáze IIIb. Do studie bylo zařazeno celkem 743 pacientů, kteří byli randomizováni k podávání bimekizumabu v dávce 320 mg Q4W (n = 373) nebo secukinumabu v dávce 300 mg jednou za týden (Q1W) do čtvrtého týdne a poté Q4W (n = 370). Pacienti ve skupině s bimekizumabem byli navíc od 16. týdne rozděleni do dvou skupin, které dostávaly udržovací dávku Q4W nebo Q8W. V 16. týdnu byla odpověď PASI 90 pozorována u 319 (85,5 %) pacientů léčených bimekizumabem ve srovnání s 275 (74,3 %) pacienty dostávajícími secukinumab. Ve 48. týdnu dosáhlo odpovědi PASI 90 celkem 83,6 % subjektů ve skupině léčené bimekizumabem a 70,5 % pacientů léčených secukinumabem [17].
Jak ukazují výše zmíněné studie, bimekizumab prokázal vysokou efektivitu v porovnání s inhibitory TNFα, inhibitory IL‑12/23 a inhibitory IL‑17A. Dlouhodobá účinnost a bezpečnost byly hodnoceny do 56. týdne, aktuálně probíhá sledování do 160. týdne ve studii BE BRIGHT. Podle výsledků studií je lék vhodný jak pro biologicky naivní pacienty, tak pro pacienty po selhání předchozí biologické léčby.
Bezpečnost bimekizumabu
Bezpečnost bimekizumabu byla sledována v rámci všech fází klinických studií. Hlášené nežádoucí účinky spojené s léčbou byly mírné nebo středně závažné, přičemž nebyla zjištěna žádná zjevná závislost na dávce. Při porovnání bimekizumabu s placebem byl zaznamenán zvýšený výskyt infekcí (nazofaryngitida, kandidové infekce, infekce herpes simplex, folikulitidy či gastroenteritida). Dále se u pacientů objevila bolest hlavy, přechodná neutropenie, ekzematózní dermatitida a také vzplanutí nespecifických střevních zánětů. Více než 98 % případů nežádoucích účinků bylo nezávažných, mírné nebo střední závažnosti a nevyžadovalo přerušení léčby [12].
Ve studii BE VIVID (bimekizumab vs. ustekinumab) byly nežádoucí účinky hlášeny u 181 (56 %) pacientů léčených bimekizumabem, u 83 (51 %) pacientů léčených ustekinumabem a u 39 (47 %) pacientů s placebem. Nejčastějšími nežádoucími účinky hlášenými v kohortě pacientů užívajících bimekizumab byly v průběhu studie nazofaryngitida, infekce horních cest dýchacích a kandidóza v dutině ústní. Co se týče výsledků bezpečnosti studie BE SURE (bimekizumab vs. adalimumab), do 24. týdne byly nežádoucí události hlášeny u 112 (70,9 %) pacientů léčených bimekizumabem Q4W, u 116 (72,0 %) pacientů léčených bimekizumabem Q4W a poté Q8W a u 111 (69,8 %) pacientů zařazených do skupiny léčené adalimumabem. U pacientů s bimekizumabem se ve srovnání s kohortou s adalimumabem častěji vyskytovaly orální kandidóza a průjem. Ve studii BE RADIANT (bimekizumab vs. secukinumab) byla bezpečnost u obou skupin podobná [14−17].
Závěr
Bimekizumab je první monoklonální protilátkou, která se selektivně váže na cytokiny IL‑17A, IL‑17F a IL‑17A/F a blokuje jejich interakci s receptorovým komplexem IL‑17RA/IL‑17RC. Podle dosud provedených klinických studií se jedná o bezpečné a účinné biologikum schválené pro léčbu středně těžké až těžké psoriázy. Dostupné výsledky studií uvádějí, že terapie bimekizumabem je vysoce účinnou a bezpečnou léčbou, která je schopna v krátké době dosáhnout odpovědí PASI 90 a PASI 100. Porovnávací studie navíc prokázaly vyšší účinnost a bezpečnostní profil bimekizumabu srovnatelný s jinými biologickými třídami, včetně přípravků anti‑TNF (adalimumab), anti‑IL‑17 (secukinumab) a anti‑IL‑12/23 (ustekinumab).
Literatura
[1] Kamiya K, Kishimoto M, Sugai J, et al. Risk factors for the development of psoriasis. Int J Mol Sci 2019; 20: 4347.
[2] Nair RP, Stuart PE, Nistor I, et al. Sequence and haplotype analysis supports HLA‑C as the psoriasis susceptibility 1 gene. Am J Hum Genet 2006; 78: 827−851.
[3] Korman NJ. Management of psoriasis as a systemic disease: what is the evidence? Br J Dermatol 2020; 182: 840–848.
[4] Blauvelt A, Chiricozzi A. The Immunologic Role of IL‑17 in Psoriasis and Psoriatic Arthritis Pathogenesis. Clinic Rev Allerg Immunol 2018; 55: 379–390.
[5] Armstrong AW, Read C. Pathophysiology, Clinical Presentation, and Treatment of Psoriasis: A Review. JAMA 2020; 323: 1945−1960.
[6] Baliwag J, Barnes DH, Johnston A. Cytokines in psoriasis. Cytokine 2015; 73: 342−350.
[7] Qi C, Wang Y, Li P, Zhao J. Gamma Delta T Cells and Their Pathogenic Role in Psoriasis. Front Immunol 2021; 12: 627139.
[8] Zhou X, Chen Y, Cui L, et al. Advances in the pathogenesis of psoriasis: from keratinocyte perspective. Cell Death Dis 2022; 13: 81.
[9] Reis, J, Vender R, Torres T. Bimekizumab: The First Dual Inhibitor of Interleukin (IL)‑17A and IL‑17F for the Treatment of Psoriatic Disease and Ankylosing Spondylitis. BioDrugs 2019; 33: 391–399.
[10] Oliver R, Krueger JG, Glatt S, et al. Bimekizumab for the treatment of moderate‑to‑severe plaque psoriasis: efficacy, safety, pharmacokinetics, pharmacodynamics and transcriptomics from a phase IIa, randomized, double‑blind multicentre study. Br J Dermatol 2022; 186: 652−663.
[11] Adams R, Maroof A, Baker T, et al. Bimekizumab, a Novel Humanized IgG1 Antibody That Neutralizes Both IL‑17A and IL‑17F. Front Immunol 2020; 11: 1894.
[12] SPC Bimzelx 2021. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/bimzelx‑epar‑product‑information_en.pdf
[13] Gordon KB, Langley RG, Warren RB, at al. Bimekizumab Safety in Patients With Moderate to Severe Plaque Psoriasis: Pooled Results From Phase 2 and Phase 3 Randomized Clinical Trials. JAMA Dermatol 2022; 158: 735−744.
[14] Gordon KB, Foley P, Krueger JG, et al. Bimekizumab efficacy and safety in moderate to severe plaque psoriasis (BE READY): a multicentre, double‑blind, placebo‑controlled, randomised withdrawal phase 3 trial. Lancet 2021; 397: 475–486.
[15] Reich K, Papp KA, Blauvelt A, et al. Bimekizumab versus ustekinumab for the treatment of moderate to severe plaque psoriasis (BE VIVID): efficacy and safety from a 52‑week, multicentre, double‑blind, active comparator and placebo controlled phase 3 trial. Lancet 2021; 397: 487–498.
[16] Griffith SK, Ahn GS, Wu JJ. Bimekizumab versus adalimumab in plaque psoriasis. N Engl J Med 2021; 385: 1149–1150.
[17] Reich K, Warren RB, Lebwohl M, et al. Bimekizumab versus secukinumab in plaque psoriasis. N Engl J Med 2021; 385: 142–152.