Zaostřeno Cushingův syndrom
Nové terapeutické možnosti u Cushingova syndromu
Slovenská endokrinologická společnost s Českou endokrinologickou společností, s Lékařskou fakultou Univerzity Komenského v Bratislavě a s V. interní klinikou LF UK a UN Bratislava uspořádala uprostřed října 2024 již 47. endokrinologické dny s mezinárodní účastí. Mezi partnery pořadatelů byla i společnost Recordati, která představila problematiku endogenního Cushingova syndromu. Na sympoziu, jemuž předsedali prezident kongresu prof. MUDr. Juraj Payer, PhD., MPH, FRCP, FEFIM, (Bratislava) a prof. MUDr. Michal Kršek, CSc., MBA, FEFIM, (Praha), hovořili kromě již zmíněného profesora Krška také doc. MUDr. Martin Kužma, PhD., (Bratislava) a MUDr. Marie Gajošová (Ostrava).
Význam včasné léčby Cushingova syndromu
Profesor Michal Kršek zahájil svou přednášku výzvou: „Doufám, že se mi podaří vás přesvědčit o tom, že Cushingův syndrom je smrtelné onemocnění, a to především v důsledku zvýšeného kardiovaskulárního rizika.“
Historická poznámka
 Americký lékař, neurochirurg a endokrinolog Harvey William Cushing (1869–1939) poprvé popsal případ hyperkortizolismu u třiadvacetileté Miss M. G., známé také jako Minnie G., která k lékaři přišla v roce 1909. Její kazuistiku uvedl v přednášce v roce 1910 a publikována byla v roce 1912 (The pituitary body and its disorders: clinical states produced by disorders of the hypophysis cerebri by Harvey Cushing, M.D., JB Lippincott Company). Tím byly položeny základy oboru endokrinologie.
Americký lékař, neurochirurg a endokrinolog Harvey William Cushing (1869–1939) poprvé popsal případ hyperkortizolismu u třiadvacetileté Miss M. G., známé také jako Minnie G., která k lékaři přišla v roce 1909. Její kazuistiku uvedl v přednášce v roce 1910 a publikována byla v roce 1912 (The pituitary body and its disorders: clinical states produced by disorders of the hypophysis cerebri by Harvey Cushing, M.D., JB Lippincott Company). Tím byly položeny základy oboru endokrinologie.
Klinický obraz, komorbidity a rizikový profil
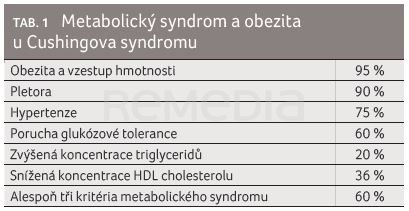 Jedná se o vzácné onemocnění s odhadovanou incidencí 1–3 nové případy na 1 000 000 obyvatel za rok [1]. Symptomy Cushingova syndromu (CS) jsou velmi pestré: z endokrinologického pohledu bývají přítomny hypotyreóza, hypogonadismus, hyposomatotropismus a hyperandrogenismus. V důsledku působení zvýšené koncentrace kortizolu dochází k poruchám tělesného složení: k redistribuci tuku, atrofii kůže a podkoží, svalové atrofii a osteoporóze. Pro hyperkoagulační stav jsou častější žilní trombózy a embolie. Pacienti s CS trpí i psychickými potížemi – depresivní poruchou, psychózami, poruchami paměti a nespavostí. Největší riziko však představuje metabolický syndrom s centrální obezitou, arteriální hypertenzí, diabetem a dyslipidemií, který společně s hyperkoagulačním stavem zvyšuje kardiovaskulární mortalitu CS (tab. 1) [2]. „Kromě kouření mají pacienti s Cushingovým syndromem všechny kardiovaskulární rizikové faktory,“ upozornil profesor Kršek.
Jedná se o vzácné onemocnění s odhadovanou incidencí 1–3 nové případy na 1 000 000 obyvatel za rok [1]. Symptomy Cushingova syndromu (CS) jsou velmi pestré: z endokrinologického pohledu bývají přítomny hypotyreóza, hypogonadismus, hyposomatotropismus a hyperandrogenismus. V důsledku působení zvýšené koncentrace kortizolu dochází k poruchám tělesného složení: k redistribuci tuku, atrofii kůže a podkoží, svalové atrofii a osteoporóze. Pro hyperkoagulační stav jsou častější žilní trombózy a embolie. Pacienti s CS trpí i psychickými potížemi – depresivní poruchou, psychózami, poruchami paměti a nespavostí. Největší riziko však představuje metabolický syndrom s centrální obezitou, arteriální hypertenzí, diabetem a dyslipidemií, který společně s hyperkoagulačním stavem zvyšuje kardiovaskulární mortalitu CS (tab. 1) [2]. „Kromě kouření mají pacienti s Cushingovým syndromem všechny kardiovaskulární rizikové faktory,“ upozornil profesor Kršek.
Porucha glukózové tolerance a diabetes mellitus u CS
V důsledku přímého účinku kortizolu je u více než 60 % pacientů přítomna porucha glukózové tolerance. Patogeneticky se uplatňuje zvýšení inzulinové rezistence periferních tkání (jaterní, tukové a příčně pruhovaných svalů), dysfunkce beta buněk pankreatu a snížení inzulinotropního účinku GLP‑1 [2,3].
Dyslipidemie
„Změny koncentrace lipidů nejsou nalézány zcela konzistentně, existují rozdíly v nálezech i interpretacích,“ komentoval profesor Kršek. Jde o zvýšení koncentrace triacylglycerolů (TAG), celkového cholesterolu a zvýšení poměru LDL cholesterolu k HDL cholesterolu jako následek stimulace lipoproteinových lipáz (hormonsenzitivní lipázy, lipázy TAG tukové tkáně), permisivního účinku na lipomobilizační účinek katecholaminů v tukové tkáni, stimulace adipogeneze a adenosinmonofosfokinázy (AMPK) ve viscerální tukové tkáni. Na úrovni jaterní tkáně dochází ke stimulaci glukoneogeneze, lipogeneze, syntézy lipoproteinů s velmi nízkou hustotou (VLDL), AMPK, k hromadění TAG, k inhibici betaoxidace volných mastných kyselin a ke vzniku jaterní steatózy [4].
Hypertenze
U Cushingova syndromu jde především o hypertenzi sekundární, respektive o zhoršení již preexistující hypertenze. Podezření na ni by měl vzbudit rychlý rozvoj těžké hypertenze, špatná/zhoršená reakce na léčbu a ve čtyřiadvacetihodinovém monitorování patrná snížená variabilita krevního tlaku a nízký nebo chybějící noční pokles tlaku.
Hypertenze u CS má různou tíži, ne vždy koreluje se stupněm hyperkortizolismu. Může být provázena hypokalemií, případně hypokalemickou alkalózou. Obvykle se rozvíjejí ostatní klinické známky CS, ale ne vždy.
Patogeneze hypertenze u pacientů s CS je komplexní a ne zcela objasněná. Nadbytek volného kortizolu v renálních tubulech stimuluje mineralokortikoidní receptory, které jsou stimulovány též intermediárními steroidními metabolity s mineralokortikoidní aktivitou. U Cushingova syndromu je popisována aktivace systému renin‑angiotenzin. Kortizol potencuje inotropní a presorické účinky vazoaktivních látek (katecholaminů, angiotenzinu II, vazopresinu) a naopak snižuje aktivitu vazodilatačních mechanismů (snižuje aktivitu NO syntázy, oslabuje vazodilatační aktivitu prostacyklinu a systému kinin‑kallikrein). Důležitou úlohu pravděpodobně hraje i aktivace glukokortikoidních a mineralokortikoidních receptorů v centrálním nervovém systému [1,5,6].
Postižení srdce a cév
V literatuře je popisována porucha geometrie levé komory srdeční s hypertrofií svaloviny a s diastolickou dysfunkcí, zejména s poruchou relaxace a plnění komory. Systolická funkce bývá zachována. Popisované změny jsou většinou po úspěšné léčbě reverzibilní. Mohou být také přítomny dysbalance mezi sympatikem a parasympatikem a alterovaná variabilita srdeční frekvence, které rovněž mohou přispívat ke zvýšené kardiovaskulární morbiditě a mortalitě.
Cévy u CS jsou postiženy akcelerovaným vývojem aterosklerózy, což lze prokázat zvýšenou intimomediální tloušťkou karotid (IMT) u pacientů s CS ve srovnání se zdravými kontrolami, která však přetrvává řadu let po úspěšné léčbě. Byla zaznamenána i alterace endoteliální funkce, respektive zvýšení koncentrace endotelinu, vaskulárního endotelového růstového faktoru (VEGF), cytoadhezních cévních molekul a některých dalších cytokinů, což je spojeno s přetrvávajícím zvýšeným kardiovaskulárním rizikem [6,7].
Hyperkoagulace
Metaanalýza 48 studií (Medline a Scopus) potvrzuje téměř dvacetinásobné zvýšení spontánního žilního tromboembolismu (VTE) u CS (OR 17,82; 95% CI 15,24–20,85, p < 0,00001) ve srovnání se zdravou populací. U pacientů s CS podstupujících operaci je poměr šancí (s antikoagulací/bez antikoagulace) spontánní VTE 0,26 (95% CI 0,07–0,11, p < 0,00001), resp. 0,34 (0,19–0,36, p < 0,00001) ve srovnání s pacienty podstupujícími operaci zlomeniny kyčelního kloubu, kteří nebyli léčeni antikoagulancii. Koagulační profily u pacientů s CS vykazovaly statisticky významné rozdíly ve srovnání s kontrolami, což se projevilo zvýšením von Willebrandova faktoru (vWF) (180,11 vs. 112,53 IU/dl, p < 0,01), snížením aktivovaného parciálního tromboplastinového času (aPTT; 26,91 vs. 30,65, p < 0,001) a zvýšení faktoru VIII (169 vs. 137 IU/dl, p < 0,05). Cushingův syndrom je tedy spojen s významně zvýšeným rizikem VTE oproti běžné populaci, ale s nižším rizikem než u pacientů podstupujících velký ortopedický výkon. I když přesné načasování, typ a dávka antikoagulační medikace ještě nejsou stanoveny, lékaři mohou při hodnocení pacientů s CS zvážit sledování vWF, aPTT a faktoru VIII a vyvažovat výhody tromboprofylaxe s rizikem krvácení [8].
Podle další studie měly děti s CS před léčbou ve srovnání s kontrolami zvýšené koncentrace prokoagulancií, antifibrinolytik a antikoagulancií; po chirurgickém řešení byla pozorována normalizace koagulačních faktorů. Přes nárůst dávkování antikoagulancií je hyperkortizolemie u dětí, stejně jako u dospělých, spojena s hyperkoagulačním stavem [9]. „Neexistuje jednotný návod, jak postupovat v prevenci tromboembolismu u pacientů s Cushingovým syndromem. Je nutné zohlednit další přídatná rizika,“ doporučil profesor Kršek. Dalšími faktory statisticky významně ovlivňujícími riziko VTE jsou věk, pohlaví, oboustranná adrenalektomie a diabetes. Riziko též (statisticky méně významně) zvyšují kuřáctví a transsfenoidální hypofyzektomie [8]. Profesor Kršek doporučuje chirurgický výkon překrýt antikoagulancii, a to po dostatečně dlouhou dobu. Podle studií může dojít k pooperační VTE až za tři měsíce s maximem výskytu v průběhu druhého měsíce u pacientů s CS, proto je racionální podávat antikoagulancia po dva měsíce, zhodnotil profesor Kršek.
Subklinický Cushingův syndrom
Takzvaný mild autonomous cortisol secretion (MACS) vedl k diskusím, zda těmto pacientům věnovat pozornost. Podle publikace z roku 2024 [10] jsou náhodně objevené tumory nadledvin většinou benigní adrenokortikální adenomy, jejichž prevalence se pohybuje v rozmezí 1–7 % při vyšetření břicha zobrazovacími metodami. Mohou to být nefunkční nádory nadledvin nebo mohou být spojeny s autonomní sekrecí kortizolu ve spektru, které sahá od vzácného klinicky zjevného Cushingova syndromu až po mnohem častější MACS bez symptomů CS. MACS je diagnostikován (na základě abnormálního nočního supresního testu s dexametazonem) u 20–50 % pacientů s adenomy nadledvin. Je spojen s kardiovaskulární morbiditou, křehkostí, sníženou kvalitou života a se zvýšenou mortalitou. Léčba MACS by měla být individualizována na základě charakteristik pacienta a zahrnuje adrenalektomii nebo konzervativní sledování s léčbou přidružených komorbidit. Identifikace pacientů s MACS, u nichž je největší pravděpodobnost, že budou mít prospěch z adrenalektomie, je náročná, protože adrenalektomie vede ke snížení kardiovaskulární morbidity u některých, ale ne u všech pacientů s MACS. Mezi současné nedostatky v klinické praxi MACS patří nedostatek specifických biomarkerů pro diagnostiku výsledků souvisejících s MACS a nedostatek či spíše neproveditelnost klinických studií prokazujících účinnost adrenalektomie na komorbidity spojené s MACS [10].
Nutnost léčit včas
Za cíle včasné léčby označil profesor Kršek terapii samotného CS a léčbu či prevenci dyslipidemie, poruchy glukózové tolerance/diabetu, hypertenze, hyperkoagulačního stavu i osteoporózy. „Některé změny u Cushingova syndromu mají výrazný vliv na morbiditu i mortalitu, a proto je nutné jim zabránit včasnou léčbou. My endokrinologové jsme internisté, takže můžeme terapeuticky zasáhnout i v léčbě komorbidit,“ nabádal profesor Kršek.
Tento článek vyšel v časopise Medicína po promoci 1/2025.
Redakčně zpracovala MUDr. Marta Šimůnková
Literatura
[1] Kršek M. Cushingův syndrom a kardiovaskulární riziko. Kardiol Rev Int Med 2015;17:161–166.
[2] Pivonello R, Faggiano A, Lombardi G, Colao A. The metabolic syndrome and cardiovascular risk in Cushing’s syndrome. Endocrinol Metab Clin North Am 2005;34:327– 339.
[3] Qi D, Rodrigues B. Glucocorticoids produce whole body insulin resistance with changes in cardiac metabolism. Am J Physiol Endocrinol Metab 2007;292:E654– E667.
[4] Arnaldi G, Scandali VM, Trementino L, et al. Patophysiology of dyslipidemia in Cushing’s syndrome. Neuroendocrinology 2010;92(Suppl 1):86– 90.
[5] Saruta T, Suzuki H, Handa M, et al. Multiple factors contribute to the pathogenesis of hypertension in Cushing’s syndrome. J Clin Endocrinol Metab 1986;62:275– 279.
[6] Mitchell BM, Webb RC. Impaired vasodilatation and nitric oxid synthase activity in glucocorticoid‑induced hypertension. Biol Res Nurs 2002;4:16– 21.
[7] Pereira AM, Delgado V, Romijn JA, et al. Cardiac dysfunction is reversed upon successful treatment of Cushing’s syndrome. Eur J Endocrinol 2010;162:331– 340. doi: 10.1530/ EJE‑ 09‑ 0621.
[8] Wagner J, Langlois F, Lim DST, et al. Hypercoagulability and Risk of Venous Thromboembolic Events in Endogenous Cushing‘s Syndrome: A Systematic Meta‑Analysis. Front Endocrinol 2019;9:805.
[9] Birdwell L, Ladish M, Tirosh A, et al. Coagulation Profile Dynamics in Pediatric Patients with Cushing Syndrome: A Prospective, Observational Comparative Study. J Pediatr 2016;177:227–231.
[10] Prete A, Bancos I. Mild autonomous cortisol secretion: pathophysiology, comorbidities and management approaches. Nat Rev Endocrinol 202;20,460–473. doi.org/10.1038/s41574‑024‑00984‑y
Léčba osilodrostatem u ACTH dependentního Cushingova syndromu
Jak uvedl docent MUDr. Martin Kužma (Bratislava), podle doporučení Evropské endokrinologické společnosti je léčba Cushingova syndromu nezbytná pro snížení mortality a souvisejících komorbidit.
Účinná léčba zahrnuje normalizaci produkce/koncentrace nebo působení kortizolu (například antagonizací účinku kortizolu na receptor pro glukokortikoidy) či zaměření na specifickou etiologii CS [1].
Chirurgická resekce kauzální léze (lézí) je obecně přístupem první volby. Volba léčby druhé linie, včetně medikace, bilaterální adrenalektomie a radiační terapie (u kortikotropních tumorů), musí být u každého pacienta individuální [1].
K indikacím farmakologické léčby patří [1]:
- odložení nebo kontraindikace operace,
- přetrvávající hyperkortizolismus po úvodní operaci,
- závažný hyperkortizolismus nebo hyperkortizolismus spojený s malignitou na zvládnutí život ohrožujícího hyperkortizolismu,
- stav po ozáření hypofýzy u pacientů s tumorem hypofýzy s přetrvávající sekrecí adrenokortikotropního hormonu (ACTH),
- ektopická produkce ACTH s okultními nebo neresekovatelnými nádory a/nebo metastatickou chorobou.
Výběr léčebné modality
„Při volbě metody léčby je nutné zohlednit etiologii Cushingova syndromu,“ předeslal docent Kužma.
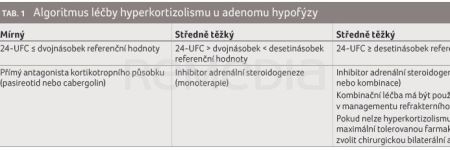 U adenomu se dává přednost opakování chirurgického řešení. V úvahu připadá inhibice steroidogeneze a terapie cílená na kortikotropní adenom. V případě nutnosti se přistupuje k bilaterální adrenalektomii (tab. 1).
U adenomu se dává přednost opakování chirurgického řešení. V úvahu připadá inhibice steroidogeneze a terapie cílená na kortikotropní adenom. V případě nutnosti se přistupuje k bilaterální adrenalektomii (tab. 1).
U adenomu nadledviny lze použít kromě adrenalektomie inhibitory steroidogeneze. U ektopické sekrece v případě, že není možné odstranit příčinu chirurgicky, připadají v úvahu inhibitory steroidogeneze.
Účinnost ketokonazolu a metyraponu
Za nejstarší farmakologickou modalitu označil docent Kužma ketokonazol. Jde o derivát imidazolu s antifungální aktivitou, který narušuje adrenální a gonadální steroidogenezi tím, že inhibuje štěpení postranního řetězce [1]. Podle četných studií se účinnost ketokonazolu pohybuje v rozmezí 40–65 %.
Metyrapon inhibuje 11β‑hydroxylázu, která katalyzuje přeměnu 11‑deoxykortizolu na kortizol. Jeho účinnost je podobná jako u ketokonazolu – kolem 50 %.
Osilodrostat
Osilodrostat je inhibitor syntézy kortizolu. Silně inhibuje 11β‑hydroxylázu (CYP11B1), enzym zodpovědný za poslední stupeň biosyntézy kortizolu v nadledvinách. Inhibice CYP11B1 je spojena s akumulací prekurzorů jako 11‑deoxykortizol a s urychlením biosyntézy steroidů v kůře nadledvin včetně androgenů. Pokles plazmatických hladin kortizolu u CS stimuluje negativní zpětnou vazbou sekreci ACTH, která urychluje biosyntézu steroidů [2]. Počáteční dávka 2 mg dvakrát denně se může zvyšovat o 1–2 mg každé dva týdny až na 30 mg dvakrát denně.
Osilodrostat byl ověřován v programu klinických studií fáze I–IV (LINC 1–6). Docent Kužma představil osmitýdenní registrační studii LINC 3 se 137 pacienty randomizovanými v poměru 1 : 1 buď k užívání osilodrostatu, nebo k placebu. Ve skupině s osilodrostatem dosáhlo a udrželo normální průměrnou 24hodinovou koncentraci volného kortizolu v moči (24‑UFC) 86,1 % léčených oproti 29,4 % v placebové skupině (p < 0,0001). Po osmi týdnech zaslepené fáze ještě následovala otevřená fáze [3].
V 36týdenní studii LINC 4 s obdobným designem bylo randomizováno 73 pacientů k léčbě osilodrostatem, nebo k placebu. Kompletní odpověď (v týdnu 36) si udrželo 77,1 % nemocných léčených osilodrostatem oproti 8,0 % pacientů na placebu (p < 0,0001) [4].
Osilodrostat u ektopického CS
Cílem retrospektivní práce francouzských autorů bylo zhodnotit skutečnou účinnost a bezpečnost osilodrostatu u pacientů s ektopickým CS. Do retrospektivní multicentrické studie z reálné klinické praxe bylo zapojeno celkem 33 pacientů s intenzivním/těžkým hyperkortizolismem. Primárním cílem byla normalizace UFC.
U 11 pacientů užívajících osilodrostat jako monoterapii první volby se medián 24‑UFC dramaticky snížil (ze 26násobného zvýšení nad horní hranici normálu [ULN 2,9–659] na 0,11násobek ULN [0,08–14,9]; p < 0,001). U devíti z nich bylo normalizace 24‑UFC dosaženo za dva týdny (medián). Třináct dalších pacientů bylo dříve léčeno klasickými inhibitory steroidogeneze. U těchto pacientů monoterapie osilodrostatem, použitá jako druhá linie, vyvolala signifikantní snížení 24‑UFC (z 2,6násobku ULN [1,1–144] na 0,22násobek ULN [0,12–0,66]; p < 0,01). Devět dalších pacientů dostávalo osilodrostat v kombinaci s jiným antikortizolickým lékem, přičemž 24‑UFC se snížila z 11,8násobku ULN (0,3–247) na 0,43násobek ULN (0,33–2,4) (p < 0,01). Souběžně s tím se hlavní klinické symptomy/komorbidity dramaticky zlepšily (krevní tlak, hyperglykemie a hypokalemie), což umožnilo přerušení léčby nebo snížení dávky. Adrenální insuficience (st. 3–4) byla hlášena u 8 z 33 pacientů [5]. Jeden pacient zemřel. Jak podotkl docent Kužma, tato data však nejsou zcela dostačující.
Bezpečnostní profily
U ketokonazolu je nejzávažnějším nežádoucím účinkem cytolytická hepatitida (< 5 % těžká), objevují se gastrointestinální potíže, raš, mužský hypogonadismus a gynekomastie. U metyraponu se podobně jako u osilodrostatu vyskytuje nauzea, dyspepsie, hirsutismus, akné a u vyšších dávek hypokalemie, hypertenze a otoky.
Kazuistika
U osmadvacetileté ženy se v srpnu 2017 objevily amenorea, nespavost, strie a nárůst hmotnosti. Byla zjištěna porucha glukózové tolerance, hypertenze, hirsutismus, snížená kostní denzita. V prosinci 2017 byl diagnostikován ACTH dependentní CS s laboratorními hodnotami: UFC 1 918 nmol/24 hodin (norma 153–759), ACTH 49,5 pg/ml (0–46), plazmatický kortizol 978 nmol/l. Na magnetické rezonanci (MRI) byl nalezen mikroadenom hypofýzy (6 mm × 4 mm × 4 mm). V dubnu 2018 byla pacientka operována (transfenoidální resekce tumoru). Po operaci na MRI přetrvává podezření na reziduální tumor. Do ledna 2020 je pacientka stabilizovaná (UFC, sérový kortizol, ACTH). Užívá inhibitor angiotenzin konvertujícího enzymu, vitamin D, kalcium, antikoncepci a byl exstirpován tukový hrbol.
V lednu 2020 dochází k relapsu klinických potíží v plném rozsahu se zvýšením hodnoty UFC na trojnásobek normy, hodnota ACTH však zvýšena není. V listopadu 2020 je na MRI ostře ohraničené ložisko (7 mm × 6,5 mm × 3,5 mm) na pravém laterálním okraji adenohypofýzy. Diferenciálně diagnosticky zvažován mikroadenom bez projevů expanze. Při porovnání s původním nálezem na MRI se může jednat o reziduum, respektive recidivu původního tumoru. V květnu 2021 byla provedena operace, po níž se normalizovala koncentrace sérového kortizolu, ale hodnota UFC je na trojnásobku ULN s chyběním diurnální variability – nasazen ketokonazol (3× 200 mg).
V srpnu 2021 jsou provedeny laboratorní kontroly s elevací jaterních enzymů, s trojnásobnou koncentrací UFC, zvýšenou koncentrací sérového kortizolu; ACTH v normě. Na MRI patrné pooperační změny s pseudocystou (8 mm × 2,5 mm × 6 mm). Léčba je tedy bez efektu, ale s nežádoucími účinky. V říjnu 2021 jsou dále zvýšeny koncentrace ALT (alaninaminotransferáza), GMT (gama‑glutamyltransferáza) a ALP (alkalická fosfatáza). Neurochirurg nepředpokládá kurabilní efekt další operace.
V lednu 2022 provedeno ozáření Leksellovým gama nožem (35 Gy). Při kontrole v únoru 2022 jsou jaterní testy v normě, přetrvává zvýšení UFC (dvojnásobek ULN) a pacientka nadále užívá ketokonazol ve zvýšené dávce (4× 200 mg). V červnu 2022 je pro neúčinnost ketokonazol vysazen a nemocná dostává pasireotid 40 mg/28 dní, který užívá s počátečním efektem do května 2023, kdy zjištěny zvýšené hodnoty UFC, ACTH i sérového kortizolu. Žádost o schválení léčby osilodrostatem není schválena; pro relativně uspokojivý klinický stav pacientka nepreferuje bilaterální adrenalektomii. V listopadu 2023 přidán metyrapon, který pacientka netoleruje (nechutenství, ztráta hmotnosti 7 kg za měsíc, nepravidelný menstruační cyklus), proto byl v prosinci 2023 vysazen. Nález na MRI je stacionární. V lednu 2024 vysazen i pasireotid a zahájena (po domluvě se společností Recordati) terapie osilodrostatem (5 mg). Na této léčbě se pacientce daří dobře, má sklon k hypotenzi, redukovala hmotnost, koncentrace kortizolu v normě (květen 2024). „Léčbu osilodrostatem hodnotíme jako velmi úspěšnou jak z klinických hledisek, tak i pro zvýšenou kvalitu života pacientky,“ komentoval přednášející.
Závěrem docent Kužma shrnul, že primární léčba CS je i nadále chirurgická. Existuje však více možností farmakologické léčby – ketokonazol, metyrapon, pasireotid a osilodrostat, který představuje účinnou terapii s dobrou snášenlivostí a menším počtem nežádoucích účinků.
Tento článek vyšel v časopise Medicína po promoci 2/2025
Redakčně zpracovala MUDr. Marta Šimůnková
Literatura
[1] Nieman LK, et al. Treatment of Cushing’s Syndrome: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab 2015;100:2807–2831.
[2] Isturisa, SPC, EMA, poslední revize 12. 12. 2024.
[3] Pivonello R, et al. Efficacy and safety of osilodrostat in patients with Cushing‘s disease (LINC 3): a multicentre phase III study with a double‑blind, randomised withdrawal phase. Lancet Diabetes Endocrinol 2020;8:748–761.
[4] Gadelha M, et al. Randomized Trial of Osilodrostat for the Treatment of Cushing Disease. J Clin Endocrinol Metab 2022;107:e2882–e2895.
[5] Dormoy A, et al. Efficacy and Safety of Osilodrostat in Paraneoplastic Cushing Syndrome: A Real‑World Multicenter Study in France. J Clin Endocrinol Metab 2023;108:1475–1487.
Léčba Cushingova syndromu v praxi
V třetí prezentaci na sympoziu společnosti Recordati se MUDr. Marie Gajošová (Ostrava) věnovala praktickým poznatkům léčby Cushingova syndromu (CS) v podobě tří kazuistik.
Paraneoplastický CS
U muže (nar. 1941) doposud léčeného pouze pro hypertenzi byl v dubnu 2021 diagnostikován dobře diferencovaný neuroendokrinní nádor s metastázami v játrech a na peritoneu. Pacient byl asymptomatický, proto bylo rozhodnuto ponechat jej bez terapie. V říjnu 2021 byla scintigraficky (octreoscan) prokázána vícečetná hypervaskularizovaná ložiska v játrech a byla zahájena léčba lanreotidem (Somatuline Autogel 120 mg), při níž dochází ke stabilizaci stavu.
 V listopadu 2023 je pacient hospitalizován pro předcházející průjmy, dochází k těžké hypokalemii (1,9 mmol/l), bez klinických známek Cushingova syndromu (CS). Na CT (výpočetní tomografie) je patrná progrese mnohočetných metastáz jater. Během hospitalizace na onkologickém oddělení přetrvává i po odeznění průjmů těžká hypokalemie s nutností denní parenterální i perorální substituce kalia (KCl 7,5 % i.v., Kalnormin, Verospiron). Proto byl přizván endokrinolog a bylo vysloveno podezření na CS, který byl laboratorním vyšetřením potvrzen: je setřelý diurnální kortizolový profil, s vysokými koncentracemi nočního kortizolu, vysokou sérovou koncentrací kortikotropinu (ACTH) i vysokými odpady kortizolu v moči za 24 hodin.
V listopadu 2023 je pacient hospitalizován pro předcházející průjmy, dochází k těžké hypokalemii (1,9 mmol/l), bez klinických známek Cushingova syndromu (CS). Na CT (výpočetní tomografie) je patrná progrese mnohočetných metastáz jater. Během hospitalizace na onkologickém oddělení přetrvává i po odeznění průjmů těžká hypokalemie s nutností denní parenterální i perorální substituce kalia (KCl 7,5 % i.v., Kalnormin, Verospiron). Proto byl přizván endokrinolog a bylo vysloveno podezření na CS, který byl laboratorním vyšetřením potvrzen: je setřelý diurnální kortizolový profil, s vysokými koncentracemi nočního kortizolu, vysokou sérovou koncentrací kortikotropinu (ACTH) i vysokými odpady kortizolu v moči za 24 hodin.
Z onkologického hlediska je indikována pouze symptomatická léčba s cílem normalizovat kalemii bez nutnosti parenterální substituce, byl plánován překlad do léčebny dlouhodobě nemocných. Jako léčebná modalita byl zvolen osilodrostat s rychlou titrací dávky až na 25 mg denně. Po třech týdnech léčby se ale u pacienta rozvinul hypokortikalismus. Osilodrostat byl vysazen a po přechodné substituci hydrokortizonu došlo po dvou týdnech k normalizaci ranní koncentrace kortizolu. Při překladu do léčebny dlouhodobě nemocných pacient neužíval hydrokortizon ani osilodrostat. V léčebně dlouhodobě nemocných byly nadále monitorovány hodnoty kortizolu, ACTH a kalia. Po třech měsících dochází opět k manifestaci CS včetně hypokalemie, osilodrostat je zpět nasazen do medikace, pacient ale progreduje do terminálního stadia onemocnění a umírá.
ACTH dependentní CS
Druhá kazuistika MUDr. Gajošové se týká opět muže (nar. 1953) – kardiaka s perzistující fibrilací síní se skóre CHA2DS2‑VASc 2, s normální funkcí levé komory, hypertenzí a hypercholesterolemií, po exstirpaci melanomu levého hemitoraxu (2018). Pacient byl odeslán k endokrinologickému vyšetření neurologem, který jej došetřoval pro polohové vertigo. Při vyšetření na magnetické rezonanci (MRI) v červnu 2024 byl nalezen cystický adenom hypofýzy (10 mm × 15 mm × 18 mm) se známkami staršího krvácení.
Při vstupním endokrinologickém vyšetření byla zjištěna zvýšená koncentrace kortizolu a ACTH. Z klinických symptomů má pacient měsícovitý obličej, centrální obezitu (BMI 33). Na základě klinického vyšetření a laboratorních nálezů byl kompletně došetřen za hospitalizace.
Laboratorní testy dokládají setřelý diurnální kortizolový profil, vysokou koncentraci ACTH, volného kortizolu v moči za 24 hodin, testy LDDST a HDDST jsou pozitivní. Výsledek desmopresinového testu nebyl průkazný pro nadprodukci ACTH z adenomu hypofýzy.
Proto bylo nutné vyloučit ektopickou produkci ACTH. Bylo doplněno sonografické vyšetření štítné žlázy s nálezem nehomogenního uzlu s kalcifikacemi v pravém laloku štítné žlázy (26 mm × 31 mm × 31 mm, objem 12,4 ml, kategorie ACR‑TIRADS: TR 5), podle FNAB (aspirační biopsie tenkou jehlou) je výsledek cytologické diagnostiky opakovaně hodnocen jako Bethesda II, koncentrace kalcitoninu 13,6 ng/l. Vzhledem k onkologické anamnéze a podezření na ektopickou produkci ACTH je doplněno vyšetření PET/CT (pozitronová emisní tomografie/výpočetní tomografie) v červnu 2024, jedinou patologií je nález hypermetabolismu 18F‑deoxyglukózy (FDG) v jednom z uzlů v pravém laloku štítné žlázy, který je velmi suspektní z přítomnosti viabilní nádorové tkáně. Pacient podstoupil totální tyreoidektomii. Pro CS byl pacient zaléčen osilodrostatem a dochází k úpravě koncentrací kortizolu, osilodrostat byl vysazen před operací. Histologicky je v pravém laloku štítné žlázy potvrzen papilární karcinom. Měsíc po operaci dochází opět ke zvýšení sérové koncentrace kortizolu a noční koncentrace kortizolu ve slinách, laboratorně je potvrzen trvající ACTH dependentní CS, u pacienta je znovu indikována terapie osilodrostatem.
V dalším průběhu kontrolní desmopresinový test opět neukazuje na nadprodukci ACTH z adenomu hypofýzy, současně ale všechna provedená vyšetření neukazují na nádor, který by byl zdrojem ektopické produkce ACTH. Proto byla v prosinci 2024 doplněna katetrizace petrózních splavů, která definitivně potvrdila nadprodukci ACTH z adenomu hypofýzy. Nyní pacient čeká na transnazální endoskopickou exstirpaci adenomu hypofýzy, je nadále léčen osilodrostatem, laboratorně došlo k normalizaci koncentrací kortizolu (v mezích normy jsou koncentrace ranního kortizolu jak ze séra, tak i slinného a došlo k poklesu koncentrací nočního slinného kortizolu).
Cushingův syndrom při adenomech nadledvin
Jako třetí kazuistiku uvedla MUDr. Gajošová polymorbidní pacientku (nar. 1948) s diabetem 2. typu na inzulinu, s hypertenzí, hyperlipidemií a obezitou. Je po ozáření tumoru glomus jugulare v oblasti levé pyramidy. Největším zdravotním problémem pacientky je chronická renální insuficience G4A2. Endokrinologem byla poprvé vyšetřena v únoru 2023 pro adenomy nadledvin, ale CS se nepotvrdil, bylo to uzavřeno jako MACS (mild autonomous cortisol secretion). V srpnu 2023 byla hospitalizována pro purulentní meningitidu. Na endokrinologickou kontrolu pacientka přichází až v listopadu 2023. Klinicky jsou nově přítomny projevy CS: „buffalo hump“ – dorzocervikální tukový hrb, temporální alopecie a centrální obezita (BMI 37,8). Došetření za hospitalizace pacientka odmítá. Při laboratorním ambulantním vyšetření je koncentrace ACTH na dolní hranici normy, zjištěny jsou vysoké koncentrace kortizolu (sérový i slinný), při 1mg dexametazonovém supresním testu (LDDS test) nedochází k supresi produkce kortizolu v séru ani kortizolu slinného; přetrvávají laboratorní známky renální insuficience (glomerulární filtrace 0,29 ml/s, urea 33,5 mmol/l, kreatinin 230 µmol/l) – bez progrese oproti únoru 2023. Kontrolní CT vyšetření nadledvin je rovněž bez progrese nálezu: pravá nadledvina zvětšená s ložiskem o velikosti 37 mm × 25 mm, nativní denzita 20–50 HU, levá nadledvina s ložiskem 10 mm, nativní denzita 45 HU. Pacientka odmítá adrenalektomii, proto je indikována léčba inhibitory steroidogeneze, v tomto případě osilodrostatem s pomalou titrací. Na této léčbě dochází k normalizaci koncentrací kortizolu slinného ranního i nočního. Pro těžkou renální insuficienci nelze efekt léčby hodnotit podle sérového kortizolu. Pacientka je dlouhodobě na terapii osilodrostatem 1 mg/den v relativně dobrém, stabilizovaném klinickém stavu.
Závěr
MUDr. Gajošová závěrem shrnula, že osilodrostat účinně inhibuje 11β‑hydroxylázu (CYP11B1) i aldosteron syntázu. Po perorálním podání se vstřebává do jedné hodiny. Eliminační poločas činí zhruba čtyři hodiny. V případě potřeby rychlé normalizace koncentrace kortizolu působí nejrychleji osilodrostat a metyrapon.
Je však třeba věnovat pozornost určitým stavům a možnosti výskytu nežádoucích účinků při léčbě osilodrostatem s tímto doporučením:
- Pro věk nad 65 let nejsou důkazy, které by naznačovaly nutnost úpravy dávky, osilodrostat lze používat s opatrností.
- Nesmí se používat u těhotných, kojících, dětí mladších 18 let.
- Kontraindikací je hypersenzitivita.
- Při navozeném hypokortikalismu se doporučuje úprava dávky, vysazení a substituční terapie hydrokortizonem.
- Není nutná úprava dávky u pacientů se středně těžkou až těžkou poruchou funkce ledvin. Koncentrace volného kortizolu v moči (UFC) se však musí interpretovat s opatrností vzhledem ke sníženému vylučování UFC. Měly by být zváženy alternativní metody monitorování hodnot kortizolu.
- Poškození jater:
- Lehké (Child–Pugh A): není nutná úprava dávky.
- Středně těžké (B): doporučená počáteční dávka je 1 mg 2× denně.
- Těžké (C): doporučená počáteční dávka je 1 mg večer s titrací na dávku 1 mg 2× denně.
- Kvůli prodloužení QT intervalu je doporučováno provést EKG (elektrokardiografické vyšetření) před zahájením léčby osilodrostatem a během prvního týdne po zahájení léčby a podle klinické indikace.
Tento článek vyšel v časopise Medicína po promoci 2/2025
Redakčně zpracovala MUDr. Marta Šimůnková
Osilodrostat
Úvod
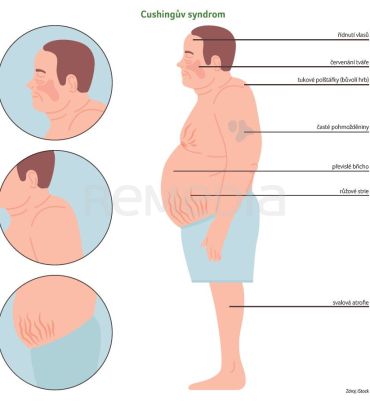
Cushingův syndrom je vyvolán dlouhodobě zvýšenou hladinou kortizolu v těle. Tento stav je asociován s četnými komorbiditami a zvýšenou mortalitou. Bývá spojen s viscerální obezitou, hypertenzí, hyperlipidemií, diabetes mellitus, osteoporózou, myopatií, zvýšeným rizikem infekce a kardiovaskulárních komplikací. Mezi typické tělesné projevy patří nárůst tělesné hmotnosti s redistribucí tuku do oblasti obličeje, krku a břicha (měsícovitý obličej, býčí šíje, tukový prstenec) a s redukcí v podkoží, s křehkostí kůže, tvorbou strií a modřin a s úbytkem svalové hmoty na končetinách. Dochází k řídnutí kostí, hirsutismu, nepravidelné menstruaci a sexuální dysfunkci. Pacienti často trpí výkyvy nálad, úzkostmi a depresemi. Endogenní Cushingův syndrom je způsoben hyperkortizolismem v důsledku sekrece adrenokortikotropního hormonu (ACTH) z nádoru hypofýzy (Cushingova choroba, 80 %)[1], nezávisle na ACTH mohou zvýšené množství kortizolu produkovat rovněž nádory nadledvin (20 %) [1]. Sekundárně je Cushingův syndrom důsledkem dlouhodobého užívání kortikosteroidů.
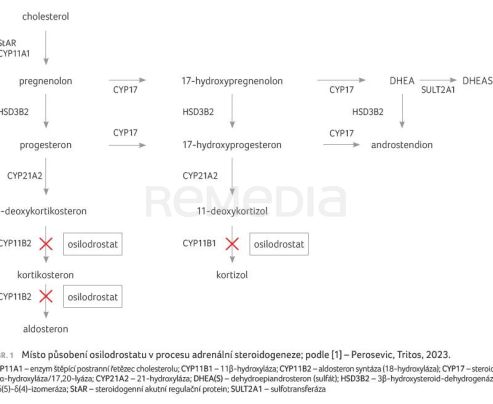 Cílem léčby je snížení produkce kortizolu. V případě endogenního Cushingova syndromu je léčbou první linie chirurgická resekce. I po odstranění nádoru ale může hyperkortizolismus přetrvávat nebo může dojít k recidivě. Data ukazují, že u 20–35 % pacientů v remisi dojde během 10–15 let k relapsu [2]. Pacienti s perzistující nebo rekurentní Cushingovou chorobou profitují z farmakologické léčby. Dostupná farmakoterapie cílí na tři oblasti: hypofýzu a inhibici sekrece ACTH z nádorových kortikotropních buněk, na nadledvinky s inhibicí syntézy kortizolu nebo na antagonizaci glukokortikoidního receptoru. Osilodrostat (LCI699), který byl původně vyvíjen ke snížení sérových koncentrací aldosteronu a ke kontrole hypertenze, patří mezi inhibitory steroidogeneze (obr. 1).
Cílem léčby je snížení produkce kortizolu. V případě endogenního Cushingova syndromu je léčbou první linie chirurgická resekce. I po odstranění nádoru ale může hyperkortizolismus přetrvávat nebo může dojít k recidivě. Data ukazují, že u 20–35 % pacientů v remisi dojde během 10–15 let k relapsu [2]. Pacienti s perzistující nebo rekurentní Cushingovou chorobou profitují z farmakologické léčby. Dostupná farmakoterapie cílí na tři oblasti: hypofýzu a inhibici sekrece ACTH z nádorových kortikotropních buněk, na nadledvinky s inhibicí syntézy kortizolu nebo na antagonizaci glukokortikoidního receptoru. Osilodrostat (LCI699), který byl původně vyvíjen ke snížení sérových koncentrací aldosteronu a ke kontrole hypertenze, patří mezi inhibitory steroidogeneze (obr. 1).
Osilodrostat je řazen do Farmakoterapeutické skupiny Antikortikosteroidy (ATC kód: H02CA02). Evropskou lékovou agenturou (EMA) byl ke klinickému používání schválen 9. ledna 2020 pro léčbu pacientů s Cushingovým syndromem, kteří nejsou kandidáty na chirurgickou léčbu nebo u nichž nebyla tato léčba úspěšná, a Úřadem pro kontrolu potravin a léčiv (FDA) 6. března 2020 pro tytéž pacienty v indikaci léčby Cushingovy choroby. Osilodrostat (Isturisa) je dostupný v potahovaných tabletách o síle 1, 5 a 10 mg.
Mechanismus účinku
Osilodrostat inhibuje syntézu kortizolu. Je silným inhibitorem 11β‑hydroxylázy (CYP11B1), enzymu, který katalyzuje poslední stupeň biosyntézy kortizolu v nadledvinách. Osilodrostat inhibuje dále 18‑hydroxylázu (CYP11B2), která vede k syntéze aldosteronu (obr. 1). Jak bylo zmíněno výše, pro tyto účinky ovlivňující mineralokortikoidní dráhu byl původně vyvíjen jako antihypertenzivum u pacientů s esenciální hypertenzí nebo s primárním aldosteronismem. Nicméně vzhledem k omezené účinnosti se zájem ve vývoji posunul právě k léčbě Cushingova syndromu [1].
Farmakokinetické vlastnosti
Farmakokinetika osilodrostatu byla charakterizována devíti studiemi fáze I (zdraví jedinci a jedinci s poruchou funkce jater nebo ledvin), dvěma studiemi fáze II (pacienti s Cushingovou chorobou nebo Cushingovým syndromem) a studií fáze III (pacienti s Cushingovou chorobou) [3].
Osilodrostat se po perorálním podání rychle a téměř kompletně vstřebává. Maximálních koncentrací je dosaženo zhruba za jednu hodinu, rovnovážného stavu do druhého dne. U pacientů asijského původu byla v porovnání s ostatními etniky zaznamenána zhruba o 20 % vyšší relativní biologická dostupnost. Podání společně s jídlem neovlivňuje absorpci v klinicky významném rozsahu [4].
Věk nebo pohlaví nemají u dospělých pacientů významný vliv na expozici osilodrostatu. Co se týče renálních funkcí, byla expozice osilodrostatu v kohortách členěných podle renálních funkcí (normální, těžké a konečné stadium renálního onemocnění) podobná, což naznačuje, že renální funkce nemá žádný vliv na expozici osilodrostatu. Oproti zdravým subjektům byl zaznamenán trend zvyšování plochy pod křivkou plazmatické koncentrace (čas od nuly do nekonečna) u subjektů se středně těžkou až těžkou poruchou funkce jater. Vazba na plazmatické bílkoviny je nízká.
Osilodrostat se intenzivně metabolizuje (asi 80 % vyloučeno ve formě metabolitů). Hlavním metabolitem v plazmě je LXB168, který není farmakologicky aktivní. Na metabolizaci se podílí více enzymů (CYP3A4, CYP2B6, CYP2D6, UDP glukuronosyltransferázy [UGT], non‑CYP a non‑UGT metabolismus). Žádný jednotlivý enzym nepřispívá k celkové clearance více než 25 %. Z tohoto důvodu jsou jeho lékové interakce (jako „victim“) méně pravděpodobné [3,4]. Osilodrostat je středně silným inhibitorem CYP1A2, slabým až středně silným inhibitorem CYP2C19 a slabým inhibitorem CYP2D6 a CYP3A4/5 (doloženo při jednorázovém podání).
Většina látek souvisejících s osilodrostatem je eliminována močí (~ 90,6 % podané dávky), pouze 5,2 % jako nezměněný osilodrostat. Eliminační poločas je asi 4 hodiny [3].
Indikace
Přípravek je indikován k léčbě endogenního Cushingova syndromu u dospělých pacientů [4].
Kontraindikace
Jedinou známou kontraindikací je hypersenzitivita na léčivou látku nebo na kteroukoliv pomocnou látku [4].
Dávkování
Léčba osilodrostatem je obvykle zahajována dávkou 2 mg podávanou 2× denně. U pacientů asijského původu je doporučeno zahajovat léčbu dávkou 1 mg 2× denně. Přípravek se podává bez ohledu na jídlo [4].
Podle odpovědi na léčbu se pak dávka osilodrostatu titruje s cílem dosáhnout normálních hodnot kortizolu. Hodnoty kortizolu (měřeno obvykle jako hodnota volného kortizolu v 24hodinovém sběru moči [24 hours urinary free cortisol, 24‑h UFC] nebo plazmatická koncentrace kortizolu) je žádoucí monitorovat v intervalu 1–2 týdnů a podle nich přizpůsobovat léčbu. Dle dosavadních zkušeností se obvyklá udržovací dávka pohybuje mezi 2–7 mg 2× denně. Maximální doporučená dávka osilodrostatu je 30 mg 2× denně.
K redukci dávky nebo i přerušení léčby se přistupuje při poklesu kortizolu pod normální hodnoty nebo při známkách hypokortizolismu (nauzea, zvracení, únava, bolest břicha, ztráta chuti k jídlu a závrať). Pacienti by na tyto příznaky měli být upozorněni.
U pediatrických pacientů nebylo použití přípravku zatím vyhodnoceno, aktuálně probíhá otevřená, nekontrolovaná studie LINC 5 fáze II v délce 48 týdnů. U nemocných starších 65 let jsou k dispozici pouze omezené údaje, nicméně žádné dostupné doklady nesvědčí pro nutnost úpravy dávkování. U pacientů s porušenou funkcí ledvin není potřeba upravovat dávkování, nicméně je doporučeno interpretovat hodnoty 24‑h UFC s opatrností s ohledem na alteraci vylučování. U pacientů s poruchou funkce jater se úpravy dávkování řídí závažností postižení. Při skóre Child–Pugh A není třeba dávku upravovat, při Child–Pugh B se léčba zahajuje redukovanou dávkou 1 mg 2× denně, při skóre Child–Pugh C dávkou 1 mg jednou denně podávanou večer s postupnou titrací na 1 mg 2× denně [4].
Klinické zkušenosti
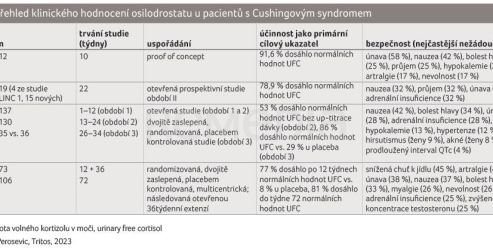 Klinické hodnocení programu LINC, který sledoval účinnost a bezpečnost osilodrostatu u pacientů s Cushingovým syndromem, shrnuje tabulka 1 [1]. Studie LINC 1–4 prezentovaly, že osilodrostat je účinný při normalizaci 24‑h UFC u většiny léčených pacientů a má příznivý bezpečnostní profil.
Klinické hodnocení programu LINC, který sledoval účinnost a bezpečnost osilodrostatu u pacientů s Cushingovým syndromem, shrnuje tabulka 1 [1]. Studie LINC 1–4 prezentovaly, že osilodrostat je účinný při normalizaci 24‑h UFC u většiny léčených pacientů a má příznivý bezpečnostní profil.
Studie LINC 3
LINC 3 (NCT02180217) byla prospektivní multicentrická otevřená studie fáze III [5]. Zařazeni byli pacienti ve věku 18–75 let s potvrzenou perzistující nebo recidivující Cushingovou chorobou s mUFC (průměrnou hodnotou volného kortizolu v moči získanou před zařazením ze tří 24hodinových sběrů moči) > 1,5násobek horní hranice normy (upper limit of normal, ULN) a ranní plazmatickou koncentrací ACTH nad spodní normální hranicí, kteří dříve podstoupili operaci hypofýzy nebo ozařování nebo byli nově diagnostikováni a odmítli operaci nebo nebyli kandidáty na chirurgický zákrok.
Studie byla rozdělena na čtyři období. Ve 12týdenním období 1 byla u všech účastníků studie zahájena léčba osilodrostatem, která byla na základě hodnoty mUFC a snášenlivosti upravována každé 2 týdny (1–30 mg 2× denně). V období 2 (týden 13–24) pacienti pokračovali v léčbě osilodrostatem v terapeutické dávce stanovené během období 1. V období 3, počínaje týdnem 26, byli účastníci s mUFC ≤ ULN v týdnu 24, bez up‑titrace po 12. týdnu, randomizováni v poměru 1 : 1 v dvojitě zaslepeném uspořádání k pokračující léčbě osilodrostatem nebo k podávání placeba po dobu 8 týdnů. Nezpůsobilí účastníci pokračovali v otevřeném podávání osilodrostatu. V období 4 (týden 35–48) byl všem účastníkům podáván v otevřeném uspořádání osilodrostat až do konce základní části studie. Primárním cílem bylo porovnat účinnost osilodrostatu oproti placebu na konci období 3. Primárním cílovým ukazatelem byl podíl účastníků, kteří byli randomizováni k aktivní léčbě nebo k placebu, s kompletní odpovědí (tj. mUFC ≤ ULN) na konci randomizovaného období vysazení (34. týden), bez up‑titrace během tohoto období. Klíčovým sekundárním cílovým ukazatelem byl podíl účastníků s kompletní odpovědí na konci jednoramenného otevřeného období (tj. období 2, týden 24) bez up‑titrace během 13.–24. týdne.
Do sledování bylo zařazeno 137 pacientů, střední věk činil 40,0 (31,0–49,0) let a 77 % (106) pacientů tvořily ženy. Celkem 72 (53 %) účastníků bylo způsobilých pro randomizaci během fáze vysazení (období 3), z nich 36 bylo přiřazeno k pokračování v léčbě osilodrostatem a 35 k placebu. Kompletní odpověď si v týdnu 34 udrželo při léčbě osilodrostatem 31 (86 %) pacientů oproti 10 (29 %) pacientům z placebové větve; poměr šancí (odds ratio, OR) 13,7 (95% interval spolehlivosti [confidence interval, CI] 3,7–53,4; p < 0,0001). V týdnu 24 si 72 (53 %; 95% CI 43,9–61,1) ze 137 pacientů udrželo kompletní odpověď bez up‑titrace po týdnu 12. Nejčastějšími nežádoucími účinky (výskyt u > 25 % účastníků) byly nevolnost (57 [42 %]), bolest hlavy (46 [34 %]), únava (39 [28 %]) a adrenální insuficience (38 [28 %]). Hypokortizolismus se vyskytl celkem u 70 (51 %) pacientů a nežádoucí účinky související s prekurzory hormonů nadledvin se vyskytly u 58 (42 %) pacientů. Osilodrostat podávaný dvakrát denně rychle snižoval mUFC a udržoval toto snížení spolu se zmírněním klinických příznaků hyperkortizolismu; byl obecně dobře snášen.
Ve studii LINC 3 byly hodnoceny také kardiometabolické parametry (krevní tlak, hmotnost, obvod pasu, index tělesné hmotnosti, celkový cholesterol, glykemie nalačno, glykovaný hemoglobin), fyzické projevy hyperkortizolismu (strie, distribuce tuku, podlitiny, hirsutismus u žen, svalová atrofie) a kvalita života. Spolu s poklesem mUFC došlo ke zmírnění klinických příznaků a dalších specifických projevů souvisejících s hyperkortizolismem.
Post hoc analýza studie LINC 3 [6] se zaměřila na změnu klinických příznaků hyperkortizolismu a kvality života podle stupně kontroly mUFC. Míra kontroly mUFC byl definována jako: kontrolovaná (mUFC ≤ ULN), částečně kontrolovaná (> ULN, ale ≥ 50% snížení oproti výchozí hodnotě) nebo nekontrolovaná (mUFC > ULN a < 50% snížení od počáteční hodnoty). Ve 24. a 48. týdnu byla mUFC kontrolována u 93 (67,9 %) a 91 (66,4 %) pacientů, částečně kontrolována u 20 (14,6 %) a 13 (9,5 %) pacientů a nekontrolovaná zůstala u 24 (17,5 %) a 33 (24,1 %) pacientů. Zlepšení kardiometabolických parametrů oproti výchozímu stavu v týdnu 24 bylo výraznější u pacientů s kontrolovanými nebo částečně kontrolovanými hodnotami mUFC oproti nekontrolovaným; v týdnu 48 došlo ke zlepšení bez ohledu na kontrolu UFC. Obecně se fyzické projevy a kvalita života progresivně zlepšily od výchozí hodnoty bez ohledu na kontrolu UFC.
Extenze studie LINC 3 si dala za cíl prozkoumat dlouhodobou účinnost a snášenlivost osilodrostatu [7]. Po 48 týdnech hlavní části studie mohli pacienti, kteří profitovali z léčby osilodrostatem ve 48. týdnu, vstoupit do prodloužení. To bylo ukončeno, když všichni pacienti dostávali ≥ 72 týdnů léčby nebo léčbu ukončili.
Medián expozice osilodrostatu od hlavní části studie do konce extenze byl 130 (1–245) týdnů a střední průměrná dávka osilodrostatu 7,4 (0,8–46,6) mg/den. Snížení mUFC dosažené během hlavní části studie bylo zachováno i během extenze a zůstalo na hodnotě ≤ ULN. Ze 106 pacientů, kteří vstoupili do prodloužení, jich mUFC ≤ ULN v 72. týdnu dosáhlo 86 (81 %). Zlepšení kardiometabolických parametrů, zmírnění fyzických projevů hyperkortizolismu a kvalita života dosažená v základní studii zůstaly během extenze také zachovány nebo dále zlepšeny. Nebyly hlášeny žádné nové bezpečnostní signály; léčbu z důvodu nežádoucích účinků přerušilo 15/137 (10,9 %) pacientů během hlavní části studie a 12/106 (11,3 %) pacientů v průběhu jejího prodloužení. Údaje z této velké multicentrické studie ukazují, že dlouhodobá léčba osilodrostatem udržuje normalizované hodnoty kortizolu spolu s klinickými přínosy u většiny pacientů s Cushingovou chorobou a je dobře tolerována.
Studie LINC 4
LINC 4 (NCT02697734) byla multicentrická studie fáze III zahrnující počáteční 12týdenní randomizovanou (v poměru 2 : 1), dvojitě zaslepenou, placebem kontrolovanou fázi s následným 36týdenním obdobím otevřené léčby [8]. Zařazeni byli dospělí pacienti (ve věku 18–75 let) s diagnózou Cushingovy choroby s mUFC ≥ 1,3násobek ULN. Primárním cílovým ukazatelem byl podíl pacientů s mUFC ≤ ULN v týdnu 12. Klíčovým sekundárním cílovým ukazatelem byl podíl dosažení mUFC ≤ ULN ve 36. týdnu (po 24 týdnech otevřené léčby osilodrostatem).
Hodnocení se účastnilo 73 pacientů (osilodrostat n = 48, placebo n = 25). Průměrný věk činil 39 (19–67) let, průměrná hodnota mUFC na počátku sledování 3,1 × ULN, medián 2,5 × ULN. Sledovaného parametru, mUFC ≤ ULN, dosáhlo ve 12. týdnu významně více pacientů s osilodrostatem (77 %) než s placebem (8 %); OR 43,4 (95% CI 7,1–343,2; p < 0,0001). Odpověď byla zachována i ve 36. týdnu, kdy mUFC ≤ ULN dosáhlo 81 % (95% CI 69,9–89,1) všech pacientů. Nejčastějšími nežádoucími účinky hlášenými během období kontrolovaného placebem (osilodrostat vs. placebo) byly: snížená chuť k jídlu (37,5 % vs. 16,0 %), artralgie (35,4 % vs. 8,0 %) a nauzea (31,3 % vs. 12,0 %). I v tomto klinickém hodnocení osilodrostat rychle normalizoval mUFC u většiny pacientů s Cushingovou chorobou a udržel tento účinek po celou dobu sledování. Bezpečnostní profil byl příznivý.
Speciální populace
Podávání osilodrostatu bylo rovněž sledováno u pacientů s paraneoplastickým/ektopickým Cushingovým syndromem, kde se ukázal jako rychlá a účinná léčba [9,10]. Tento vzácný syndrom je vyvolán extrapituitární sekrecí ACTH neuroendokrinním nádorem plic nebo jinými malignitami, jako jsou nádory ledvinových buněk, prsu nebo vaječníků. Může způsobit těžký, život ohrožující hyperkortizolismus, a vyžaduje proto rychlou a účinnou intervenci.
Nežádoucí účinky
Nejčastějšími hlášenými nežádoucími účinky při léčbě osilodrostatem byly adrenální insuficience, únava, nauzea, bolest hlavy, zvracení a edém. Nejzávažnějším nežádoucím účinkem je adrenální insuficience. Symptomatičtí pacienti mají být sledováni pro možný výskyt hypotenze, hyponatremie, hyperkalemie a/nebo hypoglykemie. Pokud existuje podezření na hypokortizolismus, je nutné změřit hodnoty kortizolu a zvážit dočasné snížení dávky nebo přerušení léčby osilodrostatem. V případě potřeby pak zahájit substituční léčbu kortikosteroidy.
Inhibice CYP11B1 osilodrostatem vede k akumulaci prekurzorů adrenálních steroidů a ke zvýšení koncentrace testosteronu. Nárůst hladiny testosteronu se může projevit vznikem mírné až středně závažné formy hirsutismu nebo akné. Po přerušení léčby se stav normalizuje [11].
Dalším nežádoucím účinkem pozorovaným během podávání osilodrostatu je prodloužení intervalu QT, které je závislé na dávce [4].
Bezpečnostní profil osilodrostatu je považován za příznivý, lék je dobře tolerován. Je však nutné pečlivé monitorování léčby, aby se zabránilo hypoadrenalismu a u pacientů se známým prodloužením intervalu QT jeho dalšímu prodloužení [1]. Neexistuje korelace mezi mírou hyperkortizolismu v předléčebném období a dávkou potřebnou k dosažení kontroly onemocnění [11]. Před zahájením léčby přípravkem Isturisa má být provedeno EKG vyšetření, další do jednoho týdne od začátku léčby, a dále dle klinické potřeby. V průběhu léčby mají být pravidelně sledovány hodnoty elektrolytů. Případné hypokalemie, hypokalcemie nebo hypomagnezemie by měly být vyřešeny před zahájením léčby.
Fertilita, těhotenství a kojení
Informace o vlivu osilodrostatu na lidskou fertilitu nejsou dostupné. Preklinické údaje ale ukazují, že osilodrostat může poškodit plod. Před zahájením léčby se proto doporučuje provést u fertilních žen těhotenský test. Během léčby (a ještě alespoň 1 týden po jejím ukončení) by ženy ve fertilním věku měly používat účinnou antikoncepci. Z hormonálních kontraceptiv je kombinace ethinylestradiolu a levonorgestrelu z hlediska možných lékových interakcí považována za bezpečnou. Není známo, zda se osilodrostat nebo jeho metabolity vylučují do lidského mateřského mléka, proto je doporučeno kojení během léčby a alespoň jeden týden po jejím ukončení přerušit [4].
Interakce
Osilodrostat prodlužuje v závislosti na dávce interval QT. Při současném podávání s jinými léčivými přípravky ovlivňujícími interval QT může dojít k dalšímu prodloužení intervalu QT a k poruchám srdečního rytmu. Je doporučeno léčbu pečlivě monitorovat a souběžnému podávání s dalšími léčivy prodlužujícími interval QT se vyhnout. Při přechodu z léčby pasireotidem a ketokonazolem je z tohoto důvodu doporučena tzv. wash out perioda.
Potenciál farmakokinetických lékových interakcí osilodrostatu je nízký. Osilodrostat je na základě klinického hodnocení považován za slabý inhibitor CYP2D6 a CYP3A4/5, slabý až střední inhibitor CYP2C19 a střední inhibitor CYP1A2. Opatrnosti je proto třeba při současném podávání léčiv s úzkým terapeutickým indexem, která jsou citlivými enzymovými substráty [4].
Tento článek vyšel v časopise Remedia 1/2025
Redakčně zpracovala PharmDr. Kateřina Viktorová
Literatura
[1] Perosevic M, Tritos NA. Clinical Utilit of Osilodrostat in Cushingʼs Disease: Review of Currently Available Literature. Drug Des Devel Ther 2023; 17: 1303–1312.
[2] Langlois F, Chu J, Fleseriu M. Pituitary‑directed therapies for Cushing’s disease. Front Endocrinol 2018; 9: 164.
[3] Han K, Tauchmanova L, Atkinson S, et al. Pharmacokinetics of osilodrostat following single and multiple doses of osilodrostat in healthy subjects and patients with Cushing’s disease. Endocrine Abstracts 2019; 63: doi 10.1530/endoabs.63.GP162.
[4] SPC Isturisa. Dostupné na: https://www.ema.europa.eu
[5] Pivonello R, Fleseriu M, Newell‑Price J, et al. Efficacy and safety of osilodrostat in patients with Cushingʼs disease (LINC 3): a multicentre phase III study with a double‑blind, randomised withdrawal phase. Lancet Diabetes Endocrinol 2020; 8: 748–761.
[6] Pivonello R, Fleseriu M, Newell‑Price J, et al. Improvement in clinical features of hypercortisolism during osilodrostat treatment: findings from the Phase III LINC 3 trial in Cushingʼs disease. J Endocrinol Invest 2024; 47: 2437–2448.
[7] Fleseriu M, Newell‑Price J, Pivonello R, et al. Long‑term outcomes of osilodrostat in Cushing’s disease: LINC 3 study extension. Eur J Endocrinol 2022; 187: 531–541.
[8] Gadelha M, Bex M, Feelders RA, et al. Randomized Trial of Osilodrostat for the Treatment of Cushing Disease. J Clin Endocrinol Metab 2022; 107: e2882–e2895.
[9] Bessiene L, Bonnet F, Tenenbaum F, et al. Rapid control of severe ectopic Cushingʼs syndrome by oral osilodrostat monotherapy. Eur J Endocrinol 2021; 184: L13–L15.
[10] Dormoy A, Haissaguerre M, Vitellius G, et al. Efficacy and Safety of Osilodrostat in Paraneoplastic Cushing Syndrome: A Real‑World Multicenter Study in France. J Clin Endocrinol Metab 2023; 108: 1475–1487.
[11] Antonini S. Brunetti A, Zampetti B, et al. Osilodrostat in Cushing’s disease: the management of its efficacy and the pitfalls of post‑surgical results. Endocrinol Diabetes Metab Case Rep 2022; 2022: 22–0311.
Komentář: Osilodrostat
Cushingův syndrom patří mezi vzácná onemocnění s předpokládanou incidencí 2–4 nové případy na jeden milion obyvatel a jeden rok. Příčinou je nadměrná autonomní produkce kortizolu a následně jeho nadměrné působení na buňky, tkáně a orgány lidského těla. Onemocnění své nositele těžce poškozuje a je spojeno s významně zvýšenou morbiditou a mortalitou, především z kardiovaskulárních příčin. Cushingův syndrom tak patří k onemocněním, která bezprostředně ohrožují život svých nositelů a je nutné je co nejdříve správně diagnostikovat a léčit, respektive normalizovat sekreci kortizolu. Jedná se o onemocnění s vícečetnou etiologií, a proto jeho diagnostika a diferenciální diagnostika jsou často obtížné a rovněž volba a provedení správné léčby mohou být komplikované.
Etiologicky dělíme Cushingův syndrom na ACTH‑dependentní formy (Cushingovu nemoc a ektopický Cushingův syndrom) a ACTH‑independentní formy (nadledvinové, adenom, karcinom a vzácné bilaterální formy). Diferenciální diagnostika zejména ACTH‑dependentních forem je obtížná a někdy komplikovaná. Snaha o správnou etiologickou diagnózu pak může vést k prodlení, které však může přinášet pro hormonálně aktivní pacienty neúměrné riziko.
U Cushingovy choroby je léčbou první volby chirurgické odstranění adenomu hypofýzy, při neúspěchu reoperace nebo radioterapie. U ektopických forem je rovněž obvykle péčí první volby léčba chirurgická, další terapeutické modality jsou voleny dle konkrétního ACTH produkujícího tumoru. U jednostranných nadledvinových forem je též péčí první volby léčba chirurgická – unilaterální adrenalektomie, u bilaterálních forem pak bilaterální adrenalektomie, či v některých případech léčba medikamentózní. V situacích, kdy trvá významná hormonální aktivita i přes použitou léčbu, u těžších případů i předoperačně, je důležitá snaha o její normalizaci. K tomuto účelu používáme léčbu medikamentózní [1].
Základními indikacemi medikamentózní léčby jsou následující situace:
- a) Trvající hormonální aktivita po neúspěšném chirurgickém řešení, včetně pacientů, kteří prodělali neúspěšnou neurochirurgickou operaci, byla u nich provedena radioterapie a čekáme na nástup jejího účinku.
- b) Normalizace nebo snížení hormonální aktivity u stavů, kdy se nám nedaří identifikovat zdroj nadprodukce ACTH, jako dočasné řešení mezi vyšetřovacími procedurami nebo kontrolními vyšetřeními.
- c) Normalizace nebo snížení hormonální aktivity nebo pokus o ni u pacientů, u nichž by byla indikována bilaterální adrenalektomie.
- d) Paliativní léčba u inoperabilních stavů a u metastazujících tumorů produkujících kortizol či ACTH.
- e) Léčba nově diagnostikovaných pacientů s Cushingovým syndromem před chirurgickým řešením. Medikamentózní snížení hormonální aktivity onemocnění předoperačně vede ke korekci metabolických odchylek, ke zlepšení klinického stavu pacientů a následně pravděpodobně ke snížení frekvence komplikací chirurgického výkonu a ke snížení preoperační, perioperační a pooperační morbidity a mortality pacientů s Cushingovým syndromem.
Podle místa, na kterém zasahuje, dělíme medikamentózní léčbu Cushingova syndromu na léčbu adrenolytickou, v praxi nejpoužívanější, které se dále budeme věnovat podrobněji, léčbu neuromodulační a léčbu antagonisty glukokortikoidních receptorů. Léčba neuromodulační působí na úrovni ACTH produkujícího tumoru hypofýzy a v současnosti máme k dispozici léčbu multiligandovým agonistou somatostatinových receptorů pasireotidem a tzv. off‑label léčbu D2 agonistou kabergolinem, která je málo účinná [1]. Léčba antagonisty glukokortikoidního receptoru t. č. není v České republice k dispozici, a navíc je její použití komplikováno především z hlediska nedostatečných možností monitorování léčby.
Adrenolytická léčba je v současnosti nejpoužívanější především z důvodu dobré účinnosti a poměrně rychlého nástupu účinku. Používáme k ní inhibitory steroidogeneze, které působí v kůře nadledvin a na různých úrovních blokují syntézu kortizolu. Nejvíce používanými jsou: ketokonazol, metopiron a osilodrostat. K dispozici máme dále ještě mitotan, který je používán při léčbě karcinomu nadledvin, a etomidat, který je celkovým anestetikem zároveň schopným blokovat steroidogenezi a který se aplikuje kontinuálně parenterálně zpravidla u vysoce aktivních pacientů, optimálně za monitorování na jednotce intenzivní péče.
Ketokonazol je původně antimykotikum, jehož vedlejším účinkem je inhibice steroidogeneze na několika úrovních syntézy kortizolu (StAR/SCC, 17α‑hydroxyláza, 11β‑hydroxyláza). Dle různých studií bylo ketokonazolem možno kontrolovat produkci kortizolu u přibližně 50 % pacientů. Jeho výhodami je rychlý nástup a blokáda steroidogeneze na více úrovních. Proto při jeho použití nedochází k významnému zvyšování produkce androgenů a mineralokortikoidů. Doba působení je 2–3 dny. Mezi hlavní nežádoucí účinky patří hepatotoxicita, gastrointestinální nežádoucí účinky (nauzea, zvracení), hypogonadismus a gynekomastie u mužů.
Metopiron je inhibitor 11β‑hydroxylázy a 18‑hydroxylázy cíleně vyvinutý pro léčbu Cushingova syndromu. Ke kontrole hormonální aktivity vede u přibližně 50 % pacientů. Doba působení je v řádu hodin. Je relativně dobře tolerován. Hlavními nežádoucími účinky jsou hirsutismus, akné u žen a při použití vyšších dávek arteriální hypertenze a hypokalemie.
Osilodrostat je rovněž inhibitorem 11β‑hydroxylázy, oproti metopironu má delší biologický poločas (4 h vs. 2 h) a vyšší afinitu k 11β‑hydroxyláze, resp. vyšší účinnost (in vitro IC50 7,5 nM vs. 2,5 nM). Doba působení je několik hodin. Nežádoucí účinky nejsou časté a patří mezi ně nauzea, bolesti hlavy, únavnost a insuficience kůry nadledvin. Insuficience kůry nadledvin je však důsledkem vysoké účinnosti a její výskyt lze minimalizovat správnou titrací [1,2].
Osilodrostat je tedy v současnosti nejúčinnějším inhibitorem steroidogeneze. Účinnost a bezpečnost osilodrostatu byly prokázány řadou studií, z nichž bych jmenoval zejména LINC 3 a LINC 4 včetně jejich extenzí. Tyto studie byly prvními randomizovanými prospektivními a placebem kontrolovanými hodnoceními s inhibitorem steroidogeneze na relativně velkém (vzhledem k vzácnosti onemocnění) souboru pacientů. Výsledky těchto studií prokazují dlouhodobou kontrolu produkce kortizolu u většiny pacientů, a to včetně osob s vysokou hormonální aktivitou [2–7]. Na základě studie LINC 3 a její extenze lze rovněž konstatovat, že se u žen není nutné obávat hirsutismu. Hodnoty testosteronu se po zahájení léčby u pacientek jen mírně zvýšily a v průběhu další léčby se navracely k normálním hodnotám a hirsutismus se jako nežádoucí účinek vyskytoval pouze zřídka [2,3]. Je tak pravděpodobné, že díky osilodrostatu bude možné zlepšit prognózu řady pacientů s vysoce hormonálně aktivním Cushingovým syndromem a u některých pacientů bude moci být upuštěno od bilaterální adrenalektomie, která se dosud, byť málo často, u části těchto nemocných jako ultimum refugium prováděla. Naše zkušenosti s léčbou osilodrostatem nám dovolují předpokládat, že tomu tak bude.
Tento článek vyšel v časopise Remedia 1/2025
Prof. MUDr. Michal Kršek, CSc., MBA
3. interní klinika – klinika endokrinologie
a metabolismu 1. LF UK a VFN, Praha
U Nemocnice 504/1, 128 08 Praha 2
e‑mail: michal.krsek@vfn.cz
Literatura
[1] Ferriere A, Tabarin A. Cushing’s syndrome: Treatment and new therapeutic approaches. Best Pract Res Clin Endocrinol Metab 2020; 34: 101381.
[2] Pivonello R, Fleseriu M, Newell‑Price J, et al. Efficacy and safety of osilodrostat in patients with Cushing’s disease (LINC 3): a multicentre phase III study with a double‑blind, randomised withdrawal phase. Lancet Diabetes Endocrinol 2020; 8: 748–761.
[3] Fleseriu M, Newell‑Price J, Pivonello R, et al. Long‑term outcomes of osilodrostat in Cushing’s disease: LINC 3 study extension. Eur J Endocrinol 2022; 187: 531–541.
[4] Gadelha M, Bex M, Feelders RA, et al. Randomized trial of osilodrostat for the treatment of Cushing disease. J Clin Endocrinol Metab 2022; 107: e2882–e2895.
[5] Gadelha M, Snyder PJ, Witek P, et al. Long‑term efficacy and safety of osilodrostat in patients with Cushing’s disease: results from the LINC 4 study extension. Front Endocrinol 2023; 14: 1236465.
[6] Newell‑Price J, Fleseriu M, Pivonello R, el al. Improved clinical outcomes during long‑term osilodrostat treatment of Cushing disease with normalization of late‑night salivary cortisol and urinary free cortisol. J Endocr Soc 2024; 9: bvae201.
[7] Pivonello R, Fleseriu M, Newell‑Price J, et al. Improvement in clinical features of hypercortisolism during osilodrostat treatment: findings from the Phase III LINC 3 trial in Cushing’s disease. J Endocrinol Invest 2024; 47: 2437–2448.