Zaostřeno PragueONCO 2025
Clarion Congress Hotel Prague se ve dnech 29.–31. ledna 2025 stal dějištěm již 16. pražského mezioborového onkologického kolokvia PragueONCO. Na rozšíření možností léčby HR+/HER2– karcinomu prsu upozornily přednášky v rámci minikolokvia podpořené společností Novartis, kterému předsedaly MUDr. Katarína Petráková, Ph.D., z Masarykova onkologického ústavu v Brně a doc. MUDr. Iveta Kolářová, Ph.D., z Kliniky onkologie a radioterapie FN Hradec Králové.
Riziko rekurence u pacientů s HR+/HER2– časným karcinomem prsu
MUDr. Kateřina Jirsová (Integrované onkologické centrum, Nemocnice Na Pleši) v úvodu první prezentace shrnula aktuální epidemiologická data časného karcinomu prsu v České republice. Karcinom prsu představuje nejčastější nádorové onemocnění u žen. Jeho incidence v posledních 20 letech narostla. Zároveň ale došlo k nárůstu incidence časných stadií karcinomu prsu s trendem klesající mortality na toto onemocnění, a to díky zavedení preventivního mamografického screeningu od roku 2002 (https://www.svod.cz/).
Karcinom prsu je velmi heterogenní typ nádoru, ve své přednášce se primářka Jirsová dále zaměřila na hormonálně dependentní (HR+) a HER2 negativní (HER2–) karcinom prsu. Standardní léčebný proces zahrnuje operaci s následnou radioterapií (v trvání 3,5–6 týdnů) a následnou adjuvantní léčbou (chemoterapie 3–6 měsíců, hormonální léčba 5–10 let, případně cílená léčba) [1].
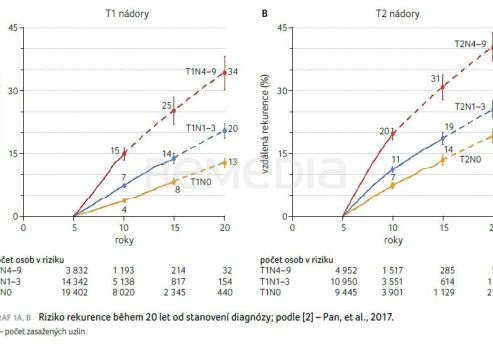 Léčba časného karcinomu prsu se provádí s kurativním záměrem, ale riziko recidivy zůstává významným problémem. Řešení recidivy je důležité, protože metastazující karcinom prsu již nelze vyléčit. Navzdory zavedené účinné terapii stále nezanedbatelný podíl pacientek relabuje. Ve stadiu II se jedná o 7–11 % pacientek, ve stadiu III je to 15–20 % pacientek v průběhu 10 let [2]. Riziko rekurence přetrvává i 20 let od stanovení diagnózy (graf 1A, B) [2].
Léčba časného karcinomu prsu se provádí s kurativním záměrem, ale riziko recidivy zůstává významným problémem. Řešení recidivy je důležité, protože metastazující karcinom prsu již nelze vyléčit. Navzdory zavedené účinné terapii stále nezanedbatelný podíl pacientek relabuje. Ve stadiu II se jedná o 7–11 % pacientek, ve stadiu III je to 15–20 % pacientek v průběhu 10 let [2]. Riziko rekurence přetrvává i 20 let od stanovení diagnózy (graf 1A, B) [2].
Na rozdíl od většiny solidních nádorů může hormonálně dependentní karcinom prsu relabovat 5–30 let po počáteční diagnóze [3]. Riziko rekurence přetrvává bez ohledu na postižení uzlin [2]. Více než 50 % recidiv se objevuje po pěti letech adjuvantní hormonální terapie [3]. S cílem zabránit časným a pozdním recidivám proto může být nezbytná delší doba adjuvantní léčby.
Stanovení rizika rekurence
Jak vyhodnotit riziko rekurence u časného karcinomu prsu? A případně pak rizikovější pacientku léčit intenzivnější terapií? Jak uvedla paní primářka Jirsová, jde o běžnou praxi onkologa. Riziko rekurence je definováno klinickými a patologickými znaky. Vychází se z velikosti nádoru, jeho charakteristik (typ onemocnění dle pozitivity hormonálních receptorů, míra proliferace dle Ki67, morfologie – duktální versus lobulární karcinom in situ) a postižení lymfatických uzlin/metastazování. U některých pacientek je na základě velikosti nádoru, grade a postižení uzlin stanovení rizika jednoznačné, existuje však nemalý podíl pacientek, kde není míra rizika rekurence jednoznačná. Ke zlepšení odhadu prognózy a stratifikace rizika je využíváno stanovení genomického rizika pomocí komerčně dostupných genomových testů (Mammaprint, Oncotype DX, případně Endopredict, Prosigma)[1,5].
Dalším nástrojem ke zhodnocení rizika rekurence je CPS‑EG skóre, které pomocí bodového systému vyhodnocuje riziko po neoadjuvantní chemoterapii. Hodnoceno je klinické stadium před léčbou (CS), patologické stadium po léčbě (PS), status estrogenových receptorů (E) a stupeň diferenciace (G). Pacientky se skóre > 3 mají vyšší riziko a zaslouží si intenzivnější adjuvantní terapii [1,5].
Highlights ASCO a ESMO 2024
Přednášející shrnula, že pacienti s HR+/HER2– časným karcinomem prsu jsou v riziku časné i pozdní rekurence bez ohledu na postižení uzlin. V další části vystoupení zmínila dvě práce prezentované na kongresu American Society of Clinical Oncology (ASCO) [6] a European Society for Medical Oncology (ESMO) [7] v loňském roce. Jde o klinická hodnocení z reálného prostředí (real world evidence, RWE) zabývající se reálným rizikem recidivy u pacientů s HR+/HER2– časným karcinomem prsu ve stadiu II–III, resp. I–III bez ohledu na uzlinové postižení [6,7].
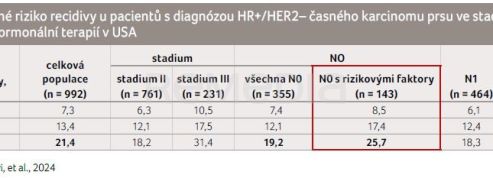 V práci prezentované na ASCO 2024 bylo zahrnuto téměř tisíc pacientek (n = 992) a riziko rekurence bylo sledováno po třech, pěti a sedmi letech. Analýza přežití bez invazivního onemocnění (invazive disease‑free survival, iDFS)/přežití bez vzdáleného onemocnění (distant disease‑free survival, DDFS) ukázala kumulativní riziko recidivy invazivního onemocnění, převážně vzdáleného onemocnění, v sedmém roce u 21,4 % pacientů [6]. Stratifikace sledovaných pacientů byla obdobná jako ve studii NATALEE (viz dále). Pacienti bez uzlinového postižení byli dále rozděleni dle přítomnosti rizikových faktorů (za rizikové faktory byly považovány T2N0 grade 3 nebo grade 2 + Ki‑67 > 20 % nebo vysoké genomické riziko). V sedmiletém sledování bylo riziko recidivy u pacientů s N0 19,2 % a u pacientek N0 s rizikovými faktory 25,7 % (tab. 1) [6].
V práci prezentované na ASCO 2024 bylo zahrnuto téměř tisíc pacientek (n = 992) a riziko rekurence bylo sledováno po třech, pěti a sedmi letech. Analýza přežití bez invazivního onemocnění (invazive disease‑free survival, iDFS)/přežití bez vzdáleného onemocnění (distant disease‑free survival, DDFS) ukázala kumulativní riziko recidivy invazivního onemocnění, převážně vzdáleného onemocnění, v sedmém roce u 21,4 % pacientů [6]. Stratifikace sledovaných pacientů byla obdobná jako ve studii NATALEE (viz dále). Pacienti bez uzlinového postižení byli dále rozděleni dle přítomnosti rizikových faktorů (za rizikové faktory byly považovány T2N0 grade 3 nebo grade 2 + Ki‑67 > 20 % nebo vysoké genomické riziko). V sedmiletém sledování bylo riziko recidivy u pacientů s N0 19,2 % a u pacientek N0 s rizikovými faktory 25,7 % (tab. 1) [6].
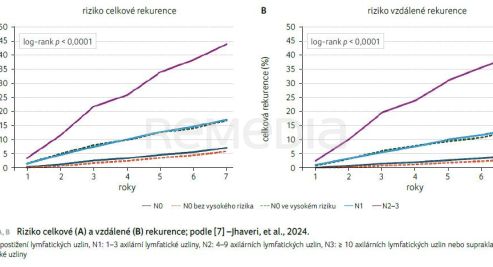 Další retrospektivní RWE analýza prezentovaná na ESMO 2024 [7] zahrnula pacientky ve věku ≥ 18 let s HR+/HER2− časným karcinomem prsu stadia I–III z americké Flatiron Health EBC databáze z elektronických zdravotních záznamů (2011–2023). Cílovými ukazateli byly celková rekurence (jakákoliv lokoregionální nebo vzdálená rekurence, s výjimkou příhody úmrtí) a vzdálená rekurence (jakákoliv příhoda zahrnující pouze vzdálenou rekurenci, s výjimkou příhody úmrtí). Pacientky bez postižení lymfatických uzlin (N0) byly opět rozděleny dle přítomnosti rizikových faktorů. Definice rizika se v obou studiích shodovala s inkluzivními kritérii studie NATALEE. Jako vysoké riziko byla definována stadia T4N0, T3N0 nebo T2N0 s dodatečnými kritérii (grade 2 s Ki‑67 ≥ 20 % nebo vysoké genomické riziko nebo grade 3). Ostatní pacientky s N0 onemocněním byly bez vysokého rizika [7].
Další retrospektivní RWE analýza prezentovaná na ESMO 2024 [7] zahrnula pacientky ve věku ≥ 18 let s HR+/HER2− časným karcinomem prsu stadia I–III z americké Flatiron Health EBC databáze z elektronických zdravotních záznamů (2011–2023). Cílovými ukazateli byly celková rekurence (jakákoliv lokoregionální nebo vzdálená rekurence, s výjimkou příhody úmrtí) a vzdálená rekurence (jakákoliv příhoda zahrnující pouze vzdálenou rekurenci, s výjimkou příhody úmrtí). Pacientky bez postižení lymfatických uzlin (N0) byly opět rozděleny dle přítomnosti rizikových faktorů. Definice rizika se v obou studiích shodovala s inkluzivními kritérii studie NATALEE. Jako vysoké riziko byla definována stadia T4N0, T3N0 nebo T2N0 s dodatečnými kritérii (grade 2 s Ki‑67 ≥ 20 % nebo vysoké genomické riziko nebo grade 3). Ostatní pacientky s N0 onemocněním byly bez vysokého rizika [7].
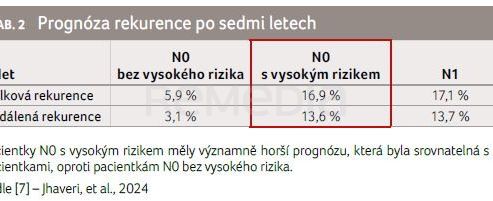 Sledováno bylo celkem 7 564 pacientek; N0 onemocnění 73,5 % (n = 5 557) z čehož 12,2 % (679/5 557) N0 mělo vysoké riziko a 87,8 % (4 878/5 557) N0 bez vysokého rizika; N1 onemocnění 20,6 % (1 560) a N2–3 onemocnění 5,9 % (447). Medián sledování činil 79,1 měsíce. Riziko celkové a vzdálené rekurence se významně lišilo mezi skupinami s N0, N1 a N2–3 (p < 0,0001), graf 2A, B. Paní primářka Jirsová upozornila, že N0 pacientky ve vysokém riziku měly podobné a výrazné riziko celkové a vzdálené rekurence jako pacientky N1 (tab. 2). Na tyto pacientky je potřeba se zaměřit a nabídnout jim rozšíření adjuvantní léčby.
Sledováno bylo celkem 7 564 pacientek; N0 onemocnění 73,5 % (n = 5 557) z čehož 12,2 % (679/5 557) N0 mělo vysoké riziko a 87,8 % (4 878/5 557) N0 bez vysokého rizika; N1 onemocnění 20,6 % (1 560) a N2–3 onemocnění 5,9 % (447). Medián sledování činil 79,1 měsíce. Riziko celkové a vzdálené rekurence se významně lišilo mezi skupinami s N0, N1 a N2–3 (p < 0,0001), graf 2A, B. Paní primářka Jirsová upozornila, že N0 pacientky ve vysokém riziku měly podobné a výrazné riziko celkové a vzdálené rekurence jako pacientky N1 (tab. 2). Na tyto pacientky je potřeba se zaměřit a nabídnout jim rozšíření adjuvantní léčby.
Přednášející v závěru shrnula, že u pacientů s HR+/HER2– časným karcinomem prsu léčených současnou standardní adjuvantní terapií přetrvává riziko časné (≤ 5 let) i pozdní (> 5 let) recidivy, a to bez ohledu na postižení uzlin. Posouzení rizika by mělo být komplexní. Na základě nových poznatků očekáváme, že dojde k vyššímu zapojení cílené terapie do léčebné strategie a tím ke snížení přetrvávajícího rizika rekurence.
Výsledky studie NATALEE – významný milník pro pacienty s časným karcinomem prsu HR+/HER2–
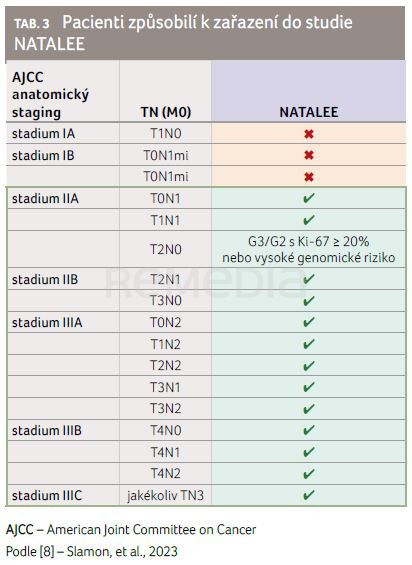 Výsledky studie NATALEE představila v navazující přednášce MUDr. Martina Zimovjanová, Ph.D., MHA, (Onkologická klinika VFN a 1. LF UK, Praha). Jednalo se o otevřenou randomizovanou studii fáze III, do níž bylo zahrnuto celkem 5 101 pacientů. Do klinického hodnocení mohli vstoupit dospělé pacientky/pacienti s HR+/HER2− časným karcinomem prsu anatomického stadia III (N0, N1, N2 nebo N3), IIB (N0 nebo N1) nebo IIA s uzlinovým postižením (N1) nebo bez něj (N0), ale v tomto případě grade 3 anebo grade 2 spolu s dalšími rizikovými faktory. Těmi byly Ki‑67 ≥ 20 %, skóre rekurence Oncotype DX Breast Recurrence Score ≥ 26 nebo vysoké riziko dle genomového profilování rizika (tab. 3) [8].
Výsledky studie NATALEE představila v navazující přednášce MUDr. Martina Zimovjanová, Ph.D., MHA, (Onkologická klinika VFN a 1. LF UK, Praha). Jednalo se o otevřenou randomizovanou studii fáze III, do níž bylo zahrnuto celkem 5 101 pacientů. Do klinického hodnocení mohli vstoupit dospělé pacientky/pacienti s HR+/HER2− časným karcinomem prsu anatomického stadia III (N0, N1, N2 nebo N3), IIB (N0 nebo N1) nebo IIA s uzlinovým postižením (N1) nebo bez něj (N0), ale v tomto případě grade 3 anebo grade 2 spolu s dalšími rizikovými faktory. Těmi byly Ki‑67 ≥ 20 %, skóre rekurence Oncotype DX Breast Recurrence Score ≥ 26 nebo vysoké riziko dle genomového profilování rizika (tab. 3) [8].
Předchozí hormonální léčba byla povolena až 12 měsíců před iniciací studijní léčby s ribociklibem (RIB). Pacienti byli randomizováni v poměru 1 : 1 do ramene s léčbou samotným nesteroidním inhibitorem aromatázy (NSAI), kterým byl letrozol, popř. anastrozol po dobu ≥ 5 let + muži a ženy v premenopauze navíc užívali LHRH inhibitor – goserelin; nebo do ramene s kombinovanou léčbou NSAI + RIB. RIB byl podáván v dávce 400 mg jednou denně po dobu 21 po sobě jdoucích dní, po nichž následovalo 7 dní pauzy, což tvořilo 28denní cyklus. Celková doba léčby RIB byla 36 měsíců. NSAI letrozol byl podáván v dávce 2,5 mg perorálně jednou denně, anastrozol v dávce 1 mg perorálně jednou denně v kontinuálním režimu po dobu 60 měsíců.
Primárním cílovým ukazatelem bylo iDFS dle kritérií STEEP (Standardized Definitions for Efficacy End Points). Sekundární cílové ukazatele zahrnovaly přežití bez rekurence, přežití bez známek vzdáleného onemocnění, celkové přežití (overall survival, OS), výstupy hlášené pacienty (patients’ reported outcomes, PRO), bezpečnost a snášenlivost léčby a farmakokinetické parametry. Mezi explorativní cílové parametry patřily přežití bez lokoregionální rekurence a genová exprese a alterace ve vzorcích nádorové ctDNA/ctRNA.
Primářka Zimovjanová připomněla odlišnosti podávání RIB ve studii NATALEE. Oproti pacientkám s metastatickým onemocněním je prvním rozdílem nižší dávka RIB podávaná v indikaci adjuvantní léčby. U nižší dávky RIB při léčbě časného karcinomu prsu se očekává nižší výskyt nežádoucích účinků závislých na dávce (nižší výskyt neutropenie) při zachované prokázané účinnosti. Dále tříleté podávání RIB (období s nejvyšším rizikem rekurence), které bylo zvoleno s cílem maximalizovat účinek a snížit riziko rekurence na podkladě imunomodulace a senescence. Delší trvání léčby může snížit pravděpodobnost návratu onemocnění (prodloužení zástavy buněčného cyklu umožňuje u většího počtu nádorových buněk indukovat senescenci a buněčnou smrt). Rovněž bylo poukázano na širokou studijní populaci a kombinační hormonální léčbu [4,8–16].
Výsledky
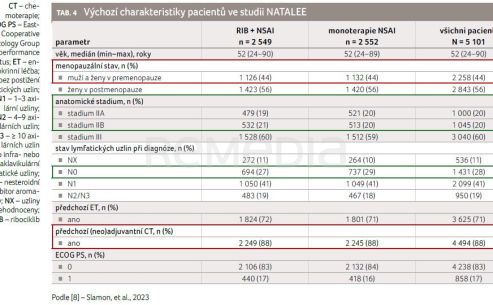 Výchozí charakteristiky zařazených pacientů byly vyvážené v obou studijních ramenech (tab. 4). 44 % tvořily premenopauzální ženy, medián věku činil 52 let. Předem bylo specifikováno, že 40 % nemocných bude klinického stadia II. O vysoké rizikovosti pacientů svědčí fakt, že 88 % bylo léčeno chemoterapií (adjuvantní či neoadjuvantní).
Výchozí charakteristiky zařazených pacientů byly vyvážené v obou studijních ramenech (tab. 4). 44 % tvořily premenopauzální ženy, medián věku činil 52 let. Předem bylo specifikováno, že 40 % nemocných bude klinického stadia II. O vysoké rizikovosti pacientů svědčí fakt, že 88 % bylo léčeno chemoterapií (adjuvantní či neoadjuvantní).
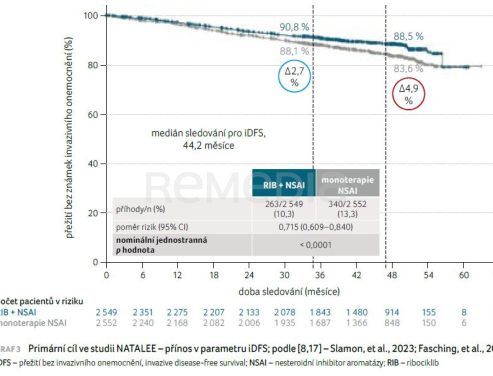 Absolutní přínos pro iDFS při kombinované léčbě RIB + NSAI byl 2,7 % po třech letech [8]. Tento přínos v parametru iDFS narůstá v čase [8,17]. Absolutní přínos kombinované léčby v parametru iDFS za čtyřleté sledovací období činil 4,9 % [17], graf 3. Většina příhod u iDFS zahrnovala vzdálenou rekurenci, která byla častější v rameni s monoterapií NSAI [17]. V rameni s monoterapií NSAI se vyskytly u 9,6 % (246/2 552) pacientů, v rameni s kombinovanou terapií u 6,9 % (176/2 549) pacientů. Nejčastěji se jednalo o generalizace do skeletu, dále o metastázy v játrech a plicích [8,17].
Absolutní přínos pro iDFS při kombinované léčbě RIB + NSAI byl 2,7 % po třech letech [8]. Tento přínos v parametru iDFS narůstá v čase [8,17]. Absolutní přínos kombinované léčby v parametru iDFS za čtyřleté sledovací období činil 4,9 % [17], graf 3. Většina příhod u iDFS zahrnovala vzdálenou rekurenci, která byla častější v rameni s monoterapií NSAI [17]. V rameni s monoterapií NSAI se vyskytly u 9,6 % (246/2 552) pacientů, v rameni s kombinovanou terapií u 6,9 % (176/2 549) pacientů. Nejčastěji se jednalo o generalizace do skeletu, dále o metastázy v játrech a plicích [8,17].
Finální analýza potvrdila přínos v parametru iDFS u všech předem specifikovaných podskupin (graf 4) [9,18]. Kombinovaná léčba s RIB přinesla benefit pacientkám bez ohledu na menopauzální stav, klinické stadium, grade, předléčení chemoterapií nebo postižení lymfatických uzlin [9,18].
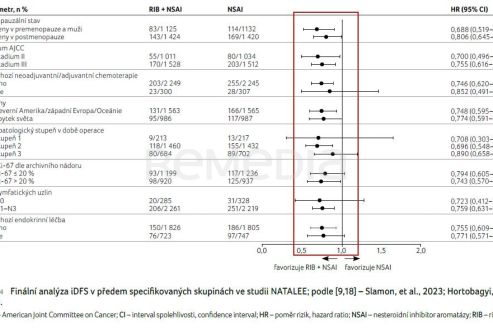 Při porovnání účinnosti léčby hodnocené iDFS dle stadia onemocnění představoval absolutní rozdíl po třech letech u stadia II 1,7 % a po čtyřech letech 4,3 %. V případě stadia III činil absolutní rozdíl po třech letech 3,5 % a ve čtyřech letech 5,9 % [19,20]. Ve stadiu N0 byl absolutní rozdíl mezi léčebnými rameny 2,6 % po třech letech a 5,1 % po čtyřech letech, v případě postižení uzlin N1–3 rozdíl představoval 2,7 %, resp. 5,0 % [19,20]. Nutno podotknout, že data N0 pacientů vyžadují delší sledování a zatím nebyla prokázána statistická signifikance.
Při porovnání účinnosti léčby hodnocené iDFS dle stadia onemocnění představoval absolutní rozdíl po třech letech u stadia II 1,7 % a po čtyřech letech 4,3 %. V případě stadia III činil absolutní rozdíl po třech letech 3,5 % a ve čtyřech letech 5,9 % [19,20]. Ve stadiu N0 byl absolutní rozdíl mezi léčebnými rameny 2,6 % po třech letech a 5,1 % po čtyřech letech, v případě postižení uzlin N1–3 rozdíl představoval 2,7 %, resp. 5,0 % [19,20]. Nutno podotknout, že data N0 pacientů vyžadují delší sledování a zatím nebyla prokázána statistická signifikance.
Při hodnocení sekundárních cílových ukazatelů činil absolutní rozdíl v době přežití bez vzdáleného relapsu (DDFS) při léčbě RIB + NSAI 2,7 % po třech letech. Dle finální analýzy se riziko rozvoje vzdáleného onemocnění při kombinované léčbě RIB + NSAI snížilo o 25,1 % oproti monoterapii NSAI [18,19]. Data pro OS nejsou při mediánu sledování 35,9 měsíce dosud zralá, je potřeba delšího sledování [19,20].
Vedle účinnosti terapie je neméně důležitá její bezpečnost a snášenlivost. Většina nežádoucích účinků byla asymptomatického charakteru. Nejčastějším nežádoucím účinkem kteréhokoliv stupně byla při kombinované léčbě neutropenie; stupeň ≥ 3 byl zaznamenán u 44,3 % pacientů, febrilní neutropenii vyvinulo pouze 0,3 % pacientů [9,18,19]. Prodloužení intervalu QT jakéhokoliv stupně bylo pozorováno u 5,2 % pacientů s kombinovanou léčbou a u 1,2 % s NSAI. Nejčastějším nežádoucím účinkem jakéhokoliv stupně vedoucím k ukončení léčby byla jaterní toxicita (8,7 % v rameni s kombinovanou léčbou vs. 1,7 % v rameni s monoterapií). K ukončení léčby RIB z důvodu nežádoucích účinků došlo nejčastěji na počátku léčby; medián doby do ukočení léčby byl čtyři měsíce. V této souvislosti zdůraznila přednášející proaktivní přístup v rozhovoru s pacientem o podstatě adjuvantní léčby s cílem maximalizovat adherenci k terapii RIB, jeho efekt a řešení vedlejších účinků.
Shrnutí
V závěru prezentace primářka Zimovjanová shrnula, že finální analýza dat ve studii NATALEE prokazuje přínos kombinace RIB + NSAI v parametrech iDFS a DDFS oproti monoterapii NSAI. Po třech letech terapie došlo ke snížení rizika recidivy onemocnění o 25,1 % (poměr rizik [HR] 0,75) a po čtyřech letech o 28,5 % (HR 0,715). Absolutní přínos v parametru iDFS se zvýšil na 2,7 % po třech letech a na 4,9 % po čtyřech letech, což ukazuje přínos této léčby i po skončení tříletého podávání ribociklibu. Vyšší účinnost kombinace RIB + NSAI oproti hormonoterapii je konzistentní napříč podskupinami. Data na vyhodnocení OS jsou nezralá, nicméně bezpečnostní profil kombinované léčby zůstává stabilní i při delším období sledování [18–20]. Shromážděné výsledky studie NATALEE podporují wprsu [19].
Literatura
[1] 12. Zhoubný novotvar prsu (C50). Dostupné na: https://www.linkos.cz/lekar‑a‑multidisciplinarni‑tym/personalizovana‑onkologie/modra‑kniha‑cos/aktualni‑vydani‑modre‑knihy/31‑12‑zhoubny‑novotvar‑prsu‑c50/
[2] Pan H, Gray R, Braybrooke J, et al. 20‑Year Risks of Breast‑Cancer Recurrence after Stopping Endocrine Therapy at 5 Years. N Engl J Med 2017; 377: 1836–1846.
[3] Pedersen RN, Esen Bö, Mellemkjaer L, et al. The Incidence of Breast Cancer Recurrence 10‑32 Years After Primary Diagnosis. J Natl Cancer Inst 2022; 114: 391–399.
[4] Hess KR, Pusztai L, Buzdar AU, Hortobagyi GN. Estrogen receptors and distinct patterns of breast cancer relapse. Breast Cancer Res Treat 2003; 78: 105–118.
[5] Neoadjuvant Therapy Outcomes Calculator. Dostupné na: https://www3.mdanderson.org/app/medcalc/index.cfm?pagename=bcnt
[6] Razavi P, Ahmed M, Roush A, et al. Real‑world (RW) risk of recurrence among patients (pts) diagnosed with stage II‑III HR+/HER22 early breast cancer (EBC) treated with endocrine therapy (ET) in the US. RWE study, ASCO 2024 Chicago, USA, 31. května–4. června 2024. Poster Nr. 541.
[7] Jhaveri K, et al. Real‑world evidence on risk of recurrence (ROR) in patients (pts) with node‑negative (N0) and node‑positive HR+/HER2– early breast cancer (EBC) from US electronic health records (EHR). ESMO 2024, Barcelona, Španělsko, 13.–17. září 2024. Poster Nr. 292P.
[8] Slamon DJ, Fasching PE, Hurvitz S, et al. Rationale and trial design of NATALEE: a Phase III trial of adjuvant ribociclib + endocrine therapy versus endocrine therapy alone in patients with HR+/HER2‑ early breast cancer. Ther Adv Med Oncol 2023; 15: 17588359231178125.
[9] Slamon DJ, Stroyakovskiy D, Yardley DA, et al. Ribociclib and endocrine therapy as adjuvant treatment in patients with HR+/HER2− early breast cancer: Primary results from the phase III NATALEE trial. 2023 ASCO Annual Meetiny. J Clin Oncol 2023; 41(suppl 17): Abstr Nr. LBA500.
[10] Beck JT, Neven P, Sohn J, et al. Ribociclib treatment benefit in patients with advanced breast cancer with ≥1 dose reduction: Data from the MONALEESA‑2, ‑3, and ‑7 trials. SABCS 2018. Cancer Res 2019; 79 (7_Suppl); Abstr. Nr. P6‑18‑06.
[11] Bria E, Carlini P, Cuppone F, et al. Early recurrence risk: aromatase inhibitors versus tamoxifen. Expert Rev Anticancer Ther 2010; 10: 1239–1253.
[12] Foldi J, O´Meara T, Marczyk M, et al. Defining Risk of Late Recurrence in Early‑Stage Estrogen Receptor‑Positive Breast Cancer: Clinical Versus Molecular Tools. J Clin Oncol 2019; 37: 1365–1369.
[13] Davies C, Pan H, Godwin J, et al. Long‑term effects of continuing adjuvant tamoxifen to 10 years versus stopping at 5 years after diagnosis of oestrogen receptor‑positive breast cancer: ATLAS, a randomised trial. Lancet 2013; 381: 805–816.
[14] Gray RG, Rea D, Handley K, et al. aTTom: Long‑term effects of continuing adjuvant tamoxifen to 10 years versus stopping at 5 years in 6,953 women with early breast cancer. J Clin Oncol 2013; 31(18_suppl): 5.
[15] Del Mastro L, Mansutti M, Bisagni G, et al. Extended therapy with letrozole as adjuvant treatment of postmenopausal patients with early‑stage breast cancer: a multicentre, open‑label, randomised, phase 3 trial. Lancet Oncol 2021; 22: 1458–1467.
[16] Rader J, Russell MR, Hart LS, et al. Dual CDK4/CDK6 inhibition induces cell‑cycle arrest and senescence in neuroblastoma. Clin Cancer Res 2013; 19: 6173–6182.
[17] Fasching PA, et al. Adjuvant ribociclib (RIB) plus nonsteroidal aromatase inhibitor (NSAI) in patients (Pts) with HR+/HER2− early breast cancer (EBC): 4‑year outcomes from the NATALEE trial. ESMO 2024. Oral LBA13
[18] Hortobagyi G, Stroyakovsky D, Yardley D, et. al. (GS03‑03) Ribociclib (RIB) + nonsteroidal aromatase inhibitor (NSAI) as adjuvant treatment in patients with HR+/HER2− early breast cancer: final invasive disease–free survival (iDFS) analysis from the NATALEE trial.Presented at: 2023 San Antonio Breast Cancer Symposium. December 5‑9, 2023; Abstract GS03‑03.
[19] Slamon D, Lipatov O, Nowecki Z, et al. Ribociclib plus Endocrine Therapy in Early Breast Cancer. N Engl J Med 2024; 390: 1080–1091.
[20] Fasching PA, et al. Adjuvant ribociclib (RIB) plus nonsteroidal aromatase inhibitor (NSAI) in patients (Pts) with HR+/HER2− early breast cancer (EBC): 4‑year outcomes from the NATALEE trial. ESMO 2024 Barcelona. Abstr. Nr. LBA13.