Karcinom močového měchýře v roce 2025: Kam pokročila léčba?
Karcinom močového měchýře představuje onemocnění, u kterého byl základní léčebný algoritmus po léta relativně stálý. K tomu patřily i omezené možnosti systémové terapie. To se nyní velmi rychle mění. U této malignity dochází k rychlému vývoji, který se týká téměř všech nemocných bez ohledu na pokročilost nádoru, což s sebou mimo jiné přináší vysoké nároky na multidisciplinární spolupráci. To vše v úvodní přednášce kolokvia Bladder Cancer Master Class shrnul přední evropský uroonkolog prof. Álvaro Pinto, MD, PhD, z Hospital Universitario La Paz ve španělském Madridu.
I u karcinomu močového měchýře platí, že hlavní veličinou rozhodující o prognóze je čas. Čím je onemocnění podchyceno časněji, tím je prognóza příznivější. Nejlépe léčitelný je svalovinu neinvadující karcinom močového měchýře (non‑muscle‑invasive bladder cancer, NMIBC), kdy se nádor nachází pouze ve vnitřní výstelce. Od 80. let minulého století se u něj používá vakcína BCG (Bacillus Calmette–Guérin). Základem nefarmakologické léčby je transuretrální resekce nádorové tkáně. U pokročilých stadií, svalovinu invadujícího karcinomu močového měchýře (muscle‑invasive bladder cancer, MIBC) a metastazujícího karcinomu se uplatňuje chemoterapie na bázi platiny, u MIBC se provádí radikální cystektomie.
Imunoterapie a intravezikální chemoterapie
U všech stadií ovšem během několika málo let přibyly nové léčebné možnosti, ať už jde o lokální, nebo systémovou léčbu. Především jde o nástup imunoterapie, zatím hlavně imunoterapie založené na inhibici kontrolních bodů imunitní reakce, konkrétně receptoru programované buněčné smrti 1 (programmed death‑1, PD‑1), resp. ligandu receptoru programované buněčné smrti 1 (programmed death ligand‑1, PD‑L1). „Dnes jsme někde úplně jinde, než jsme byli ještě před několika málo lety,“ uvedl prof. Pinto.
U NMIBC v této souvislosti prof. Pinto připomněl jednoramennou studii fáze II KEYNOTE‑057 publikovanou v roce 2021.1 Ta ukázala, že imunoterapie pembrolizumabem v monoterapii má slibnou protinádorovou aktivitu. Celkem 41 % pacientů dosáhlo kompletní odpovědi, 58 % nekompletní odpovědi. „Šlo o první výsledky svého druhu, i když monoterapie protilátkou anti‑PD‑1 asi dnes u NMIBC není tou nejúčinnější možností,“ řekl prof. Pinto.
Data podporující kombinaci imunoterapie s BCG u pacientů s vysoce rizikovým NMIBC doložila globální randomizovaná studie fáze III CREST zveřejněná v letošním roce.2 Podání vakcíny BCG a inhibitoru PD‑1 sasanlimabu v indukční i udržovací fázi oproti samotné vakcíně BCG statisticky významně a klinicky smysluplně prodloužilo přežití bez události (event‑free survival, EFS). „Šlo o první studii, která tento parametr prodloužila,“ komentoval prof. Pinto.
Velký potenciál v časné fázi onemocnění má také intravezikální chemoterapie. V tomto kontextu prof. Pinto hovořil o systému pro intravezikální podávání chemoterapie INLEXZO, který je určen pro aplikaci gemcitabinu a který byl nyní schválen americkým Úřadem pro kontrolu potravin a léčiv.3 Jeho využitím dosahuje 82 % pacientů úplné odpovědi, aniž by muselo dojít k reindukci. „Pro některé pacienty s NMIBC, kteří neodpovídají na podání BCG, se jedná o potenciální praxi měnící přístup. Vidíme velký podíl léčebných odpovědí, které přetrvávaly relativně dlouho,“ řekl prof. Pinto s tím, že na cestě do klinické praxe jsou další takové systémy pracující s instilací jiných látek.
Nová data přinášejí podle prof. Pinto také nové otázky: „Například se musíme ptát, zda jsou recentní důkazy dostatečné, abychom každého nemocného s NMIBC léčili kombinací BCG a imunoterapie. Zatím také nevíme, zda nové intravezikální přístupy mají být standardem u BCG refrakterních pacientů.“
Imunoterapie v pokročilých stadiích
Imunoterapie postoupila i u nemocných, u nichž již došlo k invazi do svalové tkáně. U pacientů s vysoce rizikovým MIBC, kteří podstoupili radikální operaci, prokázala svou účinnost adjuvantní imunoterapie inhibitorem PD‑1. V multicentrické randomizované dvojitě zaslepené placebem kontrolované studii fáze III podání nivolumabu u pacientů s expresí PD‑L1 ≥ 1 % významně prodloužilo přežití bez známek onemocnění oproti placebu (medián 20,8 vs. 10,8 měsíce).4 Po šesti měsících bylo přeživších 74,9 % vs. 60,3 % pacientů (p < 0,001).
U pacientů s MIBC tvoří standard péče neoadjuvantní chemoterapie a po ní radikální cystektomie. V randomizované otevřené studii fáze III NIAGARA se osvědčilo přidání durvalumabu perioperačně k chemoterapii, tedy před operací, a poté jeho adjuvantní podávání v monoterapii.5 Tento postup vedl k prodloužení EFS i odhadovaného celkového přežití (po 24 měsících bylo přeživších 82,2 % vs. 75,2 % pacientů; p = 0,01).
I do léčby uroteliálního karcinomu vstupují konjugáty protilátky–léčivo (antibody–drug conjugate, ADC), tedy přípravky, které propojují monoklonální protilátku s vysoce účinným cytostatickým léčivem. Ve studii EV‑303/KEYNOTE‑905 kombinace pembrolizumabu s ADC enfortumab vedotinem podaná před operací a po ní u pacientů s MIBC významně zlepšila EFS i celkové přežití a dosažení patologické kompletní odpovědi (pozn. red.: na ESMO 2025 byly prezentovány hlavní závěry této studie a jednoznačně potvrdily první pozitivní výsledky).6
Ukazuje se také, že personalizovaný přístup s využitím ctDNA ke zjištění molekulární reziduální nemoci u pacientů s MIBC silně predikoval benefit adjuvantní imunoterapie z hlediska přežití bez známek onemocnění i celkového přežití. Dokládají to předběžná data ze studie fáze III IMvigor011 s atezolizumabem.7
K podobnému posunu dochází i u metastazujícího onemocnění. Pacienti s pokročilým nebo metastazujícím uroteliálním karcinomem, u nichž došlo k progresi po chemoterapii založené na platině, v druhé linii léčby profitovali více z užívání pembrolizumabu než z chemoterapie.8 Pembrolizumab významně zlepšil medián celkového přežití (10,3 vs. 7,4 měsíce, poměr rizik pro úmrtí 0,73; p = 0,002). Kromě toho se ve skupině s imunoterapií vyskytlo méně toxicity související s léčbou.
K dispozici jsou také data potvrzující význam imunoterapie pro udržovací léčbu. Zde prof. Pinto vyzdvihl význam studie JAVELIN Bladder 100, publikované v časopise New England Journal of Medicine v roce 2020.9
Šlo o mezinárodní otevřenou studii fáze III, do níž bylo zahrnuto 700 pacientů s histologicky verifikovaným lokálně pokročilým neresekabilním/metastazujícím uroteliálním karcinomem, kteří po absolvování první linie systémové léčby dosáhli stabilizace onemocnění, parciální remise nebo kompletní remise. Pacienti byli následně randomizováni (v poměru 1 : 1) do dvou studijních ramen, a to do ramene s užíváním avelumabu a do ramene s nejlepší podpůrnou péčí bez avelumabu. U pacientů s udržovací léčbou avelumabem bylo celkové přežití signifikantně vyšší v porovnání s kontrolní skupinou. Jednoletého přežití bylo dosaženo u 71,3 % pacientů léčených imunoterapií a u 58,4 % v kontrolní skupině. Medián celkového přežití byl 21,4 vs. 14,3 měsíce (pozn. red.: podle update to bylo 23,8 vs. 15,0 měsíce).
Do léčebného armamentaria zde také přibývají ADC, jak ukazují aktuální data o enfortumab vedotinu u nemocných s metastazujícím uroteliálním karcinomem.10
 U této populace pacientů se také vytváří prostor pro cílenou terapii. Například z ní mohou profitovat pacienti s alteracemi receptorů pro fibroblastový růstový faktor (fibroblast growth factor receptor, FGFR). Inhibitor FGFR erdafitinib prodloužil oproti chemoterapii celkové přežití u nemocných, kteří progredovali na předchozích liniích léčby zahrnujících imunoterapii.11
U této populace pacientů se také vytváří prostor pro cílenou terapii. Například z ní mohou profitovat pacienti s alteracemi receptorů pro fibroblastový růstový faktor (fibroblast growth factor receptor, FGFR). Inhibitor FGFR erdafitinib prodloužil oproti chemoterapii celkové přežití u nemocných, kteří progredovali na předchozích liniích léčby zahrnujících imunoterapii.11
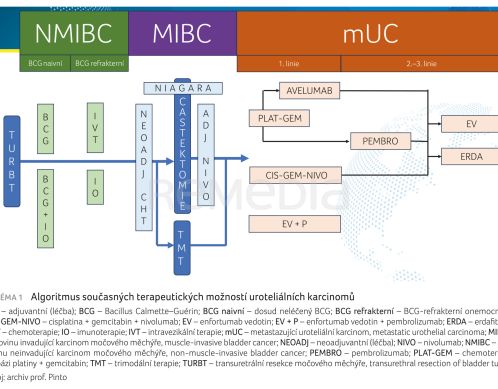
Prof. Pinto na závěr své prezentace shrnul současné terapeutické možnosti u všech stadií do jednoho algoritmu s tím, že stále přetrvává řada nedořešených otázek (schéma 1).
Literatura
[1] Balar AV, Kamat AM, Kulkarni GS, et al. Pembrolizumab monotherapy for the treatment of high‑risk non‑muscle‑invasive bladder cancer unresponsive to BCG (KEYNOTE‑057): an open‑label, single‑arm, multicentre, phase 2 study. Lancet Oncol 2021; 22: 919–930.
[2] Shore ND, Powles TB, Bedke J, et al. Sasanlimab plus BCG in BCG‑naive, high‑risk non‑muscle invasive bladder cancer: the randomized phase 3 CREST trial. Nat Med 2025; 31: 2806–2814.
[3] ESMO. FDA approves gemcitabine intravesical system for non‑muscle invasive bladder cancer. ESMO Oncology News 2025; 19. 9. 2025. Dostupné z: https://www.esmo.org/oncology‑news/fda‑approves‑gemcitabine‑intravesical‑system‑for‑non‑muscle‑invasive‑bladder‑cancer
[4] Bajorin DF, Witjes JA, Gschwend JE, et al. Adjuvant nivolumab versus placebo in muscle‑invasive urothelial carcinoma. N Engl J Med 2021; 384: 2102–2114.
[5] Powles T, Catto JWF, Galsky MD, et al. Perioperative durvalumab with neoadjuvant chemotherapy in operable bladder cancer. N Engl J Med 2024; 391: 1773–1786.
[6] Merck. KEYTRUDA® (pembrolizumab) plus Padcev® (enfortumab vedotin‑ejfv) significantly improved event‑free and overall survival and pathologic complete response rate for certain patients with muscle‑invasive bladder cancer when given before and after surgery. Tisková zpráva Merck 2025; 12. 8. 2025. Dostupné z: https://www.merck.com/news/keytruda‑pembrolizumab‑plus‑padcev‑enfortumab‑vedotin‑ejfv‑significantly‑improved‑
event‑free‑survival‑overall‑survival‑and‑pathologic‑complete‑response‑rates‑for‑
cisplatin‑eligible‑pa/
[7] Natera. IMvigor011 bladder cancer trial achieves positive results, with Signatera™ strongly predicting adjuvant immunotherapy benefit. Tisková zpráva Natera 2025; 18. 8. 2025. Dostupné z: https://tinyurl.com/4vdvzd5w
[8] Bellmunt J, de Wit R, Vaughn DJ, et al. Pembrolizumab as second‑line therapy for advanced urothelial carcinoma. N Engl J Med 2017; 376: 1015–1026.
[9] Powles T, Park SH, Voog E, et al. Avelumab maintenance therapy for advanced or metastatic urothelial carcinoma. N Engl J Med 2020; 383: 1218–1230.
[10] Powles T, Valderrama BP, Gupta S, et al. Enfortumab vedotin and pembrolizumab in untreated advanced urothelial cancer. N Engl J Med 2024; 390: 875–888.
[11] Loriot Y, Matsubara N, Park SH, et al. Erdafitinib or chemotherapy in advanced or metastatic urothelial carcinoma. N Engl J Med 2023; 389: 1961–1971.