Léčba pokročilého uroteliálního karcinomu v éře nových možností: Jak pomáhají studie a jak vypadá praxe
Jak dnes optimálně volit léčbu u pacientů s pokročilým uroteliálním karcinomem? Jaký význam má rizikové skóre pro prognózu a rozhodování o terapii? Jak interpretovat výsledky klíčových klinických studií a jak je přenášet do každodenní praxe? Kde má své místo chemoterapie, imunoterapie a jejich kombinace v jednotlivých liniích léčby? A jak do rozhodování vstupují kvalita života, toxicita léčby a preference pacienta? Na tyto i další otázky odpověděli přednášející v rámci II. sekce odborného programu kolokvia Bladder Cancer Master Class, zaměřené na léčbu pokročilého uroteliálního karcinomu v kontextu současných i nově se objevujících terapeutických možností.
Význam skóre rizika
 V úvodní přednášce bloku hovořil prof. Piotr Wysocki z Gdański Uniwersytet Medyczny v polském Gdaňsku o paliativní péči.1 Jak uvedl, nacházíme se v éře nových možností pro léčbu pacientů s pokročilým uroteliálním karcinomem (advanced urothelial carcinoma, aUC) a konkrétně pokročilým karcinomem močového měchýře (advanced bladder cancer, aBC). Intenzivně se diskutuje, jak je začlenit do doporučených postupů, neboť „odpověď není jednoduchá“. „Není to tak, že jediná systémová léčba, kterou mnoho mezinárodních doporučených postupů považuje za nejlepší, je optimální volbou pro každého jednotlivého pacienta,“ uvedl.
V úvodní přednášce bloku hovořil prof. Piotr Wysocki z Gdański Uniwersytet Medyczny v polském Gdaňsku o paliativní péči.1 Jak uvedl, nacházíme se v éře nových možností pro léčbu pacientů s pokročilým uroteliálním karcinomem (advanced urothelial carcinoma, aUC) a konkrétně pokročilým karcinomem močového měchýře (advanced bladder cancer, aBC). Intenzivně se diskutuje, jak je začlenit do doporučených postupů, neboť „odpověď není jednoduchá“. „Není to tak, že jediná systémová léčba, kterou mnoho mezinárodních doporučených postupů považuje za nejlepší, je optimální volbou pro každého jednotlivého pacienta,“ uvedl.
Upozornil, že u pacientů s metastazujícím uroteliálním karcinomem (metastatic urothelial carcinoma, mUC) pomáhá s rozhodováním o léčbě a určením prognózy aktualizované skóre rizika vycházející ze čtyř negativních prognostických faktorů – výkonnostního stavu (performance status, PS) podle Eastern Cooperative Oncology Group (ECOG PS) > 0, anémie (koncentrace hemoglobinu < 10 g/dl), přítomnosti metastáz v játrech a zvýšené koncentrace C‑reaktivního proteinu (CRP). U pacientů, kteří nemají žádný z nich, je pravděpodobnost přežití po jednom roce 63 %, při minimálně třech jen přibližně 15 %.2
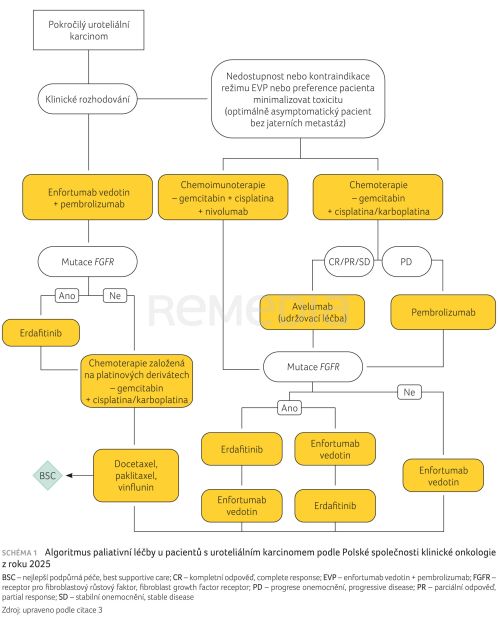 Pokyny Polské společnosti klinické onkologie z roku 2025 kladou velký důraz na klinické rozhodování společně s pacientem a upozorňují, že chemoterapie (CHT) má stále uplatnění u více pacientů než jen u těch, kteří nejsou kandidáty na kombinaci enfortumab vedotin + pembrolizumab (schéma 1).3 „Domníváme se, že preference pacientů, jejich asymptomatický stav a absence metastáz v játrech nám umožňují zvážit jako 1. linii léčby standardní chemoterapii v kombinaci se souběžnou nebo sekvenční imunoterapií,“ dodal prof. Wysocki. Připomněl důležitost první volby s ohledem na další linie terapie.
Pokyny Polské společnosti klinické onkologie z roku 2025 kladou velký důraz na klinické rozhodování společně s pacientem a upozorňují, že chemoterapie (CHT) má stále uplatnění u více pacientů než jen u těch, kteří nejsou kandidáty na kombinaci enfortumab vedotin + pembrolizumab (schéma 1).3 „Domníváme se, že preference pacientů, jejich asymptomatický stav a absence metastáz v játrech nám umožňují zvážit jako 1. linii léčby standardní chemoterapii v kombinaci se souběžnou nebo sekvenční imunoterapií,“ dodal prof. Wysocki. Připomněl důležitost první volby s ohledem na další linie terapie.
Zaměřeno na design studie EV‑302
Kombinace enfortumab vedotin + pembrolizumab prokázala ve studii EV‑302 u pacientů s aUC lepší výsledky než standardní CHT tvořená gemcitabinem a cisplatinou nebo karboplatinou.4 Standardní CHT však byla podávána po dobu 18 týdnů, zatímco enfortumab vedotin + pembrolizumab až do progrese onemocnění nebo výskytu nepřijatelné toxicity. Až později také došlo k zařazení udržovací terapie avelumabem pro pacienty, u kterých došlo alespoň ke stabilizaci onemocnění. To však bylo pouze 30 % celé kontrolní skupiny a o těchto pacientech podle prof. Wysocki nejsou k dispozici žádné údaje. Kombinace enfortumab vedotin + pembrolizumab se z hlediska přežití bez progrese (progression‑free survival, PFS) i celkového přežití (overall survival, OS) jeví jako velmi účinná strategie a ve studii EV‑302/KEYNOTE‑A39 byl napříč podskupinami přínos konzistentní, neznáme však samostatné výsledky zmíněných 30 % pacientů, kteří užívali CHT a udržovací léčbu avelumabem. Dále studie ukázala, že CHT je toxičtější než enfortumab vedotin + pembrolizumab; rozdíl však podle přednášejícího spočíval ve výskytu anémie, neutropenie a trombocytopenie, tedy – jak podotkl – „běžných nežádoucích účinků, se kterými umíme zacházet“. Dodal však, že „na druhé straně ve skupině enfortumab vedotin + pembrolizumab vidíme dlouhodobou toxicitu, která může významně ovlivnit kvalitu života pacientů během dlouhodobé léčby, kdy jsou pacienti aktivně léčeni“. Zdůraznil nutnost uvědomit si, že údaje o kvalitě života u pacientů absolvujících CHT jsou prezentovány pouze za 18 týdnů, po které jim byla podávána, a že poté již tito pacienti nebyli léčeni, zatímco ve skupině s kombinací enfortumab vedotin + pembrolizumab podstupovali terapii nepřetržitě po dalších 20 až 30 týdnů.5
Celkové přežití a kvalita života vzájemně významně korelují, což prokázala například metaanalýza dat 44 000 pacientů.6 „Je tedy velmi důležité uvědomit si, že s novými léky, které nyní používáme v klinické praxi, přicházejí také nové toxické účinky,“ připomněl prof. Wysocki. Upozornil na jeden z velmi vzácných, ale život ohrožujících stavů – na toxickou epidermální nekrolýzu, která se vyskytuje přibližně u 1 z 125 (cca 0,8 %) pacientů, ale riziko úmrtí při ní je přibližně 50 %.7
Jak zlepšit účinnost chemoterapie?
Data nezahrnující kombinaci enfortumab vedotin + pembrolizumab ukazují, že nejlepší výsledky mají pacienti absolvující CHT na bázi cisplatiny, výrazně horší výsledky měly režimy neobsahující platinu, samotná imunoterapie (IT) i režimy na bázi karboplatiny.8 Pokyny Polské společnosti klinické onkologie zdůrazňují možnost použití CHT samostatně, nebo v kombinaci s nivolumabem na základě studie CheckMate 901 (viz schéma 1).3,9 Ta prokázala, že kombinací CHT + IT lze docílit lepšího OS i PFS než samotnou CHT. Z hlediska míry odpovědi je podle přednášejícího důležité také nepřímé porovnání s kombinací enfortumab vedotin + pembrolizumab V obou studiích byla účinnost kombinace gemcitabin–cisplatina podobná a přidání IT k ní signifikantně zlepšilo celkovou míru odpovědi. Oba režimy tedy umožňují významné zlepšení kontroly onemocnění i její dosažení u podobného podílu pacientů.10,11
Souběžné podávání CHT a IT je sice spojeno se zvýšenou toxicitou, avšak takovou, kterou slovy přednášejícího současní onkologové znají a umějí léčit. „A víme, že to pacienti nejen snášejí, ale také je známo, že to zlepšuje výsledky léčby. Pacienti s imunitně zprostředkovanými nežádoucími účinky mají lepší výsledky než pacienti bez nich,“ uvedl s opětovným upozorněním na polské doporučení, v nichž se předpokládá, že kandidáty na CHT jsou pouze pacienti, kterým nelze nabídnout IT hned na začátku léčby, tj. ti, kteří nedávno užívali antibiotika, zejména fluorochinolony, ale i inhibitory protonové pumpy, kortikoidy, pacienti ve špatném ECOG PS či pacienti s kachexií.3
Prof. Wysocki upozornil také na skutečnost, že cisplatina může mít podobný přínos, ať je podávána ve standardních dávkách (70 mg/m2 každé 3 týdny), nebo v rozdělených dávkách (35 mg/m2 v 1. a 8. den každého třítýdenního cyklu).12 „Údaje jasně ukazují, že kombinace gemcitabinu a cisplatiny podávaná v rozdělených dávkách nabízí našim pacientům významný přínos. A je také bezpečná,“ ujistil přednášející.
Cisplatina a CKD
Nedávné údaje o riziku chronického onemocnění ledvin (chronic kidney disease, CKD) u pacientů léčených cisplatinou ukazují, že IV. stadium CKD se vyskytuje vzácně. Bylo pozorováno u 0,9 % pacientů, kteří před CHT netrpěli CKD; průměrný pokles clearance kreatininu (creatinine clearance, CrCl) byl < 10 ml/min.13 Cisplatina je kontraindikována u pacientů s mírou glomerulární filtrace (glomerular filtration rate, GFR) < 40 ml/min, u pacientů s GFR 40–60 ml/min jen nutno použít rozdělenou dávku cisplatiny.14 I zde má tedy významnou roli optimální výběr pacientů pro cisplatinu. Přednášející vyzdvihl, že „vždy je nutné zkontrolovat, zda naši pacienti nemají reverzibilní onemocnění ledvin, které lze snadno překonat urologickou léčbou“.
Možnosti 2. až 5. linie léčby
Po platinové CHT lze navázat imunoterapií – buď udržovací léčbou avelumabem u pacientů bez progrese (CR/PR/SD), nebo při progresi zvolit imunoterapii jako 2. linii – typicky pembrolizumab. Postup ve 2. a 3. linii léčby podle polských doporučení ukazuje schéma 1; důkazy pro udržovací léčbu avelumabem vyplývají ze studie JAVELIN Bladder 100, pro pembrolizumab ve 2. linii po progresi ze studie KEYNOTE‑045.15–17 Dnes existuje řada možností, z nichž lze vybírat; klíčová je kvalita života, toxicita a preference pacienta. Také v pozdějších liniích léčby je možné zvolit enfortumab vedotin, zejména u pacientů, kterým dosud podán nebyl.
Početná skupina (zhruba 25 %) pacientů s BC se vyznačuje mutací receptoru fibroblastového růstového faktoru 3 (fibroblast growth factor receptor 3, FGFR3), která způsobuje rezistenci vůči CHT. Pro ně jsou k dispozici inhibitory FGFR. Podobný přínos z hlediska OS oproti CHT ukázal enfortumab vedotin ve studii EV‑301 i erdafitinib ve studii THOR. V době konání kolokvia nebyla dostupná žádná doporučení, zda je u pacientů s mutací FGFR3 vhodnější použít nejprve enfortumab vedotin, nebo erdafitinib. Jelikož se ale enfortumab vedotin a erdafitinib vzájemně liší toxicitou, přednášející doporučil optimalizovat léčbu těmito přípravky na základě počátečního rizika toxicity.
Místo pro enfortumab vedotin nebo erdafitinib je i ve 4. linii, v 5. linii se znovu otevírá prostor pro CHT (viz schéma 1). „Víme, že chemoterapie je stále účinná. U pacientů, kteří byli léčeni enfortumabem a pembrolizumabem ve 3. linii, jsme stále zaznamenali klinický přínos u každého druhého pacienta,“ upozornil prof. Wysocki.
Shrnul, že léčba aBC je dlouhodobá a sekvenční a že se jedná o terapii chronického onemocnění. „Zatím neexistují žádné údaje o tom, že by bylo možné vyléčení. Bez ohledu na to, jak tvrdě zasáhneme, nemůžeme naše pacienty vyléčit. Proto jsou moudrá a kvalifikovaná rozhodnutí o léčbě zásadní,“ řekl v závěru své přednášky a zdůraznil, že rozhodnutí o postupné léčbě musí být založeno na komorbiditách, toxicitě a preferencích pacienta.
Role patologie a správného výběru pacientů
 Přednáškou o důležitosti správného výběru pacientů navázal prof. Dr. med. Arndt Hartmann, z Universitätsklinikum Erlangen, Pathologisches Institut v německém Erlangenu.18 Ve svém sdělení přiblížil, že z molekulárního i histopatologického hlediska existuje několik typů BC.
Přednáškou o důležitosti správného výběru pacientů navázal prof. Dr. med. Arndt Hartmann, z Universitätsklinikum Erlangen, Pathologisches Institut v německém Erlangenu.18 Ve svém sdělení přiblížil, že z molekulárního i histopatologického hlediska existuje několik typů BC.
Vývoj UC označil za komplexní proces – papilární a solidní nebo invazivní UC vznikají různými cestami. Dnes se podle prof. Hartmanna mluví hlavně o agresivním solidním BC, který se vyvíjí z normálního ektodermu přes karcinom in situ. Tento typ tvoří asi 30 % všech případů BC a za jeho velkou nestabilitou a agresivitou stojí mnoho molekulárních změn. „Naštěstí většina pacientů, které urologové léčí, trpí jinými nádory močového měchýře,“ poznamenal přednášející.
Papilární nádory se vyznačují několika mutacemi v genech řídících proliferaci, zejména FGFR3, ale také PIK3CA a STAG2. Mohou postupovat až k invazivnímu onemocnění. „Takže od začátku rozlišujeme dva typy karcinomu močového měchýře,“ doplnil prof. Hartmann.
Od roku 2012 trvá snaha o analýzu genové exprese pro případnou definici specifických typů BC. V roce 2020 byla provedena metaanalýza dosavadních studií na toto téma.19 Následně bylo rozlišeno šest typů invazivního karcinomu močového měchýře (muscle‑invasive bladder cancer, MIBC): tři typy luminálních nádorů (papilární, nespecifikovaný a nestabilní), nádor, u nějž klíčovou roli hraje stroma (stroma‑rich), bazální/skvamózní a malá skupina velmi agresivních neuroendokrinních karcinomů.20
Urotel představuje specifický epitel s různými typy buněk (umbrella buňky, intermediární, bazální), které exprimují různé imunohistochemické markery. A od různých populací buněk lze odvodit různé typy BC, které mohou různě reagovat na CHT, ale i na nové možnosti léčby. Existují také nádory s adenoidními rysy, rozlišují se různé luminální a bazální markery. Studie z roku 2020 pak přišla s klasifikací BC podle genové exprese, z níž vyplývá odlišná prognóza různých typů, přičemž velmi špatná je u neuroendokrinních BC.20 „Tato klasifikace exprese se používá v mnoha současných neoadjuvantních studiích s novou terapií, abychom zjistili, zda bychom mohli přijít s klasifikátorem genové exprese, který je již na trhu a mohl by předpovědět, která terapie by byla pro konkrétního pacienta nejvhodnější,“ doplnil prof. Hartmann.
K bazální či luminální diferenciaci dochází už během karcinogeneze. Molekulární podtypy se tedy diferencují během přechodu od karcinomu in situ k invazivnímu karcinomu a poté jsou stabilní.21 „To je dobrá zpráva, protože se pak daný podtyp už příliš nemění,“ podotkl přednášející.
Z histologických variant jsou podtypy
Invazivní karcinom vykazuje odlišnou histologii a molekulární podtypy. V patologické klasifikaci World Health Organization z roku 2022 došlo ke změně terminologie – pojem „histologické varianty“ byl změněn na „histologické podtypy“. A v nich se odráží, že v močovém měchýři (MM) existují extrémně rozmanité formy diferenciace, u UC se rozlišuje diferenciace uroteliální (konvenční a nekonvenční) a non‑uroteliální (divergentní).
Přednášející upozornil, že histologické podtypy bývají spojovány se špatnou prognózou, podle systematického přehledu a metaanalýzy z roku 2020 však pro toto tvrzení existují pouze retrospektivní data, která ukazují relativně malý efekt (poměr rizik 1,37).22 „Mnohé studie neměly referenční patologii, čerpaly pouze z archivů. Je tedy pravděpodobné, že některé z těchto podtypů mají špatnou prognózu, ale ve skutečnosti neexistují žádné prospektivní údaje,“ uvedl k tomu prof. Hartmann. Vyjádřil svůj názor, že podtypy budou důležité pro prognózu a predikci terapie.
Mikroprostředí nádoru a rozvoj svalovinu invadujícího UC
Typy genové exprese se odrážejí v mikroprostředí nádoru, které je zase velmi důležité pro predikci odpovědi na IT. Na základě mikroprostředí se rozlišují čtyři typy BC – imunologicky „studené“ (nezánětlivé) nádory, zánětlivé s nízkou infiltrací, imunologicky „horké“ s vysokou zánětlivou infiltrací, zánětlivé nádory s výraznými mechanismy imunitního úniku (ty jsou silně pozitivní na ligand programované buněčné smrti 1 [programmed death‑ligand 1, PD‑L1] a jedná se o kandidáty IT).23,24 Luminální/luminální papilární nádory, které příliš nereagují na IT nebo CHT, jsou imunologicky „studené“ (nezánětlivé) nádory.23 Je tedy zřejmé, že mikroprostředí má prognostický význam z hlediska přežití. „U vysoce zánětlivých nádorů je prognóza mnohem lepší, zatímco u imunologicky ,studených‘ velmi špatná. Odráží to imunitní reakci pacienta na nádor,“ připojil přednášející.
Prediktivní význam pro léčbu zůstává nejasný, „protože vyšetřujeme primární nádor, ale léčíme metastázy“ – s tím je spojena hypotéza, že je vyšetřován špatný materiál. Ze všech studií je vyžadována předběžná biopsie pouze v méně než 15 % případů. V práci publikované v roce 2023 autoři spárovali primární nádory a metastázy a u 30 % pacientů se ukázala nesrovnalost v imunitním infiltrátu.25,26 V souboru 50 pacientů nekorelovaly na jedné straně odpověď na inhibitory kontrolních bodů imunity (immune checkpoint inhibitors, ICI) podávané v 2. linii a výsledky pacientů a na druhé straně fenotyp primárního nádoru. Naproti tomu pomocí biopsie metastáz bylo možné predikovat, jaké je mikroprostředí nádoru a kteří pacienti mohou mít velmi dobré výsledky pouze s imunoterapií. I mezi různými typy metastáz ale platí odlišnosti – na terapii špatně reagují metastázy v játrech či kostech (stabilní, studený fenotyp), dobře v plicích či ledvinách (velmi nestabilní, horký fenotyp).
Konjugáty protilátka–léčivo
Patologie může pomoci při sekvenování léčby či predikci pravděpodobné reakce na konjugáty protilátka–léčivo (antibody–drug conjugates, ADC), např. enfortumab vedotin. Ve studiích je ale vidět také význam skóre věku – vysoká hodnota skóre se pojí s mnohem lepší reakcí na enfortumab vedotin.27 „Podle Toma Powlese by měl každý dostat enfortumab vedotin. Nicméně také v jeho studiích, pokud máte vysoké skóre věku, máte mnohem lepší odpověď na léčbu,“ uvedl přednášející s tím, že k podobnému zjištění dospěl také jeho tým na své kohortě pacientů. „Vidíme velmi silnou korelaci mezi skóre věku a odpovědí na enfortumab vedotin.“
Otevírá se potenciál pro další cíle ADC. Například studie fáze II DESTINY‑PANTUMOR02 ukazuje na roli HER2‑neu. Do budoucna tak podle přednášejícího bude několik možných cílů ADC, jako je Nectin‑4, EGFR, Her2‑neu, HER3, TROP2 aj. – a pro odezvu na tuto cílenou léčbu budou potřeba prediktivní markery.
Role multidisciplinárního tumor boardu
Kazuistika 1
 Ap. Prof. Priv.‑Doz. Dr. David D’Andrea, FEBU, z Medizinischen Universität a Allgemeinen Krankenhauses ve Vídni představil případ, který se vyvíjel od svalovinu neinvadujícího BC (NMIBC) k metastazujícímu.28 Narazil přitom na důležitou roli multidisciplinárního tumor boardu.
Ap. Prof. Priv.‑Doz. Dr. David D’Andrea, FEBU, z Medizinischen Universität a Allgemeinen Krankenhauses ve Vídni představil případ, který se vyvíjel od svalovinu neinvadujícího BC (NMIBC) k metastazujícímu.28 Narazil přitom na důležitou roli multidisciplinárního tumor boardu.
Jde o 62letého pacienta, kuřáka, s ECOG PS 0, je ženatý, má tři děti, je sporadicky aktivní, tj. jde o netypického pacienta s UC. Pacient se dostavil na pohotovost kvůli makrohematurii. Vyšetření výpočetní tomografií (computed tomography, CT) odhalilo ztluštění močového měchýře, ale žádné vzdálené metastázy.
Při cystoskopii provedené několik týdnů předtím byl zjištěn třícentimetrový papilární nádor na pravé stěně močového měchýře. Cílem bylo zcela odstranit nádor (nejdůležitější krok u NMIBC), ale nikoli močový měchýř, získat dobrý vzorek pro patologa a optimalizovat onkologické výsledky, a zároveň provést bezpečnou operaci s minimalizací morbidity.
Pacient tedy podstoupil transuretrální resekci (transurethral resection of bladder tumor, TURB) en bloc, která podle literatury poskytuje oproti standardní resekci BC lepší histologický vzorek s méně komplikacemi. „Během operace také vyplňujeme kontrolní check list, což je velmi důležité, a to jsme udělali i u tohoto pacienta. Doporučuji vám, abyste jej používali ve své klinické praxi. Jedná se pouze o 10 položek, které uvedete ve své chirurgické zprávě. Bylo prokázáno, že u těchto pacientů to skutečně zlepšuje výsledky a přežití bez recidivy,“ uvedl s tím, že zpráva je velmi informativní pro chirurga, ale i pro lékaře, který následně musí rozhodnout o typu adjuvantní léčby.
Patologická zpráva pacienta tedy uváděla UC pTa high grade, bez konkomitantního karcinomu in situ a nepříznivých znaků, s přítomností fragmentů detruzoru ve vzorku, nejednalo se o jiný histologický podtyp.
V souladu s odbornými pokyny byla provedena druhá TURB, neboť u těchto pacientů může být až 50 % zbytkového nádoru. Jelikož ta vyšla negativní, přešlo se k adjuvantní léčbě.
Po diskusi s pacientem byla v adjuvantní fázi zvolena intravezikální instilace Bacillus Calmette–Guérin (BCG). Absolvoval celý indukční cyklus a první kontrolní cystoskopie, cytologie i biopsie prokázaly rekurenci během nebo po instilaci BCG. Jako vsuvku přednášející uvedl, že nedávno byly shrnuty všechny studie publikované do roku 2024 na téma absence účinku intravezikální instilace BCG nebo její selhávání a dohromady zahrnovaly 68 různých léčebných ramen.29 „Máme tedy k dispozici celou řadu léků a možností, které můžeme pacientům nabídnout,“ poznamenal a připomněl zejména studii KEYNOTE‑057 s monoterapií pembrolizumabem.30 Doporučení současných evropských i amerických směrnic, jak postupovat při selhání intravezikální instilace BCG, se shodují – tento pacient musí podstoupit radikální cystektomii. Pacient je ovšem mladý, aktivní, má rodinu, chce si zachovat kvalitu života a žádá alternativy. V roce 2025 je řada možností, které by mu teoreticky bylo možné nabídnout, jako chemohypertermii, do jisté míry také druhou šanci pro BCG, ICI, inhibitor FGFR, superagonistu interleukinu 15 a stále ještě též CHT, která je pravděpodobně nejlevnější ze všech.
Pacientovi byla na základě dat z retrospektivní studie nabídnuta chemoterapie gemcitabin–docetaxel.31 Podává se 6 týdnů 1× týdně v dávce 1 g gemcitabinu a 37,5 mg docetaxelu. Ze zmíněné studie vyplývá vysoká odezva, která je navíc trvalá, a velmi vysoké přežití bez recidivy (po 1 roce 60 %, po 2 letech 46 %).
Kontrola po šesti měsících ukázala, že pacient terapii velmi dobře snáší, nevyskytly se žádné nežádoucí účinky. Z kontrolní CT vyplynulo podezření na patologii jedné kyčelní lymfatické uzliny vpravo. Kromě toho měl urostomii vyplněnou papilárním nádorem. Cytologie byla negativní na nádor vysokého stupně, močový měchýř byl bez patologie.
Na řadu přišla diskuse v multidisciplinárním tumor boardu, který přednášející označil za „pro tyto pacienty velmi důležitý“, o tom, co nabídnout. Pacient opět odmítl radikální cystektomii. Nádorový tým navrhl provést TURB, lymfadenektomii a sekvenování nové generace (next‑generation sequencing, NGS) u nádoru a/nebo uzliny. Histologie po TURB ukázala invazivní UC, laparoskopická lymfadenektomie prokázala pozitivitu jedné lymfatické uzliny a NGS panel u metastáz v lymfatické uzlině ukázal mutaci čtyř genů (FGFR, ERBB2, KRAS, HER2). „Máme tedy určitý prostor pro cílenou terapii,“ poznamenal přednášející.
CtDNA šest týdnů po operaci byla negativní.
„Existují tedy určité náznaky nebo signály, že u těchto pacientů by mohlo být onkologické onemocnění vyléčeno,“ konstatoval přednášející.
Kazuistika 2
 Jiný případ přiblížila OÄ Dr. Dora Niedersüß‑Beke, MBA, z Wiener Gesundheitsverbund Klinik Ottakring.32
Jiný případ přiblížila OÄ Dr. Dora Niedersüß‑Beke, MBA, z Wiener Gesundheitsverbund Klinik Ottakring.32
Jedná se o mladšího, 59letého muže, jemuž byl v roce 2014 diagnostikován UC. Podstoupil 3× TURB, poslední v roce 2015, a histologie potvrdila stadium T1 G3. V roce 2019 se ztratil ze sledování.
Až v červnu 2022 se dostavil s bolestí a makrohematurií. Měl hydronefrózu na obou stranách stupně 3–4, koncentraci kreatininu 1,6 mg/dl a recidivu lokalizovaného BC, ECOG PS byl 1. Anamnéza zahrnovala prodělání cévní mozkové příhody (2019), hypertenzi, diabetes mellitus nezávislý na inzulinu, ischemickou chorobu srdeční (zavedený stent), vše s náležitou medikací.
Nová TURB doložila vysoký stupeň papilárního UC, dále byly zjištěny PD‑L1 pozitivita, mikrosatelitová stabilita a podle NGS mutace PIK3CA a ERBB3. Urolog naplánoval cystektomii na září 2022. Pro tohoto pacienta nebyla vhodná neoadjuvantní CHT.
Izotopový nefrogram v srpnu 2022 již odhalil nefunkční pravou ledvinu. Pacient se ovšem nedostavil k operaci a opět se ztratil z dohledu.
V červenci 2023 přišel na pohotovost pro stejný problém. Měl makrohematurii, byl unavený, dostavovaly se křeče, měl anémii, opět zvýšenou koncentraci kreatininu (5,5 mg/dl) a všechny příznaky akutního selhání ledvin.
Vyšetření CT prokázalo progresi nádoru. Močový měchýř byl vyplněn nádorem, který infiltroval m. rectus abdominis. Pacient měl patologické lokální, paraaortální a parailiakální lymfatické uzliny, ale žádné viscerální metastázy. Radiologicky se jednalo o stadium rT4N3M0.
Pacientovi byla provedena nefrostomie vlevo a poprvé bylo povoláno onkologické konsilium, tedy pracoviště přednášející. Podána byla podpůrná terapie a pacient podstoupil rebiopsii.
V srpnu 2023 byl zařazen do multidisciplinárního tumor boardu. ECOG PS měl 2, funkce ledvin se po nefrostomii mírně zlepšila (koncentraci kreatininu 2,2 mg/dl). Podána byla kombinace enfortumab vedotin + pembrolizumab. „Ještě před prezentací na kongresu European Society for Medical Oncology jsme u tohoto pacienta zahájili léčbu kombinací enfortumab vedotin + pembrolizumab kvůli jeho špatné funkci ledvin, protože jsme již měli na našem oddělení k dispozici některé údaje,“ vysvětlila přednášející.
Po dvou dávkách enfortumab vedotinu (za 16 dnů) se pacient dostavil na naše onkologické oddělení s horečkou, bolestmi v podbřišku a obrovským abscesem v dolní části břišní stěny. Příčinou byla infekce v místě bulky onemocnění po velké regresi nádorové hmoty. Pacient dostal antibiotika, byla mu provedena drenáž a „dařilo se mu dobře“.
Ve druhém cyklu byl nejprve podán jen pembrolizumab, až poté (8. den) opět podán enfortumab vedotin, a to v dávce snížené na 85 %. Ve 3. až 5. cyklu byla pacientovi znovu podána plná dávka enfortumab vedotinu, objevila se však mírná neuropatie. V prosinci 2023 dostal 6. cyklus kombinační terapie enfortumab vedotin + pembrolizumab, ve kterém byla proto dávka opět snížena na 85 %. Jak uvedla přednášející, „pacient léčbu toleroval docela dobře“.
V lednu 2024 byla prokázána regrese primárního nádoru a úplná remise všech patologických lymfatických uzlin. Zmenšoval se i MM, který ještě zbývalo dořešit. „V celém těle pacienta jsme již nenacházeli žádné další patologie,“ doplnila přednášející.
Pacient byl znovu předložen multidisciplinárnímu tumor boardu. „Myslím, že je to opravdu důležité, protože časy se mění a stav pacientů s metastázami se díky novým terapeutickým možnostem bude stále zlepšovat. Musíme tedy zvážit pozdější radikální cystektomii. A to jsme u našeho pacienta provedli, protože jsme věděli, že hlavním problémem je močový měchýř, a ne metastázy v lymfatických uzlinách, které během této terapie zmizely,“ dodala přednášející.
V březnu 2024 muž podstoupil rozsáhlou operaci s cystektomií, prostatektomií a vpravo též ureterektomií i nefrektomií. Histologicky byl stále přítomen nádor ypT2a (invazivní nediferencovaný papilární UC, chronická infekční infiltrace a myxoidní degenerace), ale všechny lymfatické uzliny a všechny ostatní lokalizace byly negativní. Pacient odmítl adjuvantní IT se slovy, že „už podstoupil šest cyklů systémové terapie a má toho dost“.
Zatím poslední vyšetření mu bylo provedeno tři měsíce předtím, než byl ve stavu ECOG 0, s koncentrací kreatininu 2,0 mg/dl, a 1,5 roku poté stále neměl žádné známky onemocnění.
Rozhodování s individualizací péče
Jako souhrn a rekapitulace řečeného s akcentací personalizované medicíny na příkladech z praxe byly pojaty dvě kazuistiky, které přiblížil prof. Dr. Javier Puente, PhD, z Institute of Oncology v Hospital Clinico San Carlos v Madridu33
Kazuistika 1
Jednalo se o 66letého muže s hematurií, s dobře kontrolovanou hypertenzí v anamnéze, bývalého kuřáka (20 krabičkoroků), který měl velmi dobrý ECOG PS 0 a dobrou funkci ledvin (odhadovaná glomerulární filtrace [estimated glomerular filtration rate, eGFR] 67 ml/min). Ultrasonografie odhalila zesílení stěny MM vlevo s podezřením na malignitu, vyšetření CT prokázalo 42milimetrovou pevnou masu v levé části močového měchýře s extenzí do perivezikálního tuku. TURB potvrdila UC ve stadiu cT3 a invazi do lamina muscularis propria.
Pacient podstoupil neoadjuvantní CHT na bázi gemcitabin–cisplatina s durvalumabem, 4 cykly podle studie NIAGARA, a po ní radikální cystektomii + disekci pánevních lymfatických uzlin. Volbu odejmutí MM namísto snahy o jeho zachování trimodální terapií přednášející zdůvodnil stadiem nádoru.
Histopatologická zpráva odhaluje vysokou míru infiltrace s rozsáhlou skvamózní diferenciací do celé tloušťky stěny MM, žádné metastázy v uzlinách, PD‑L1 pozitivitu (kombinované pozitivní skóre 20). Stadium tedy bylo T3N0M0.
Jako následné možnosti se nabízely pouhé sledování, podávání nivolumabu po dobu jednoho roku, radioterapie nebo adjuvantní CHT. Zvolen byl nivolumab na základě studie CheckMate 274.34
Po 11 měsících užívání nivolumabu došlo k progresi – metastazování do plic a lymfatických uzlin. Pacient měl stále ECOG PS 1 a eGFR 60 ml/min. Jako další postup bylo možné zvolit enfortumab vedotin nebo IT atezolizumabem či pembrolizumabem, nebo CHT kombinací gemcitabin–cisplatina, a po ní avelumab nebo kombinaci gemcitabin–cisplatina + nivolumab nebo kombinaci enfortumab vedotin + pembrolizumab.
Vzhledem k nízké odezvě na neoadjuvantní CHT (pacient měl po ní nádor ve stadiu T3) byla radši než režim s CHT zvolena kombinace enfortumab vedotin + pembrolizumab (v ČR v době konání kolokvia nebyla schválena).
Další vývoj přednášející neprezentoval.
Kazuistika 2
Druhý klinický případ pojednával o 72leté ženě s ECOG PS 1 s metastazujícím UC, který u ní byl stabilizován podáním CHT na bázi gemcitabin–cisplatina coby 1. linie léčby. Jako udržovací terapii následně užívala avelumab. V anamnéze má dále hypercholesterolémii a diabetes mellitus, CrCl kolem 45 ml/min (jako konkomitantní medikaci užívá enalapril 10 mg, omeprazol 20 mg, metformin 850 mg a podle potřeby paracetamol).
„V našem zařízení provádíme molekulární analýzu a pacientka je mikrosatelitově stabilní, má mutaci FGFR3, ale také amplifikaci ERBB2 s pozitivním HercepTestem,“ připojil přednášející.
Přežití bez progrese při prvoliniové CHT a avelumabu činilo 21 měsíců, pak se ukázala progrese s metastázami v plicích, lymfatických uzlinách a kostech. „Pacientka je však v dobrém výkonnostním stavu, má dobrou clearance kreatininu (48 ml/min) a je mírně symptomatická,“ doplnil přednášející.
K výběru nyní byly enfortumab vedotin, pembrolizumab, erdafitinib, trastuzumab deruxtekan nebo sacituzumab govitekan. Pacientka užívala v 2. linii enfortumab vedotin, který byl podáván i.v. infuzemi v dávce 1,25 mg/kg 1., 8. a 15. den 28denního cyklu. Trpěla dermatologickou toxicitou (erytematózní pruritické papuly) a také periferní neuropatií stupně 2. Na enfortumab vedotin reagovala dobře, což prokázaly zobrazovací metody 12 týdnů po jeho nasazení.
Poté však došlo k metastazování do mozku a k progresi v plicích. V tomto okamžiku se rozhodovalo mezi nejlepší podpůrnou péčí, pembrolizumabem, erdafitinibem, trastuzumab deruxtekanem nebo sacituzumab govitekanem. Kromě toho bylo možné zařadit pacientku do otevřené studie, v níž byl napříč kohortami medián PFS 6,9 měsíce a medián OS 13,4 měsíce.35,36
Pacientka účast ve studii odmítla a ve 3. linii léčby jí byl podán erdafitinib. Na něj reagovala dobře, ještě 12 měsíců od zahájení jeho podávání trvala odpověď v mozku a plicích, což přednášející označil za zázrak. „Jedná se o výjimky. Většina našich pacientů v těchto situacích zemře do dvou, nejpozději tří měsíců. Začala užívat erdafitinib a v tuto chvíli je stále naživu,“ konstatoval v závěru.
Klíčové body
- Volba 1. linie u pokročilého/metastazujícího UC má vycházet z prognostické stratifikace (ECOG PS, hemoglobin < 10 g/dl, jaterní metastázy, CRP), cíle léčby (kontrola symptomů vs. dlouhodobé přežití) a plánované sekvence dalších linií.
- Enfortumab vedotin + pembrolizumab představuje vysoce účinný režim; interpretace studie EV‑302/KEYNOTE‑A39 však musí zohlednit design (časově omezená CHT v kontrolním rameni, neplošné použití udržovací léčby avelumabem, kontinuální expozice v rameni enfortumab vedotin + pembrolizumab).
- Profily toxicit se zásadně liší: hematologická toxicita CHT je obvykle předvídatelná a zvládnutelná, zatímco u režimu enfortumab vedotin + pembrolizumab dominuje kumulativní dlouhodobá toxicita (kožní nežádoucí účinky, periferní neuropatie), včetně vzácné, ale fatální toxické epidermální nekrolýzy.
- Cisplatinová CHT zůstává referenčním standardem u vhodných pacientů; split‑dose cisplatina umožňuje rozšířit populaci způsobilých k užívání cisplatiny při zachování účinnosti a přijatelné bezpečnosti.
- Gemcitabin–cisplatina + nivolumab (CheckMate 901) přináší zlepšení OS, PFS i ORR oproti samotné CHT a představuje klinicky relevantní alternativu 1. linie s dobře známým a zvládnutelným profilem toxicity.
- Renální funkce je klíčovým determinantem strategie: cisplatina je kontraindikována u pacientů s GFR < 40 ml/min, u pacientů s GFR 40–60 ml/min jen nutno použít rozdělenou dávku cisplatiny; je vhodné aktivně vyloučit reverzibilní urologické příčiny zhoršení renálních funkcí.
- Po platině má zásadní roli imunoterapie: udržovací léčba avelumabem po odpovědi či stabilizaci (JAVELIN Bladder 100) nebo pembrolizumabem ve 2. linii (KEYNOTE‑045), s důrazem na kvalitu života a dlouhodobou kontrolu onemocnění.
- V dalších liniích je rozhodování založeno na různých biomarkerech, potenciální toxicitě: u mutací FGFR3 přichází v úvahu erdafitinib a/nebo enfortumab vedotin; optimální sekvence není univerzálně stanovena a závisí na klinickém kontextu.
- Patologie, molekulární subtypizace a fenotyp tumorového mikroprostředí (studené/horké/s únikem) podporují predikci odpovědi zejména na ICI; pro rozhodování v metastatickém stadiu může být přínosnější biopsie metastázy než primárního tumoru.
- Multidisciplinární tumor board je nezbytný pro dynamické rozhodování, eskalaci či deeskalaci léčby a případné konverzní lokální řešení po hluboké systémové odpovědi (včetně využití NGS/ctDNA, správného sekvenování a načasování cystektomie).
Literatura
[1] Wysocki P. Urothelial bladder cancer finding the right treatment sequence. Bladder Cancer Master Class; 24–26 Sep 2025; Brno.
[2] Abuhelwa AY, Sonpavde G, Galsky MD, et al. Enhanced Bellmunt risk score for survival prediction in urothelial carcinoma treated with immunotherapy. Clin Genitourin Cancer 2022; 20: 132–138.
[3] Wysocki P, Rutkowski P, Jassem J, et al. Optimization of systemic treatment in patients with bladder, ureter, and renal pelvis cancer – expert opinion of the Polish Society of Clinical Oncology. Oncol Clin Pract 2025; 21: 177–192.
[4] Powles T, Perez‑Valderrama B, Gupta S, et al. Enfortumab vedotin and pembrolizumab in untreated advanced urothelial cancer. N Engl J Med 2024; 390: 875–888.
[5] Gupta S, Powles T, Sonpavde G, et al. Age and other criteria influencing non‑treatment of patients with locally advanced or metastatic urothelial carcinoma: results of a physician survey in five European countries. Presented at: ASCO Annual Meeting; 2024.
[6] Huang RS, Yang J, Lee J, et al. Patient‑reported outcomes as prognostic indicators for overall survival in cancer: a systematic review and meta‑analysis. JAMA Oncol 2025; 11: 1303–1312.
[7] Khanjar B, Lacouture ME, Anadkat MJ, et al. Enfortumab vedotin toxic epidermal necrolysis–like blistering dermatosis: a case series and review of the literature. JAAD Case Rep 2024; 43: 40–50.
[8] Bilen MA, Zibelman M, Geynisman DM, et al. Clinical and economic outcomes in patients with metastatic urothelial carcinoma receiving first‑line systemic treatment (IMPACT UC I). Oncologist 2023; 28: 790–798.
[9] Galsky M, Powles T, van der Heijden MS, et al. Characterization of complete responders to nivolumab plus gemcitabine–cisplatin vs gemcitabine–cisplatin alone in advanced urothelial carcinoma (CheckMate 901). J Clin Oncol 2024; 42(Suppl): abstract 4509.
[10] Gupta S, Powles T, Petrylak DP, et al. Exploratory analysis of responders from the phase 3 EV‑302 trial of enfortumab vedotin plus pembrolizumab vs chemotherapy in untreated advanced urothelial carcinoma. Presented at: ASCO Annual Meeting; 2025.
[11] van der Heijden MS, Sonpavde G, Powles T, et al. Nivolumab plus gemcitabine–cisplatin in advanced urothelial carcinoma. N Engl J Med 2023; 389: 1778–1789.
[12] de Velasco G, Castellano D, Puente J, et al. Split‑dose cisplatin plus atezolizumab for patients with urothelial carcinoma considered ineligible for full‑dose cisplatin (SOGUG‑AUREA). JCO Oncol Adv 2025; 2: e2500033.
[13] Grant RC, Dixon S, Booth CM, et al. Predicting chronic kidney disease after cisplatin treatment using population‑level data. JAMA Oncol 2025; 11: 1179–1185.
[14] Kintzel PE, Dorr RT. Anticancer drug renal toxicity and elimination: dosing guidelines for altered renal function. Cancer Treat Rev 1995; 21: 33–64.
[15] Powles T, Park SH, Voog E, et al. Avelumab first‑line maintenance for advanced urothelial carcinoma: results from the JAVELIN Bladder 100 trial. J Clin Oncol 2023; 41: 3486–3492.
[16] Bellmunt J, de Wit R, Vaughn DJ, et al. KEYNOTE‑045: open‑label, phase III study of pembrolizumab versus investigator’s choice of paclitaxel, docetaxel, or vinflunine for previously treated advanced urothelial cancer. Presented at: SITC Annual Meeting; 9–13 Nov 2016; abstract 470.
[17] Fradet Y, Bellmunt J, Vaughn DJ, et al. Long‑term follow‑up of pembrolizumab versus chemotherapy in advanced urothelial carcinoma: KEYNOTE‑045. Ann Oncol 2019; 30: 970–976.
[18] Hartmann A. Urothelial cancer – subtypes and biomarkers — role of pathology. Bladder Cancer Master Class; 24–26 Sep 2025; Brno.
[19] Taber A, Christensen E, Lamy P, et al. Molecular correlates of cisplatin‑based chemotherapy response in muscle‑invasive bladder cancer. Nat Commun 2020; 11: 4858.
[20] Kamoun A, de Reynies A, Allory Y, et al. A consensus molecular classification of muscle‑invasive bladder cancer. Eur Urol 2020; 77: 420–433.
[21] Wullweber A, Seiler R, Junker K, et al. Bladder tumor subtype commitment occurs in carcinoma in situ driven by key signaling pathways. Cancer Res 2021; 81: 1552–1566.
[22] Mori K, Janisch F, Mostafaei H, et al. Variant histology in urothelial carcinoma treated with radical cystectomy: a systematic review and meta‑analysis. J Urol 2020; 204: 224–232.
[23] Pfannstiel C, Strissel PL, Chiappinelli KB, et al. The tumor immune microenvironment correlates with bladder cancer subtypes and prognosis. Cancer Immunol Res 2019; 7: 923–938.
[24] Eckstein M, Erben P, Kriegmair MC, et al. Cytotoxic T‑cell gene expression signature predicts survival in muscle‑invasive bladder cancer. J Immunother Cancer 2020; 8: e000162.
[25] Erlmeier F, Eckstein M, Wirtz RM, et al. Spatial immune phenotypes of distant metastases predict response to immune checkpoint inhibition. Eur Urol 2023; 83: 133–142.
[26] Bolenz C, Kunath F, Zengerling F, Wezel F, Schmidt S, Hartmann A, Eckstein M. Increasing biomarker guidance in the treatment of urothelial carcinoma: systematic review of international clinical trials. Urol Int 2023; 107: 480–488.
[27] Klümpers N, Raggi D, Alessi A, et al. NECTIN4 amplification predicts response to enfortumab vedotin in metastatic urothelial cancer. J Clin Oncol 2024; 42: 2446–2455.
[28] D’Andrea D. Multidisciplinary tumor board – case presentation. Bladder Cancer Master Class; 24–26 Sep 2025; Brno.
[29] D’Andrea D, Soria F, Abufaraj M, et al. En bloc versus conventional resection of primary bladder tumor (eBLOC). Eur Urol Oncol 2023; 6: 508–515.
[30] Necchi A, Raggi D, Gallina A, et al. Pembrolizumab monotherapy for high‑risk non‑muscle‑invasive bladder cancer unresponsive to BCG (KEYNOTE‑057). Lancet Oncol 2024; 25: 720–730.
[31] Steinberg RL, Thomas LJ, O’Donnell MA, et al. Sequential gemcitabine and docetaxel as rescue therapy for non‑muscle‑invasive bladder cancer. J Urol 2020; 203: 902–909.
[32] Niedersüss‑Beke D. Case presentation. Bladder Cancer Master Class; 24–26 Sep 2025; Brno.
[33] Puente J. Case studies and interactive discussions. Bladder Cancer Master Class; 24–26 Sep 2025; Brno.
[34] Galsky M, Arija JAA, Bamias A, et al. Adjuvant nivolumab in high‑risk muscle‑invasive urothelial carcinoma: CheckMate 274. J Clin Oncol 2025; 43: 15–21.
[35] Meric‑Bernstam F, Makker V, Oaknin A, et al. Trastuzumab deruxtecan in HER2‑expressing solid tumors: DESTINY‑PanTumor02 interim results. Presented at: ASCO Annual Meeting; 2023; abstract LBA3000.
[36] Meric‑Bernstam F, Makker V, Oaknin A, et al. Trastuzumab deruxtecan in HER2‑expressing solid tumors: DESTINY‑PanTumor02. J Clin Oncol 2024; 42: 47–58.