Moderní diagnostické přístupy u uroteliálních nádorů: Role molekulárního profilování, ctDNA a farmakogenetiky v éře personalizované onkologie
Co dnes v onkologii uroteliálních nádorů znamená „moderní diagnostika“ a proč už nestačí jen histopatologický závěr? Jakou přidanou hodnotu přináší transkriptomické subtypy a co nám říkají o biologii nádoru a pravděpodobné odpovědi na imunoterapii? Kdy může být ctDNA praktickým nástrojem pro monitoraci léčby a detekci minimální reziduální nemoci – a jaké jsou její limity včetně falešné negativity a preanalytických úskalí? A proč by farmakogenetika a lékové interakce měly být součástí klinického uvažování stejně samozřejmě jako výkonnostní stav nebo renální funkce? Existují rozdíly u léčby pacientů s nádory močového měchýře a horních cest močových? Těmto a mnoha dalším otázkám se věnovala I. sekce odborného programu kolokvia Bladder Cancer Master Class, která zdůraznila, že precizní medicína je výsledkem komplexního klinického uvažování, které propojuje různé biologické i klinické informace v čase a v jednotlivých liniích léčby.
Moderní diagnostika karcinomu močového měchýře: současné přístupy a inovace
 Diagnostika karcinomu močového měchýře se v posledních letech posouvá od tradiční histopatologie k multiomickým strategiím, které umožňují přesnější porozumění biologii nádoru i jeho odpovědi na léčbu.1 Jak zdůraznila dr. Marzia Del Re z Saint Camillus International University of Health and Medical Sciences v Římě, moderní diagnostika již dávno není jen „popisem buňky pod mikroskopem“, ale komplexní interpretací genomických, transkriptomických a dynamických cirkulujících markerů, které společně určují prognózu i volbu optimální terapie. Její výrok, že „diagnostika znamená pochopit, jak nádor žije, jak se mění a jak reaguje na tlak léčby“ výstižně shrnuje současný trend směrem k personalizované onkologii.
Diagnostika karcinomu močového měchýře se v posledních letech posouvá od tradiční histopatologie k multiomickým strategiím, které umožňují přesnější porozumění biologii nádoru i jeho odpovědi na léčbu.1 Jak zdůraznila dr. Marzia Del Re z Saint Camillus International University of Health and Medical Sciences v Římě, moderní diagnostika již dávno není jen „popisem buňky pod mikroskopem“, ale komplexní interpretací genomických, transkriptomických a dynamických cirkulujících markerů, které společně určují prognózu i volbu optimální terapie. Její výrok, že „diagnostika znamená pochopit, jak nádor žije, jak se mění a jak reaguje na tlak léčby“ výstižně shrnuje současný trend směrem k personalizované onkologii.
Molekulární klasifikace MIBC: význam transkriptomických subtypů
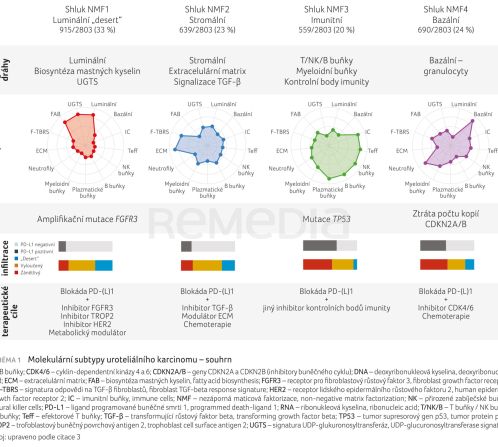 Konsenzuální molekulární klasifikace svalovinu invadujícího karcinomu močového měchýře (muscle‑invasive bladder cancer, MIBC), publikovaná Kamounem a Chuem, představuje jeden z pilířů této transformace.1,2 RNA‑seq analýzy rozsáhlých kohort (včetně kohort z IMvigor studií) ukázaly, že nádory lze zjednodušeně členit do čtyř biologicky odlišných klastrů – luminálního, stromálního, imunitního a bazálního – s rozdílnou aktivací signálních drah a odlišnou imunitní infiltrací.3 Dr. Del Re ve své přednášce detailně popsala jejich charakteristiky: luminální klastr je spojen zejména s aktivací lipidového metabolismu, stromální je obohacen o složky extracelulární matrix a signalizaci transformujícího růstového faktoru beta (transforming growth factor beta, TGF‑β), zatímco imunitní a bazální klastry jsou definovány výraznou infiltrací myeloidních či granulocytárních buněk. Tyto rozdíly mají přímý klinický dopad. Jak uvedla, „NMF1 a NMF2 jsou tumory bez imunitní infiltrace, zatímco NMF3 a NMF4 jsou skutečně zánětlivé nádory – právě ony reagují nejlépe na checkpoint inhibitory“. Tato zjednodušená biologická stratifikace proto představuje užitečný nástroj pro predikci odpovědi na imunoterapii a pro racionální volbu léčebných strategií (schéma 1).1,3
Konsenzuální molekulární klasifikace svalovinu invadujícího karcinomu močového měchýře (muscle‑invasive bladder cancer, MIBC), publikovaná Kamounem a Chuem, představuje jeden z pilířů této transformace.1,2 RNA‑seq analýzy rozsáhlých kohort (včetně kohort z IMvigor studií) ukázaly, že nádory lze zjednodušeně členit do čtyř biologicky odlišných klastrů – luminálního, stromálního, imunitního a bazálního – s rozdílnou aktivací signálních drah a odlišnou imunitní infiltrací.3 Dr. Del Re ve své přednášce detailně popsala jejich charakteristiky: luminální klastr je spojen zejména s aktivací lipidového metabolismu, stromální je obohacen o složky extracelulární matrix a signalizaci transformujícího růstového faktoru beta (transforming growth factor beta, TGF‑β), zatímco imunitní a bazální klastry jsou definovány výraznou infiltrací myeloidních či granulocytárních buněk. Tyto rozdíly mají přímý klinický dopad. Jak uvedla, „NMF1 a NMF2 jsou tumory bez imunitní infiltrace, zatímco NMF3 a NMF4 jsou skutečně zánětlivé nádory – právě ony reagují nejlépe na checkpoint inhibitory“. Tato zjednodušená biologická stratifikace proto představuje užitečný nástroj pro predikci odpovědi na imunoterapii a pro racionální volbu léčebných strategií (schéma 1).1,3
Genomická heterogenita a klonální evoluce při terapii
Genomická heterogenita uroteliálního karcinomu dále zvyšuje komplexitu diagnostického rozhodování. Chu et al. ukazují, že spektrum mutací se významně liší podle histologických variant: neuroendokrinní tumory nesou častěji mutace TP53 (a další alterace), papilární nádory bývají charakterizovány změnami receptoru pro fibroblastové růstové faktory (fibroblast growth factor receptor 3, FGFR3) a agresivní varianty často vykazují aktivaci dráhy fosfatidylinositol‑3‑kinázy (phosphoinositide 3‑kináza, PI3K) nebo amplifikaci receptoru lidského epidermálního růstového faktoru 2 (human epidermal growth factor receptor 2, HER2).2 Dr. Del Re v této souvislosti zdůraznila, že „mutace nejsou statické – nádor akumuluje nové mutace pod tlakem terapie a často mění svou histologii jako mechanismus rezistence“. Tento vývoj odpovídá modelu „trunk‑and‑branches“, kdy primární řídící alterace tvoří „kmen“ nádoru, zatímco později vznikající změny během léčby určují selhání specifických terapií.2 Mezi typické příklady patří mutace ligand‑binding domény FGFR po cílené léčbě nebo změny exprese Nectin‑4 či aktivace transportních mechanismů (např. MDR‑1 pumpy) vedoucí k rezistenci na terapii konjugáty protilátka–léčivo (antibody–drug conjugates, ADC), například enfortumab vedotin. Důležitý je přitom praktický aspekt, což dr. Del Re shrnula: „Rezistence u ADC nemusí znamenat novou mutaci – stačí jiná exprese cílového proteinu nebo aktivace transportérů.“
Konjugáty protilátka–léčivo se mezitím staly důležitou součástí léčby pokročilého karcinomu močového měchýře. Prezentované práce ukazují interindividuální variabilitu exprese TROP2 a Nectin‑4.4,5 Dr. Del Re upozornila: „Stále diskutujeme, co je skutečně prediktivní – mRNA exprese, nebo protein. U ADC léčby může rezistence vzniknout i bez mutace – stačí změna exprese cílového proteinu.“ Tyto poznatky zdůrazňují potřebu kombinovat molekulární a proteomický přístup při interpretaci účinnosti a selhání ADC.4,5
Tekutá biopsie a ctDNA: klinické možnosti a praktická úskalí
Významným pilířem moderní diagnostiky je tekutá biopsie, zejména analýza cirkulující nádorové DNA (circulating tumor DNA, ctDNA). Literatura opakovaně zdůrazňuje její roli ve sledování odpovědi na léčbu, detekci minimální reziduální nemoci, identifikaci mechanismů rezistence i predikci časných relapsů.6–9 Praktický výklad dr. Del Re ale dodal klíčový kontext: jedním z největších limitů je falešná negativita. Jak uvedla: „Pokud v ctDNA najdete mutaci, máte jistotu, že ji nese nádor. Pokud ji nenajdete, nemůžete říct vůbec nic.“ Nízká koncentrace ctDNA je typická například u kostních metastáz a intrakraniálního postižení, kde fyziologické bariéry brání jejímu uvolňování do cirkulace. Tumor‑informed ctDNA testy se staly klíčovou součástí monitorace minimální reziduální nemoci v časných stadiích. Studie NIAGARA ukázala, že clearance ctDNA po neoadjuvantní terapii a cystektomii významně koreluje s dobou přežití bez známek onemocnění (disease‑free survival, DFS) i dobou přežití bez události.10 Současně je však nutné zdůraznit, že ctDNA negativita nepředstavuje absolutní záruku: „Křivka ctDNA‑negativních pacientů není horizontální – něco nám stále uniká, ať už jde o panel, biologii nebo klonální dynamiku,“ poznamenala dr. Del Re. Tato perspektiva podporuje využití ctDNA jako citlivého nástroje pro časnou identifikaci rizika relapsu, ale zároveň upozorňuje na limity současných panelů.
Farmakogenetika a lékové interakce: opomíjený, ale zásadní faktor léčby
Farmakogenetika představuje méně „viditelný“, avšak klinicky významný pilíř moderního managementu. Zanger a Schwab uvádějí, že až 80 % onkologických léčiv včetně podpůrné medikace je metabolizováno prostřednictvím CYP450 systému.11 Interakce mezi léčivy, dietními faktory a genetickými polymorfismy mohou vysvětlovat neočekávanou toxicitu nebo selhání léčby – například při mutaci cytidindeaminázy ovlivňující metabolismus gemcitabinu či při dietních inhibitorech CYP3A4 (např. grapefruit).8 Dr. Del Re to shrnula prakticky: „Někdy hledáme mechanismus rezistence v nádoru, ale důvodem selhání je prostě léková interakce.“ Farmakogenetické vyšetření by proto mělo být zvažováno zejména u pacientů s komorbiditami a polypragmazií.11
Závěrečné sdělení přednášky podtrhlo význam integrace diagnostických přístupů. Precizní medicína u karcinomu močového měchýře nevzniká z jediného biomarkeru, ale z propojení histologie, transkriptomu, mutačního profilu, dynamiky ctDNA a farmakogenetických informací.1–11 Dr. Del Re shrnula tuto potřebu integrace výstižně: „Nemůžeme uvažovat izolovaně. Musíme integrovat diagnostiku, genomiku, tekutou biopsii i farmakogenetiku. A právě zde nám pomůže umělá inteligence. Ne jako náhrada, ale jako nástroj, který zvládne velké množství dat.“
V diskusi zazněla otázka rutinní dostupnosti multiomických vyšetření (sekvenování nové generace, ctDNA, subtypizace) v italské praxi. Dr. Del Re uvedla, že „není to standardní u všech pacientů“ a že významná část těchto přístupů zůstává zatím ve výzkumné sféře, přesto probíhá postupná implementace – zejména u tekuté biopsie v první linii.
Moderní diagnostika karcinomu močového měchýře se tak stává komplexní, datově bohatou disciplínou, která umožňuje individualizovat léčbu, předcházet rezistenci a včas zachytit změny v biologii nádoru. Multiomická integrace představuje jednu z nejperspektivnějších cest ke zlepšení klinických výsledků v nadcházejících letech.
Komplexní management recidivujícího uroteliálního karcinomu: kazuistika mladého pacienta s desetiletým sledováním
 Prezentace Fruzsiny Fazekas, MD, PhD, z budapešťské Péterfy Sándor Kórház‑Rendelőintézet Urológiai Osztály nabídla výjimečně působivý pohled na dlouhodobý průběh agresivního uroteliálního karcinomu u mladého pacienta. Jednalo se o 46letého muže, původně zcela zdravého, jehož onemocnění během deseti let ilustrovalo většinu zásadních klinických výzev spojených s léčbou vysoce rizikového uroteliálního karcinomu. Přednášející uvedla případ slovy: „Přivezla jsem vám případ, který mě provází mnoho let. Je to příběh nejen medicínských rozhodnutí, ale i velké motivace pacienta, který chtěl vidět synovu promoci.“
Prezentace Fruzsiny Fazekas, MD, PhD, z budapešťské Péterfy Sándor Kórház‑Rendelőintézet Urológiai Osztály nabídla výjimečně působivý pohled na dlouhodobý průběh agresivního uroteliálního karcinomu u mladého pacienta. Jednalo se o 46letého muže, původně zcela zdravého, jehož onemocnění během deseti let ilustrovalo většinu zásadních klinických výzev spojených s léčbou vysoce rizikového uroteliálního karcinomu. Přednášející uvedla případ slovy: „Přivezla jsem vám případ, který mě provází mnoho let. Je to příběh nejen medicínských rozhodnutí, ale i velké motivace pacienta, který chtěl vidět synovu promoci.“
První projevy, časná diagnostika a vysoké riziko
Onemocnění se manifestovalo v roce 2015 příchodem pacienta na pohotovost pro makroskopickou hematurii. Do té doby byl zcela zdráv, bez komorbidit, neužíval žádnou chronickou medikaci, nekouřil a v rodinné anamnéze byl přítomen pouze karcinom ledviny u babičky z matčiny strany. Cystoskopie, cytologie i vyšetření výpočetní tomografií (computed tomography, CT) potvrdily lokalizovaný nádor močového měchýře. V průběhu čtyř transuretrálních resekcí byl opakovaně prokázán uroteliální karcinom stadia pT1, high grade, tedy vysoce riziková neinvazivní léze. Po čtvrté resekci byl nález poprvé negativní, nicméně podle skórování EORTC (European Organisation for Research and Treatment of Cancer) dosahovalo riziko recidivy 38 % v jednom roce a 62 % v pěti letech. Lékaři proto doporučili časnou radikální cystektomii, pacient se však rozhodl pro zachování močového měchýře a zvolil léčbu intravezikálními instilacemi BCG.
Rychlá progrese a komplikovaná příprava k radikální léčbě
Navzdory BCG terapii došlo k časné recidivě, tentokrát již ve formě svalovinu invadujícího karcinomu lokalizovaného v močové trubici. Pozitivní cytologie, nález pT2 v uretrální biopsii a CT průkaz zvětšených parailických uzlin a hydronefrózy svědčily pro rychlou progresi onemocnění. Přípravu k radikální cystektomii navíc komplikovala hospitalizace pro těžkou pyelonefritidu. Jak dr. Fazekas poznamenala: „V té době se zdálo, že operace nebude možná, protože klinický stav pacienta nebyl vůbec příznivý.“
Radikální léčba ve dvou fázích
Po stabilizaci celkového stavu bylo nakonec rozhodnuto o provedení radikální cystektomie, která však musela být realizována ve dvou krocích. V lednu 2017 byla provedena cystektomie s ileálním konduitem, přičemž histologický nález potvrdil pT2, high grade onemocnění s pozitivními parailickými lymfatickými uzlinami. Následovala uretrektomie a na začátku roku 2018 ureterální reimplantace s paraaortální lymfadenektomií, kde byla opět prokázána metastáza uroteliálního karcinomu. V březnu 2018 byla zahájena léčba pembrolizumabem. Pacient patřil mezi první v Maďarsku, kteří tuto imunoterapii ve své indikaci obdrželi. Léčba trvala téměř čtyři roky a byla ukončena pro rozvoj imunologicky podmíněné artritidy. Přes tuto komplikaci zůstává pacient v kompletní remisi bez známek onemocnění až do současnosti.12
Následná diskuse potvrdila, že v tomto konkrétním případě nebyla neoadjuvantní cisplatinová chemoterapie vzhledem ke snížené renální clearance vhodná, což je v souladu s doporučeními European Association of Urology (EAU) pro pacienty s postižením uretry, kde je důkaz pro neoadjuvantní chemoterapii slabší než u primárního MIBC.12,13
Diskuse terapeutických rozhodnutí
Případ vyvolal řadu odborných otázek týkajících se optimální sekvence léčby. V retrospektivním pohledu zaznělo, že uretrální lokalizace, časná recidiva po BCG a nízký věk pacienta by mohly podporovat časnější indikaci radikální cystektomie. Diskutována byla rovněž volba adjuvantní systémové léčby, zejména dilema mezi karboplatinovým režimem a imunoterapií u pacientů s renální insuficiencí. Jak poznamenal jeden z diskutujících: „V reálné praxi je někdy karboplatina rozumnější volba než imunoterapie, pokud nemáme jasný benefit u PD‑L1 negativních.“14,15 Další diskutující však oponoval, že imunoterapie má u těchto pacientů slušné postavení, lepší než karboplatina.
Tento dlouhodobě sledovaný případ ukazuje, že léčba agresivního uroteliálního karcinomu nebývá lineární. Vyžaduje flexibilitu, interdisciplinární spolupráci a schopnost individualizovat terapeutická rozhodnutí v čase, ale také respektovat životní cíle konkrétního pacienta. Kazuistika podtrhuje význam imunoterapie u metastazujícího onemocnění a demonstruje, že i u vysoce rizikových pacientů může kombinace komplexní péče a osobní motivace vést k dlouhodobému přežití bez známek nemoci. Prezentaci dr. Fazekas uzavřela slovy: „Pomáhá nám pomáhat. A co je nejdůležitější: opravdu viděl promoci svého syna. A znovu jezdí na motorce.“ Příběh tím však nekončí – pacient se aktivně zapojil do edukačních projektů, kde sdílí svou zkušenost a pomáhá dalším nemocným překonávat obavy z léčby.12,14–19
Perioperační léčba UTUC: neoadjuvantní vs. adjuvantní chemoterapie v klinické praxi
 Prof. Javier Puente, MD, PhD, z Hospital Clínico San Carlos v Madridu představil komplexní přehled současné role perioperační systémové léčby u pacientů s lokalizovaným high‑risk karcinomem horních močových cest. V úvodu zdůraznil, že cílem jeho sdělení není pouze uvádět jednotlivé poměry rizik (hazard ratio, HR) či procenta odpovědí z klinických studií, ale především ukázat, jak lze dostupná data smysluplně implementovat do každodenní klinické praxe. Uroteliální karcinom horních močových cest podle něj představuje specifickou onkologickou jednotku, u níž zůstávají dlouhodobé výsledky léčby navzdory radikální nefroureterektomii s excizí ureterálního ústí neuspokojivé. U invazivních stadií se pětileté přežití pohybuje v rozmezí 43–75 % u T2, 16–33 % u T3 a pouhých 0–5 % u T4 či N+ onemocnění, což jasně podtrhuje potřebu účinnějších perioperačních strategií.12,20
Prof. Javier Puente, MD, PhD, z Hospital Clínico San Carlos v Madridu představil komplexní přehled současné role perioperační systémové léčby u pacientů s lokalizovaným high‑risk karcinomem horních močových cest. V úvodu zdůraznil, že cílem jeho sdělení není pouze uvádět jednotlivé poměry rizik (hazard ratio, HR) či procenta odpovědí z klinických studií, ale především ukázat, jak lze dostupná data smysluplně implementovat do každodenní klinické praxe. Uroteliální karcinom horních močových cest podle něj představuje specifickou onkologickou jednotku, u níž zůstávají dlouhodobé výsledky léčby navzdory radikální nefroureterektomii s excizí ureterálního ústí neuspokojivé. U invazivních stadií se pětileté přežití pohybuje v rozmezí 43–75 % u T2, 16–33 % u T3 a pouhých 0–5 % u T4 či N+ onemocnění, což jasně podtrhuje potřebu účinnějších perioperačních strategií.12,20
Výzvy přesného stagingu a rizikové stratifikace
Zásadní překážkou efektivního využití perioperační léčby zůstává správná identifikace pacientů, kteří z ní mohou skutečně profitovat. Prof. Puente upozornil, že u high‑risk uroteliálního karcinomu horních močových cest (upper tract urothelial carcinoma, UTUC) je přesné stanovení klinického stadia před operací mimořádně obtížné a že riziková stratifikace je zatížena významnými limitacemi. Až jedna čtvrtina ureteroskopických biopsií je neadekvátních a často neumožňuje spolehlivě odlišit neinvazivní papilární nádor, karcinom in situ a invazivní karcinom.21,22 Klinický grading může rozhodování částečně napomoci, jeho pozitivní prediktivní hodnota pro svalovou invazi však dosahuje pouze přibližně 60 %.21,23
K tradičně uváděným rizikovým faktorům patří velikost tumoru nad 2 cm, hydronefróza, vysoký histologický stupeň, pozitivní cytologie či uzlinové postižení. Jak shrnul: „Výběr pacientů je u horních uroteliálních nádorů mnohem složitější než u nádorů močového měchýře.“ Nedávno publikovaný americký nomogram zahrnující více než 6 000 pacientů identifikoval jako nezávislé prediktory invazivity věk, histologický stupeň, lymfovaskulární invazi, velikost tumoru nad 5 cm a klinickou lymfadenopatii.20,23 Přesnost predikce dosáhla 80 % pro svalovou invazi a 88 % pro uzlinové postižení, což představuje významný posun, nikoli však definitivní řešení problému.
Neoadjuvantní chemoterapie: racionální koncept s limitovanými důkazy
V části věnované neoadjuvantní chemoterapii prof. Puente vysvětlil racionální základ tohoto přístupu. Radikální nefroureterektomie často vede ke zhoršení renální funkce a značná část pacientů se po operaci stává pro platinovou chemoterapii neindikovatelnou.24 „Podání systémové léčby před chirurgickým výkonem by proto mohlo zajistit, že více pacientů obdrží plnou dávku cisplatiny a potenciálně dosáhne lepších výsledků,“ uvedl. Navzdory této logice však zůstává úroveň důkazů podporujících neoadjuvantní chemoterapii omezená. K dispozici je pouze několik malých prospektivních studií a více než deset retrospektivních analýz. Metaanalýzy uvádějí průměrnou míru kompletní patologické odpovědi kolem 11 % a parciální odpověď přibližně u 43 % pacientů, přičemž zlepšení celkového přežití je naznačeno, ale jedná se o důkaz úrovně 2.14,16
Prospektivní data MSKCC a rozdílné transatlantické pohledy
Za nejvýznamnější prospektivní studii v této oblasti označil prof. Puente práci Memorial Sloan Kettering Cancer Center, která hodnotila rozdělené dávkování gemcitabinu a cisplatiny u pacientů s lokalizovaným high‑risk UTUC.14 Podle prezentovaných výsledků dosáhlo 63 % pacientů patologické odpovědi pod úrovní ypT2 a 19 % kompletní patologické remise. Dvouleté přežití bez progrese činilo 89 % a pětileté 72 %, přičemž celkové pětileté přežití u respondentů dosahovalo téměř 80 %. Přestože jsou tato data velmi povzbudivá, jejich zobecnitelnost je limitována malým počtem pacientů a dlouhou dobou náboru.
Prof. Puente dále upozornil na rozdílný pohled mezi americkými a evropskými odborníky. Zatímco část amerických autorů považuje tato data za dostatečně silná k úvahám o zařazení neoadjuvantní chemoterapie mezi standardní postupy, evropští odborníci zůstávají rezervovaní a upozorňují, že nepřesnost stagingu může vést jak k nadléčení, tak k podléčení. Stejně zdrženlivě hodnotil i neoadjuvantní imunoterapii, u níž dosud dostupné studie nepřinesly přesvědčivé důkazy o klinickém přínosu. Podle prof. Puente proto v roce 2025 není dostatek důkazů pro rutinní doporučení neoadjuvantní imunoterapii u UTUC.25,26
Adjuvantní chemoterapie: nejrobustnější dostupný důkaz
Nejsilnější důkazní základ v celém perioperačním spektru představuje adjuvantní chemoterapie. Prof. Puente detailně rozebral přelomovou studii POUT, která prokázala signifikantní prodloužení přežití bez známek onemocnění i bez metastáz při použití gemcitabinu v kombinaci s cisplatinou nebo karboplatinou oproti pouhé observaci. Poměr rizik pro DFS činil 0,45 ve prospěch adjuvantní léčby a toxicita byla přijatelná bez úmrtí souvisejících s terapií.17,27 „Finální analýza celkového přežití ukázala trend ke zlepšení (HR 0,76), byť nedosáhla statistické signifikance. Přesto studie poskytla důkaz úrovně 1 a zásadně ovlivnila klinická doporučení,“ zdůraznil.
Na základě těchto dat EAU i NCCN jednoznačně doporučují platinovou adjuvantní chemoterapii u pacientů s high‑risk UTUC, kteří jsou k ní způsobilí.26,28 Neoadjuvantní chemoterapie naopak zůstává mimo doporučení EAU, zatímco NCCN ji – v návaznosti na americká data – připouští u vybraných pacientů.
Adjuvantní imunoterapie: slibná, ale zatím nejednoznačná
V oblasti adjuvantní imunoterapie shrnul prof. Puente výsledky tří klíčových studií. Studie IMvigor010 s atezolizumabem nesplnila primární cílový ukazatel a neprokázala zlepšení DFS.18 Naopak studie CheckMate 274 s nivolumabem ukázala benefit v celé populaci uroteliálního karcinomu, avšak subanalýza zaměřená na UTUC nepřinesla přesvědčivý signál účinnosti.19 Podobně heterogenní výsledky byly zaznamenány i u pembrolizumabu.29 Ačkoli tedy mohou být inhibitory receptoru programované buněčné smrti 1 / ligandu receptoru programované buněčné smrti 1 (programmed death‑1 / programmed death ligand‑1, PD‑1/PD‑L1) zvažovány u pacientů, kteří nejsou kandidáty platinové chemoterapie, jejich role v adjuvantní léčbě UTUC zůstává nejasná a dostupná data jsou zatím limitovaná.
Prof. Puente v závěru zdůraznil, že UTUC zůstává jednou z nejkomplexnějších diagnóz urogenitální onkologie a že ani v roce 2025 neexistuje univerzální ideální algoritmus péče. Nejlépe podloženým přístupem zůstává adjuvantní chemoterapie, jejíž přínos pro DFS představuje nejsilnější dostupný důkaz. Naději do budoucna přinášejí probíhající studie, jako je evropská studie URANUS, které by měly umožnit přesnější vymezení role perioperační systémové léčby. Každý pacient s UTUC by měl být podle prof. Puente posuzován individuálně a ideálně diskutován v rámci multidisciplinárního tumor boardu, protože správná volba léčby vyžaduje pečlivé zvážení klinických faktorů i úzkou spolupráci všech zapojených specialistů.12,14–19,24–27,30
Imunoterapie v léčbě UTUC: od biologických specifik k současným klinickým důkazům
 OÄ Priv.‑Doz. Dr. Hossein Taghizadeh, PhD, MSc., z Wiener Privatklinik ve své přednášce představil komplexní a zároveň velmi praktický pohled na roli imunoterapie u UTUC. Hned v úvodu zdůraznil, že UTUC nelze vnímat pouze jako anatomickou variantu uroteliálního karcinomu močového měchýře. Jde o biologicky agresivnější onemocnění, které je často diagnostikováno v pokročilejším stadiu a u pacientů se zhoršeným celkovým stavem. Tyto charakteristiky zásadně ovlivňují terapeutické rozhodování. Karcinom horních močových cest tvoří přibližně 5–10 % všech uroteliálních karcinomů, avšak již v době diagnózy je až 60 % případů invazivních, což se výrazně promítá do prognózy.12,20
OÄ Priv.‑Doz. Dr. Hossein Taghizadeh, PhD, MSc., z Wiener Privatklinik ve své přednášce představil komplexní a zároveň velmi praktický pohled na roli imunoterapie u UTUC. Hned v úvodu zdůraznil, že UTUC nelze vnímat pouze jako anatomickou variantu uroteliálního karcinomu močového měchýře. Jde o biologicky agresivnější onemocnění, které je často diagnostikováno v pokročilejším stadiu a u pacientů se zhoršeným celkovým stavem. Tyto charakteristiky zásadně ovlivňují terapeutické rozhodování. Karcinom horních močových cest tvoří přibližně 5–10 % všech uroteliálních karcinomů, avšak již v době diagnózy je až 60 % případů invazivních, což se výrazně promítá do prognózy.12,20
Standardem léčby zůstává radikální nefroureterektomie, nicméně data z velkých mezinárodních kohort, včetně práce Margulis et al., ukazují, že i po adekvátním chirurgickém výkonu dochází k relapsu přibližně u třetiny pacientů.20 Zároveň se jedná o populaci často geriatrickou a polymorbidní, což dále komplikuje možnosti systémové léčby. Jak upozornil dr. Taghizadeh, „není výjimkou, že pacient přichází již se sníženou funkcí ledvin, která se po operaci dále zhorší natolik, že znemožní podání cisplatiny“. Podle dostupných dat má v době diagnózy přibližně 40 % pacientů chronické onemocnění ledvin stupně ≥ 3, po operaci pak až 85 %.24
Adjuvantní chemoterapie jako základ, ale s omezeným účinkem
Zásadním milníkem v léčbě UTUC byla studie POUT, která prokázala, že adjuvantní chemoterapie významně zlepšuje pětileté přežití bez známek onemocnění (DFS 62 % vs. 45 %; HR 0,55) a přináší také trend ke zlepšení celkového přežití (66 % vs. 57 %; HR 0,68).17,27 Přesto podle dr. Taghizadeha zůstává prostor pro další zlepšení: „Chemoterapie funguje, to víme. Její účinek je ale jen částečný a relapsy nejsou vzácné. Potřebujeme účinnější systémovou léčbu, která dokáže zasáhnout mikrometastatické onemocnění.“ Tím se pozornost přirozeně obrací k imunoterapii, která díky svému mechanismu účinku může překonat některá omezení chemoterapie, zejména v kontextu renální insuficience.
Imunogenomické charakteristiky UTUC
Významnou část prezentace tvořil přehled imunogenomických rysů UTUC. Dostupné studie ukazují, že UTUC má obecně vyšší mutační nálož než karcinom močového měchýře a častěji vykazuje expresi PD‑L1 či fenotyp vysoké mikrosatelitové nestability. Přibližně 10 % případů je spojeno s deficitem systému opravy chyb párování DNA (mismatch repair, MMR), často v kontextu Lynchova syndromu.12,25 Tyto charakteristiky naznačují potenciální citlivost k imunoterapii, avšak klinická realita je komplexnější.
Karcinom horních močových cest vykazuje výraznou molekulární heterogenitu. Luminální‑papilární nádory s mutacemi FGFR3 mají typicky tzv. „immune‑desert“ mikroprostředí, charakterizované nízkou infiltrací T lymfocytů a nízkou pravděpodobností odpovědi na checkpoint inhibitory. Naproti tomu bazální a zánětlivé podtypy jsou spojeny s vyšší imunitní aktivitou a potenciálně lepší odpovědí na imunoterapii.1–3 Dr. Taghizadeh tuto ambivalenci shrnul výstižně: „Karcinom horních močových cest je geneticky bohatý, ale imunologicky často tichý. A právě v této ambivalenci se skrývá klíč – pochopit, u koho imunoterapie skutečně fungovat může.“
Neoadjuvantní imunoterapie: zajímavý koncept bez přesvědčivých důkazů
V přednášce byla diskutována také data z oblasti neoadjuvantní imunoterapie. Studie iNDUCT‑V08, hodnotící kombinaci durvalumabu s chemoterapií, sice prokázala downstaging u 42–50 % pacientů, avšak míra kompletní patologické remise zůstala nízká (5–13 %) a studie byla hodnocena jako negativní.31 Podobně studie PURE‑02 s pembrolizumabem nepřinesla očekávaný efekt – nebyla zaznamenána žádná patologická odpověď a došlo dokonce k jednomu úmrtí souvisejícímu s léčbou.31
V souladu s těmito výsledky EAU doporučení z roku 2025 uvádějí, že pro použití neoadjuvantní imunoterapie u UTUC neexistují dostatečné důkazy.26 Ačkoliv biologický potenciál tohoto přístupu existuje, klinická data zatím nepřinesla jasnou podporu jeho rutinního použití.
Adjuvantní imunoterapie: smíšené a nejednoznačné výsledky
Adjuvantní imunoterapie přinesla robustní výsledky u uroteliálního karcinomu jako celku, jak ukázaly studie CheckMate 274 a AMBASSADOR.19,29 Subanalýzy zaměřené specificky na UTUC však neprokázaly statisticky významný benefit, pravděpodobně i v důsledku nízkého počtu zařazených pacientů. Doporučení EAU 2025 proto hodnotí tuto oblast zdrženlivě a konstatují, že pacienti s UTUC z těchto studií neprofitovali jednoznačně.26 Dr. Taghizadeh k tomu poznamenal: „Víme, že imunoterapie funguje u karcinomu močového měchýře a u metastazujícího uroteliálního karcinomu. Ale v adjuvantním nastavení po operaci u UTUC zatím jasnou odpověď nemáme.“
Výjimku představuje studie JAVELIN Bladder 100, která se týká pacientů s metastatickým postižením. Tato studie prokázala prodloužení celkového přežití při udržovací léčbě avelumabem po chemoterapii. Tento účinek byl konzistentní napříč podskupinami, včetně pacientů s UTUC, kteří tvořili přibližně 25 % celé studijní populace.30
Imunoterapie a ADC v metastatickém stadiu
Zásadní posun v léčbě pokročilého uroteliálního karcinomu přinesla kombinace imunoterapie a ADC. Data pro enfortumab vedotin ať už v monoterapii, nebo v kombinaci s pembrolizumabem (EV‑103, EV‑302) ukázala vysokou účinnost bez ohledu na primární lokalizaci nádoru.32,34,35 Kombinace enfortumab vedotin + pembrolizumab se stala novým standardem první linie u pokročilého onemocnění. Jak shrnul dr. Taghizadeh: „V metastatickém stadiu už se neptáme, odkud nádor vyšel – moderní imunoterapie a ADC fungují napříč uroteliálními karcinomy.“
Imunoterapie představuje důležitý pilíř moderní léčby UTUC, její role se však liší podle klinického kontextu. Zatímco v neoadjuvantním a adjuvantním nastavení zůstávají důkazy omezené a nejednoznačné, v metastatickém stadiu – zejména v kombinaci s ADC – dosahuje imunoterapie výrazného klinického přínosu.19,24–27,29–35 Klíčovou výzvou do budoucna zůstává lepší biologická stratifikace pacientů, která umožní přesněji identifikovat ty, kteří z imunoterapie skutečně profitují.
ADC v léčbě UTUC: nové klinické poznatky a jejich význam pro praxi
 Prof. MUDr. Tomáš Büchler, Ph.D., z Onkologické kliniky 2. LF UK a FN v Motole v Praze ve své přednášce představil komplexní přehled role ADC v léčbě uroteliálního karcinomu, se zvláštním zaměřením na UTUC. Zdůraznil, že ačkoli ADC patří mezi nejrychleji se rozvíjející terapeutické třídy současné onkologie, jejich postavení v léčbě UTUC je zatím definováno pouze částečně. Karcinom horních močových cest tvoří přibližně 5–10 % všech uroteliálních karcinomů, avšak biologicky i klinicky se významně liší od nádorů močového měchýře, což se promítá i do odpovědi na systémovou léčbu.36,37
Prof. MUDr. Tomáš Büchler, Ph.D., z Onkologické kliniky 2. LF UK a FN v Motole v Praze ve své přednášce představil komplexní přehled role ADC v léčbě uroteliálního karcinomu, se zvláštním zaměřením na UTUC. Zdůraznil, že ačkoli ADC patří mezi nejrychleji se rozvíjející terapeutické třídy současné onkologie, jejich postavení v léčbě UTUC je zatím definováno pouze částečně. Karcinom horních močových cest tvoří přibližně 5–10 % všech uroteliálních karcinomů, avšak biologicky i klinicky se významně liší od nádorů močového měchýře, což se promítá i do odpovědi na systémovou léčbu.36,37
ADC v praxi: účinnost, limity a interpretace dat
Renální dysfunkce je přítomna u 30–40 % pacientů již v době diagnózy a po radikální nefroureterektomii může k dalšímu významnému poklesu renální funkce dojít až u 50–70 % nemocných. Tento fakt zásadně omezuje možnosti podání platinové chemoterapie a představuje jeden z hlavních důvodů, proč jsou ADC v populaci UTUC mimořádně atraktivní.24,36 Jejich účinnost není podmíněna plně zachovanou renální funkcí a současně cílí na molekulární struktury, které jsou u UTUC často exprimované.
V prezentaci zaznělo, že Nectin‑4, hlavní cíl enfortumab vedotinu, je exprimován u 65–80 % případů UTUC. Podobně HER2 pozitivita dosahuje u UTUC 30–36 %, což představuje až trojnásobek oproti nádorům močového měchýře a poukazuje na významné biologické rozdíly mezi oběma lokalizacemi.4,5 Tyto charakteristiky vytvářejí prostředí, v němž mohou ADC sehrát potenciálně výraznější roli než u uroteliálních karcinomů dolních močových cest.
Prof. Büchler následně shrnul současné portfolio ADC využívaných v léčbě uroteliálních nádorů: enfortumab vedotin (anti‑Nectin‑4), disitamab vedotin RC48 (anti‑HER2), sacituzumab govitekan (anti‑TROP2) a trastuzumab deruxtekan (anti‑HER2).32–35 Připomněl však, že většina registračních studií historicky zahrnovala společně nádory močového měchýře i horních močových cest, a proto jsou čistě UTUC‑specifická data dostupná teprve v posledních letech, především z menších prospektivních studií a reálné klinické praxe.
Kombinace enfortumab vedotin + pembrolizumab: nový standard s otevřenými otázkami
Největší klinický dopad má v současnosti kombinace enfortumab vedotinu s pembrolizumabem (EV‑302/KEYNOTE‑A39). Tato studie prokázala významné prodloužení přežití bez progrese (12,5 vs. 6,3 měsíce; HR 0,45) i celkového přežití (31,5 vs. 16,1 měsíce; HR 0,47), přičemž pacienti s UTUC tvořili přibližně 27 % celé studijní populace a dosažené výsledky byly konzistentní napříč jednotlivými podskupinami.32,34,35
Prof. Büchler však upozornil na nutnost opatrné interpretace těchto dat. Kontrolní rameno studie podstoupilo chemoterapii pouze po dobu 18 týdnů, zatímco léčba kombinací enfortumab vedotin + pembrolizumab pokračovala až do progrese nebo toxicity. To vedlo k výrazně delší expozici léčbě s mediánem 12 cyklů a u pacientů v kompletní remisi až 30 cyklů. Kromě toho přibližně u třetiny pacientů chyběla spolehlivá data o následné udržovací léčbě avelumabem, což komplikuje hodnocení optimálních sekvenčních strategií.34,35 Jak prof. Büchler poznamenal: „Tato absence dat je překvapivá právě v populaci, kde by informace o sekvenci měly největší význam.“
Toxicita ADC a otázka dlouhodobé léčby
Ačkoli enfortumab vedotin vykazuje nižší výskyt hematologických toxicit než klasická chemoterapie, je spojen s jinými typy nežádoucích účinků, které mohou být klinicky závažné. Jako příklad prof. Büchler uvedl toxickou epidermální nekrolýzu, vzácnou komplikaci vyskytující se přibližně u 0,8 % pacientů, s mortalitou kolem 50 % a vyžadující intenzivní specializovanou péči.33 Současně zdůraznil, že dlouhodobé podávání kombinace enfortumab vedotin + pembrolizumab může negativně ovlivňovat kvalitu života pacientů, zejména při kumulaci kožní toxicity a periferní neuropatie.
Klinické implikace a budoucí perspektivy
Na základě dostupných důkazů lze podle prof. Büchlera vymezit několik klinických situací, v nichž ADC představují racionální a potenciálně vysoce účinnou léčebnou možnost. V první linii se kombinace enfortumab vedotin + pembrolizumab jeví jako zvláště vhodná pro pacienty nevhodné k užívání cisplatiny, což je u UTUC velmi častý scénář v důsledku renální dysfunkce. Ve druhé linii má pevné místo enfortumab vedotin na základě studie EV‑301, přesto však zůstává otevřenou otázkou optimální sekvence léčby u pacientů, kteří již obdrželi enfortumab vedotin + pembrolizumab v první linii.33
Pacienti s HER2‑pozitivními nádory mohou teoreticky profitovat také z disitamab vedotinu nebo trastuzumab deruxtekanu, přičemž UTUC vykazuje nejvyšší míru HER2 exprese v rámci uroteliálních karcinomů. Konjugáty protilátka–léčivo rovněž představují vhodnou alternativu pro nemocné, u nichž by chemoterapie znamenala nepřijatelnou toxicitu nebo další zhoršení renálních funkcí.32–37
Prof. Büchler uzavřel své sdělení konstatováním, že množství důkazů pro použití ADC v léčbě UTUC rychle narůstá, avšak stále se nachází v relativně rané fázi. Všechny dosud publikované UTUC‑only studie jsou malé a převážně nerandomizované, což omezuje možnost formulovat definitivní závěry. Přesto dostupná data naznačují, že účinnost ADC u UTUC je srovnatelná, nebo dokonce vyšší než u nádorů močového měchýře, a že jejich bezpečnostní profil je při včasné identifikaci specifických toxicit dobře zvládnutelný. Přednáška vyzněla jako apel na pokračování UTUC‑specifického klinického výzkumu a na biomarkerově řízený přístup, který by mohl umožnit přesnější výběr pacientů.32–37 Jak prof. Büchler shrnul: „Konjugáty protilátka–léčivo podle všeho představují jednu z nejslibnějších cest, jak překonat limity chemoterapie v renálně fragilní populaci UTUC a jak formovat budoucnost léčby tohoto onemocnění.“
Metastazující UTUC: terapeutické strategie a klinická kazuistika
 Doc. MUDr. Jindřich Kopecký, Ph.D., z Kliniky onkologie a radioterapie LF UK a Hradec Králové ve své prezentaci zdůraznil, že metastazující UTUC nelze považovat pouze za anatomickou variantu uroteliálního karcinomu močového měchýře, ale že představuje biologicky i klinicky odlišnou jednotku. Pacienti s UTUC jsou obvykle starší a již při zahájení léčby mají horší renální funkci, která se po radikální nefroureterektomii často dále zhoršuje. Tento fakt má zásadní dopad na způsobilost k podání cisplatiny a významně ovlivňuje volbu léčebné sekvence v první linii. Současně se u metastazujícího UTUC setkáváme s odlišnými metastatickými vzorci, kdy oproti karcinomu močového měchýře častěji dominují retroperitoneální uzlinové metastázy a kostní postižení. Tyto faktory společně vytvářejí specifické klinické prostředí, které vyžaduje individualizovaný terapeutický přístup.36,37
Doc. MUDr. Jindřich Kopecký, Ph.D., z Kliniky onkologie a radioterapie LF UK a Hradec Králové ve své prezentaci zdůraznil, že metastazující UTUC nelze považovat pouze za anatomickou variantu uroteliálního karcinomu močového měchýře, ale že představuje biologicky i klinicky odlišnou jednotku. Pacienti s UTUC jsou obvykle starší a již při zahájení léčby mají horší renální funkci, která se po radikální nefroureterektomii často dále zhoršuje. Tento fakt má zásadní dopad na způsobilost k podání cisplatiny a významně ovlivňuje volbu léčebné sekvence v první linii. Současně se u metastazujícího UTUC setkáváme s odlišnými metastatickými vzorci, kdy oproti karcinomu močového měchýře častěji dominují retroperitoneální uzlinové metastázy a kostní postižení. Tyto faktory společně vytvářejí specifické klinické prostředí, které vyžaduje individualizovaný terapeutický přístup.36,37
Synchronní vs. metachronní UTUC
Jedním z klíčových sdělení prezentace bylo rozlišení mezi synchronním a metachronním UTUC. Data konzistentně ukazují, že synchronní forma onemocnění má signifikantně horší prognózu než UTUC vznikající metachronně. U synchronních nádorů je vyšší riziko časné systémové diseminace a kratší celkové přežití, a to i při srovnatelném rozsahu primárního onemocnění. Jak doc. Kopecký uvedl, „tento poznatek zdůrazňuje potřebu vyšší ostražitosti při rozhodování o intenzitě terapie a sledování u synchronních nádorů, a to bez ohledu na jejich původní staging“.
Nedostatečné zastoupení UTUC v klinických studiích
Dalším zásadním problémem je výrazný nesoulad mezi skutečným výskytem UTUC v populaci a jeho zastoupením v klinických studiích. Podle údajů práce Nally et al. tvoří UTUC v randomizovaných studiích první linie léčby metastazujícího onemocnění pouze 5–10 % zařazených pacientů.37 V mnoha studiích jsou navíc data pro UTUC sloučena s karcinomem močového měchýře nebo nejsou samostatně analyzována. Tento přístup významně omezuje robustnost závěrů pro UTUC populaci a nutí klinickou praxi k extrapolaci výsledků studií, které byly primárně navrženy pro jinou biologickou entitu. Doc. Kopecký zdůraznil, že právě tento nedostatek představuje jednu z hlavních překážek tvorby kvalitních důkazů a že UTUC nutně vyžaduje samostatné prospektivní klinické studie.
Léčebná rozhodnutí v kontextu renální funkce a guidelines
Současná doporučení odborných společností (EAU, NCCN, American Urological Association) sice formulují obecné principy léčby společné pro UTUC i karcinom močového měchýře, jejich aplikace je však u UTUC pacientů často limitována renální funkcí.28 Doc. Kopecký vysvětlil, že významná část pacientů s UTUC není schopna podstoupit chemoterapii cisplatinou, ať už z důvodu preexistující renální insuficience, nebo následného poklesu renální rezervy po chirurgické léčbě. Z tohoto důvodu pacienti s UTUC častěji přecházejí na karboplatinové režimy nebo na léčbu kombinující imunoterapii a ADC. Nejde přitom nutně o biologicky optimální volbu, ale o důsledek funkčních limitací organismu. Léčebná sekvence se tak u UTUC přirozeně liší od karcinomu močového měchýře, přestože je rámcově popsána ve stejných doporučeních.
Oligometastatický UTUC a role lokálních metod
Specifickou podskupinu představuje oligometastatický UTUC. U pacientů s omezeným počtem metastatických ložisek mohou hrát významnou roli lokální léčebné metody, zejména stereotaktická radioterapie nebo další fokální přístupy, a to s potenciálem dlouhodobé kontroly onemocnění. Přestože pro tyto strategie chybí randomizovaná data, jejich použití je v souladu s klinickou praxí a opírá se o menší soubory a kazuistiky. Jak zaznělo, „lokální léčba může být přínosná zejména u pacientů s bolestivými kostními metastázami nebo s izolovanými uzlinovými ložisky“, kde umožňuje jak symptomatickou úlevu, tak podporu systémové kontroly onemocnění.
Variantní histologie jako zásadní prognostický faktor
Významným negativním prognostickým faktorem metastazujícího UTUC je přítomnost variantní histologie. Studie Deuker et al. a Douglawi et al. ukazují, že pacienti s variantními histologickými typy mají výrazně kratší celkové přežití, často v rozmezí 8–10 měsíců, a vyšší výskyt metastáz, zejména uzlinových a kostních.38,39 Přestože prezentace neuváděla detailní numerická data, dostupná literatura poskytuje konzistentní závěr, že variantní histologie má zásadní dopad na prognózu i volbu léčebné strategie. U těchto pacientů může být racionální časnější nasazení intenzivnější systémové léčby nebo dřívější využití ADC, pokud jsou dostupné, vzhledem k vysokému riziku rychlé progrese.
Klinická kazuistika: typický průběh UTUC v reálné praxi
Prezentovaná kazuistika 65letého pacienta s UTUC ilustrovala typický průběh metastazujícího onemocnění v reálné klinické praxi. Pacient po radikální nefroureterektomii absolvoval čtyři cykly chemoterapie cisplatinou a gemcitabinem a následně udržovací imunoterapii avelumabem. Navzdory této sekvenci došlo k progresi onemocnění s rozvojem kostních, plicních a retroperitoneálních metastáz. Bolestivá kostní léze byla řešena paliativní radioterapií a další systémovou linií se stal enfortumab vedotin. Tento průběh dobře ilustruje typickou trajektorii pokročilého UTUC, kdy i při optimální sekvenci léčby zůstává riziko relapsu vysoké a léčebná strategie musí být plánována s ohledem na renální funkci, biologii tumoru i reálné možnosti pacienta.
Z kazuistiky vyplývá několik zásadních poznatků: UTUC představuje biologicky odlišnou entitu s vyšším rizikem časné metastatické progrese; renální funkce zásadně ovlivňují volbu systémové terapie; variantní histologie zhoršuje prognózu a může vyžadovat intenzivnější terapeutický přístup. Lokální metody, zejména radioterapie, mohou sehrát důležitou roli v kontrole symptomů i v udržení celkové léčebné trajektorie. Případ rovněž zdůrazňuje nutnost multimodálního a flexibilního uvažování, protože efektivní management UTUC vyžaduje kombinaci chirurgie, systémové léčby, imunoterapie, přesné paliace a moderních léčiv typu ADC.30,32,33
Popsaný případ i dostupná literatura ukazují, že léčba metastazujícího UTUC se sice opírá o obecné principy léčby uroteliálního karcinomu, avšak skutečné terapeutické výsledky jsou zásadně ovlivněny specifickou biologickou povahou tohoto onemocnění. Úspěch péče proto nezávisí pouze na správné sekvenci léčebných modalit, ale také na schopnosti individualizovat terapii podle renální funkce, histologických podtypů, dynamiky progrese a preferencí pacienta. Metastazující UTUC vyžaduje multidisciplinární přístup, racionální využití lokálních metod a realistické plánování dalších linií systémové léčby včetně moderních ADC. Tento komplexní přístup představuje největší šanci na stabilizaci onemocnění a zachování přijatelné kvality života u pacientů s biologicky agresivním nádorem se sklonem k časné systémové progresi.28,36–39
Klíčové body
- Moderní diagnostika UC vyžaduje integraci histologie, genomiky, transkriptomiky, proteomických korelátů a dynamických cirkulujících markerů, s interpretací v čase a podle léčebné linie, nikoli izolované posuzování jednotlivých testů.
- Transkriptomická klasifikace MIBC umožňuje biologickou stratifikaci nádorů a predikci odpovědi na imunoterapii; imunitně zánětlivé fenotypy obecně profitují z léčby checkpoint inhibitory více než nádory bez imunitní infiltrace.
- Genomická heterogenita a klonální evoluce pod selekčním tlakem léčby vysvětlují selhání terapie a podporují potřebu opakované re‑biopsie/reeskalace molekulární charakterizace při progresi; rezistence je často dána změnami exprese a fenotypu, nikoli pouze vznikem nových mutací.
- U ADC je zásadní exprese funkčního cílového proteinu (např. Nectin‑4, TROP2), přičemž hladiny mRNA nemusejí mít prediktivní hodnotu; selhání léčby může nastat i bez detekovatelné genetické alterace.
- ctDNA je využitelná pro monitorování odpovědi, detekci minimální reziduální nemoci a časný záchyt relapsu; pozitivita je vysoce specifická, zatímco negativita nevylučuje perzistenci onemocnění a vyžaduje opatrnou interpretaci.
- Farmakogenetika a lékové interakce mají přímý dopad na účinnost i toxicitu systémové léčby a měly by být standardní součástí klinického rozhodování, zejména u polymorbidních pacientů a pacientů s polyfarmakoterapií.
- UTUC představuje biologicky specifickou entitu s obtížným stagingem a častou renální limitací; nejsilnější perioperační důkaz podporuje adjuvantní platinovou chemoterapii, zatímco role neoadjuvantní a adjuvantní imunoterapie zůstává nejednoznačná.
- V metastatickém stadiu UC zásadně mění léčebné algoritmy kombinace imunoterapie s ADC, které vykazují vysokou účinnost napříč lokalizacemi včetně UTUC a redefinují sekvenční strategie léčby.
Literatura
[1] Kamoun A, de Reyniès A, Allory Y, et al. A consensus molecular classification of muscle‑invasive bladder cancer. Eur Urol 2020; 77: 420–433.
[2] Chu CE, Chen Z, Whiting K, Ostrovnaya I, et al. Clinical outcomes, genomic heterogeneity, and therapeutic considerations across histologic subtypes of urothelial carcinoma. Eur Urol 2025; 88: 472–481.
[3] Hamidi H, Bergholtz H, Ekström J, et al. Molecular heterogeneity in urothelial carcinoma and determinants of clinical benefit to PD‑L1 blockade. Cancer Cell 2024; 42: 2098–2112.
[4] Chou J, Trepka K, Sjöström M, et al. TROP2 Expression Across Molecular Subtypes of Urothelial Carcinoma and Enfortumab Vedotin‑resistant Cells. Eur Urol Oncol 2022; 5: 714–718.
[5] Bahlinger V, Eckstein M, Erben P, et al. Protein expression profiling in urothelial carcinoma. Histopathology 2024; 84: 863–876.
[6] Alix‑Panabières C, Pantel K. Liquid biopsy: From discovery to clinical application. Nat Biomed Eng 2017; 1: 0065.
[7] Zhu Y, Chen Y, Xu L, et al. Clinical applications of circulating tumor DNA. J Hematol Oncol 2023; 16: 36.
[8] Escudero L, Lloreta J, Gaya JM, et al. Liquid biopsy in urothelial carcinoma. Cancers (Basel) 2021; 13: 1989.
[9] Ferro M, La Civita E, Musi G, et al. Circulating biomarkers in bladder cancer. J Pers Med 2021; 11: 237.
[10] Pascual J, Attard G, Bidard FC, et al. ctDNA‑guided management in solid tumors. Ann Oncol 2022; 33: 750–768.
[11] Zanger UM, Schwab M. Cytochrome P450 enzymes in drug metabolism. Pharmacol Ther 2013; 138: 103–141.
[12] Leow JJ, Chong KT, Chang SL, et al. Contemporary management of UTUC. Eur Urol 2021; 79: 635–654.
[13] Seisen T, Colin P, Rouprêt M. Risk‑adapted strategy for kidney‑sparing management of UTUC. Nat Rev Urol 2015; 12: 155–166.
[14] Coleman JA, Sfakianos JP, Galsky MD, et al. Neoadjuvant gemcitabine and cisplatin in UTUC. J Clin Oncol 2023; 41: 1618–1625.
[15] Sternberg CN, Bellmunt J, Sonpavde G, et al. Bladder cancer overview. Lancet 2020; 395: 1268–1277.
[16] Fajkovic H, Cha EK, Jeldres C, et al. Disease‑free survival as a surrogate endpoint in UTUC. World J Urol 2013; 31: 5–11.
[17] Birtle AJ, Chester JD, Jones RJ, et al. POUT trial. ASCO GU 2021; Abstract 455.
[18] Bellmunt J, Hussain M, Gschwend JE, et al. Adjuvant atezolizumab vs observation (IMvigor010). Lancet Oncol 2021; 22: 525–537.
[19] Bajorin DF, Witjes JA, Gschwend JE, et al. Adjuvant nivolumab vs placebo. N Engl J Med 2021; 384: 2102–2114.
[20] Margulis V, Shariat SF, Matin SF, et al. Outcomes of radical nephroureterectomy for UTUC. Cancer 2009; 115: 1224–1233.
[21] Subiela JD, Shariat SF, Favaretto RL, et al. Diagnostic accuracy of ureteroscopic biopsy in UTUC. Eur J Surg Oncol 2020; 46: 1989–1997.
[22] Tavora F, Fajardo DA, Lee TK, et al. Small endoscopic biopsies of the ureter and renal pelvis. Am J Surg Pathol 2009; 33: 1540–1546.
[23] Soukup V, Čapoun O, Cohen D, et al. Prognostic performance of WHO grading systems in NMIBC. Eur Urol 2017; 72: 801–813.
[24] Kaag MG, O’Malley RL, O’Malley P, et al. Changes in renal function following nephroureterectomy. Eur Urol 2010; 58: 581–587.
[25] Escobar D, Necchi A, Rouprêt M, et al. Diagnosis and management of UTUC. Cancers (Basel) 2025.
[26] Masson‑Lecomte A, Rouprêt M, Seisen T, et al. EAU Guidelines on UTUC – 2025 update. Eur Urol 2025; 87: 697–716.
[27] Birtle AJ, Chester JD, Jones RJ, et al. Final results of the POUT trial. J Clin Oncol 2024; 42: 1466–1471.
[28] EAU, NCCN, AUA. Guidelines on urothelial carcinoma. Dostupné z: https://uroweb.org/guidelines; https://www.nccn.org/guidelines/category_1; https://www.auanet.org/guidelines‑and‑quality/guidelines
[29] Apolo AB, Bajorin DF, Witjes JA, et al. Adjuvant pembrolizumab vs observation. N Engl J Med 2025; 392: 45–55.
[30] Powles T, Park SH, Voog E, et al. Avelumab maintenance therapy (JAVELIN Bladder 100). N Engl J Med 2020; 383: 1218–1230.
[31] Necchi A, Raggi D, Gallina A, et al. PURE‑02: Neoadjuvant pembrolizumab in UTUC. Urol Oncol 2022; 40: 10.e1–10.e8.
[32] Powles T, Rosenberg JE, Sonpavde GP, et al. Enfortumab vedotin and pembrolizumab in untreated advanced urothelial can cer. N Engl J Med 2024; 390: 875–888.
[33] Powles T, Rosenberg JE, Sonpavde GP, et al. Enfortumab vedotin after platinum and IO (EV‑301). N Engl J Med 2021; 384: 1125–1135.
[34] van der Heijden MS, Loriot Y, Necchi A, et al. EV‑302 subgroup analyses. J Clin Oncol 2024; 42(Suppl): LBA530.
[35] Bedke J, Powles T, Loriot Y, et al. EV‑302 long‑term analysis. J Clin Oncol 2025; 43(Suppl): 4571.
[36] Zuo W, Zhang Y, Liu Z, et al. Outcomes of metastatic UTUC. Clin Genitourin Cancer 2024; 22: 102192.
[37] Nally K, O’Donnell PH, Plimack ER, et al. UTUC representation in metastatic trials. Cancer Manag Res 2024; 16: 467–475.
[38] Deuker M, Stolzenbach F, Becker A, et al. Variant histology in urothelial carcinoma. Clin Genitourin Cancer 2021; 19: 117–124.
[39] Douglawi A, Necchi A, Sonpavde GP, et al. Impact of variant histology in advanced UC. Clin Genitourin Cancer 2023; 21: 563–568.