Osilodrostat
Úvod
Cushingův syndrom je vyvolán dlouhodobě zvýšenou hladinou kortizolu v těle. Tento stav je asociován s četnými komorbiditami a zvýšenou mortalitou. Bývá spojen s viscerální obezitou, hypertenzí, hyperlipidemií, diabetes mellitus, osteoporózou, myopatií, zvýšeným rizikem infekce a kardiovaskulárních komplikací. Mezi typické tělesné projevy patří nárůst tělesné hmotnosti s redistribucí tuku do oblasti obličeje, krku a břicha (měsícovitý obličej, býčí šíje, tukový prstenec) a s redukcí v podkoží, s křehkostí kůže, tvorbou strií a modřin a s úbytkem svalové hmoty na končetinách. Dochází k řídnutí kostí, hirsutismu, nepravidelné menstruaci a sexuální dysfunkci. Pacienti často trpí výkyvy nálad, úzkostmi a depresemi. Endogenní Cushingův syndrom je způsoben hyperkortizolismem v důsledku sekrece adrenokortikotropního hormonu (ACTH) z nádoru hypofýzy (Cushingova choroba, 80 %)[1], nezávisle na ACTH mohou zvýšené množství kortizolu produkovat rovněž nádory nadledvin (20 %) [1]. Sekundárně je Cushingův syndrom důsledkem dlouhodobého užívání kortikosteroidů.
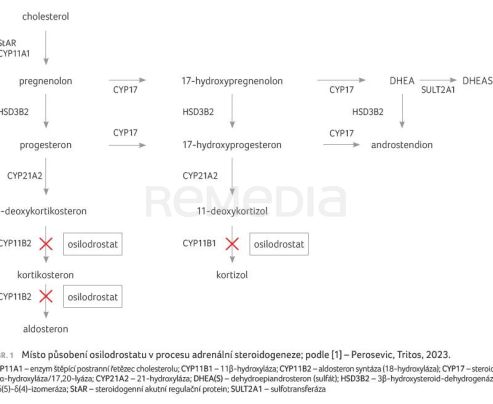 Cílem léčby je snížení produkce kortizolu. V případě endogenního Cushingova syndromu je léčbou první linie chirurgická resekce. I po odstranění nádoru ale může hyperkortizolismus přetrvávat nebo může dojít k recidivě. Data ukazují, že u 20–35 % pacientů v remisi dojde během 10–15 let k relapsu [2]. Pacienti s perzistující nebo rekurentní Cushingovou chorobou profitují z farmakologické léčby. Dostupná farmakoterapie cílí na tři oblasti: hypofýzu a inhibici sekrece ACTH z nádorových kortikotropních buněk, na nadledvinky s inhibicí syntézy kortizolu nebo na antagonizaci glukokortikoidního receptoru. Osilodrostat (LCI699), který byl původně vyvíjen ke snížení sérových koncentrací aldosteronu a ke kontrole hypertenze, patří mezi inhibitory steroidogeneze (obr. 1).
Cílem léčby je snížení produkce kortizolu. V případě endogenního Cushingova syndromu je léčbou první linie chirurgická resekce. I po odstranění nádoru ale může hyperkortizolismus přetrvávat nebo může dojít k recidivě. Data ukazují, že u 20–35 % pacientů v remisi dojde během 10–15 let k relapsu [2]. Pacienti s perzistující nebo rekurentní Cushingovou chorobou profitují z farmakologické léčby. Dostupná farmakoterapie cílí na tři oblasti: hypofýzu a inhibici sekrece ACTH z nádorových kortikotropních buněk, na nadledvinky s inhibicí syntézy kortizolu nebo na antagonizaci glukokortikoidního receptoru. Osilodrostat (LCI699), který byl původně vyvíjen ke snížení sérových koncentrací aldosteronu a ke kontrole hypertenze, patří mezi inhibitory steroidogeneze (obr. 1).
Osilodrostat je řazen do Farmakoterapeutické skupiny Antikortikosteroidy (ATC kód: H02CA02). Evropskou lékovou agenturou (EMA) byl ke klinickému používání schválen 9. ledna 2020 pro léčbu pacientů s Cushingovým syndromem, kteří nejsou kandidáty na chirurgickou léčbu nebo u nichž nebyla tato léčba úspěšná, a Úřadem pro kontrolu potravin a léčiv (FDA) 6. března 2020 pro tytéž pacienty v indikaci léčby Cushingovy choroby. Osilodrostat (Isturisa) je dostupný v potahovaných tabletách o síle 1, 5 a 10 mg.
Mechanismus účinku
Osilodrostat inhibuje syntézu kortizolu. Je silným inhibitorem 11β‑hydroxylázy (CYP11B1), enzymu, který katalyzuje poslední stupeň biosyntézy kortizolu v nadledvinách. Osilodrostat inhibuje dále 18‑hydroxylázu (CYP11B2), která vede k syntéze aldosteronu (obr. 1). Jak bylo zmíněno výše, pro tyto účinky ovlivňující mineralokortikoidní dráhu byl původně vyvíjen jako antihypertenzivum u pacientů s esenciální hypertenzí nebo s primárním aldosteronismem. Nicméně vzhledem k omezené účinnosti se zájem ve vývoji posunul právě k léčbě Cushingova syndromu [1].
Farmakokinetické vlastnosti
Farmakokinetika osilodrostatu byla charakterizována devíti studiemi fáze I (zdraví jedinci a jedinci s poruchou funkce jater nebo ledvin), dvěma studiemi fáze II (pacienti s Cushingovou chorobou nebo Cushingovým syndromem) a studií fáze III (pacienti s Cushingovou chorobou) [3].
Osilodrostat se po perorálním podání rychle a téměř kompletně vstřebává. Maximálních koncentrací je dosaženo zhruba za jednu hodinu, rovnovážného stavu do druhého dne. U pacientů asijského původu byla v porovnání s ostatními etniky zaznamenána zhruba o 20 % vyšší relativní biologická dostupnost. Podání společně s jídlem neovlivňuje absorpci v klinicky významném rozsahu [4].
Věk nebo pohlaví nemají u dospělých pacientů významný vliv na expozici osilodrostatu. Co se týče renálních funkcí, byla expozice osilodrostatu v kohortách členěných podle renálních funkcí (normální, těžké a konečné stadium renálního onemocnění) podobná, což naznačuje, že renální funkce nemá žádný vliv na expozici osilodrostatu. Oproti zdravým subjektům byl zaznamenán trend zvyšování plochy pod křivkou plazmatické koncentrace (čas od nuly do nekonečna) u subjektů se středně těžkou až těžkou poruchou funkce jater. Vazba na plazmatické bílkoviny je nízká.
Osilodrostat se intenzivně metabolizuje (asi 80 % vyloučeno ve formě metabolitů). Hlavním metabolitem v plazmě je LXB168, který není farmakologicky aktivní. Na metabolizaci se podílí více enzymů (CYP3A4, CYP2B6, CYP2D6, UDP glukuronosyltransferázy [UGT], non‑CYP a non‑UGT metabolismus). Žádný jednotlivý enzym nepřispívá k celkové clearance více než 25 %. Z tohoto důvodu jsou jeho lékové interakce (jako „victim“) méně pravděpodobné [3,4]. Osilodrostat je středně silným inhibitorem CYP1A2, slabým až středně silným inhibitorem CYP2C19 a slabým inhibitorem CYP2D6 a CYP3A4/5 (doloženo při jednorázovém podání).
Většina látek souvisejících s osilodrostatem je eliminována močí (~ 90,6 % podané dávky), pouze 5,2 % jako nezměněný osilodrostat. Eliminační poločas je asi 4 hodiny [3].
Indikace
Přípravek je indikován k léčbě endogenního Cushingova syndromu u dospělých pacientů [4].
Kontraindikace
Jedinou známou kontraindikací je hypersenzitivita na léčivou látku nebo na kteroukoliv pomocnou látku [4].
Dávkování
Léčba osilodrostatem je obvykle zahajována dávkou 2 mg podávanou 2× denně. U pacientů asijského původu je doporučeno zahajovat léčbu dávkou 1 mg 2× denně. Přípravek se podává bez ohledu na jídlo [4].
Podle odpovědi na léčbu se pak dávka osilodrostatu titruje s cílem dosáhnout normálních hodnot kortizolu. Hodnoty kortizolu (měřeno obvykle jako hodnota volného kortizolu v 24hodinovém sběru moči [24 hours urinary free cortisol, 24‑h UFC] nebo plazmatická koncentrace kortizolu) je žádoucí monitorovat v intervalu 1–2 týdnů a podle nich přizpůsobovat léčbu. Dle dosavadních zkušeností se obvyklá udržovací dávka pohybuje mezi 2–7 mg 2× denně. Maximální doporučená dávka osilodrostatu je 30 mg 2× denně.
K redukci dávky nebo i přerušení léčby se přistupuje při poklesu kortizolu pod normální hodnoty nebo při známkách hypokortizolismu (nauzea, zvracení, únava, bolest břicha, ztráta chuti k jídlu a závrať). Pacienti by na tyto příznaky měli být upozorněni.
U pediatrických pacientů nebylo použití přípravku zatím vyhodnoceno, aktuálně probíhá otevřená, nekontrolovaná studie LINC 5 fáze II v délce 48 týdnů. U nemocných starších 65 let jsou k dispozici pouze omezené údaje, nicméně žádné dostupné doklady nesvědčí pro nutnost úpravy dávkování. U pacientů s porušenou funkcí ledvin není potřeba upravovat dávkování, nicméně je doporučeno interpretovat hodnoty 24‑h UFC s opatrností s ohledem na alteraci vylučování. U pacientů s poruchou funkce jater se úpravy dávkování řídí závažností postižení. Při skóre Child–Pugh A není třeba dávku upravovat, při Child–Pugh B se léčba zahajuje redukovanou dávkou 1 mg 2× denně, při skóre Child–Pugh C dávkou 1 mg jednou denně podávanou večer s postupnou titrací na 1 mg 2× denně [4].
Klinické zkušenosti
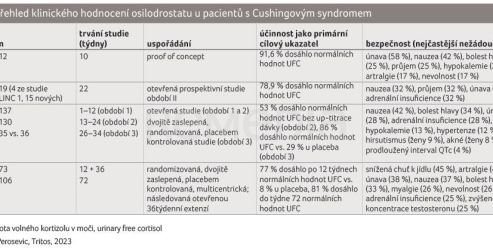 Klinické hodnocení programu LINC, který sledoval účinnost a bezpečnost osilodrostatu u pacientů s Cushingovým syndromem, shrnuje tabulka 1 [1]. Studie LINC 1–4 prezentovaly, že osilodrostat je účinný při normalizaci 24‑h UFC u většiny léčených pacientů a má příznivý bezpečnostní profil.
Klinické hodnocení programu LINC, který sledoval účinnost a bezpečnost osilodrostatu u pacientů s Cushingovým syndromem, shrnuje tabulka 1 [1]. Studie LINC 1–4 prezentovaly, že osilodrostat je účinný při normalizaci 24‑h UFC u většiny léčených pacientů a má příznivý bezpečnostní profil.
Studie LINC 3
LINC 3 (NCT02180217) byla prospektivní multicentrická otevřená studie fáze III [5]. Zařazeni byli pacienti ve věku 18–75 let s potvrzenou perzistující nebo recidivující Cushingovou chorobou s mUFC (průměrnou hodnotou volného kortizolu v moči získanou před zařazením ze tří 24hodinových sběrů moči) > 1,5násobek horní hranice normy (upper limit of normal, ULN) a ranní plazmatickou koncentrací ACTH nad spodní normální hranicí, kteří dříve podstoupili operaci hypofýzy nebo ozařování nebo byli nově diagnostikováni a odmítli operaci nebo nebyli kandidáty na chirurgický zákrok.
Studie byla rozdělena na čtyři období. Ve 12týdenním období 1 byla u všech účastníků studie zahájena léčba osilodrostatem, která byla na základě hodnoty mUFC a snášenlivosti upravována každé 2 týdny (1–30 mg 2× denně). V období 2 (týden 13–24) pacienti pokračovali v léčbě osilodrostatem v terapeutické dávce stanovené během období 1. V období 3, počínaje týdnem 26, byli účastníci s mUFC ≤ ULN v týdnu 24, bez up‑titrace po 12. týdnu, randomizováni v poměru 1 : 1 v dvojitě zaslepeném uspořádání k pokračující léčbě osilodrostatem nebo k podávání placeba po dobu 8 týdnů. Nezpůsobilí účastníci pokračovali v otevřeném podávání osilodrostatu. V období 4 (týden 35–48) byl všem účastníkům podáván v otevřeném uspořádání osilodrostat až do konce základní části studie. Primárním cílem bylo porovnat účinnost osilodrostatu oproti placebu na konci období 3. Primárním cílovým ukazatelem byl podíl účastníků, kteří byli randomizováni k aktivní léčbě nebo k placebu, s kompletní odpovědí (tj. mUFC ≤ ULN) na konci randomizovaného období vysazení (34. týden), bez up‑titrace během tohoto období. Klíčovým sekundárním cílovým ukazatelem byl podíl účastníků s kompletní odpovědí na konci jednoramenného otevřeného období (tj. období 2, týden 24) bez up‑titrace během 13.–24. týdne.
Do sledování bylo zařazeno 137 pacientů, střední věk činil 40,0 (31,0–49,0) let a 77 % (106) pacientů tvořily ženy. Celkem 72 (53 %) účastníků bylo způsobilých pro randomizaci během fáze vysazení (období 3), z nich 36 bylo přiřazeno k pokračování v léčbě osilodrostatem a 35 k placebu. Kompletní odpověď si v týdnu 34 udrželo při léčbě osilodrostatem 31 (86 %) pacientů oproti 10 (29 %) pacientům z placebové větve; poměr šancí (odds ratio, OR) 13,7 (95% interval spolehlivosti [confidence interval, CI] 3,7–53,4; p < 0,0001). V týdnu 24 si 72 (53 %; 95% CI 43,9–61,1) ze 137 pacientů udrželo kompletní odpověď bez up‑titrace po týdnu 12. Nejčastějšími nežádoucími účinky (výskyt u > 25 % účastníků) byly nevolnost (57 [42 %]), bolest hlavy (46 [34 %]), únava (39 [28 %]) a adrenální insuficience (38 [28 %]). Hypokortizolismus se vyskytl celkem u 70 (51 %) pacientů a nežádoucí účinky související s prekurzory hormonů nadledvin se vyskytly u 58 (42 %) pacientů. Osilodrostat podávaný dvakrát denně rychle snižoval mUFC a udržoval toto snížení spolu se zmírněním klinických příznaků hyperkortizolismu; byl obecně dobře snášen.
Ve studii LINC 3 byly hodnoceny také kardiometabolické parametry (krevní tlak, hmotnost, obvod pasu, index tělesné hmotnosti, celkový cholesterol, glykemie nalačno, glykovaný hemoglobin), fyzické projevy hyperkortizolismu (strie, distribuce tuku, podlitiny, hirsutismus u žen, svalová atrofie) a kvalita života. Spolu s poklesem mUFC došlo ke zmírnění klinických příznaků a dalších specifických projevů souvisejících s hyperkortizolismem.
Post hoc analýza studie LINC 3 [6] se zaměřila na změnu klinických příznaků hyperkortizolismu a kvality života podle stupně kontroly mUFC. Míra kontroly mUFC byl definována jako: kontrolovaná (mUFC ≤ ULN), částečně kontrolovaná (> ULN, ale ≥ 50% snížení oproti výchozí hodnotě) nebo nekontrolovaná (mUFC > ULN a < 50% snížení od počáteční hodnoty). Ve 24. a 48. týdnu byla mUFC kontrolována u 93 (67,9 %) a 91 (66,4 %) pacientů, částečně kontrolována u 20 (14,6 %) a 13 (9,5 %) pacientů a nekontrolovaná zůstala u 24 (17,5 %) a 33 (24,1 %) pacientů. Zlepšení kardiometabolických parametrů oproti výchozímu stavu v týdnu 24 bylo výraznější u pacientů s kontrolovanými nebo částečně kontrolovanými hodnotami mUFC oproti nekontrolovaným; v týdnu 48 došlo ke zlepšení bez ohledu na kontrolu UFC. Obecně se fyzické projevy a kvalita života progresivně zlepšily od výchozí hodnoty bez ohledu na kontrolu UFC.
Extenze studie LINC 3 si dala za cíl prozkoumat dlouhodobou účinnost a snášenlivost osilodrostatu [7]. Po 48 týdnech hlavní části studie mohli pacienti, kteří profitovali z léčby osilodrostatem ve 48. týdnu, vstoupit do prodloužení. To bylo ukončeno, když všichni pacienti dostávali ≥ 72 týdnů léčby nebo léčbu ukončili.
Medián expozice osilodrostatu od hlavní části studie do konce extenze byl 130 (1–245) týdnů a střední průměrná dávka osilodrostatu 7,4 (0,8–46,6) mg/den. Snížení mUFC dosažené během hlavní části studie bylo zachováno i během extenze a zůstalo na hodnotě ≤ ULN. Ze 106 pacientů, kteří vstoupili do prodloužení, jich mUFC ≤ ULN v 72. týdnu dosáhlo 86 (81 %). Zlepšení kardiometabolických parametrů, zmírnění fyzických projevů hyperkortizolismu a kvalita života dosažená v základní studii zůstaly během extenze také zachovány nebo dále zlepšeny. Nebyly hlášeny žádné nové bezpečnostní signály; léčbu z důvodu nežádoucích účinků přerušilo 15/137 (10,9 %) pacientů během hlavní části studie a 12/106 (11,3 %) pacientů v průběhu jejího prodloužení. Údaje z této velké multicentrické studie ukazují, že dlouhodobá léčba osilodrostatem udržuje normalizované hodnoty kortizolu spolu s klinickými přínosy u většiny pacientů s Cushingovou chorobou a je dobře tolerována.
Studie LINC 4
LINC 4 (NCT02697734) byla multicentrická studie fáze III zahrnující počáteční 12týdenní randomizovanou (v poměru 2 : 1), dvojitě zaslepenou, placebem kontrolovanou fázi s následným 36týdenním obdobím otevřené léčby [8]. Zařazeni byli dospělí pacienti (ve věku 18–75 let) s diagnózou Cushingovy choroby s mUFC ≥ 1,3násobek ULN. Primárním cílovým ukazatelem byl podíl pacientů s mUFC ≤ ULN v týdnu 12. Klíčovým sekundárním cílovým ukazatelem byl podíl dosažení mUFC ≤ ULN ve 36. týdnu (po 24 týdnech otevřené léčby osilodrostatem).
Hodnocení se účastnilo 73 pacientů (osilodrostat n = 48, placebo n = 25). Průměrný věk činil 39 (19–67) let, průměrná hodnota mUFC na počátku sledování 3,1 × ULN, medián 2,5 × ULN. Sledovaného parametru, mUFC ≤ ULN, dosáhlo ve 12. týdnu významně více pacientů s osilodrostatem (77 %) než s placebem (8 %); OR 43,4 (95% CI 7,1–343,2; p < 0,0001). Odpověď byla zachována i ve 36. týdnu, kdy mUFC ≤ ULN dosáhlo 81 % (95% CI 69,9–89,1) všech pacientů. Nejčastějšími nežádoucími účinky hlášenými během období kontrolovaného placebem (osilodrostat vs. placebo) byly: snížená chuť k jídlu (37,5 % vs. 16,0 %), artralgie (35,4 % vs. 8,0 %) a nauzea (31,3 % vs. 12,0 %). I v tomto klinickém hodnocení osilodrostat rychle normalizoval mUFC u většiny pacientů s Cushingovou chorobou a udržel tento účinek po celou dobu sledování. Bezpečnostní profil byl příznivý.
Speciální populace
Podávání osilodrostatu bylo rovněž sledováno u pacientů s paraneoplastickým/ektopickým Cushingovým syndromem, kde se ukázal jako rychlá a účinná léčba [9,10]. Tento vzácný syndrom je vyvolán extrapituitární sekrecí ACTH neuroendokrinním nádorem plic nebo jinými malignitami, jako jsou nádory ledvinových buněk, prsu nebo vaječníků. Může způsobit těžký, život ohrožující hyperkortizolismus, a vyžaduje proto rychlou a účinnou intervenci.
Nežádoucí účinky
Nejčastějšími hlášenými nežádoucími účinky při léčbě osilodrostatem byly adrenální insuficience, únava, nauzea, bolest hlavy, zvracení a edém. Nejzávažnějším nežádoucím účinkem je adrenální insuficience. Symptomatičtí pacienti mají být sledováni pro možný výskyt hypotenze, hyponatremie, hyperkalemie a/nebo hypoglykemie. Pokud existuje podezření na hypokortizolismus, je nutné změřit hodnoty kortizolu a zvážit dočasné snížení dávky nebo přerušení léčby osilodrostatem. V případě potřeby pak zahájit substituční léčbu kortikosteroidy.
Inhibice CYP11B1 osilodrostatem vede k akumulaci prekurzorů adrenálních steroidů a ke zvýšení koncentrace testosteronu. Nárůst hladiny testosteronu se může projevit vznikem mírné až středně závažné formy hirsutismu nebo akné. Po přerušení léčby se stav normalizuje [11].
Dalším nežádoucím účinkem pozorovaným během podávání osilodrostatu je prodloužení intervalu QT, které je závislé na dávce [4].
Bezpečnostní profil osilodrostatu je považován za příznivý, lék je dobře tolerován. Je však nutné pečlivé monitorování léčby, aby se zabránilo hypoadrenalismu a u pacientů se známým prodloužením intervalu QT jeho dalšímu prodloužení [1]. Neexistuje korelace mezi mírou hyperkortizolismu v předléčebném období a dávkou potřebnou k dosažení kontroly onemocnění [11]. Před zahájením léčby přípravkem Isturisa má být provedeno EKG vyšetření, další do jednoho týdne od začátku léčby, a dále dle klinické potřeby. V průběhu léčby mají být pravidelně sledovány hodnoty elektrolytů. Případné hypokalemie, hypokalcemie nebo hypomagnezemie by měly být vyřešeny před zahájením léčby.
Fertilita, těhotenství a kojení
Informace o vlivu osilodrostatu na lidskou fertilitu nejsou dostupné. Preklinické údaje ale ukazují, že osilodrostat může poškodit plod. Před zahájením léčby se proto doporučuje provést u fertilních žen těhotenský test. Během léčby (a ještě alespoň 1 týden po jejím ukončení) by ženy ve fertilním věku měly používat účinnou antikoncepci. Z hormonálních kontraceptiv je kombinace ethinylestradiolu a levonorgestrelu z hlediska možných lékových interakcí považována za bezpečnou. Není známo, zda se osilodrostat nebo jeho metabolity vylučují do lidského mateřského mléka, proto je doporučeno kojení během léčby a alespoň jeden týden po jejím ukončení přerušit [4].
Interakce
Osilodrostat prodlužuje v závislosti na dávce interval QT. Při současném podávání s jinými léčivými přípravky ovlivňujícími interval QT může dojít k dalšímu prodloužení intervalu QT a k poruchám srdečního rytmu. Je doporučeno léčbu pečlivě monitorovat a souběžnému podávání s dalšími léčivy prodlužujícími interval QT se vyhnout. Při přechodu z léčby pasireotidem a ketokonazolem je z tohoto důvodu doporučena tzv. wash out perioda.
Potenciál farmakokinetických lékových interakcí osilodrostatu je nízký. Osilodrostat je na základě klinického hodnocení považován za slabý inhibitor CYP2D6 a CYP3A4/5, slabý až střední inhibitor CYP2C19 a střední inhibitor CYP1A2. Opatrnosti je proto třeba při současném podávání léčiv s úzkým terapeutickým indexem, která jsou citlivými enzymovými substráty [4].
Tento článek vyšel v časopise Remedia 1/2025
Literatura
[1] Perosevic M, Tritos NA. Clinical Utilit of Osilodrostat in Cushingʼs Disease: Review of Currently Available Literature. Drug Des Devel Ther 2023; 17: 1303–1312.
[2] Langlois F, Chu J, Fleseriu M. Pituitary‑directed therapies for Cushing’s disease. Front Endocrinol 2018; 9: 164.
[3] Han K, Tauchmanova L, Atkinson S, et al. Pharmacokinetics of osilodrostat following single and multiple doses of osilodrostat in healthy subjects and patients with Cushing’s disease. Endocrine Abstracts 2019; 63: doi 10.1530/endoabs.63.GP162.
[4] SPC Isturisa. Dostupné na: https://www.ema.europa.eu
[5] Pivonello R, Fleseriu M, Newell‑Price J, et al. Efficacy and safety of osilodrostat in patients with Cushingʼs disease (LINC 3): a multicentre phase III study with a double‑blind, randomised withdrawal phase. Lancet Diabetes Endocrinol 2020; 8: 748–761.
[6] Pivonello R, Fleseriu M, Newell‑Price J, et al. Improvement in clinical features of hypercortisolism during osilodrostat treatment: findings from the Phase III LINC 3 trial in Cushingʼs disease. J Endocrinol Invest 2024; 47: 2437–2448.
[7] Fleseriu M, Newell‑Price J, Pivonello R, et al. Long‑term outcomes of osilodrostat in Cushing’s disease: LINC 3 study extension. Eur J Endocrinol 2022; 187: 531–541.
[8] Gadelha M, Bex M, Feelders RA, et al. Randomized Trial of Osilodrostat for the Treatment of Cushing Disease. J Clin Endocrinol Metab 2022; 107: e2882–e2895.
[9] Bessiene L, Bonnet F, Tenenbaum F, et al. Rapid control of severe ectopic Cushingʼs syndrome by oral osilodrostat monotherapy. Eur J Endocrinol 2021; 184: L13–L15.
[10] Dormoy A, Haissaguerre M, Vitellius G, et al. Efficacy and Safety of Osilodrostat in Paraneoplastic Cushing Syndrome: A Real‑World Multicenter Study in France. J Clin Endocrinol Metab 2023; 108: 1475–1487.
[11] Antonini S. Brunetti A, Zampetti B, et al. Osilodrostat in Cushing’s disease: the management of its efficacy and the pitfalls of post‑surgical results. Endocrinol Diabetes Metab Case Rep 2022; 2022: 22–0311.