Duální inhibice prozánětlivých cytokinů přináší novou naději v léčbě hidradenitis suppurativa
Hidradenitis suppurativa (HS) je chronické zánětlivé onemocnění kůže, které je doprovázeno výraznými bolestmi a fyzickými omezeními. Léčba časných forem HS zahrnuje především konzervativní metody, včetně topických a systémových antibiotik. U těžších forem onemocnění se kromě antibiotik uplatňuje biologická léčba a chirurgické zákroky. Schválenou biologickou léčbu představují adalimumab a secukinumab. Účinnost a bezpečnost bimekizumabu v terapii HS hodnotilo několik klinických studií. Interleukiny (IL) 17A a 17F hrají klíčovou roli v zánětlivých procesech HS. Dvojitá inhibice IL‑17A a IL‑17F bimekizumabem proto poskytuje potenciál pro efektivnější kontrolu zánětu u HS a lék vykazuje příznivý bezpečnostní profil.
Hidradenitis suppurativa, také známá jako acne inversa, je chronické zánětlivé onemocnění kůže, které je doprovázeno výraznými bolestmi a fyzickými omezeními [1,2]. Odhaduje se, že HS postihuje přibližně 1–2 % světové populace, přičemž odhady se pohybují mezi 0,05–4,1 % v závislosti na metodách sběru dat, etnickém složení a geografické poloze [3]. Hidradenitis suppurativa je charakterizována přetrvávajícími bolestivými kožními noduly, abscesy a drénujícími píštělemi, které nejčastěji postihují axilární, anogenitální, inguinální a perianální oblasti. Chronický nekontrolovaný zánět vede k nezvratnému poškození tkáně a jizvení.
Patogeneze a klinický obraz hidradenitis suppurativa
Patogeneze HS zahrnuje komplexní dysregulaci imunitního systému, genetickou predispozici a environmentální faktory. Hlavní patogenetické mechanismy zahrnují folikulární okluzi, bakteriální infekci a následnou chronickou zánětlivou odpověď. Cytokiny jako tumor nekrotizující faktor alfa (TNFα), IL-17 a IL‑23 hrají klíčovou roli v zánětlivých procesech a tvorbě hnisavých ložisek a mikrobiální dysbióza přispívá k chronickému zánětu [4].
Imunitní dysregulace vede k nadprodukci prozánětlivých cytokinů, jako jsou IL‑1β, IL‑17, IL‑23 a TNFα. Tyto cytokiny stimulují zánětlivé buňky (neutrofily, makrofágy), což vede k zánětlivým lézím a tvorbě abscesů [4].
Formy onemocnění
 V roce 1989 byla dle závažnosti klinického obrazu stanovena dosud platná Hurleyho klasifikace, kde jsou pacienti rozděleni do tří základních stupňů (tab. 1): Hurley I (45,5–68 % pacientů), Hurley II (28–41,5 % pacientů) a Hurley III (4–13,0 % pacientů) [5–7].
V roce 1989 byla dle závažnosti klinického obrazu stanovena dosud platná Hurleyho klasifikace, kde jsou pacienti rozděleni do tří základních stupňů (tab. 1): Hurley I (45,5–68 % pacientů), Hurley II (28–41,5 % pacientů) a Hurley III (4–13,0 % pacientů) [5–7].
Léčba časných forem hidradenitis suppurativa
Léčba časných forem HS (Hurleyho stupeň I a II) zahrnuje hlavně konzervativní metody, včetně topických a systémových antibiotik, které pomáhají kontrolovat infekci a zánět. Běžně používaná topická antibiotika zahrnují klindamycin a tetracykliny. Systémová antibiotika, jako jsou doxycyklin, minocyklin, klindamycin a rifampicin, se často používají ve formě dlouhodobého a opakovaného podávání [8].
Konzervativní přístupy také zahrnují intralezionální injekce kortikosteroidů ke zmírnění zánětu a bolesti. Při mírných formách HS může být účinná rovněž lokální aplikace antiseptických roztoků, např. s chlorhexidinem [8].
Terapie off‑label, chirurgické zákroky, antibiotika
Kromě schválených biologických léků se v léčbě HS často využívají také off‑label přístupy. Patří sem imunomodulační léky jako infliximab, etanercept a ustekinumab, které jsou schváleny pro jiná zánětlivá onemocnění, ale prokázaly účinnost i při HS. Používání těchto léků je však limitováno kvůli nedostatku robustních důkazů a potenciálním nežádoucím účinkům [8].
Jiné inhibitory IL‑17 – ixekizumab a brodalumab – jsou také zkoumány v léčbě HS, přičemž ukazují slibné výsledky ve zmírňování zánětu a redukci lézí. Inhibitory Janus kináz (JAK), např. tofacitinib a baricitinib, představují další potenciální léky, které se zaměřují na jiné dráhy imunitní odpovědi [8].
Chirurgické zákroky jsou často nezbytné pro pacienty s pokročilou formou HS, kde konzervativní léčebné přístupy selhávají. Mezi nejčastější chirurgické zákroky patří incize a drenáž abscesů, deroofing, ablace CO2 laserem a široká excize postižených oblastí. Přestože tyto postupy mohou přinést úlevu, často dochází k recidivě onemocnění s nutností dalšího chirurgického zákroku [3,8].
Antibiotika jsou základním kamenem léčby HS, zejména v kombinaci s jinými léky. Pomáhají redukovat bakteriální nálož a zánět, ale jejich dlouhodobé užívání může vést k rezistenci a výskytu nežádoucích účinků [1,2,8].
Průkopnické studie v biologické léčbě hidradenitis suppurativa
První schválenou biologickou léčbou pro HS byl adalimumab, inhibitor TNFα. Studie PIONEER I a PIONEER II byly zásadní pro schválení tohoto léku [9]. V uvedených studiích bylo prokázáno, že adalimumab významně snižuje počet zánětlivých lézí a zlepšuje kvalitu života pacientů se středně těžkou až těžkou HS. Ve studii PIONEER I dosáhlo klinické odpovědi dle HiSCR (Hidradenitis Suppurativa Clinical Response) 41,8 % pacientů léčených adalimumabem ve srovnání s 26 % ve skupině s placebem. Ve studii PIONEER II dosáhlo HiSCR 58,9 % pacientů léčených adalimumabem ve srovnání s 27,6 % ve skupině s placebem [9].
Následovaly studie SUNSHINE a SUNRISE se secukinumabem – inhibitorem IL‑17A [10]. Ve studii SUNSHINE dosáhlo HiSCR v týdnu 16 přibližně 45 % pacientů léčených secukinumabem každé dva týdny a 42 % pacientů léčených každé čtyři týdny ve srovnání s 34 % pacientů v placebové skupině. Ve studii SUNRISE dosáhlo HiSCR 42 % pacientů léčených secukinumabem každé dva týdny a 46 % každé čtyři týdny ve srovnání s 31 % pacientů v placebové skupině [10].
Bimekizumab – dvojitá inhibice IL‑17A a IL‑17F
Bimekizumab je monoklonální protilátka, která selektivně inhibuje IL‑17A i IL‑17F. Interleukiny 17A a 17F jsou cytokiny, které hrají klíčovou roli v zánětlivých procesech HS. Dvojitá inhibice bimekizumabu poskytuje potenciál pro efektivnější kontrolu zánětu ve srovnání s inhibitory, které blokují pouze IL‑17A [11].
Studie fáze II – účinnost a bezpečnost bimekizumabu
Studie fáze II, jejíž výsledky byly publikovány v časopise JAMA Dermatology, se zabývala hodnocením účinnosti a bezpečnosti bimekizumabu u pacientů se středně těžkou až těžkou HS. Studie byla dvojitě zaslepená, placebem kontrolovaná a probíhala od září 2017 do února 2019. Zúčastnilo se jí 90 pacientů, kteří byli náhodně rozděleni do skupin s bimekizumabem (640 mg v týdnu 0, 320 mg každé dva týdny), s placebem nebo s adalimumabem (160 mg v týdnu 0, 80 mg v týdnu 2 a 40 mg každý týden od týdne 4 do týdne 10). Pacienti měli HS s diagnózou minimálně 12 měsíců před začátkem studie, s Hurleyho stupněm II nebo III a celkovým počtem abscesů a zánětlivých nodulů alespoň 3 [12].
Primárním cílovým ukazatelem bylo dosažení HiSCR v týdnu 12, definované jako snížení počtu abscesů a zánětlivých nodulů o 50 % nebo více bez nárůstu počtu abscesů nebo drénujících píštělí. Výsledky ukázaly, že 57,3 % pacientů léčených bimekizumabem dosáhlo HiSCR ve srovnání s 26,1 % pacientů v placebové skupině. Bimekizumab také prokázal výraznější klinická zlepšení ve srovnání s placebem, přičemž 46 % pacientů dosáhlo HiSCR 75 (75% zlepšení dle HiSCR) a 32 % dosáhlo HiSCR 90 (90% zlepšení dle HiSCR), zatímco v placebové skupině byly tyto hodnoty 10 % a 0 % [12].
Studie BE HEARD I a BE HEARD II
Cílem studií BE HEARD I a II bylo vyhodnotit účinnost a bezpečnost bimekizumabu u pacientů se středně těžkou až těžkou formou HS. Tyto studie byly multicentrické, randomizované, dvojitě zaslepené a kontrolované placebem, trvaly 48 týdnů a zúčastnilo se jich celkem 1 014 pacientů [13].
Uspořádání studií a dávkování
Pacienti byli náhodně přiřazeni do skupin, které dostávaly bimekizumab buď každé dva týdny, nebo každé čtyři týdny, nebo placebo do 16. týdne následované bimekizumabem každé dva týdny. Primárním cílovým ukazatelem byla odpověď HiSCR 50 definovaná jako snížení počtu abscesů a zánětlivých nodulů alespoň o 50 % bez nárůstu počtu abscesů nebo drénujících píštělí.
Studie BE HEARD I a BE HEARD II rovněž hodnotily sekundární a explorativní cílové ukazatele, které zahrnovaly zlepšení kvality života, zmírnění bolesti, redukci počtu drénujících píštělí a celkové zmírnění závažnosti onemocnění podle skórovacích systémů International Hidradenitis Suppurativa Severity Score (IHS4) a Dermatology Life Quality Index (DLQI) [13].
Výsledky
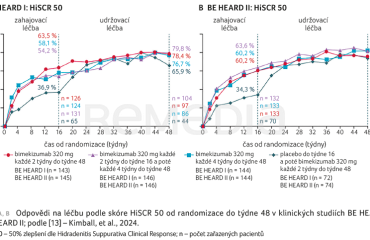 Primárního cílového ukazatele bylo dosaženo, přičemž bimekizumab prokázal významně vyšší odpověď HiSCR 50 ve srovnání s placebem. Ve studii BE HEARD I dosáhlo HiSCR 50 celkem 54,2 % pacientů léčených bimekizumabem podávaným každé dva týdny ve srovnání s 36,9 % pacientů v placebové skupině. Ve studii BE HEARD II byly tyto hodnoty 64,6 % vs. 34,3 % (graf 1A, B) [13].
Primárního cílového ukazatele bylo dosaženo, přičemž bimekizumab prokázal významně vyšší odpověď HiSCR 50 ve srovnání s placebem. Ve studii BE HEARD I dosáhlo HiSCR 50 celkem 54,2 % pacientů léčených bimekizumabem podávaným každé dva týdny ve srovnání s 36,9 % pacientů v placebové skupině. Ve studii BE HEARD II byly tyto hodnoty 64,6 % vs. 34,3 % (graf 1A, B) [13].
Sekundární cílové ukazatele zahrnovaly zlepšení kvality života podle DLQI, zmírnění bolesti měřené pomocí Numeric Rating Scale (NRS) a redukci počtu drénujících píštělí. Ve studii BE HEARD I bylo průměrné zlepšení v DLQI skóre 10 bodů u pacientů léčených bimekizumabem každé dva týdny, zatímco v placebové skupině to byly jen 4 body. Ve studii BE HEARD II bylo zlepšení DLQI skóre 11 bodů v léčené skupině ve srovnání s 5 body v placebové skupině [13].
Pacienti léčení bimekizumabem dosáhli významného zmírnění bolesti. Ve studii BE HEARD I byla zaznamenána redukce bolesti na NRS o 3,5 bodu v léčené skupině ve srovnání s 1,8 bodu v placebové skupině. Ve studii BE HEARD II bylo toto snížení 4,0 bodu při léčbě bimekizumabem ve srovnání s 2,1 bodu u placeba [13].
Redukce počtu drénujících píštělí byla dalším významným ukazatelem účinnosti bimekizumabu. Ve studii BE HEARD I se počet drénujících píštělí snížil v léčené skupině o 45 % ve srovnání se snížením o 18 % v placebové skupině. Ve studii BE HEARD II představovala tato redukce při léčbě bimekizumabem 48 % ve srovnání s 20 % u placeba [13].
Bezpečnost a snášenlivost
Bimekizumab byl obecně dobře tolerován. Nejčastějšími nežádoucími účinky byly kvasinkové infekce (např. orální kandidóza) a bolesti hlavy. Kvasinkové infekce se vyskytly u 10 % pacientů léčených bimekizumabem ve studii BE HEARD I a u 12 % ve studii BE HEARD II oproti 1 % a 2 % pacientů v placebových skupinách [13]. Jeden případ úmrtí ve studii BE HEARD I byl považován za nesouvisející s léčbou bimekizumabem [13].
Přínos a budoucnost léčby hidradenitis suppurativa
Bimekizumab představuje nový přístup v léčbě HS s dvojitou inhibicí IL‑17A a IL‑17F, čímž nabízí zlepšenou kontrolu zánětlivých procesů. Výsledky studií BE HEARD I a II podporují použití bimekizumabu jako účinného a bezpečného terapeutického nástroje pro pacienty se středně těžkou až těžkou formou HS. Tento klinický výzkum přispívá k rozšíření terapeutických možností a přináší naděje pro lepší kvalitu života pacientů s HS [13].
Budoucí klinické výzkumy by měly zahrnovat studie zaměřené na optimalizaci farmakologických, chirurgických a adjuvantních terapií, aby bylo dosaženo cílů léčby, které jsou pro pacienty nejdůležitější. Real‑world studie a metaanalýzy mohou také pomoci při budoucích rozhodováních kliniků při léčbě středně těžké až těžké formy HS [13].
Závěr
Bimekizumab rozšiřuje léčebné portfolio hidradenitis suppurativa a ukazuje významné klinické přínosy. Tento lék má potenciál stát se důležitým nástrojem v léčbě tohoto zničujícího onemocnění a přinášet úlevu pacientům, kteří dosud neměli dostatečné terapeutické možnosti.
Literatura
[1] Ocker L, Rached NA, Seifert C, et al. Current Medical and Surgical Treatment of Hidradenitis Suppurativa – A comprehensive review. J Clin Med 2022; 11: 7240.
[2] Nowak‑Liduk A, Kitala D, Ochała‑Gierek G, et al. Hidradenitis Suppurativa: an Interdisciplinary problem in Dermatology, Gynecology, and Surgery – Pathogenesis, Comorbidities, and Current Treatments. Life (Basel) 2023; 13: 1895.
[3] Alotaibi HM. Incidence, Risk Factors, and Prognosis of Hidradenitis Suppurativa Across the Globe: Insights from the Literature. Clin Cosmet Investig Dermatol 2023; 16: 545–552.
[4] Krueger JG, Frew J, Jemec GBE, et al. Hidradenitis suppurativa: new insights into disease mechanisms and an evolving treatment landscape. Br J Dermatol 2024; 190: 149–162.
[5] Langerová E. Hidradenitis suppurativa/acne inversa – diagnostika a léčba. Dermatol praxi 2019; 13: 168–173.
[6] Zouboulis CC, Desai N, Emstestam L, et al. European S1 guideline for the treatment of hidradenitis suppurativa/acne inversa. J Eur Acad Dermatol Venereol 2015; 29: 619–644.
[7] Vanlaerhoven AMJD, Ardon CB, van Straalen KR, et al. Hurley III Hidradenitis Suppurativa Has an Aggressive Disease Course. Dermatology 2018; 234: 232–233.
[8] Zouboulis CC, Bechara FG, Fritz K, et al. S2K guideline for the treatment of hidradenitis suppurativa / acne inversa – Short version. J Dtsch Dermatol Ges 2024; 22: 868–889.
[9] Kimball AB, Okun MM, Williams DA, et al. Two phase 3 trials of adalimumab for hidradenitis suppurativa. N Engl J Med 2016; 375: 422–434.
[10] Kimball AB, Jemec GBE, Alavi A, et al. Secukinumab in moderate‑to‑severe hidradenitis suppurativa: week 16 and week 52 results of two identical, multicentre, randomised, placebo‑controlled, double blind phase III trials. Lancet 2023; 401: 747–761.
[11] Adams R, Maroof A, Baker T, et al. Bimekizumab: A novel Humanised IgG1 antibody that neutralizes both IL17‑A and IL17‑F. Front Immunol 2020; 11: 894.
[12] Glatt S, Jemec GBE, Forman S, et al. Efficacy and Safety of Bimekizumab in Moderate to Severe Hidradenitis Suppurativa: A Phase 2, Double‑blind, Placebo‑Controlled Randomized Clinical Trial. JAMA Dermatol 2021; 157: 1279–1288.
[13] Kimball AB, Jemec GBE, Sayed CJ, et al. Efficacy and safety of bimekizumab in patients with moderate ‑to‑severe hidradenitis suppurativa (BE HEARD I and BE HEARD II): two 48‑week, randomised, double‑blind, placebo‑controlled, multicentre phase 3 trials. Lancet 2024; 403: P2504–2519.