Kombinované vakcíny proti záškrtu, tetanu a pertusi
Souhrn
Fabiánová K. Kombinované vakcíny proti záškrtu, tetanu a pertusi. Remedia 2024; 34: 322–326.
Záškrt (difterie, D), tetanus (T) a černý kašel (pertuse, P) jsou závažná infekční onemocnění, která ohrožují jak děti, tak dospělé a mohou mít fatální následky. Vakcíny proti těmto třem nákazám, tzv. DTP vakcíny, patří mezi nejstarší kombinované očkovací látky a jejich plošné používání významně snížilo nemocnost a úmrtnost na tyto stále obávané infekce.
Klíčová slova: záškrt – tetanus – černý kašel – DTP očkovací látky.
Summary
Fabianova K. Combined vaccines against diphtheria, tetanus and pertussis. Remedia 2024; 34: 322–326.
Diphtheria (diphtheria, D), tetanus (T) and whooping cough (pertussis, P) are serious infectious diseases that threaten both children and adults and can have fatal consequences. Vaccines against these three infections, the so‑called DTP vaccines, are among the oldest combined vaccines, and their widespread use has significantly reduced morbidity and mortality from these still dreaded infections.
Key words: diphtheria – tetanus – whooping cough – DTP vaccine.
Úvod
První kombinovaná vakcína, a to proti záškrtu (difterii, D), tetanu (T) a černému kašli (pertusi, P), byla do očkování zavedena již v roce 1948 [1]. Sloučení očkovacích látek proti záškrtu, tetanu a černému kašli do jedné očkovací látky (DTP) významně přispělo ke snížení nemocnosti a úmrtnosti na tato onemocnění a zásadně ovlivnilo prevenci v dětské populaci. Důležitým krokem bylo v 90. letech 20. století nahrazení celobuněčné složky vakcíny proti pertusi (wP) méně reaktogenní, acelulární složkou (aP). To následně umožnilo kombinaci DTaP vakcíny s dalšími očkovacími látkami, jako jsou inaktivovaná vakcína proti dětské obrně (inactivated poliovirus vaccine, IPV), vakcína proti Haemophilus influenzae (Hib) a vakcína proti hepatitidě B (HepB), a otevřelo cestu dalším kombinovaným vakcínám.
Záškrt
Záškrt (řecky „difthera“ = vyčiněná kůže, blána) je velmi závažné, akutní horečnaté infekční onemocnění vyvolané korynebakteriemi, které produkují toxin, nejčastěji Corynebacterium diphtheriae, méně často pak Corynebacterium ulcerans a vzácně Corynebacterium pseudotuberculosis vyskytující se primárně u zvířat. Historicky patřil záškrt mezi hlavní příčiny dětské nemocnosti a úmrtnosti. Používání antidifterického toxinu/toxoidu, posléze léčba antibiotiky a povinné očkování dětí významně snížily fatální následky této závažné infekce.
Bakterie záškrtu objevili a popsali němečtí bakteriologové Edwin Klebs a Friedrich Löffler. V roce 1888 Émile Roux a Alexandre Yersin jako první prokázali, že bakterie způsobující záškrt uvolňují smrtící toxin. V roce 1923 Gaston Ramon inaktivoval toxin formalínem a teplem a od roku 1924 se tento „anatoxin“ (toxoid) začal používat k aktivní imunizaci proti záškrtu osob všech věkových kategorií.
Difterický anatoxin je dnes součástí monovakcín proti záškrtu nebo je obsažen v kombinovaných vakcínách; buď společně s tetanickým toxoidem (DT nebo TD), nebo v kombinaci s DTwP či DTaP. V kombinovaných vakcínách mohou být obsaženy ještě IPV, vakcína proti invazivnímu Hib a/nebo vakcína při hepatitidě B.
Prevencí záškrtu je jednoznačně očkování. Vakcinace vedla na celém světě k významnému poklesu výskytu onemocnění, nicméně v některých státech světa se záškrt stále vyskytuje, a to i endemicky. Očkování poskytuje dlouhodobou, ale ne celoživotní ochranu a při absenci přirozeného boostrování imunita po základním očkování slábne a jedinec se postupně stává vnímavým vůči infekci [2–4].
Podle Světové zdravotnické organizace (WHO) má být základní očkování vakcínou proti záškrtu, tetanu a pertusi (s DTwP, nebo DTaP) třídávkové; 94–100 % dětí by mělo mít ochranné hladiny protilátek proti difterickému toxinu vyšší než 0,01 IU (mezinárodních jednotek)/ml a jsou tak považovány za plně chráněné. WHO doporučuje, aby pro očkování dětí ve věku do šesti let byla používána vakcína s vysokým obsahem difterického toxoidu, tedy ne méně než 30 IU na dávku (D). Vakcíny s nižším obsahem difterického toxoidu (d), 2 IU, jsou licencovány pro děti od tří, případně pěti let, pro dospívající a dospělou populaci. Snížení dávky difterického toxoidu minimalizuje reakci v místě vpichu, ale množství toxoidu je stále dostatečné pro vyvolání protilátkové odpovědi u starší populace.
Pro dostatečnou ochranu proti případné infekci jsou po základním očkování nezbytné další tři posilovací dávky, v ideálním případě podávané během druhého roku života, ve školním věku a během dospívání. Aby nedocházelo v populaci k epidemiím záškrtu, musí kolektivní imunita navozená očkováním dosahovat více než 85 % [5].
V bývalém Československu se proti záškrtu začaly děti plošně povinně očkovat od roku 1946 (zákon č. 189/1946 Sb.). Od roku 1958 bylo v ČR zahájeno očkování celkem pěti dávkami kombinované vakcíny československé výroby proti záškrtu, tetanu a pertusi (Alditepera) a stalo se součástí pravidelného očkování dětí. Od roku 2007 se pro základní očkování dětské populace používá kombinovaná vakcína proti šesti infekcím. Aktuálně v ČR není samostatná vakcína proti záškrtu registrována.
V kombinovaných očkovacích látkách používaných v ČR pro děti v rámci základního očkování obsahuje jedna dávka (0,5 ml) vakcíny ne méně než 20 IU (Hexacima) nebo 30 IU (Infanrix Hexa) difterického anatoxinu adsorbovaného na hydratovaný hydroxid hlinitý (Al(OH)3). Státní ústav pro kontrolu léčiv (SÚKL) uvádí ještě další registrované vakcíny, hexavakcínu Vaxelis a vakcínu Tetraxim [6]. Vakcína Vaxelis (DTaP‑HB‑IPV‑Hib) je indikována k základnímu očkování a přeočkování kojenců a batolat starších šesti týdnů proti difterii, tetanu, pertusi, hepatitidě B, poliomyelitidě a invazivním onemocněním způsobeným Hib. Vakcína Tetraxim je indikována k základnímu očkování a přeočkování kojenců a dětí ve věku od dvou měsíců proti difterii, tetanu, pertusi a poliomyelitidě (DTaP‑IPV).
K dispozici jsou dále vakcíny se sníženým množstvím antigenů, které jsou určeny k očkování starších dětí, dospívajících a dospělých; vakcíny Adacel a Adacel Polio, Boostrix a Boostrix Polio obsahují minimálně 2 IU difterického anatoxinu (tab. 1) [6].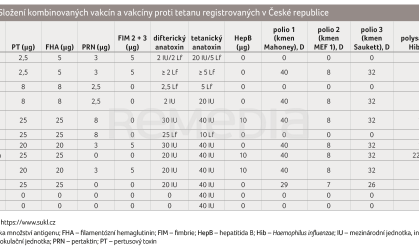
V dospělosti je přeočkování proti záškrtu v některých zemích doporučováno každých 10–15 let, ať již v kombinaci s tetanickým toxoidem, případně s aP složkou, nebo, spíše výjimečně, s vakcínou proti poliomyelitidě. Například v Rakousku doporučují dospělým ve věku do 65 let očkování kombinovanou vakcínou proti difterii, tetanu, pertusi a poliomyelitidě (DTaP‑IPV) každých 10 let [7].
Očkování proti záškrtu je rovněž doporučeno všem cestovatelům, zejména pokud cestují do oblastí s endemickým výskytem nákazy.
Vakcína proti záškrtu je účinná, a v zemích s vysokou proočkovaností je proto nákaza dobře kontrolována. Hladina protilátek proti záškrtu však postupně s věkem klesá a bez posilovací (booster) dávky se dospělí mohou opět stát vnímavými vůči nákaze. Očkování dospělé populace je zejména důležité v zemích, kde se případy záškrtu dlouho nevyskytovaly a kde nedocházelo k přirozenému posilování malými dávkami. Udržování vysoké hladiny protilátek proti záškrtu v populaci je důležité i kvůli často omezenému přístupu k difterickému antitoxinu, zásadnímu léku při léčbě těžkých forem záškrtu.
V poslední době dochází zejména v zemích s dobrou proočkovaností ke změně epidemiologické situace a ke zvýšenému záchytu infekcí způsobených kmeny C. diphtheriae, které neprodukují difterický toxin. U značného počtu nemocných dominují v klinickém obraze invazivní infekce, včetně bakteriemie, sepse a endokarditidy. Invazivní netoxikogenní infekce C. diphtheriae jsou asociovány s vysokou úmrtností. Tyto případy v populaci by měly být v rámci surveillance záškrtu důsledně monitorovány. I proto se studují možnosti nové vakcíny, která by byla účinná nejen proti infekci záškrtem, ale i proti infekcím způsobeným kmeny C. diphtheriae, jež neprodukují difterický toxin a nesplňují kritéria záškrtu. Současná vakcína proti záškrtu obsahuje pouze difterický toxoid, a proto chrání před působením difterického toxinu, což je hlavní faktor virulence pro onemocnění záškrtem, ale nechrání proti infekcím způsobeným netoxigenními kmeny.
Tetanus
Tetanus je závažné onemocnění vyvolané toxiny, které produkují bakterie Clostridium tetani. K nákaze může dojít při poranění a zanesení spor do rány, zejména při zhmoždění, zanesení cizího tělesa do rány nebo při nekróze tkání. Onemocnění tetanem není přenosné z člověka na člověka. Původce onemocnění byl izolován na konci 19. století. Poté byla prakticky okamžitě zahájena výroba heterologního, obvykle koňského séra proti tetanu. Jeho použití však u některých osob mělo i negativní účinky ve formě sérové nemoci nebo alergické reakce. V roce 1924 byl vyvinut chemicky inaktivovaný tetanový toxin označovaný jako tetanový/tetanický toxoid, který po úpravě již neměl původní toxické vlastnosti, ale byl stále schopen indukovat imunitní odpověď. Od roku 1937 byla ve Spojených státech amerických komerčně dostupná vakcína proti tetanu obsahující tetanický toxoid k aktivní imunizaci proti infekcím vyvolaným C. tetani a byla poprvé hromadně použita k očkování vojáků během druhé světové války [1,8].
K očkování proti tetanu se v současné době používají monovakcíny určené pouze k prevenci tetanu obsahující minimálně 40 IU tetanického anatoxinu nebo kombinované vakcíny (tetra‑, penta‑ nebo hexavakcíny), které vedle tetanu poskytují ochranu proti dalším infekcím: záškrtu, pertusi, invazivnímu onemocnění vyvolanému původcem Hib, přenosné dětské obrně a virové hepatitidě B. Kombinované vakcíny se sníženým obsahem antigenů jsou určeny pro přeočkování dětí ve věku od čtyř let, dospívajících a dospělých. Aktuálně jsou v ČR registrovány monovakcíny Tetavax a Vacteta a kombinované vakcíny Adacel a Adacel Polio, Boostrix a Boostrix Polio, Hexacima, Infanrix a Infanrix Hexa, Tetraxim.
Kombinovaná vakcína proti záškrtu, tetanu a pertusi (DTwP) byla poprvé registrována v roce 1948 v USA a stala se poté součástí dětských očkovacích programů na celém světě. V rámci prevence novorozeneckého tetanu se také od 70. let minulého století úspěšně očkují těhotné ženy, zejména v zemích s nedostatečnou úrovní porodní a poporodní péče.
Vzhledem k postupnému snižování protektivních hladin protilátek se v dospělosti doporučuje pravidelné přeočkování proti tetanu každých 10–15 let. Pravidelné přeočkování proti tetanu v dospělém věku je možné spojit právě s očkováním kombinovanou vakcínou proti tetanu, záškrtu a pertusi nebo případně ještě v kombinaci s vakcínou proti poliomyelitidě.
Vakcíny proti tetanu jsou velmi účinné, ale bylo prokázáno, že některé faktory mohou ovlivnit postvakcinační imunitu, například příliš krátké intervaly mezi podanými dávkami, použití subpotentních šarží vakcín a nesprávné podmínky skladování vakcíny, zejména vystavení teplotám pod bodem mrazu, které způsobují strukturální poškození vazeb adjuvans‑antigen a narušují její účinnost. Také u osob s narušenou imunitou nemusí po očkování dojít k navození dostatečné hladiny ochranných protilátek. Mnoho studií se proto zabývá možností, jak vylepšit stávající vakcíny, ať již změnou adjuvans, zlepšením stability vakcín, či geneticky upraveným proteinem v rekombinantní vakcíně.
V dnešní době jsou kombinované DTP vakcíny široce používány. Podle starší studie probíhá jejich výroba nejméně ve 46 zemích a odhaduje se, že existuje asi 63 různých variant vakcín [9].
Technologické postupy jednotlivých výrobců se tak mohou lišit, a tím i složení výsledného produktu, nicméně difterický a tetanický toxoid se na celém světě vyrábějí stejnou cestou. Koncentrace toxoidů je stanovena ve flokulačních jednotkách (Lf) a čistota toxoidů musí splňovat požadavky WHO. Vakcíny obsahující toxoid musejí být aplikovány intramuskulárně a při jejich skladování musí být dodržen chladový řetězec.
Pertuse
Pertuse (černý kašel) je vysoce nakažlivé onemocnění respiračního traktu způsobené bakterií Bordetella pertussis. Podobné onemocnění mohou způsobovat i ostatní druhy bordetel, Bordetella parapertussis, B. bronchiseptica nebo B. holmesii, ale proti těmto druhům bordetel není dostupné očkování. Onemocnění je svým průběhem a možnými komplikacemi závažné zejména pro malé neočkované nebo neúplně očkované děti, pro osoby s chronickým respiračním onemocněním a pro seniory.
V roce 1906 byl izolován původce černého kašle. Celobuněčná vakcína s pertusovou složkou získala licenci již v roce 1914. Od roku 1947 byla vakcína s wP složkou dostupná a doporučovaná v kombinaci s difterickým a tetanickým toxoidem (DTwP). Předpokládalo se, že po zahájení očkování se bude cirkulace původce v populaci postupně snižovat a epidemické 3–5leté cykly ve výskytu onemocnění se budou postupně prodlužovat, překvapivě však pokračovaly. Vakcinací se podařilo výskyt onemocnění omezit u dětí, ale cirkulace B. pertussis v populaci nikdy nebyla přerušena.
Způsob přípravy celobuněčné očkovací látky proti pertusi ovlivňuje její reaktogenitu, zejména způsob purifikace bakterinu, použité adjuvans a konzervační látky. Konvenční wP vakcíny jsou vyráběny v mnoha zemích. Jejich základní příprava je podobná: bakterie jsou usmrceny a částečně detoxikovány teplem nebo chemicky nebo kombinací těchto metod. Čištěné suspenze inaktivovaných kmenů B. pertussis jsou vyráběny buď ze standardních sbírkových kmenů, nebo z kmenů izolovaných v populaci země, kde se vakcína vyrábí. Očkovací látka by měla obsahovat hlavní povrchové antigeny typu 1, 2, 3, které se vyskytují v kmenech B. pertussis v kombinacích 1, 2 nebo 1, 3 nebo 1, 2, 3. Celobuněčné vakcíny obsahují usmrcenou bakterii B. pertussis se všemi antigeny důležitými pro vyvolání adekvátní imunitní odpovědi.
Postvakcinační komplikace a skutečnost, že očkování ani prožité onemocnění neposkytují dlouhodobou imunitu, vedly k potřebě vyvinout „bezpečnější“ vakcínu nejen pro děti, ale i pro dospělou populaci. První aP vakcíny vznikly v Japonsku v roce 1981. V USA byla první aP vakcína zaregistrována v roce 1991. Acelulární vakcíny obsahují podle druhu vakcíny odlišný počet a množství jednotlivých antigenních komponent, liší se bakteriálním klonem použitým pro primární produkci antigenů, metodou purifikace a detoxifikace a použitými adjuvancii a konzervačními látkami. Obsahují obvykle 1–5 vybraných purifikovaných antigenů B. pertussis: pertusový toxin (PT), pertaktin (PRN), filamentózní hemaglutinin (FHA) a fimbrie 2 a 3 (FIM 2, FIM 3). Čím více antigenů aP vakcína obsahuje, tím je účinnější. Stanovení optimálního složení acelulární vakcíny je obtížné, protože neexistuje spolehlivá metoda, která by umožnila určit protektivní účinek vakcíny.
Kombinované vakcíny s aP složkou byly do očkování zařazeny na doporučení Poradní komise pro imunizační postupy (Advisory Committee on Immunization Practices, ACIP) v roce 1992, nejprve jako čtvrtá a pátá dávka [10]. Vakcíny aP postupně nahradily ve vyspělých státech wP vakcíny. Podle obsahu jednotlivých antigenů ve vakcíně jsou určeny pro dětskou nebo dospělou populaci.
V současné době se stále používají oba druhy inaktivovaných pertusových vakcín, celobuněčná a acelulární v kombinaci s difterickým a tetanickým toxoidem. Monovakcína proti pertusi zatím není ve světě dostupná.
V bývalém Československu bylo pravidelné očkování zahájeno od roku 1958 kombinovanou očkovací látkou Alditepera (DTwP) československé výroby, kde byla pertusová složka vyráběna z kmenů B. pertussis aktuálně kolujících v populaci. Od přelomu let 2000 a 2001 do roku 2006 byla Alditepera v pravidelném očkování nahrazena zahraniční vakcínou TETRAct‑HIB (DTwP s hemofilovou složkou). V té době již bylo možné z důvodů indikace pediatra nebo za úhradu očkovat děti kombinovanými vakcínami s aP složkou Hexavac nebo Infanrix. Od roku 2005 byla pátá dávka v plošném očkování nahrazena vakcínou Infanrix a od roku 2007 bylo plošné očkování prováděno pouze kombinovanou vakcínou s aP složkou, čtyři dávky vakcínou Infanrix Hexa, pátá dávka vakcínou Infanrix. Vzhledem k vysokému výskytu pertuse ve věkové skupině 10–14 let byla v roce 2009 zavedena posilovací dávka/booster vakcínou proti záškrtu, tetanu, pertusi a poliomyelitidě (DTaP + IPV) pro teenagery ve věku od 10. do 11. roku (6. dávka očkování proti pertusi).
Od 1. ledna 2018 došlo k úpravě v očkovacím kalendáři v podobě snížení počtu dávek u očkování hexavakcínou ze čtyř na tři dávky (změna ze schématu 3 + 1 na 2 + 1).
Dospělé populaci je doporučeno nechat se očkovat proti pertusi kombinovanou vakcínou se sníženým množstvím antigenů minimálně jednou za život.
V rámci prevence onemocnění je doporučeno očkování těhotných žen proti pertusi kombinovanou vakcínou se sníženým množstvím antigenů od 27. gestačního týdne. Při správném načasování očkování dochází k přenosu dostatečného množství mateřských protilátek do těla plodu a po narození je dítě chráněno před závažným průběhem onemocnění v době, kdy ještě není zralé pro očkování.
Přes dobrou proočkovanost proti pertusi hlásí řada států v posledních letech nárůst počtu případů tohoto onemocnění, které si stále zachovává svůj cyklický výskyt. Mezi faktory, které se podílejí na změně epidemiologické situace, se kromě lepší diagnostiky a vyvanutí imunity řadí i změny v bakterii B. pertussis samotné. Jsou popisovány například změny v pertusovém toxinu, výskyt pertaktin negativních kmenů, výskyt kmenů rezistentních na makrolidová antibiotika, ale také změny v imunitní odpovědi osob očkovaných aP vakcínou. Většina odborníků si myslí, že současné aP vakcíny je třeba doplnit nebo nahradit jinou účinnou vakcínou proti černému kašli.
Závěr
Kombinované DTP vakcíny se osvědčily jako bezpečné a účinné očkovací látky. V současné době je však ze zemí s dobrou proočkovaností hlášen nárůst počtu případů onemocnění preventabilních očkováním. V reakci na očkování jsou u původců onemocnění popisovány významné změny, zejména produkce nových faktorů virulence nebo potlačení produkce faktorů, které jsou přítomny ve vakcínách jako antigeny.
V zemích s dobrou proočkovaností bylo přirozené posilování v populaci prostřednictvím subklinických infekcí výrazně sníženo, a zejména z tohoto důvodu dochází s věkem k postupnému vyvanutí imunity a k poklesu hladin specifických protilátek. Zvyšuje se tak počet vnímavých osob. V zemích s dobrou proočkovaností se běžně nevyskytují závažné případy infekčních onemocnění a vzrůstá nedůvěra k očkování a proočkovanost klesá. Infekce se budou v populaci nadále vyskytovat, proto je nutné epidemiologickou situaci stále důsledně monitorovat a sbírat podklady pro výrobu nových vakcín či úpravu stávajících očkovacích látek.
Zavedení kombinovaných vakcín do doporučených dětských očkovacích schémat, ale i do očkování dospělých má jak ekonomický efekt, tak také výrazný pozitivní dopad pro zdravotníky, rodiče, děti a očkované osoby samotné. Došlo zejména k výraznému snížení počtu aplikovaných injekcí se všemi důsledky (např. méně bolestivých vpichů či nežádoucích reakcí po očkování), redukci počtu návštěv u lékaře, což v důsledku vedlo k lepší compliance očkování a ke zmírnění stresu a zátěže pro kojence a děti i k lepšímu dodržování mnohdy složitých očkovacích schémat [11–13].
Potřeba většího počtu kombinovaných vakcín stále narůstá s počtem doporučených očkování proti dalším infekcím. Vakcinace se tak značně prodražuje a neúměrně zaplňuje očkovací kalendáře. Kombinované vakcíny mohou být v budoucnu řešením této situace nejen u dětí, ale i u dospělých.
MUDr. Kateřina Fabiánová, Ph.D.
Oddělení epidemiologie infekčních nemocí, Státní zdravotní ústav
Šrobárova 48, 100 42 Praha 10
e-mail: katerina.fabianova@szu.cz
Literatura
[1] Plotkin SA, Orenstein WA, Offit PA, Edwards KM. Plotkin’s Vaccines. 7th edn. Elsevier, 2017. 1 720 s.
[2] Berbers G, van Gageldonk P, van de Kassteele J, et al. Serosurveillance Study Team. Circulation of pertussis and poor protection against diphtheria among middle‑aged adults in 18 European countries. Nat Commun 2021; 12: 2871.
[3] Muscat M, Gebrie B, Efstratiou A, et al. Diphtheria in the WHO European Region, 2010 to 2019. Euro Surveill 2022; 27: 2100058.
[4] Clarke KEN, MacNeil A, Hadler S, et al. Global Epidemiology of Diphtheria, 2000–2017. Emerg Infect Dis 2019; 25: 1834–1842.
[5] Diphtheria vaccines: WHO position paper – August 2017. WER No 31; 2017; 92: 417–436.
6] https://www.sukl.cz
[7] ECDC, Vaccine Scheduler. Dostupné na: https://vaccine‑schedule.ecdc.europa.eu/
[8] Brightman C. Tetanus: an ever‑present infection risk. Trends in Urology & Men’s Health 2018; 29–31. Dostupné na: https://wchh.onlinelibrary.wiley.com/doi/pdf/10.1002/tre.638
[9] Milstien JB, Gellin BG, Kane M, et al. Global DTP manufacturing capacity and capability. Status report: January 1995. Vaccine 1996; 14: 313–320.
[10] Pertussis vaccination: acellular pertussis vaccine for the fourth and fifth doses of the DTP series update to supplementary ACIP statement. Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep 1992; 41(RR‑15): 1–5.
[11] Skibinski DA, Baudner BC, Singh M, O’Hagan DT. Combination vaccines. J Glob Infect Dis 2011; 3: 63–72.
[12] Marshall GS, Happe LE, Lunacsek OE, et al. Use of combination vaccines is associated with improved coverage rates. Pediatr Infect Dis J 2007; 26: 496–500.
[13] Kalies H, Grote V, Verstraeten T, et al. The use of combination vaccines has improved timeliness of vaccination in children. Pediatr Infect Dis J 2006; 25: 507–512.