Bezpečnost dlouhodobé expozice ofatumumabu u pacientů s relabující roztroušenou sklerózou
Ofatumumab, první plně humánní anti‑CD20 monoklonální protilátka, indukuje lýzu B buněk primárně prostřednictvím cytotoxicity závislé na komplementu. Ofatumumab doložil svoji účinnost a bezpečnost v léčbě pacientů s relabujícími formami roztroušené sklerózy a byl schválen pro terapii dospělých pacientů s aktivním onemocněním definovaným klinicky nebo pomocí zobrazovacích metod [1].
Ofatumumab, první plně humánní
anti CD20 monoklonální protilátka, indukuje lýzu B buněk
primárně prostřednictvím cytotoxicity závislé na komplementu.
Ofatumumab doložil svoji účinnost a bezpečnost v léčbě
pacientů s relabujícími formami roztroušené sklerózy a byl
schválen pro terapii dospělých pacientů s aktivním
onemocněním definovaným klinicky nebo pomocí zobrazovacích metod
[1].
Pro prověření profilu přínosů a rizik této léčby modifikující onemocnění (disease modifying therapy, DMT) v dlouhodobém horizontu probíhá i nadále sledování expozice ofatumumabu. Klinickým hodnocením, které si dalo za cíl monitorovat bezpečnost, snášenlivost a účinnost několikaleté léčby ofatumumabem, je ALITHIOS [2]. Do této otevřené studie fáze IIIb mohli vstoupit pacienti, kteří dokončili klinické studie ASCLEPIOS I/II (fáze III) [3], APLIOS [4] nebo APOLITOS (fáze II) [5]. Klinické hodnocení bylo zahájeno 22. listopadu 2018 s předpokládaným uzavřením v roce 2029 [2]. První výsledky sledování byly představeny letos na kongresu Americké neurologické akademie (AAN 2022) [6,7].
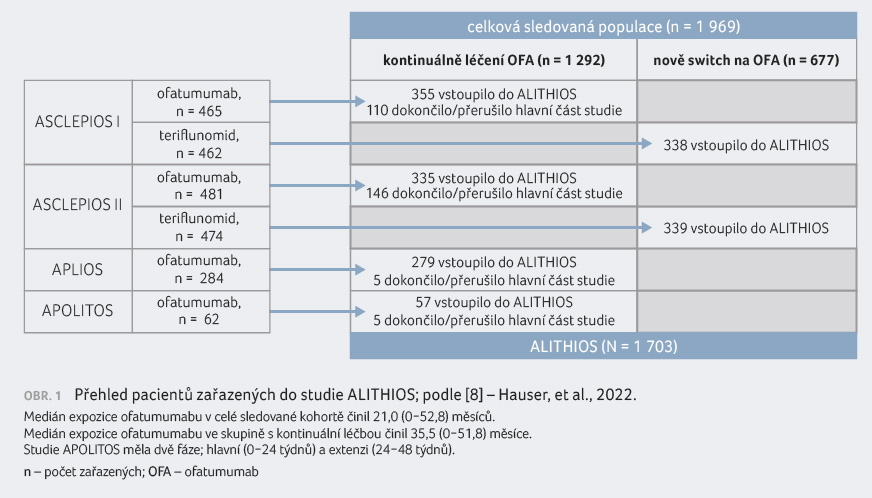
Aktuální interim analýza, jejíž výsledky prezentujeme (uzávěrka dat k 29. lednu 2021), shrnuje kumulativní data expozice ofatumumabu až po dobu 3,5 roku [8]. Analyzována byla bezpečnostní data pacientů kontinuálně léčených ofatumumabem nebo těch, kteří byli na terapii ofatumumabem převedeni později (switch), obrázek 1. Sledovaná populace čítala 1 969 nemocných: 1 292 pacientů léčených ofatumumabem kontinuálně (medián 35,5 měsíce; 3 253 pacientoroků) a 677 pacientů, kteří byli na terapii ofatumumabem převedeni nově (medián 18,3 měsíce; 986 pacientoroků) [8].
Výsledky interim analýzy
Průměrný věk sledovaných pacientů byl 38,7 roku, ženy tvořily 68,3 %. Průměrná doba od stanovení diagnózy činila 6,4 roku a průměrné skóre disability dle Expanded Disability Status Scale (EDSS) 2,9. Z pacientů, kteří vstoupili do studie ALITHIOS, bylo v době uzávěrky dat ofatumumabem nadále léčeno 1 569 (92,1 %) [8].
Celkem 1 650 pacientů (83,8 %) mělo alespoň jednu nežádoucí příhodu (87,3 % ve skupině s kontinuální terapií ofatumumabem, 77,1 % nově převedených na ofatumumab) [8]. Většina nežádoucích účinků byla mírné až střední závažnosti a jejich povaha a četnost byly srovnatelné s těmi, které byly pozorovány ve studiích ASCLEPIOS I/II [3]. Nebyly identifikovány žádné nové bezpečnostní signály. U 191 pacientů (9,7 %) byla zaznamenána alespoň jedna závažná nežádoucí příhoda (u 12,0 % při kontinuální terapii ofatumumabem, u 5,3 % pacientů po switchi); jednalo se nejčastěji o infekce. Ve skupině s kontinuální léčbou nebyla ve výskytu nežádoucích příhod zaznamenána významná meziroční změna (exposure adjusted incidence rate, EAIR).
Systémové reakce spojené s injekcí
(injection related reaction, IRR), tedy reakce hlášené do 24
hodin, byly pozorovány celkem u 24,8 % pacientů (u 26,0 %
s kontinuální léčbou a u 22,6 % po switchi
na ofatumumab). U nově léčených pacientů byly
systémové IRR mírné až střední intenzity a zřídka vedly
k přerušení léčby (n = 4, dva z nich
po první injekci). Systémové IRR se vyskytly většinou
po první injekci ofatumumabu, u následujících injekcí
míra incidence výrazně klesla. Tyto výsledky jsou v souladu
se závěry klinického hodnocení ASCLEPIOS I/II [3]. Reakce v místě
vpichu se vyskytly u 11,5 % celkové populace (u 13,2 %
s kontinuální terapií ofatumumabem a u 8,3 % nově
léčených).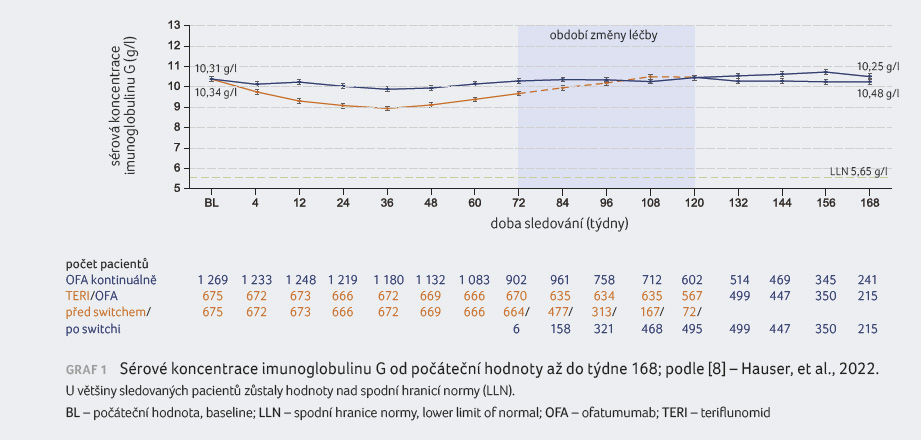
Infekce byly pozorovány celkem u 1 070 pacientů (54,3 %), incidence infekcí odpovídala jejich výskytu ve studiích ASCLEPIOS I/II (51,6 %) [3]. Nebyl zaznamenán meziroční nárůst výskytu související s delší expozicí ofatumumabu (EAIR). Nebyly hlášeny oportunní infekce, reaktivace hepatitidy B ani výskyt progresivní multifokální leukoencefalopatie, riziko malignit bylo nízké (zaznamenány u 0,6 % z celkové populace). Průměrné sérové koncentrace imunoglobulinu G (IgG) zůstaly stabilní (graf 1). Průměrné hodnoty imunoglobulinu M (IgM) se snížily, ale u většiny sledovaných zůstaly nad spodní hranicí normálu (graf 2). Výskyt závažných infekcí byl nízký a snížené sérové koncentrace imunoglobulinů nebyly spojeny se závažnými infekcemi [8].
Nežádoucí účinky vedoucí
k přerušení léčby byly v celkové sledované populaci
zaznamenány u 115 pacientů (5,8 %); u 89 (6,9 %)
kontinuálně léčených a 26 (3,8 %) nově převedených
na ofatumumab. Nejčastějšími příčinami byly snížené
hodnoty IgG (n = 53; 46,1 %) a snížené hodnoty
dalších imunoglobulinů (n = 11; 9,6 %)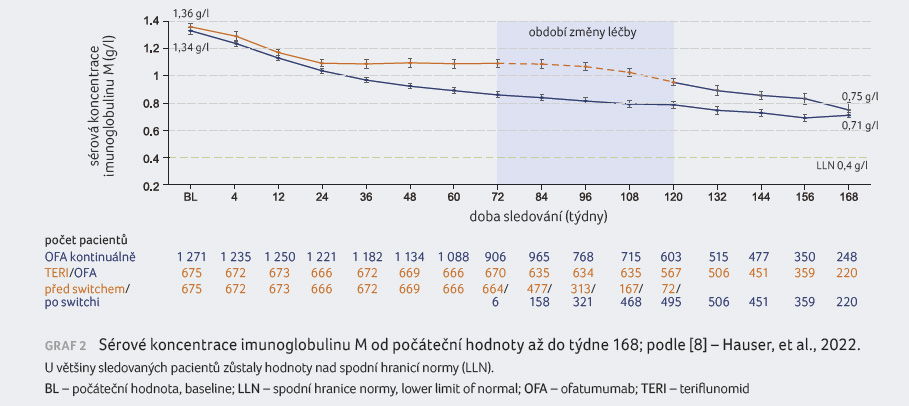
Dosud pozorovaný výskyt infekcí covid 19 a související výsledky u pacientů léčených ofatumumabem nevykazují žádné známky zvýšení výskytu covidu 19 nebo jeho závažného průběhu oproti běžné populaci [9].
V malé kohortě 14 těhotných žen, které byly vystaveny ofatumumabu, nebyly zaznamenány žádné vrozené vady, hlášené vrozené anomálie nebo závažné infekce. Další údaje o expozici matek ofatumumabu poskytnou budoucí data z registru.
Shrnutí
Tato analýza poskytla již poměrně robustní obraz týkající se bezpečnosti ofatumumabu u populace větší velikosti a s delší dobou expozice. Podíl pacientů s nežádoucími účinky, i těmi závažnějšími nebo s těmi, které vedly k přerušení léčby, byl v souladu s předchozím pozorováním a jejich četnost se v průběhu času nezvyšovala. Stejně tak zůstalo nízké a nezvyšovalo se riziko rozvoje vážných infekcí nebo malignit.
U pacientů s expozicí ofatumumabu až 3,5 roku tedy nebyla zjištěna žádná nová bezpečnostní rizika. Léčba byla dobře tolerována. Měsíční interval aplikace ofatumumabu představuje pro pacienty ve srovnání s dalšími injekčními terapiemi menší zátěž, adherenci k léčbě podporuje dále minimální výskyt doprovodných chřipkových příznaků a v neposlední řadě subkutánní cesta podání s možností aplikace v domácím prostředí [8]. Aktuální zjištění dokládají vedle nepopiratelné účinnosti příznivý profil přínosů a rizik této terapie [8].
Redakčně zpracovala PharmDr. Kateřina Viktorová
Seznam použité literatury
- [1] Souhrn údajů o přípravku Kesimpta. Dostupné na: https://www.sukl.cz
- [2] Novartis Pharmaceuticals Corporation. Longterm safety, tolerability and effectiveness study of ofatumumab in patients with relapsing MS (ALITHIOS). ClinicalTrials.gov Identifier: NCT03650114 (updated 11 May 2021). Dostupné na: https://clinicaltrials.gov/ct2/show/NCT03650114?term=ALITHIOS&draw=2&rank=1 (2021, accessed 9 June 2021).
- [3] Hauser SL, Bar‑Or A, Cohen JA, et al. Ofatumumab versus teriflunomide in multiple sclerosis. N Engl J Med 2020; 383: 546–557.
- [4] Bar‑Or A, Wiendl H, Montalban X, et al. Rapid and sustained B‑cell depletion with subcutaneous ofatumumab in relapsing multiple sclerosis: APLIOS, a randomized phase 2 study. Mult Scler 2022; 28: 910–924.
- [5] Kira J, Nakahara J, Sazonov DV, et al. Effect of ofatumumab versus placebo in relapsing multiple sclerosis patients from Japan and Russia: Phase 2 APOLITOS study. Mult Scler 2022; 28: 1229–1238.
- [6] Hauser SL, Fox E, Aungst A, et al. Long‑term Efficacy of Ofatumumab in Patients With Relapsing Multiple Sclerosis. AAN 2022; 2‑7 April 2022, Poster Nr. P 5.004.
- [7] Hauser SL, Cross AH, Winthrop K, et al. Long‑term Safety of Ofatumumab in Patients With Relapsing Multiple Sclerosis. AAN 2022; 2‑7 April 2022, Poster Nr. S 14.004.
- [8] Hauser SL, Cross AH, Winthrop K, et al. Safety experience with continued exposure to ofatumumab in patients with relapsing forms of multiple sclerosis for up to 3.5 years. Mult Scler J 2022; 28: 1576–1590.
- [9] Cross AH, Delgado S, Habek M, et al. Outcomes of COVID‑19 in patients with relapsing multiple sclerosis receiving ofatumumab: Data from the ALITHIOS study and post marketing surveillance. Poster (LB‑ECTRIMS‑2021‑01573) presented at the 37th ECTRIMS meeting, Vienna, 13–15 October 2021.