Blinatumomab v léčbě akutní lymfoblastické leukemie dospělých
Souhrn:
Relabující nebo refrakterní akutní lymfoblastická leukemie dospělých (ALL) představuje vážný klinický problém, který je jen velmi obtížně řešitelný klasickou chemoterapií. Příliš mnoho těchto pacientů nedospěje do stadia remise a jejich přežití se počítá v řádu měsíců. Blinatumomab je nový nadějný lék ze skupiny imunoterapeutik, který je cílen na antigen CD19 přítomný na povrchu naprosté většiny nádorových buněk u ALL z B řady. Klinické studie prokázaly, že s jeho pomocí dosáhne více pacientů kompletní remise, a mohou tak podstoupit alogenní transplantaci a mít šanci na trvalé vyléčení. Nežádoucí účinky jsou obvykle mírné a dobře zvladatelné. Největší nevýhodou je velmi vysoká cena tohoto léku, omezující jeho použití ve více klinických situacích.
Key words: adult acute lymphoblastic leukemia – blinatumomab – treatment – clinical trials.
Summary:
Relapsed/refractory adult acute lymphoblastic leukemia (ALL) is a serious clinical issue poorly manageable by the standard of care chemotherapy. Too many of these patients do not achieve a remission and survive only several months. Blinatumomab is a new promising immunotherapy drug targeting CD19 antigen present on a vast majority of B lineage ALL cells. Clinical trials have proven it to induce a remission more frequently compared to the standard treatment and thus such patients can proceed to an allogeneic transplant and take their chance towards a permanent cure. Adverse events are usually moderate and easily manageable. The limiting factor for the use in a broader spectrum of patients is a very high market price, making blinatumomab the most expensive cancer drug on the market.
Úvod
Akutní lymfoblastická leukemie dospělých (acute lymphoblastic leukemia, ALL) je vzácné onemocnění, které postihuje především tzv. mladé dospělé (ve věku do 25 let) a osoby starší 50 let. Průměrná roční incidence v dospělé populaci představuje 1,2 případu na 100 000 obyvatel. Jedná se o agresivní prekursorové lymfoproliferativní onemocnění charakterizované zmnožením nezralých forem buněk lymfoidní řady (lymfoblastů) v kostní dřeni a v periferní krvi. Iniciální klinické příznaky jsou obvykle velmi nespecifické, nejčastěji se objevují bolesti svalů, kostí a kloubů, zvýšená teplota bez jasné infekční příčiny, únava, slabost, nechutenství, úbytek tělesné hmotnosti a kožní nebo slizniční krvácení. Diagnóza je stanovena poměrně snadno morfologickým a imunofenotypizačním vyšetřením periferní krve a kostní dřeně [1].
Léčba pacientů s ALL spočívá v podávání kombinací cytostatik a u vybraných nemocných ohrožených vysokým rizikem relapsu také v provedení alogenní transplantace krvetvorných buněk. Tabulka 1 uvádí tzv. klasické prognostické faktory platné již téměř třicet let [2]. Zavedení intenzivní léčby inspirované pediatrickými protokoly zlepšilo dosažení hematologické remise až na 90 % a celkové přežití v průměru až na 60 % [3].
tzv. klasické prognostické faktory platné již téměř třicet let [2]. Zavedení intenzivní léčby inspirované pediatrickými protokoly zlepšilo dosažení hematologické remise až na 90 % a celkové přežití v průměru až na 60 % [3].
Nejvýznamnějším prognostickým faktorem je v dnešní době minimální reziduální nemoc (minimal residual disease, MRD), přetrvávající malá populace zbývajících nádorových buněk, která je zjistitelná pouze velmi citlivými metodami [4]. Tabulka 2 uvádí i další nové prognostické faktory, které jsou však méně významné. Pacienti s hematologickým relapsem (zejména časným), s molekulárním relapsem anebo s přetrvávající pozitivitou MR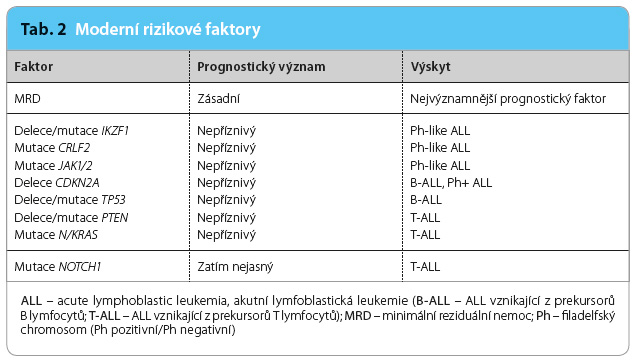 D zůstávají skupinou nemocných, které sice dokážeme včas a přesně identifikovat, ale už ne tak dobře terapeuticky ovlivnit; klasická léčba zde velmi často selhává [5–7]. Tyto svízelné klinické situace pomáhá zvládat cílená léčba. Mezi nejúčinnější nové moderní léky patří v případě ALL s pozitivitou filadelfského (Ph) chromosomu tyrosinkinázové inhibitory druhé a třetí generace [8] a v případě fenotypu ALL z B řady imunoterapie zaměřená na antigeny CD19, CD20, CD22 nebo CD52 vyskytující se na povrchu nádorových buněk [9,10].
D zůstávají skupinou nemocných, které sice dokážeme včas a přesně identifikovat, ale už ne tak dobře terapeuticky ovlivnit; klasická léčba zde velmi často selhává [5–7]. Tyto svízelné klinické situace pomáhá zvládat cílená léčba. Mezi nejúčinnější nové moderní léky patří v případě ALL s pozitivitou filadelfského (Ph) chromosomu tyrosinkinázové inhibitory druhé a třetí generace [8] a v případě fenotypu ALL z B řady imunoterapie zaměřená na antigeny CD19, CD20, CD22 nebo CD52 vyskytující se na povrchu nádorových buněk [9,10].
Charakteristika léčiva (farmakodynamika)
Blinatumomab je bispecifický protilátkový konstrukt anti CD19 a anti CD3, jehož strukturu ilustruje obr. 1. Krkolomný název vychází z písmen slov B lymfocytární (B ), řada (lineage, lin ), protinádorová (anti tumor, atu ), myší (mouse, mo ), monoklonální (monoclonal, m ), protilátka (antibody, ab).
Při intravenózním podávání zůstává blinatumomab v plazmě, distribuční objem je 4,52 litru a ustálené sérové koncentrace je dosaženo v průběhu jednoho dne. Degradace probíhá katalytickými drahami na malé peptidy a aminokyseliny, do moči se vylučuje pouze v zanedbatelném množství [11].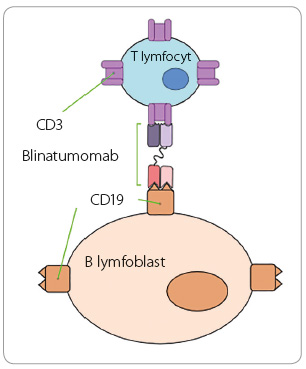
Část anti CD19 se v krvi váže na antigen CD19, který je přítomen na povrchu B lymfocytu ve všech jeho vývojových stadiích. Na nádorových B lymfoblastech se vyskytuje ve více než 95 % případů. Druhá část molekuly, anti CD3, vede k navázání a k aktivaci T lymfocytu. Ten pak svými cytotoxickými mechanismy nádorovou buňku zničí a pomocí cytokinů a adhezních molekul předává tuto informaci i okolním T lymfocytům. Velmi rychle tak dojde k depleci většiny přítomných buněk B řady, mezi nimi i nádorových lymfoblastů [12].
Po ukončení podávání blinatumomabu jeho koncentrace v krvi vlivem rychlé vazby klesá a přípravek se stává neúčinným. Z toho plyne nezbytnost trvalé, kontinuální intravenózní infuze léku. Dávkování v prvním cyklu je 9 µg/den po dobu prvních 7 dní, dále 28 µg/den. Ve druhém a dalších cyklech pak již od počátku 28 µg/den. Jeden cyklus trvá 28 dní, mezi cykly je dvoutýdenní přestávka [11].
Indikace
Terapeutické indikace blinatumomabu značně závisejí na úhlu pohledu (údaje z října 2016):
- indikace ověřené v klinických studiích – relabující nebo refrakterní prekursorová B ALL a MRD pozitivní B ALL, a to jak Ph negativní, tak i Ph pozitivní [13–18];
- indikace dle souhrnu údajů o přípravku (SPC) – relabující nebo refrakterní Ph negativní prekursorová B ALL [11];
- indikace ve specifickém léčebném programu (SLP) – relabující nebo refrakterní Ph pozitivní ALL, molekulární relaps B ALL, relabující nebo refrakterní dětská B ALL; tento program v České republice skončil v srpnu 2016;
- indikace pravděpodobné, nyní zkoumané – 1. linie léčby B ALL; klinické studie jsou na počátku, je ale zřejmé, že pro plné nasazení v praxi není dostatek financí;
- indikace možné, zatím neověřené – další B lymfoproliferace;
- indikace hrazené z veřejného zdravotního pojištění – úhrada není stanovena v žádné situaci, o schválení je třeba žádat revizního lékaře příslušné pojišťovny [19].
Klinické zkušenosti
Klinické studie fáze II prokázaly účinnost a bezpečnost blinatumomabu u pacientů s relabující nebo s refrakterní prekursorovou B ALL, Ph negativní i Ph pozitivní [15,16], a u nemocných s B ALL a s přetrvávající MRD [13,14,17]. V randomizované klinické studii fáze III bylo u pacientů s relabující nebo refrakterní Ph negativní prekursorovou B ALL prokázáno zlepšení v dosažení kompletní remise a 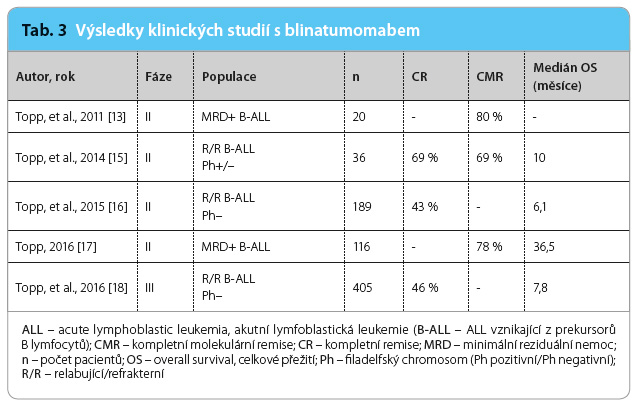 prodloužení celkového přežití ve srovnání se standardní léčbou [18]. Nejdůležitější výsledky těchto studií jsou shrnuty v tab. 3.
prodloužení celkového přežití ve srovnání se standardní léčbou [18]. Nejdůležitější výsledky těchto studií jsou shrnuty v tab. 3.
Závažné nežádoucí účinky nebyly příliš časté: infekce (32 %), neurologické potíže (16 %), neutropenie (15 %), cytokinový syndrom (0,5 %), syndrom nádorového rozpadu (0,5 %). Mezi nejčastější nežádoucí účinky jakéhokoliv stupně závažnosti patřily infuzní reakce (67 %), infekce (63 %), pyrexie (60 %), bolest hlavy (34 %), febrilní neutropenie (28 %) a periferní otoky (26 %). Neurologické nežádoucí účinky se objevily až v 52 % případů, závažné však jen u 16 % případů. Byly různého charakteru a plně reverzibilní podáním dexamethasonu nebo dočasným přerušením infuze. Tyto klinické studie zaměřené na molekulární a hematologický relaps nebo refrakteritu probíhaly i ve velkých českých hematoonkologických centrech.
Příznivé výsledky vedly k registraci léku ve Spojených státech amerických (prosinec 2014) a poté i v České republice (listopad 2015). Lék je registrován pod názvem BlinCyto (prášek pro přípravu injekčního roztoku, 38,5 µg, 10 ml). Cena tohoto přípravku je ovšem astronomická a představuje přibližně 64 000 dolarů nebo dva miliony korun na jeden cyklus pro jednoho pacienta. Jedná se o dosud nejdražší registrovaný lék na světě [20]. Ve velkých českých centrech rovněž až do srpna 2016 probíhal výrobcem sponzorovaný specifický léčebný program zaměřený na hematologický relaps Ph pozitivní ALL a molekulární relaps B ALL, výsledky však zatím nebyly zveřejněny.
Tento přípravek podléhá dalšímu sledování i po uvedení na trh, což by mělo umožnit rychlé získání nových informací o bezpečnosti. Hlavní a nespornou výhodou blinatumomabu je, že pomáhá dosáhnout u významné části pacientů s relabující nebo s refrakterní B ALL hematologické, nebo dokonce molekulární remise a pokračovat k léčbě alogenní transplantací.
Jako možné a spíše relativní nevýhody lze zmínit nepohodlné podávání kontinuální infuzí trvající 28 dní, nepříjemné neurologické nežádoucí účinky, častější výskyt extramedulárních relapsů a v neposlední řadě i velmi vysokou cenu.
Závěr
Blinatumomab je moderní, účinný a relativně bezpečný lék pro relabující a refrakterní prekursorovou B ALL z nové rozvíjející se skupiny imunoterapeutik. I přes jasně prokázanou účinnost zůstane ale pravděpodobně ještě dlouhou dobu vyhrazen pouze pro specifické situace, jako je refrakterní nebo časně relabující Ph negativní prekursorová B ALL. Hlavní omezení většího rozšíření blinatumomabu zatím představuje jeho velmi vysoká cena.
Seznam použité literatury
- [1] Faderl S, O’Brien S, Pui C‑H, et al. Adult acute lymphoblastic leukemia: Concepts and strategies. Cancer 2010; 116: 1165–1176.
- [2] Hoelzer D, Thiel H, Loffler H, et al. Prognostic factors in a multicenter study for treatment of acute lymphoblastic leukemia in adults. Blood 1988; 71: 123–131.
- [3] Bassan R, Hoelzer D. Modern therapy of acute lymphoblastic leukemia. J Clin Oncol 2011; 29: 532–543.
- [4] Brüggemann M, Schrauder A, Raff T, et al. Standardized MRD quantification in European ALL trials: proceedings of the Second international symposium on MRD assessment in Kiel, Germany, 18–20 September 2008. Leukemia 2010; 24: 521–535.
- [5] Bassan R, Spinelli O, Oldani E, et al. Improved risk classification for risk‑specific therapy based on the molecular study of minimal residual disease (MRD) in adult acute lymphoblastic leukemia (ALL). Blood 2009; 113: 4153–4162.
- [6] Gökbuget N, Kneba M, Raff T, et al. Adult patients with acute lymphoblastic leukemia and molecular failure display a poor prognosis and are candidates for stem cell transplantation and targeted therapies. Blood 2012; 120: 1868–1876.
- [7] Fielding AK, Richards SM, Chopra R, et al. Outcome of 609 adults after relapse of acute lymphoblastic leukemia (ALL); an MRC UKALL12/ECOG 2993 study. Blood 2007; 109: 944–950.
- [8] Malagola M, Papayannidis C, Baccarani M. Tyrosine kinase inhibitors in Ph+ acute lymphoblastic leukaemia: facts and perspectives. Ann Hematol 2016; 95: 681–693.
- [9] Ai J, Advani A. Current status of antibody therapy in ALL. Br J Haematol 2015; 168: 471–480.
- [10] Jabbour E, O’Brien S, Ravandi F, Kantarjian H. Monoclonal antibodies in acute lymphoblastic leukemia. Blood 2015; 125: 4010–4016.
- [11] SPC BLINCYTO, Státní ústav pro kontrolu léčiv: Databáze léků [online]. Dostupné na: http://www.sukl.
- [12] Löffler A, Kufer P, Lutterbüse R, et al. A recombinant bispecific single‑chain antibody, CD19 vs. CD3, induces rapid and high lymphoma‑directed cytotoxicity by unstimulated T lymphocytes. Blood 2000; 95: 2098–2103.
- [13] Topp MS, Kufer P, Gökbuget N, et al. Targeted therapy with the T‑cell‑engaging antibody blinatumomab of chemotherapy‑refractory minimal residual disease in B‑lineage acute lymphoblastic leukemia patients results in high response rate and prolonged leukemia‑free survival. J Clin Oncol 2011; 29: 2493–2498.
- [14] Topp MS, Gökbuget N, Zugmaier G, et al. Long‑term follow‑up of hematologic relapse‑free survival in a phase 2 study of blinatumomab in patients with MRD in B‑lineage ALL. Blood 2012; 120: 5185–5187.
- [15] Topp MS, Gökbuget N, Zugmaier G, et al. Phase II
- [16] Topp MS, Gokbuget N, Stein AS, et al. Safety and activity of blinatumomab for adult patients with relapsed or refractory B‑precursor acute lymphoblastic leukaemia: a multicentre, single‑arm, phase 2
- [17] Topp MS. Confirmatory phase II study of blinatumomab (MT103) in patients with minimal residual disease of B‑precursor acute lymphoblastic leukemia (ALL) (BLAST). Clinicaltrials.gov: NCT01207388.
- [18] Topp MS, Stein A, Gökbuget N, et al. Blinatumomab improved overall survival in patients with relapsed or refractory Philadelphia negative B‑cell precursor acute lymphoblastic leukemia in a randomized, open‑label phase 3 study (TOWER). Haematologica 2016; 101(s1): 24–25.
- [19] Databáze léků Státního ústavu pro kontrolu léčiv, http://www.sukl.cz, navštíveno 15. 10. 2016.
- [20] Sanford M. Blinatumomab: first global approval. Drugs 2015; 75: 321–327.