Aktualizace gastroenterologického doporučeného postupu pro praktické lékaře
V úvodu letošní XVIII. jarní interaktivní konference SVL ČLS JEP, která se konala ve Slovanském domě v Praze, představili odborníci z oboru gastroenterologie aktualizovaný doporučený diagnostický a terapeutický postup určený všeobecným praktickým lékařům. Sympozium zaměřené na nová doporučení pro diagnostiku a léčbu příznaků a onemocnění horní části trávicího traktu podpořila společnost PRO.MED.CS, odborným garantem byl doc. MUDr. Bohumil Seifert, Ph.D.
Novinky v doporučeném postupu
Změnami v doporučeném postupu se zabýval jeho hlavní autor doc. MUDr. Radek Kroupa, Ph.D., (Interní gastroenterologická klinika FN Brno, LF MU Brno) [1]. Postup je výsledkem mezioborové snahy o usnadnění přístupu k pacientům se symptomy horní části gastrointestinálního traktu (GIT), podílela se na něm řada odborníků z různých pracovišť a z různých oborů. Podklady pro aktualizaci vycházely z reálné situace s ohledem na vývoj nových poznatků. Poslední postup byl publikován v roce 2012, bylo proto třeba jej aktualizovat na novější standardy a obnovit jeho praktickou využitelnost. Autoři přihlíželi také k vývoji ve světě, kdy celá řada mezinárodních odborných společností přispěla určitým způsobem k nastavení přístupu k pacientům se symptomy horní části GIT. Většina úprav se týká racionalizované redukce péče a potřeby vyšetřování pacientů a rovněž stratifikace péče jak z hlediska praktických lékařů, tak gastroenterologů.
V České republice jsou určité specifické odlišnosti, mj. v epidemiologii onemocnění či v ekonomických podmínkách (např. oproti západní Evropě), péči rovněž ovlivňuje možnost dosahu specialisty, která je navíc regionálně rozdílná. Bylo tedy nutné zasadit doporučený postup do kontextu mezinárodních doporučení, z nichž je možné čerpat, a upravit jej na lokální poměry. Docent Kroupa uvedl některé souvislosti, které je potřeba vzít v úvahu. V České republice je ročně provedeno asi 260 000 gastroskopií (tj. 25–26 výkonů/1 000 obyvatel/rok), oproti tomu např. ve Velké Británii je poměr gastroskopií k počtu obyvatel zhruba poloviční [2]. Další odlišností je prevalence Helicobacter pylori, jež je v současnosti v ČR odhadována na přibližně 20 %, v podobných zemích střední Evropy se předpokládá vyšší, v Německu činí tato prevalence 26–35 %. Jedním z důvodů změny prevalence je i promísení populace s obyvateli z jiných oblastí světa. Jiným důležitým kontextem ve vztahu k onemocnění GIT jsou nádory. Zhoubných nádorů jícnu postupně v čase mírně přibývá, naopak incidence nádorů žaludku v dlouhodobém časovém trendu klesá. Většina nádorů se vyskytuje ve věku vyšším než 50 let [3].
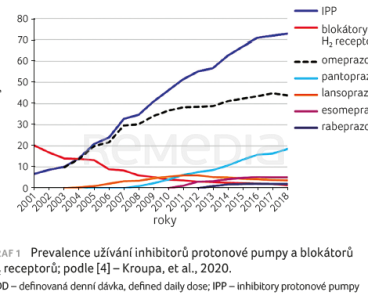 Epidemiologické souvislosti a doporučení ovlivňuje způsob užívání léků na horní část GIT. Za posledních 20 let se preskripce těchto léků téměř zdesetinásobila, výrazný je nárůst užívání především u inhibitorů protonové pumpy (IPP), graf 1 [4]. „S tímto nárůstem je spojena otázka, zda skutečně máme o tolik více jasných indikací a důvodů, proč tyto léky podávat. Myslím si, že tomu tak není,“ komentoval docent Kroupa.
Epidemiologické souvislosti a doporučení ovlivňuje způsob užívání léků na horní část GIT. Za posledních 20 let se preskripce těchto léků téměř zdesetinásobila, výrazný je nárůst užívání především u inhibitorů protonové pumpy (IPP), graf 1 [4]. „S tímto nárůstem je spojena otázka, zda skutečně máme o tolik více jasných indikací a důvodů, proč tyto léky podávat. Myslím si, že tomu tak není,“ komentoval docent Kroupa.
Struktura doporučeného postupu
Struktura aktualizovaného doporučeného postupu částečně kopíruje předchozí doporučení, skládá se z obecné části zaměřené na diferenciální diagnostiku symptomů, racionální základní vyšetření a empirický přístup v terapii v ordinaci praktického lékaře a nově byla přidána kapitola věnovaná spolupráci s gastroenterologickou ambulancí. Na obecnou část navazuje část speciální týkající se nejčastějších onemocnění a další problematiky (funkční dyspepsie, peptický vřed a H. pylori, gastroduodenální toxicita nesteroidních antirevmatik, refluxní nemoc jícnu, racionální preskripce antisekreční medikace). Z hlediska přístupu k pacientům je asi nejdůležitější snaha o rozbor symptomů, k němuž je v gastroenterologii na rozdíl od jiných oborů k dispozici jen omezené množství dalších exaktních parametrů (laboratorní vyšetření, zobrazovací metody atd.), podle nichž můžeme nemocné dále stratifikovat [1].
Role praktického lékaře a gastroenterologa
Praktický lékař by měl u pacienta se symptomy horní části GIT provést základní rozvahu směřující k pracovní diagnóze a nastavení léčby. Věková hranice 50 let, nad níž je třeba více zvažovat riziko nádorových onemocnění, je nepřesná, důležitá je především anamnéza včetně zjištění výskytu nádorů v rodině, rovněž užívané léky a region, ze kterého pacient pochází. Klinické a základní laboratorní vyšetření by měla být provedena v každém případě, účelem běžné ultrasonografie břicha je zejména vyloučení jiné patologie. Novinkou – na základě britských doporučení – je z důvodu narůstající incidence karcinomu pankreatu časné provedení CT vyšetření u pacientů ve věku nad 60 let s bolestmi břicha a s hmotnostním úbytkem.
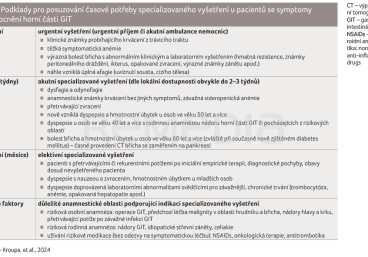 Doporučený postup třídí kritéria na diagnostické údaje a další faktory, které by měly praktickému lékaři usnadnit rozhodování o tom, kdy kterého pacienta vyšetřovat – zda urgentně, nebo ambulantním specialistou v akutním termínu, který se však liší podle dostupnosti v regionu v řádu týdnů, či zcela elektivně (tab. 1) [1].
Doporučený postup třídí kritéria na diagnostické údaje a další faktory, které by měly praktickému lékaři usnadnit rozhodování o tom, kdy kterého pacienta vyšetřovat – zda urgentně, nebo ambulantním specialistou v akutním termínu, který se však liší podle dostupnosti v regionu v řádu týdnů, či zcela elektivně (tab. 1) [1].
 Pacient s obtížemi v horní části GIT nemusí automaticky směřovat do gastroenterologické ambulance. Pokud už je ke gastroenterologovi praktickým lékařem odeslán, měl by s sebou mít k dispozici výše zmiňovanou rozvahu praktika – která vyšetření byla provedena, jaká je pracovní diagnóza, jaká léčba byla zvažována, jak reagoval pacient. Gastroenterolog by měl dispenzarizovat pacienty se specifickými komplikovanými chorobami, jejichž výčet je ale limitovaný, navíc u některých i v intervalu více let (tab. 2) [1]. Na praktickém lékaři je zabezpečit základní péči a preskripci v mezidobí a zhodnotit to, zda má další intervalové vyšetření pro pacienta např. z hlediska podchycení prekancerózy smysl v kontextu jeho celkového zdravotního stavu. Role gastroenterologické ambulance spočívá tedy v navázání na předchozí péči, racionalizované spolupráci s ordinací praktického lékaře a dodržování pravidel medicíny založené na důkazech (EBM).
Pacient s obtížemi v horní části GIT nemusí automaticky směřovat do gastroenterologické ambulance. Pokud už je ke gastroenterologovi praktickým lékařem odeslán, měl by s sebou mít k dispozici výše zmiňovanou rozvahu praktika – která vyšetření byla provedena, jaká je pracovní diagnóza, jaká léčba byla zvažována, jak reagoval pacient. Gastroenterolog by měl dispenzarizovat pacienty se specifickými komplikovanými chorobami, jejichž výčet je ale limitovaný, navíc u některých i v intervalu více let (tab. 2) [1]. Na praktickém lékaři je zabezpečit základní péči a preskripci v mezidobí a zhodnotit to, zda má další intervalové vyšetření pro pacienta např. z hlediska podchycení prekancerózy smysl v kontextu jeho celkového zdravotního stavu. Role gastroenterologické ambulance spočívá tedy v navázání na předchozí péči, racionalizované spolupráci s ordinací praktického lékaře a dodržování pravidel medicíny založené na důkazech (EBM).
Empirická léčba všeobecným praktickým lékařem vychází z pracovní diagnózy podle převažujících symptomů (refluxní potíže, bolest a diskomfort). Kromě toho je třeba dohlížet na užívání nesteroidních antirevmatik (non‑steroidal anti‑inflammatory drugs, NSAIDs) a rizika závažných nežádoucích účinků. Empirická eradikace H. pylori musí být individuálně zvážena. Při stávající prevalenci H. pylori je nutné si uvědomit, co od léčby očekáváme. V případě některých onemocnění (vředová choroba gastroduodena) a u prekancerózních stavů je indikace jasná, ale například v případě funkční dyspepsie zlepšení nastává pouze asi u 10 % případů, nutné je zvažovat medikaci při intoleranci léčby či při alergiích a z důvodu antibiotické rezistence. Máme testovat jen takového pacienta, u kterého v případě pozitivity uvažujeme o eradikaci H. pylori. Je možno testovat cestou praktického lékaře, k dispozici je test ze stolice, který je relativně levný, dostupný a přesný. Léčba je v současné době v ČR minimálně desetidenní (10–14 dní) trojkombinací IPP a antibiotik, v případě pacientů s alergií nebo selhání první léčby je přístupná fixní kombinace s bismutem.
Závěr
Aktualizované doporučené postupy představují praktický návod pro určení závažnosti symptomatologie a případné směrování pacienta ke specializované péči. Jejich cílem je zlepšit spolupráci mezi gastroenterology a všeobecnými praktiky, nedílnou součástí daného přístupu je racionalizace empirické terapie a redukce zátěže lékařů i pacientů.
Funkční dyspepsie
V další prezentaci se tématu funkční dyspepsie věnoval doc. MUDr. Jiří Dolina, Ph.D., (Interní gastroenterologická klinika FN Brno, LF MU Brno). V úvodu připomněl klasifikaci dyspepsií na orgánové (doprovodný symptom všech organických typů onemocnění v GIT), sekundární (doprovodný symptom onemocnění mimo GIT) a funkční, jejichž symptomatologie přetrvává po vyloučení organických a sekundárních příčin [1].
Obecný přístup k pacientovi s dyspepsií
Co se týče diagnostiky, zvažujeme nejen tzv. typické symptomy, ale rovněž případné alarmující příznaky. V případě negativní endoskopie lze hovořit o funkční problematice. V léčbě bychom měli pacientovi především poskytnout srozumitelné poučení o charakteru onemocnění, o možných příčinách jeho obtíží a způsobu terapie. „Pacient by měl vědět, že potíže jsou u této choroby perzistující a že beze změny životosprávy se jeho situace nezmění a bude se do ambulance vracet,“ zdůraznil docent Dolina. Konzervativní způsob léčby zahrnuje antisekreční medikaci, eradikaci H. pylori, prokinetika, režimová a dietní opatření, ale také fytoterapii, relaxační metody, antidepresiva a psychoterapii.
 Důležité je věnovat se alarmujícím příznakům, které by měly uspíšit vyšetřovací postup. Mezi takové příznaky se řadí dysfagie, odynofagie, přetrvávající zvracení, nevysvětlený úbytek hmotnosti, hmatná rezistence v břiše, bolest břicha, obtíže pacienta po operačním zákroku nebo nově vzniklé potíže u pacienta ve věku nižším než 50 let (40 let u pozitivní rodinné anamnézy), tabulka 3 [1].
Důležité je věnovat se alarmujícím příznakům, které by měly uspíšit vyšetřovací postup. Mezi takové příznaky se řadí dysfagie, odynofagie, přetrvávající zvracení, nevysvětlený úbytek hmotnosti, hmatná rezistence v břiše, bolest břicha, obtíže pacienta po operačním zákroku nebo nově vzniklé potíže u pacienta ve věku nižším než 50 let (40 let u pozitivní rodinné anamnézy), tabulka 3 [1].
Přednášející dále zmínil profesora Zdeňka Mařatku, který v roce 1996 vizionářsky rozdělil funkční dyspepsie na dráždivý žaludek, chabý žaludek a atypické tvary. To odpovídá dělení podle aktualizovaných Římských kritérií IV na tři základní fenotypy pacientů: 1. postprandiální plnost (postprandial distress syndrome, PDS) – časná sytost s dominující dysmotilitou; 2. bolest v epigastriu (epigastric pain syndrome, EPS) – bolest, pálivé pocity v epigastriu, dysmotilita, hypersenzitivita; 3. kombinace symptomů nebo jejich překryv [5,6].
K anamnestickým údajům, které podporují diagnózu funkční dyspepsie, patří dlouhá anamnéza obtíží a jejich začátek v mládí, překrývají se s jinými druhy funkčních potíží. Pacienti udávají bezpříznaková období, větší psychický stres a zátěž v rodině nebo v práci, často se do ordinace vracejí kvůli konzultaci funkční problematiky. Dále hrají roli nepříznivé psychosociální faktory, psychologické trauma nebo negativní životní událost [1]. Pomocníkem pro praktické lékaře může být vyplnění krátkého dotazníku pacientem před vstupem do ordinace, který nasměruje k fenotypu. U funkční dyspepsie může dojít k překryvu s refluxní chorobou jícnu, do budoucna se dokonce uvažuje o clusteru nemocí označených jako tzv. dráždivý trávicí trakt [7].
Jaká je správná léčba?
„Máme obrovské možnosti léčby, ale musíme vědět, co léčit, jak léčit a jak dlouho léčit,“ upozornil přednášející. Armamentárium k léčbě symptomů horní části GIT zahrnuje IPP, blokátory H2 receptorů, antacida, prokinetika, psychofarmaka, spasmolytika, analgetika a jejich kombinace [1]. Terapie by měla být cílena podle fenotypů. U skupiny EPS dáváme přednost supresi HCl, začínáme tzv. systémem step‑up, to znamená od antacid, blokátorů H2 receptorů až k IPP. Pokud už je léčba zahájena IPP, je důležité vědět, že tyto léky jsou indikovány pro dlouhodobou terapii a velmi obtížně se vysazují. Blokátory H2 receptorů bude pacient v tomto případě považovat za méně účinné, ačkoliv nová éra těchto léků je aktuálním tématem. Je nutné přehodnocovat efekt antisekreční léčby s ohledem na lékové interakce a možné dopady při dlouhodobé terapii. U PDS preferujeme prokinetika – účinným a bezpečným lékem při dlouhodobém užívání, který je i na českém trhu, je itoprid. Jeho účinnost a zlepšení kvality života pacientů prokázaly statisticky významně dvě neintervenční poregistrační studie [8,9]. V případě kombinace EPS a PDS se používají prokinetika a IPP. Po konzultaci s psychologem lze podávat např. i tricyklická antidepresiva, neboť psychické ladění, hypersenzitivita trávicího traktu jsou u pacientů s funkčními poruchami dobře vyjádřeny. V neposlední řadě je nutné opakovat edukaci pacienta se zaměřením na dietní a režimová opatření.
Blokátory H2 receptorů mají řadu výhod, rychlejší nástup účinku oproti IPP (do jedné hodiny), ale s krátkou dobou jeho trvání (zhruba 12 hodin). Efekt IPP nastupuje do tří hodin a trvá přibližně tři dny. Nežádoucí účinky blokátorů H2 receptorů a IPP jsou srovnatelné – nejčastěji bolest hlavy, suchost v krku, průjem. Jedna z analýz ve zmiňovaných studiích s itopridem doložila, že IPP jsou zbytečně preskribovány také v indikacích, kde by měl lékař zahajovat léčbu prokinetiky. U PDS byl zjištěn podíl IPP až 60 % u žen a 60 % u mužů, u kombinované funkční poruchy 73 % u žen a 80 % u mužů [8].
Riziko gastroduodenální toxicity NSAIDs
Mezi faktory rizika nežádoucích účinků NSAIDs v GIT patří dávka léku, délka léčby, typ léčiva (selektivní/neselektivní), věk pacienta vyšší než 65 let, konkomitantní léčba kyselinou acetylsalicylovou, glukokortikoidy, antiagregancii, antikoagulancii, bisfosfonáty nebo inhibitory zpětného vychytávání serotoninu. Je však třeba myslet i na další faktory, které mohou riziko poškození trávicího traktu zvýšit – např. H. pylori, kouření, alkohol. Opatrnost je nutná u pacientů s vředovou chorobou gastroduodena v anamnéze nebo s komplikovaným průběhem tohoto onemocnění. Nový doporučený postup přináší odhad míry rizika pro jednotlivé faktory (vysoké, střední, nízké) [1]. Odhad pomůže např. u pacientů, kteří prodělali vředovou chorobu gastroduodena a zvažuje se u nich podávání IPP.
Shrnutí
Inhibitory protonové pumpy představují účinné léky zvláště u jasně diagnostikovaných skupin pacientů s gastroezofageálním refluxem nebo vředovou chorobou gastroduodena. V průběhu antisekreční léčby by pacienti měli být sledováni, především se to týká rizikových skupin – pacienti s kardiovaskulárním onemocněním, s anémií, osteoporózou, sklonem k dysbióze, renální insuficiencí. Při rozhodnutí o dlouhodobé antisekreční medikaci je nutné pacienta informovat o potencionálních rizicích a benefitech léčby, rovněž o její možné deeskalaci. Roste zájem o léčbu blokátory H2 receptorů zvláště u skupin pacientů s funkční dyspepsií, funkční pyrózou a hypersenzitivitou, neboť představují vhodnou alternativu za IPP, nebo se podávají v kombinaci s IPP. Významná je racionálně vedená léčba prokinetiky u pacientů s funkční dyspepsií, gastroezofageálním refluxem a překryvnými symptomy a racionálně vedená antisekreční léčba, která zahrnuje zvážení jednak terapeutického přínosu, jednak všech nežádoucích účinků preskribované medikace.
Refluxní choroba jícnu a racionalizace použití IPP
Sympozium uzavřel příspěvek doc. MUDr. Martina Bortlíka, Ph.D., (Gastroenterologické oddělení Nemocnice České Budějovice, Interní klinika 1. LF UK a ÚVN, Farmakologický ústav 1. LF UK, Praha) zaměřený na refluxní chorobu jícnu.
„Refluxní chorobu jícnu lze považovat za nejexaktnější část mezi chorobami horní části GIT, má celkem jasně definovaná kritéria z hlediska diagnostiky, má známé komplikace související s nedostatečnou nebo neléčenou chorobou. Podíl pacientů, které jsme schopni léčit úspěšně v případě refluxní choroby jícnu, je asi největší z celého spektra onemocnění postihujících horní část GIT,“ vysvětlil přednášející.
Refluxní chorobu jícnu definujeme jako stav, kdy u pacienta dochází k patologickému refluxu obsahu žaludku do jícnu a je spojen s obtížemi nebo komplikacemi [1]. Obtíže mohou, ale nemusejí mít pacienti, kteří jsou náchylní ke komplikacím v podobě stenózy nebo vzniku Barrettova jícnu – právě u těchto nemocných je symptomatologie často minimální, a dochází tak u nich k dlouhodobému refluxu a vzniku těchto komplikací.
Prevalence je v ekonomicky vyspělých částech světa víceméně stejná, pohybuje se kolem jedné třetiny až jedné čtvrtiny naší populace, jedna z 15–20 osob má každodenní obtíže (což není podmínkou diagnózy), zhruba 10–15 % pacientů s refluxní chorobou jícnu trpí závažnou formou v podobě prekancerózy – Barrettova jícnu. Riziko vzniku adenokarcinomu je relativně nízké u těch pacientů, kteří mají Barrettův jícen bez histologicky verifikovaných dysplastických změn. U pacientů s dysplastickými změnami riziko významně narůstá.
Projevy a diagnostika onemocnění
Projevy refluxní choroby jícnu jsou jednak typické (pyróza, regurgitace), které jsou nejčastějším základem diagnostiky, jednak atypické, mimojícnové (např. respirační potíže, kašel aj.). Velkou pozornost je třeba věnovat projevům alarmujícím, které vyžadují specializovanou péči. Základem diagnostiky je symptomatologie. Ta zpravidla v klinické praxi v kombinaci s terapeutickým testem postačuje ke stanovení diagnózy a k zahájení terapie u pacientů, kteří nejsou rizikoví, jsou ve věku do 50 let a nemají žádné alarmující symptomy. Pokud pacient nedostatečně reaguje na terapeutický test nebo má projevy, které považujeme za alarmující nebo méně obvyklé, je zapotřebí provést endoskopické vyšetření. Endoskopický nález ezofagitidy není podmínkou pro diagnózu refluxní choroby jícnu, 70 % pacientů s tímto onemocněním nemá patologický endoskopický nález (tzv. neerozivní refluxní chorobu jícnu). U atypických projevů je třeba diagnózu ověřit a potvrdit pH‑metrií s impedancí. Pacienti s patologickým nálezem na endoskopii (erozivní forma, zhruba 30 % jedinců) jsou náležitě klasifikováni, nejčastěji podle tzv. Losangeleské klasifikace [10].
Další vyšetření, jež nepatří do spektra základních diagnostických metod – RTG nebo manometrie jícnu –, se používají u komplikovanějších případů, např. tam, kde zvažujeme chirurgickou léčbu, k vyloučení koincidence s achalázií nebo s jinou motilitní poruchou.
U pacientů se mohou objevit stavy, které nejsou pravou refluxní chorobou jícnu, ale překrývají se s ní. Je to např. refluxní hypersenzitivita, kdy má pacient obtíže typické pro toto onemocnění, ale nemá patologický reflux, nýbrž reflux fyziologický. Při funkční pyróze pacient trpí pyrózou a refluxními obtížemi, ale není zde žádná souvislost s refluxní epizodou (potvrzena pH‑metrií). Uvedené stavy vyžadují určitou modifikaci terapie.
Terapeutické možnosti
Z terapeutického hlediska máme k dispozici spektrum možností počínaje režimovými a dietními opatřeními přes terapii medikamentózní až po léčbu chirurgickou. Režimová opatření jsou žádoucí a týkají se mnoha pacientů, jsou však velmi individuální a jen zřídka jsou sama o sobě dostačující k odstranění obtíží. U mnoha nemocných do značné míry souvisejí s nadváhou, která je aspektem významně zhoršujícím průběh symptomatologie refluxní choroby jícnu. Základem je léčba medikamentózní. Jedná se především o léčbu antisekreční, tedy terapii, která potlačuje produkci žaludeční kyseliny. Na počátku stojí terapeutický test, u nějž se doporučuje, aby počáteční dávka IPP byla vyšší, neboť v terapii refluxní choroby jícnu je nutné používat vyšší dávky této medikace, než je běžné u dyspepsií nebo vředové choroby jícnu (dávka omeprazolu by měla odpovídat 20–40 mg). Abychom test mohli považovat za validní, je lépe lék podávat spíše dvakrát denně než jednou denně. Inhibitory protonové pumpy jsou základem rovněž dlouhodobé terapie, u pacientů s neerozivní formou nebo lehkou ezofagitidou je můžeme podávat jednou denně, obvykle v první fázi osm týdnů, u pacientů s těžkým endoskopickým nálezem dvakrát denně po minimální dobu 12 týdnů. Po eventuálním přerušení léčby u 80 % pacientů dochází k recidivě obtíží a je nutné v terapii pokračovat. Dlouhodobá terapie by měla být denní, u pacientů s lehčí formou nemoci lze podávat podle potřeby. Také dlouhodobou terapii je možné modifikovat, např. využitím blokátorů H2 receptorů u lehčích onemocnění. Blokátory H2 receptorů mohou být rovněž alternativou pro pacienty, kteří IPP netolerují.
U některých pacientů se mohou objevit refrakterní obtíže způsobené tzv. nočním průlomem žaludeční kyselosti (nocturnal acid breakthrough, NAB), kdy navzdory standardní terapii ve dvou denních dávkách IPP dochází v noční fázi k poklesu pH < 4 na dobu delší než jedna hodina. I zde je možné v době před spaním s výhodou využít dávku blokátoru H2 receptoru, který tuto situaci může pozitivně ovlivnit a přispět k eliminaci nočního průlomu. Součástí terapie refluxní choroby jícnu mohou být také prokinetika, konkrétně itoprid. Je vhodný jako doplněk antisekreční terapie při jejím nedostatečném efektu nebo u pacientů s doprovodnými projevy tzv. chabého žaludku.
Shrnutí
Refluxní choroba jícnu je častým onemocněním, které lze označit za civilizační. Jeho diagnostika je založena na typické symptomatologii a terapeutickém testu, základem léčby je antisekreční terapie, ale je možné využívat i další léky včetně léčby tzv. on‑demand, tedy podle potřeby. To představuje jeden z kroků, které by měly přispívat k racionalizaci využívání antisekreční terapie. Týká se to zejména inhibitorů protonové pumpy, jež jsou v dnešní době velmi rozšířené, avšak ne všichni pacienti, jimž jsou tyto léky předepisovány, je skutečně potřebují užívat dlouhodobě.
Literatura
[1] Kroupa R, Cyrany J, Dolina J, et al. Doporučené diagnostické a terapeutické postupy pro všeobecné praktické lékaře. Gastroenterologie. Příznaky a onemocnění horní části trávicího traktu. 2024. Dostupné na: https://www.svl.cz/doporucene‑postupy/gastroenterologie‑100057
[2] Black CJ, Paine PA, Agrawal A, et al. British Society of Gastroenterology guidelines on the management of functional dyspepsia. Gut 2022; 71: 1697–1723.
[3] Epidemiologie zhoubných nádorů v České republice. Dostupné na: https://www.svod.cz
[4] Kroupa R, Katinova I, Pavlik T, et al. Incidence trends of esophageal cancer in the Czech Republic by histological subtype and stage and prescription rate of acid suppressing drugs. Cancer Epidemiol 2020; 69: 101853.
[5] Drossman DA, Chang L, Chey WD, et al. Rome IV. Functional Gastrointestinal Disorders. Disorders of Gut‑Brain Interaction. Fourth Edition. Rome Foundation 2017.
[6] Aziz I, Palsson OS, Törnblom H, et al. The Prevalence and Impact of Overlapping Rome IV‑Diagnosed Functional Gastrointestinal Disorders on Somatization, Quality of Life, and Healthcare Utilization: A Cross‑Sectional General Population Study in Three Countries. Am J Gastroenterol 2018; 113: 86–96.
[7] Kaji M, Fijiwara Y, Shiba M, et al. Prevalence of overlaps between GERD, FD and IBS and impact on health‑related quality of life. J Gastroenterol Hepatol 2010; 25: 1151–1156.
[8] ITO‑NPS‑01‑PMCS‑2021
[9] ITO‑NPS‑02‑PMCS‑2021
[10] Navrátil V, Urban O, Gregar J. Současná léčba refluxní choroby jícnu. Farmakoter Rev 2020; 5: 317–323.