3D tlač a jej uplatnenie vo výrobe tuhých perorálnych liekových foriem
Súhrn:
Špaglová M, Čuchorová M, Čierna M, Mikušová V. 3D tlač a jej uplatnenie vo výrobe tuhých perorálnych liekových foriem. Remedia 2022; 32: 496–500.
V posledných rokoch sa čoraz častejšie skloňuje pojem personalizovaná medicína. Dosiahnutie požadovaného účinku liečiva nezávisí len od jeho farmakokinetického profilu, ale vo veľkej miere je ovplyvnené fyziológiou a anatómiou pacienta (vekom, hmotnosťou, pridruženými chorobami ai.). Pomocou 3D tlače je možné efektívne meniť množstvo liečiva v lieku a tiež riadiť jeho uvoľňovanie. Personalizovaná medicína sprostredkovaná 3D tlačou by v budúcnosti mohla znamenať liečbu pacienta priamo v zdravotníckom zariadení podľa jeho zdravotného stavu. Úprava chuti, farby a tvaru liekových foriem môže zvýšiť komplianciu najmä u pediatrických pacientov. Ďalšou kľúčovou skupinou sú pacienti s polymorbiditou, u ktorých hrozí riziko zníženia účinnosti, interakcií liečiv, resp. znásobenie prejavov nežiaducich účinkov. Formulácia viacerých liečiv v jednom perorálnom lieku alebo oddelenie inkompatibilných liečiv v jednotlivých vrstvách znamená zlepšenie kompliancie aj vďaka zjednodušeniu dávkovania. 3D tlač nachádza okrem toho uplatnenie aj v predklinických fázach vývoja nových liekov a v oblasti terapie vzácnych ochorení, kde môže prispieť k urýchleniu vývoja a výroby tzv. orphan liekov. V neposlednom rade, zavedenie individuálnej personalizovanej medicíny znamená obrovské ekologické odbremenenie od nespotrebovaných hromadne vyrábaných liekov. Aditívna výroba nemôže zatiaľ konkurovať zaužívaným a fungujúcim konvenčným spôsobom výroby perorálnych liekových foriem. Mohla by sa však využiť vtedy, keď nie je hromadná výroba potrebná, keď sa vyžaduje skôr individuálny prístup, presnosť dávkovania. Existuje množstvo metód 3D tlače. Nie všetky sú však vhodné pre farmaceutickú výrobu. Stručný prehľad sumarizuje metódy aditívnej výroby vhodné pre tlač perorálnych tuhých liekových foriem a zaujímavé vedecké práce v tejto oblasti z posledných rokov.
Summary:
Spaglova M, Cuchorova M, Cierna M, Mikusova V. 3D printing and its application in the production of solid oral dosage forms. Remedia 2022; 32: 496–500.
In recent years, the term personalized medicine has become increasingly common. The desired effect of the drug does not only depend on its pharmacokinetic profile but is largely influenced by the physiology and anatomy of the patient (age, weight, associated diseases, etc.). 3D printing provides a simple way to modify the amount of drug and its delivery. Due to personalized medicine produced by 3D printing, a patient´s treatment could be adjusted directly in the medical institution according to his health condition in the future. The taste and colour of the dosage form can improve compliance, especially in paediatric patients. Other key patients are those with co‑morbidity, who are at risk of reduction of drug action, drug interactions, and eventually multiplication of side effects. Formulation of multiple drugs in one medicine or separation of incompatible drugs in individual layers could improve compliance by simplifying the dosing. 3D printing finds application in the preclinical phases of the development of new drugs. It could be helpful also in the treatment of rare diseases because it can accelerate the development and production of the so‑called "orphan" drugs. The introduction of individualized personalized medicine would mean a huge environmental burden from unused mass‑produced medicines. The 3D printing process cannot compete with the usual and working conventional manufacturing technique for the production of oral solid dosage forms. However, it could be used when mass production is not needed and when an individual approach and dosing accuracy are recquired. There are many methods of 3D printing but not all are suitable for pharmaceutical production. The review briefly summarizes the techniques of 3D printing suitable for the production of oral solid dosage forms and the interesting scientific works in this field in the recent years.
Key words: 3D printing, oral dosage forms, personalized medicine, microparticles.
Možnosti využitia 3D tlače vo vývoji
perorálnych liekových foriem
Technológia 3D tlače je perspektívnou
metódou vo vývoji pevných perorálnych liekových foriem. 3D tlač
alebo inak aditívna výroba je metóda výroby trojrozmerných
objektov z digitálnych 3D modelov [1]. Táto technológia umožňuje
výrobu nových formulácií aj v prípade, ak sú možnosti
výroby perorálnych liekov konvenčnými metódami obmedzené.
Umožňuje vyvinúť rôzne veľkosti a tvary liekov, a dokonca
riadiť spôsob uvoľňovania liečiva z nich. Každá metóda
3D tlače začína vytvorením modelu pomocou softvéru
a optimalizáciou geometrie podľa špecifikácie tlačiarne.
Nasleduje export 3D modelu najčastejšie do formátu STL, ktorý
obsahuje súradnice bodov tvoriacich trojuholníky. Ďalším
používaným formátom je OBJ, v ktorom sú zakódované
informácie o polygonálnych povrchoch alebo o textúre farieb
[2]. V súbore sa vytvoria jednotlivé vrstvy, ktoré sa budú
tlačiť. Techník 3D tlače je mnoho (podrobnejšie referuje Elbl
a kol. [3]). Najčastejšie používané vo vývoji perorálnych
liekových foriem [4] sú uvedené v tabulke 1 spolu so
stručnou charakteristikou.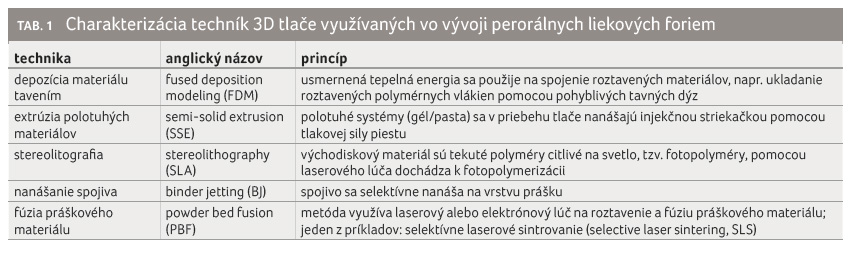
Nie je možné jednoznačne určiť, ktorá z uvedených techník je najvhodnejšia k výrobe tuhých perorálnych liekov. Každá má svoje výhody i nevýhody. Výber konkrétnej závisí od typu formulácie a požiadavky na fyzikálno mechanické vlastnosti, ktoré sa majú dosiahnuť, napr. pevnosť, odolnosť voči oderu, disolučný profil liečiva [5].
Aditívna výroba perorálnych tuhých liekov
Prípravok Spritam je prvým liekom pripraveným pomocou 3D tlače (metódou BJ – nanášanie spojiva, binder jetting), ktorý bol schválený Americkou agentúrou pre potraviny a lieky (FDA) v roku 2015. Ide o orodispergovateľné tablety obsahujúce antiepileptikum levetiracetam (250, 500, 750 až 1 000 mg) pripravené patentovanou technológiou ZipDoseod spoločnosti Aprecia. Tablety sa užívajú s malým množstvom vody (10 – 15 ml), čím dochádza k rýchlemu rozpadu tablety za menej ako 15 sekúnd bez ohľadu na množstvo slín. U konvenčných orodispergovateľných tabliet je rozpad tablety závislý od množstva slín pacienta, ktoré sa môže meniť „dávku od dávky“. V prípade tablety s celkovou hmotnosťou nad 500 mg sa môže vplyvom tohto faktora jej rozpad výrazne spomaliť [1]. Dôležité je tiež spomenúť, že hromadná výroba tohto lieku si vyžadovala optimalizáciu výrobného zariadenia. Vo veľkovýrobe pracuje niekoľko 3D tlačiarní súčasne na jednom páse. Na konci pásovej výroby sa tablety zbavia prachu a ten sa recykluje v ďalšom výrobnom cykle [6]. Zabezpečenie hromadnej výroby takýchto produktov je z tohto dôvodu ekonomicky veľmi náročné a pre farmaceutický priemysel menej rentabilné. Tento aspekt sa často hodnotí ako jedno z najpodstatnejších obmedzení v implementácii 3D tlače vo veľkovýrobe perorálnych liekov. Naopak výhodným riešením môže byť v klinickom prostredí na substitúciu nedostatku hromadne vyrábaných liekov alebo pre zaistenie individuálnej personalizovanej medicíny, v prípade nutnosti úpravy dávkovania pre konkrétneho pacienta.
Zaujímavá je tiež navrhnutá formulácia čokoládových žuvacích tabliet prostredníctvom 3D tlače (metódou SSE – extrúzia polotuhých materiálov, semi solid extrusion). V prvej fáze sa porovnávala extrudovateľnosť materiálu pripraveného zmiešaním rôznych pomerov roztavenej horkej čokolády a kukuričného sirupu (1 : 0,5; 1 : 0,6; 1 : 0,7; 1 : 0,8; 1 : 0,9; 1 : 1; 1 : 1,2). Zmesi s nízkym obsahom kukuričného sirupu a viskozitou nižšou ako 350 Pa.s (meranou pri rýchlostnom spáde 0,1 s 1) boli neextrudovateľné. Najoptimálnejšie vlastnosti pre 3D tlač vykazovala zmes čokolády a kukuričného sirupu v pomere 1 : 1, v ktorej sa rozpustil paracetamol, eventuálne dispergoval ibuprofén vo výslednej koncentrácii 22,9 mg/g alebo 19,6 mg/g. Takto pripravené spojivo bolo ihneď naplnené do kazety 3D tlačiarne a zahriate na 45 °C. Výsledné tablety mali vylepšený dizajn – išlo najmä o rôzne geometrické tvary a kreslené postavy. In vitro disolučné skúšky preukázali rýchle uvoľnenie liečiva do disolučného média simulujúceho sliny. Špeciálna úprava vzhľadu a chuti pripravených žuvacích tabliet môže mať pozitívny vplyv na liečbu pediatrických pacientov [7].
Okrem využitia 3D tlače k zabezpečeniu individuálnej personalizovanej medicíny je možné týmto spôsobom poskytnúť nový, sofistikovaný prístup k výrobe liekových foriem vhodných pre špecifické skupiny pacientov, napr. so zrakovým znevýhodnením. Perorálne tablety značené Braillovým písmom umožňujú ich identifikáciu i po vyňatí z pôvodného obalu. Awad a kol. [8] vyrobili pomocou SLS metódy (selektívne laserové sintrovanie, selective laser sintering) paracetamolové tablety označené Braillovým a Moonovým písmom. Ako východiskový materiál sa použila zmes 92 % Kollidonu, 5 % paracetamolu a 3 % Candurin Gold Sheen vo funkcii absorbenta. Diódový laser absorbuje v oblasti viditeľného svetla, a pretože väčšina farmaceutických práškov je biela, nedochádza k absorpcii. Preto sa do zmesi pomocnej látky a liečiva pridalo toto farbivo farmaceutickej kvality. Následne sa vyhodnotila kvalita tabliet ako aj čitateľnosť písma nezaujatým posudzovateľom so zrakovým znevýhodnením.
Goyanes a kol. [9] sa zamerali na výrobu tabliet s obsahom itrakonazolu (35 %) priamou extrúziou prášku. Ako ďalšie pomocné látky sa použili štyri rôzne druhy hydroxypropylcelulózy. Všetky výtlačky vykazovali dobré mechanické a fyzikálne vlastnosti bez degradácie liečiva. Výsledky potvrdzujú, že všetky druhy použitého polyméru sú veľmi vhodnými materiálmi na priamu 3D tlač bez potreby použitia ďalších pomocných látok. Čas tlače jedného výtlačku (s priemerom 10 mm, výškou 3,63 mm a obsahom cca 100 mg itrakonazolu) bol podobný ako pri použití technológie FDM (depozícia materiálu tavením, fused deposition modeling; 2 – 3 minúty). Skutočnosť, že nie je potrebné vykonať predbežný krok extrúzie za horúca (hot melt extrusion, HME), robí proces priamej práškovej tlače oveľa jednoduchším a rýchlejším v porovnaní s HME spojeným s FDM tlačou. HME je samostatný výrobný krok, počas ktorého sa v extrudéri rotačným pohybom homogenizuje zmes pomocných a účinných látok. Výsledkom procesu je pretlačený extrudát v podobe rovnomerného vlákna.
Ďalšou výhodou aditívnej tlače je možnosť produkovať lieky s malou hmotnosťou alebo s nízkou dávkou liečiva. Čiastočne je možné zamedziť stratám vznikajúcim v priebehu bežnej výroby tabliet lisovaním (počas granulácie, v homogenizačnom zariadení alebo pri lisovaní), ale samozrejme vo veľkej miere to závisí od zvolenej technológie 3D tlače. Znížením množstva potrebného materiálu a prípravou formulácií „na mieru“ by sa mohla táto technológia využívať v rámci predklinických skúšok.
Scoutaris a kol. [10] vyrobili žuvacie tablety zo zmesi indometacínu, acetát sukcinát hypromelózy a polyetylénglykolu v hmotnostnom zastúpení 20/60/20. Zmes sa za rôznych teplotných podmienok spracovala v extrudéri a následne sa pristúpilo k FDM. Okrem tradičných skúšok zameriavajúcich sa na hodnotenie kvality výtlačku sa vyhodnotila aj schopnosť pomocných látok potlačiť nepríjemnú chuť liečiva. Tvar žuvacích tabliet bol inšpirovaný gumovými cukríkmi Haribo za účelom zlepšenia kompliancie u detských pacientov.
Herrada Manchón a kol. [11]
vyrobili prostredníctvom 3D tlače (metódou SSE) žuvacie tablety
na motívy rôznych kreslených postáv s cieľom zvýšiť
adherenciu pediatrických pacientov k liečbe. K ich
príprave sa použila kombinácia polymérov karagénu, xantánovej
gumy a želatíny spolu s tekutým sladidlom a potravinárskym
farbivom pre zlepšenie chuti a celkového vzhľadu (obr. 1).
Dve formulácie obsahovali liečivo ranitidín, ďalšie dve boli
referenčnými vzorkami bez obsahu liečiva, vďaka ktorým bolo
možné vyhodnotiť vplyv liečiva a kukuričného škrobu
na extrudovateľnosť materiálu a tiež finálne
vlastnosti liekovej formy. Problém vznikol pri nastavení dávky
liečiva vo finálnej liekovej forme, pretože odparením vody počas
gelatinizácie došlo k miernemu zvýšeniu obsahu liečiva, čo
spôsobilo značné rozdiely v jednotlivých formuláciách
napriek tomu, že v rámci jednej formulácie sa obsah liečiva
javil rovnomerný.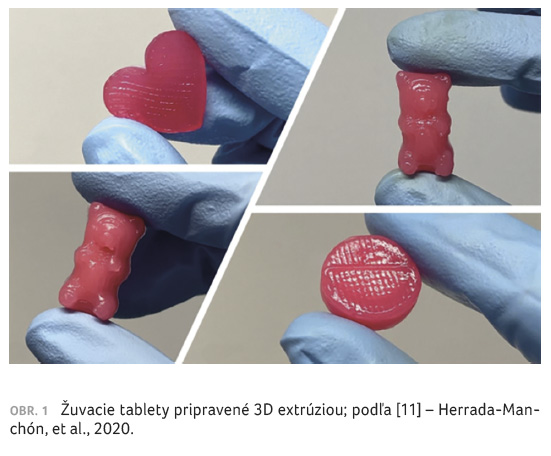
Tagami a kol. [12] vyrobili prostredníctvom 3D tlače (SSE metódou) perorálnu formuláciu s obsahom antiepileptika lamotrigínu pre pediatrických pacientov. Základom bola želatína, hydroxypropylmetylcelulóza (HPMC) a škrobový sirup. Zaujímali sa najmä o vplyv podielu gélotvorných látok na mechanické vlastnosti želé. Zistili, že pevnosť referenčnej formulácie, ktorá pozostávala len zo želatínového hydrogélu, rastie so stúpajúcim obsahom želatíny. To isté platilo pre formulácie s prídavkom HPMC a liečiva v škrobovom sirupe. Obsah želatíny značne vplýval na pevnosť a textúru želé, zatiaľ čo vplyv liečiva a HPMC bol menej výrazný.
Rycerz a kol. [13] vyrobili SSE metódou želatínové tablety v tvare „lega“ s kombináciou liečiv ibuprofénu a paracetamolu, ktoré sa používajú najmä v pediatrii na potlačenie bolesti, horúčky, resp. pooperačnej bolesti (obr. 2). Suspenzia liečiva sa priamou extrúziou vtlačila do želatínovej matrice za zvýšenej teploty (70 °C). Následne sa lieky nechali tuhnúť pri laboratórnej teplote. Vyhodnotil sa vplyv reologických vlastností vnorenej fázy, rýchlosť tlače a veľkosť ihly na kvalitu vyrobených produktov. Na základe skúšky disolúcie sa zistilo, že matrica na báze želatíny sa rýchlo rozpustí a nasleduje pomalé uvoľňovanie liečiva z pasty.
Prostredníctvom aditívnej výroby je možné vyrobiť lieky mikro až makro rozmerov. Práve vďaka tejto možnosti sa 3D tlač začala skúmať popri výrobe konvenčných perorálnych liekových foriem aj ako technológia výroby mikročasticových systémov. Kvalita tlače samozrejme závisí od použitej techniky a mierky [14].
Z farmaceutického hľadiska môžu mikročasticové systémy, ako sú pelety, mikrokapsuly alebo mikrosféry, poskytovať niektorú z výhod: a) chrániť liečivo pred vplyvmi prostredia (napr. oxidáciou, teplotou, pH), b) chrániť organizmus pred iritačným účinkom liečiva, c) optimalizovať, predlžovať alebo cieliť účinok liečiva.
Výhody násobnej liekovej formy v spojitosti s 3D tlačiarenskou technológiou sa aplikovali aj pri výskume zameranom na terapiu kolorektálneho karcinómu. Alginátové častice obsahujúce 5 flourouracil boli prevedené 3D tlačou do formy tabliet. K tomuto účelu sa použila technika FDM. Výsledné tablety pozostávali z hornej vrstvy tvorenej kyselinou polymliečnou, ktorá je nerozpustná vo vode. Spodná vrstva tvorená zmesou polymetakrylátov zabezpečila cielené uvoľňovanie liečiva v hrubom čreve [15].
Na prípravu PLGA (kopolymér kyseliny mliečnej a glykolovej, poly lactic co glycolic acid) mikročastíc s obsahom paklitaxelu, sa použila piezoelektrická 3D tlač (s nanášaním spojiva). Mikročastice vykazovali dvojfázový profil uvoľňovania liečiva s počiatočným nárazovým uvoľnením v dôsledku difúzie a následnou pomalou fázou uvoľňovania spôsobenou degradáciou PLGA častíc. Rýchlosť uvoľňovania závisela od ich geometrie a povrchovej plochy [16].
V niektorých prípadoch, ako napríklad v prípade použitia FDM technológie, sa vyžaduje vysoká teplota na tavenie polyméru. Preto nie sú termolabilné liečivá vhodné na spracovanie touto technológiou. Pokrok v tomto smere prináša vývoj nových polymérov spracovateľných pri nízkych teplotách. Inou možnosťou, ako riešiť problém termolabilných liečiv, je využitie nanonosičov, ktoré im poskytnú ochranu počas spracovania [14].
Z hydrogélovej matrice sa liečivo pomerne rýchlo uvoľní. Pre zabezpečenie riadeného uvoľňovania môže byť liečivo enkapsulované v polymérnych mikro alebo nanočasticiach. Napríklad enkapsuláciou cyklosporínu A do PLGA mikrosfér v alginátovom hydrogéli sa dosiahlo predĺžené uvoľňovanie. Najprv sa metódou SSE extrudovali vlákna polykaprolaktón/PLGA zmesi a voľné priestory sa vyplnili alginátovým hydrogélom s liečivom enkapsulovaným v mikrosférach. In vitro profil uvoľňovania preukázal iniciálne nárazové uvoľnenie liečiva v priebehu prvého dňa, s následným postupným uvoľňovaním v priebehu 28 dní s celkovým dosiahnutým množstvom uvoľneného liečiva 75 %. Mikrosféry v tomto prípade poslúžili ako nosiče hydrofóbneho liečiva s cieľom zabezpečiť jeho predĺžené uvoľňovanie [17].
Sommer a kol. [18] testovali zaujímavé spojivo pre 3D tlač – emulziu typu olej vo vode stabilizovanú nanočasticami oxidu kremičitého modifikovanými chitozánom. Hoci sú emulzné systémy tradične využívané v technológii liekov, tlač emulzií do matrice predstavuje nové možnosti riadeného uvoľňovania senzibilných látok. Vďaka prítomnosti oleja a vody môže emulzia obsahovať tak hydrofilné, ako aj lipofilné liečivo, prípadne aj obe súčasne. Výsledky in vitro uvoľňovania farbiva simulujúceho enkapsulované liečivo demonštrovali potenciál uplatnenia tohto zloženého systému ako systému s riadeným uvoľňovaním.
Hodnotenie kvality východiskového
materiálu a finálnych aditívne vyrábaných perorálnych
liekov
Aditívnej výrobe predchádza dôkladné štúdium vlastností východiskového materiálu. Vplyv pomocných látok v práškovej zmesi je možné sledovať prostredníctvom charakteristík, ako je sypný uhol alebo Hausnerov pomer. Samozrejme, limity týchto charakteristík, ktoré sú odporúčané pre dosiahnutie ideálnych tokových vlastností tabletoviny pri lisovaní, nie sú totožné (napr. pri výrobe tabliet lisovaním sa odporúča Hausnerov pomer vstupného materiálu do 1,34, pri spracovaní 3D tlačou môže byť vyšší [19]). V prípade spojiva používaného pri BJ technike sa hodnotia jeho základné charakteristiky – uhol zmáčania, povrchové napätie (γ), viskozita (η), hustota (ρ) priemer kvapiek (α). Spomenuté charakteristiky sú dôležité aj pre posúdenie možnosti použitia spojiva pre účely 3D tlače, jeho tzv. tlačiteľnosť (printability) – P [19]:
Až 86 % vedeckých štúdií zameraných na aditívnu výrobu tuhých perorálnych liekových foriem sa venuje práve tabletám, ktoré predstavujú najpoužívanejšiu liekovú formu vôbec. Väčšina autorov pristupuje k vykonaniu požadovaných liekopisných skúšok (hmotnostná rovnorodosť, rozpad, disolúcia, oder, pevnosť, stanovenie obsahu liečiva) doplnených o zobrazenie morfológie liekovej formy prostredníctvom SEM (rastrovacia elektrónová mikroskopia, scanning electron microscopy) [5]. Vďaka tradičným liekopisným skúškam, z ktorých väčšina má presne stanovené limity, je možné porovnávať tablety vyrobené lisovaním verzus 3D tlačou.
Predformulačná charakterizácia fyzikálnych vlastností východiskového materiálu, či už ide o spojivo, alebo vstupný materiál v podobe prášku, je nevyhnutná pre posúdenie vplyvu vlastností materiálu na kvalitu finálnych produktov. Napríklad pri technike BJ je dôležité pochopiť interakcie medzi spojivom a prá

škom, ktoré je možné charakterizovať prostredníctvom kapilárneho toku a dynamického kontaktného uhla, ktorý sa stanovuje na základe času a hĺbky penetrácie spojiva do zmesi prášku. Vďaka tejto metóde sa tiež zistilo, že suspendovaním nanočastíc do spojiva sa do istej miery zlepší penetrácia spojiva do prášku spôsobená zvýšením jeho viskozity [20]. Zmena vlastností vstupného materiálu (napr. viskozita spojiva) umožňuje modifikovať mechanické vlastnosti výtlačku. Okrem toho charakterizácia fyzikálnych vlastností vstupného materiálu umožňuje voľbu alternatívnych pomocných látok s podobnými vlastnosťami.
Splniť požiadavky regulačných orgánov pre zavedenie 3D tlačených liekov do praxe je náročný proces. FDA sa snaží prispieť k implementácii tejto technológie vlastným výskumom. Vydala niekoľko usmernení ohľadom aditívne vyrábaných zdravotníckych pomôcok. Po preukázaní ekvivalencie pomôcky vyrobenej 3D tlačou s pomôckou vyrobenou tradičnou metódou môže byť udelené povolenie k výrobe. Podobný trend sa očakáva aj v súvislosti s aditívne vyrábanými liekmi. Najprv sa však musia stanoviť špecifické usmernenia a zvoliť jasná regulačná cesta, ktorá by vyriešila napr. aj spôsob schvaľovania personalizovaných liekov. Otázkou ostáva aj zodpovednosť za dohľad pri výrobe v mieste poskytovania zdravotnej starostlivosti [21].
Záver
Rozvoj 3D tlače a jej implementácia do farmaceutického priemyslu sú výzvou. Perspektívne k prijatiu ako všestranného výrobného nástroja tuhých liekových foriem sa zdajú byť práve tri zo spomínaných techník: depozícia materiálu tavením (FDM), nanášanie spojiva (BJ) a selektívne laserové sintrovanie (SLS). Obzvlášť dôležitý prínos poskytuje 3D technológia výroby liekov v pediatrii. Špeciálne detské motívy a tvary liekových foriem zvyšujú adherenciu k liečbe a znižujú emociálne dopady choroby u detských pacientov. Uvoľňovanie liečiv, resp. aktívnych farmaceutických zložiek z perorálnych liekov vyrobených 3D tlačiarenskou technológiou je možné rôznymi spôsobmi ovplyvňovať, vďaka čomu možno pripraviť systémy s okamžitým uvoľňovaním alebo oneskoreným uvoľňovaním, či dokonca vyrobiť kompletný dávkovací systém pre konkrétneho pacienta s polymorbiditou (všetky liečivá v požadovanej dávke v jednej tablete). Stále tu však existuje priestor na zlepšenie spojený najmä s minimalizáciou celkových výrobných nákladov a rýchlosťou výrobného procesu, čomu by mohol napomôcť pokrok vo vývoji tlačiarenských strojov a pozitívny trend vo vzraste ich ekonomickej dostupnosti.
Seznam použité literatury
- [1] Maniruzzaman M. 3D and 4D Printing in Biomedical Applications: Process Engineering and Additive Manufacturing. John Wiley & Sons, 2019.
- [2] Jamróz W, Szafraniec J, Kurek M, Jachowicz R. 3D Printing in Pharmaceutical and Medical Applications – Recent Achievements and Challenges. Pharm Res 2018; 35: 176.
- [3] Elbl J, Muselík J, Franc A. Využití 3D tisku při přípravě a výrobě léků. Chem Listy 2019; 113: 301–306.
- [4] Mohapatra S, Kar RK, Biswal PK, Bindhani S. Approaches of 3D printing in current drug delivery. Sens Int 2022; 3: 100146.
- [5] Brambilla C, Okafor‑Muo O, Hassanin H, ElShaer A. 3DP printing of oral solid formulations: a systematic review. Pharmaceutics 2021; 13: 358.
- [6] Gaisford S. 8 – 3D printed pharmaceutical products. In: Kalaskar DM (ed.). 3D Print. Med., Woodhead Publishing, 2017, p. 155–166. Dostupné na: https://doi.org/10.1016/B978‑0‑08‑100717‑4.00007‑7.
- [7] Karavasili C, Gkaragkounis A, Moschakis T, et al. Pediatric‑friendly chocolate‑based dosage forms for the oral administration of both hydrophilic and lipophilic drugs fabricated with extrusion‑based 3D printing. Eur J Pharm Sci 2020; 147: 105291.
- [8] Awad A, Fina F, Goyanes A, et al. 3D printing: Principles and pharmaceutical applications of selective laser sintering. Int J Pharm 2020; 586: 119594.
- [9] Goyanes A, Allahham N, Trenfield SJ, et al. Direct powder extrusion 3D printing: Fabrication of drug products using a novel single‑step process. Int J Pharm 2019; 567: 118471.
- [10] Scoutaris N, Ross SA, Douroumis D. 3D Printed “Starmix” Drug Loaded Dosage Forms for Paediatric Applications. Pharm Res 2018; 35: 34.
- [11] Herrada‑Manchón H, Rodríguez‑González D, Alejandro Fernández M, et al. 3D printed gummies: Personalized drug dosage in a safe and appealing way. Int J Pharm 2020; 587: 119687.
- [12] Tagami T, Ito E, Kida R, et al. 3D printing of gummy drug formulations composed of gelatin and an HPMC‑based hydrogel for pediatric use. Int J Pharm 2021; 594: 120118.
- [13] Rycerz K, Stepien KA, Czapiewska M, et al. Embedded 3D Printing of Novel Bespoke Soft Dosage Form Concept for Pediatrics. Pharmaceutics 2019; 11: E630.
- [14] Jain A, Bansal K, Tiwari A, et al. Role of Polymers in 3D Printing Technology for Drug Delivery – An Overview. Curr Pharm Des 2018; 24: 4979–4990.
- [15] Gioumouxouzis CI, Chatzitaki A‑T, Karavasili C, et al. Controlled Release of 5‑Fluorouracil from Alginate Beads Encapsulated in 3D Printed pH‑Responsive Solid Dosage Forms. AAPS PharmSciTech 2018; 19: 3362–3375.
- [16] Lee B, Yun Y, Choi JS, et al. Fabrication of drug‑loaded polymer microparticles with arbitrary geometries using a piezoelectric inkjet printing system. Int J Pharm 2012; 427: 305–310.
- [17] Song T‑H, Jang J, Choi Y‑J, et al. 3D‑Printed Drug/Cell Carrier Enabling Effective Release of Cyclosporin a for Xenogeneic Cell‑Based Therapy. Cell Transplant 2015; 24: 2513–2525.
- [18] Sommer MR, Alison L, Minas C, et al. 3D printing of concentrated emulsions into multiphase biocompatible soft materials. Soft Matter 2017; 13: 1794–1803.
- [19] Wang Z, Han X, Chen R, et al. Innovative color jet 3D printing of levetiracetam personalized paediatric preparations. Asian J Pharm Sci 2021; 16: 374–386.
- [20] Bai Y, Wall C, Pham H, et al. Characterizing Binder–Powder Interaction in Binder Jetting Additive Manufacturing Via Sessile Drop Goniometry. J Manuf Sci Eng 2019; 141: 011005.
- [21] Vithani K, Goyanes A, Jannin V, et al. An Overview of 3D Printing Technologies for Soft Materials and Potential Opportunities for Lipid‑based Drug Delivery Systems. Pharm Res 2018; 36: 4.