Vlastnosti a rizika kyseliny borité
Souhrn
Katrnošková S, Gregorová J. Vlastnosti a rizika kyseliny borité. Remedia 2023; 33: 361–364.
Sloučeniny s obsahem boru (kyselina boritá a její soli) jsou známy svým antibakteriálním a antifungálním účinkem. Jejich používání v topických lékových formách je však stále kontroverznější, a to z důvodu pouze malého antiseptického potenciálu v nízkých koncentracích a možného rizika toxicity při použití vyšších dávek. Článek pojednává o vlastnostech kyseliny borité, symptomech a terapii předávkování, ke kterému může dojít jak při úmyslném nebo neúmyslném perorálním požití, tak po lokální aplikaci.
Klíčová slova: kyselina boritá – farmakokinetika – intoxikace – nežádoucí účinky.
Summary
Katrnoskova S, Gregorova J. Properties and risks of boric acid. Remedia 2023; 33: 361–364.
Compounds containing boron (boric acid and its salts) are known for their antibacterial and antifungal effects. However, their use in topical medicinal forms is becoming increasingly controversial due to their low antiseptic potential at low concentrations and possible toxicity at higher doses. This article discusses the properties of boric acid, symptoms, and treatment of an overdose, which can occur both after unintentional or intentional oral ingestion and after local application.
Key words: boric acid – pharmacokinetics – intoxication – adverse effects.
Kyselina boritá (BA) je slabá anorganická kyselina s molekulovou hmotností 61,83 g/mol. Z důvodu vyšší disociační konstanty (pKa 9,2) se ve vodném prostředí stejně jako její soli (boritany) při fyziologickém pH vyskytuje téměř výhradně v nedisociované formě. BA a boritany vykazují obdobné farmakologické účinky [1]. Absorpce BA gastrointestinálním traktem (GIT) je rychlá a kompletní [2]. K absorpci dochází také po lokální aplikaci na poraněnou pokožku. Stupeň absorpce porušenou pokožkou závisí na rozsahu poškození a použitém vehikulu (léčivé přípravky obsahující hydrofilní základ budou vstřebány dokonaleji než ty s lipofilním základem). Rozsah vstřebávání dále zvyšuje opakované podání, nepřetržitá aplikace a vyšší dávky boritanových sloučenin [3–5].
 Po absorpci je BA prostřednictvím difuze rychle distribuována do extracelulární a intracelulární tekutiny. Maximální plazmatické koncentrace je dosaženo přibližně dvě hodiny po perorálním podání. Koncentrace boru v měkkých tkáních jsou srovnatelné s koncentracemi v plazmě (v tukové tkáni je vzhledem k nízkému obsahu vody dosahováno nižších koncentrací ve srovnání s koncentracemi v jiných měkkých tkáních). Nejvyšší tkáňové koncentrace jsou naměřeny v kostech (převody jednotek pro vyjádření koncentrace boru a BA – tab. 1). Vazebnost na plazmatické bílkoviny je zanedbatelná. Uváděné hodnoty distribučního objemu (Vd) jsou značně variabilní v závislosti na citovaném literárním zdroji: dle Jansena a kol. (1984) [6] je celkový Vd přibližně 1 l/kg, zatímco Dart a kol. (2004) [7] uvádějí Vd v rozmezí 0,17–0,5 l/kg. K metabolizaci BA nedochází z důvodu potřeby vysoké energie na rozrušení vazby mezi borem a kyslíkem, je tedy vylučována v nezměněné podobě ledvinami glomerulární filtrací. Hodnota renální clearance je ovlivněna tubulární reabsorpcí. Zdá se, že význam reabsorce v renálních tubulech klesá s rostoucí plazmatickou koncentrací boru. Celková clearance se ve studii Jansena a kol. z roku 1984 [6] po jednorázovém intravenózním podání 562–611 mg BA dospělým dobrovolníkům pohybovala okolo 55 ml/min/1,73 m2. Průměrný poločas eliminace BA je 13 hodin s rozmezím 4–28 hodin. Více než 90 % BA je vyloučeno v nezměněné podobě ledvinami za 96 hodin [2,4,8–10].
Po absorpci je BA prostřednictvím difuze rychle distribuována do extracelulární a intracelulární tekutiny. Maximální plazmatické koncentrace je dosaženo přibližně dvě hodiny po perorálním podání. Koncentrace boru v měkkých tkáních jsou srovnatelné s koncentracemi v plazmě (v tukové tkáni je vzhledem k nízkému obsahu vody dosahováno nižších koncentrací ve srovnání s koncentracemi v jiných měkkých tkáních). Nejvyšší tkáňové koncentrace jsou naměřeny v kostech (převody jednotek pro vyjádření koncentrace boru a BA – tab. 1). Vazebnost na plazmatické bílkoviny je zanedbatelná. Uváděné hodnoty distribučního objemu (Vd) jsou značně variabilní v závislosti na citovaném literárním zdroji: dle Jansena a kol. (1984) [6] je celkový Vd přibližně 1 l/kg, zatímco Dart a kol. (2004) [7] uvádějí Vd v rozmezí 0,17–0,5 l/kg. K metabolizaci BA nedochází z důvodu potřeby vysoké energie na rozrušení vazby mezi borem a kyslíkem, je tedy vylučována v nezměněné podobě ledvinami glomerulární filtrací. Hodnota renální clearance je ovlivněna tubulární reabsorpcí. Zdá se, že význam reabsorce v renálních tubulech klesá s rostoucí plazmatickou koncentrací boru. Celková clearance se ve studii Jansena a kol. z roku 1984 [6] po jednorázovém intravenózním podání 562–611 mg BA dospělým dobrovolníkům pohybovala okolo 55 ml/min/1,73 m2. Průměrný poločas eliminace BA je 13 hodin s rozmezím 4–28 hodin. Více než 90 % BA je vyloučeno v nezměněné podobě ledvinami za 96 hodin [2,4,8–10].
Biologická aktivita BA je pravděpodobně zprostředkována afinitou k cis‑hydroxyskupinám, které jsou součástí velkého množství sloučenin. Tvorbou komplexů s glykolipidy, glykoproteiny a fosfoinositidy zasahuje BA do membránové integrity a redoxního metabolismu [11]. Přesný mechanismus toxického působení není plně objasněn, BA může negativně ovlivňovat buněčný metabolismus prostřednictvím inhibice tvorby adenosintrifosfátu (ATP) [1]. Projevy toxicity jsou nejvíce pozorovány ve tkáních, kde je dosahováno vysokých koncentrací, tedy v ledvinách, mozku, GIT a játrech [12]. Akutní předávkování se nejčastěji projevuje nežádoucími účinky na GIT – gastroenteritidou s nevolností, zvracením a průjmem, které mohou být modrozelené barvy. Dále se vyskytují neurologické nežádoucí účinky, např. bolest hlavy, slabost, neklid, podrážděnost, křeče (častější po vysokých dávkách a při chronické intoxikaci) a ospalost. Také se může objevit kožní erytém, deskvamace a renální toxicita ve formě akutní tubulární nekrózy (zejména po expozici velké dávce), hepatotoxické postižení bývá vzácné. Chronické předávkování je zpravidla závažnější než akutní. Chronická intoxikace se projevuje stejnými nežádoucími účinky jako akutní s převahou dermatologických (nejčastější), renálních a neurologických. Velké dávky BA nebo chronická expozice mohou mít za následek exfoliativní dermatitidu s erytémem zvaným „boiled lobster syndrome“ s manifestací typicky na hýždích, šourku, ústní sliznici, periorálně a análně. Gastrointestinální nežádoucí účinky se zpravidla projevují krátce po požití (po dermální absorpci BA může být nástup GIT obtíží opožděn v řádu několika hodin), erytém do 24 hodin. Plné rozvinutí kožních projevů toxicity může trvat 3–5 dní. Při předávkování vysokými dávkami BA dochází následkem dehydratace a šoku k závažným projevům toxicity, jako jsou kardiovaskulární kolaps, křeče, kóma, oligurie až anurie, tyto projevy mohou končit i fatálně [8,13–17].
Terapie předávkování sloučeninami boru je pouze podpůrná a odvíjí se od tíže symptomů. Neexistuje žádné specifické antidotum, použití aktivního uhlí je málo efektivní [18]. Vzhledem k vlastnostem BA (malá molekula, nízká vazba na plazmatické bílkoviny, vysoká rozpustnost ve vodě, relativně malý distribuční objem a poměrně vysoká renální clearance) lze s výhodou použít hemodialýzu [19]. V kazuistických sděleních je zmiňováno použití tekutinové resuscitace a forsírované diurézy [12]. Hemodialýza je indikována zejména při oligurickém selhání ledvin, výrazné tekutinové či minerálové dysbalanci nereagující na konvenční terapii, při závažných klinických příznacích a při sérové koncentraci BA vyšší než 200 000 µg/l [20]. Corradi a kol. (2010) [21] v kazuistickém sdělení popisují, že časné použití hemodialýzy nebo forsírované diurézy je dobré zvážit i u pacientů bez známek renálního selhání po závažné intoxikaci BA k prevenci renálního poškození a jeho komplikací. Teshima a kol. (1992) [4] uvádějí, že při akutní intoxikaci BA byl poločas eliminace BA 13,46 hodiny (clearance 17 ml/min) a při použití low‑flux dialyzační membrány byl zkrácen na 3,76 hodiny (clearance 59 ml/min). Naderi a Palmer (2006) [22] prezentovali případ intoxikace s použitím high‑flux dialyzační membrány s poločasem eliminace 0,33 hodiny a průměrnou clearance 274 ml/min.
Kazuistika
64letý muž v dlouhodobé péči chirurgické kliniky pro špatně se hojící defekt po hemikorporektomii provedené v květnu 2016.
Během hospitalizace byla v defektech opakovaně vykultivována bakterie Pseudomonas aeruginosa citlivá jen ke kolistinu. Dne 1. listopadu 2016 byla při převazu na operačním sále provedena nekrektomie a exkochleace, dále proběhla kontrola defektu plastickým chirurgem a bylo doporučeno použít při převazech lokální terapii BA. Dne 3. listopadu byla rána poprvé ošetřena BA. Dle zápisu v dokumentaci pacient od 4. listopadu neměl chuť k jídlu a opětovně zvracel tekutiny (700 ml), břicho bylo klidné, bez známek peritoneálního dráždění, bez ileózních fenoménů, močil, stolice byla naředěná. Pacient se jinak cítil dobře naladěný, bez bolestí a obtíží s dýcháním, zánětlivé parametry byly nízké. Dne 5. listopadu pacient stále neměl chuť k jídlu a zvracel (900 ml čiré vody a hleny). Téhož dne byl proveden další převaz (defekt klidný, povrchové povlaky zatím neodloučeny) s aplikací jodové masti v makrogolovém základu a zásypu BA. Následující den (6. listopadu) přetrvávaly nauzea a vomitus (300 ml čiré vody a hleny), pacient se necítil dobře.
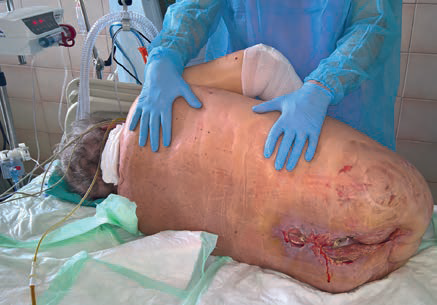 Z důvodu nejasné etiologie gastrointestinálních symptomů byl konzultován klinický farmaceut k vyloučení polékové etiologie: medikace byla v popsaném období beze změny kromě nově zavedené lokální terapie BA. S ošetřujícím personálem byly diskutovány způsob aplikace a velikost podané dávky BA při jednotlivých převazech. Vzhledem k rozsahu defektu (obr. 1) bylo zjištěno, že ve dnech 3. a 5. listopadu bylo pokaždé aplikováno 25 g BA (tj. 1 kelímek), tedy celkem 50 g, a protože k absorpci BA dochází i lokálně přes porušenou pokožku, byla vyjádřena suspekce na možný systémový nežádoucí účinek a doporučeno při převazech již neaplikovat BA. Dále bylo doporučeno stanovení plazmatické koncentrace BA. Dne 8. listopadu pacient neměl chuť k jídlu, nauzea stále trvala, ale již nezvracel. Ráno 9. listopadu pacient udával zlepšení stavu s chutí k jídlu.
Z důvodu nejasné etiologie gastrointestinálních symptomů byl konzultován klinický farmaceut k vyloučení polékové etiologie: medikace byla v popsaném období beze změny kromě nově zavedené lokální terapie BA. S ošetřujícím personálem byly diskutovány způsob aplikace a velikost podané dávky BA při jednotlivých převazech. Vzhledem k rozsahu defektu (obr. 1) bylo zjištěno, že ve dnech 3. a 5. listopadu bylo pokaždé aplikováno 25 g BA (tj. 1 kelímek), tedy celkem 50 g, a protože k absorpci BA dochází i lokálně přes porušenou pokožku, byla vyjádřena suspekce na možný systémový nežádoucí účinek a doporučeno při převazech již neaplikovat BA. Dále bylo doporučeno stanovení plazmatické koncentrace BA. Dne 8. listopadu pacient neměl chuť k jídlu, nauzea stále trvala, ale již nezvracel. Ráno 9. listopadu pacient udával zlepšení stavu s chutí k jídlu.
Komentář
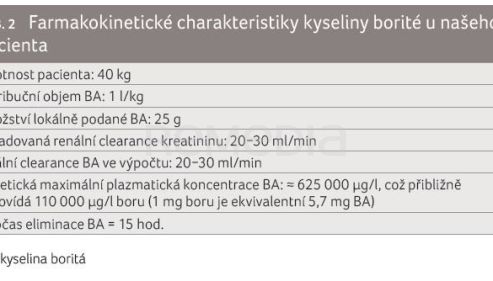 Průměrný denní příjem boru v běžné stravě je v našich zeměpisných podmínkách udáván v rozmezí 0,8–1,9 mg/den [23]. Fyziologická sérová koncentrace boru se pohybuje mezi 30–100 µg/l, u dětí může být dosaženo hodnoty až 1 250 µg/l [2,24]. Plazmatická koncentrace BA bohužel u našeho pacienta z důvodu nedostupnosti vyšetření nebyla stanovena. Proto byl vypočítán alespoň přibližný poločas eliminace po jednorázovém lokálním podání 25 g BA k posouzení rychlosti eliminace a odeznívání GIT symptomů (tab. 2). Vzhledem ke způsobu první aplikace (krystalická BA) a rozsahu defektů jsme pro potřeby našeho výpočtu počítali se 100% absorpcí.
Průměrný denní příjem boru v běžné stravě je v našich zeměpisných podmínkách udáván v rozmezí 0,8–1,9 mg/den [23]. Fyziologická sérová koncentrace boru se pohybuje mezi 30–100 µg/l, u dětí může být dosaženo hodnoty až 1 250 µg/l [2,24]. Plazmatická koncentrace BA bohužel u našeho pacienta z důvodu nedostupnosti vyšetření nebyla stanovena. Proto byl vypočítán alespoň přibližný poločas eliminace po jednorázovém lokálním podání 25 g BA k posouzení rychlosti eliminace a odeznívání GIT symptomů (tab. 2). Vzhledem ke způsobu první aplikace (krystalická BA) a rozsahu defektů jsme pro potřeby našeho výpočtu počítali se 100% absorpcí.
Minimální letální dávky po perorálním podání BA jsou 15–20 g pro dospělé, 2–6 g pro děti v závislosti na jejich věku [8]. V dostupné literatuře jsou popisovány případy úspěšné léčby intoxikace i po užití dávek BA převyšujících uvedené hodnoty. Šestadvacetiletá žena požila v suicidálním úmyslu 36 g BA. Do nemocnice byla přivezena s obleněným vědomím, horečkou a erytémem 14 hodin po ingesci. Použití forsírované diurézy s furosemidem a zavedení intravenózní hydratace vedly k ústupu obtíží [25]. Dvaaosmdesátiletý pacient byl přijat k hospitalizaci po neúmyslném požití 30 g BA, v rámci úspěšné terapie intoxikace byla použita forsírovaná diuréza a hemodialýza [21].
Symptomy toxicity jsou popisovány při plazmatických koncentracích BA obvykle vyšších než 20 000 µg/l (3 500 µg/l boru) [20]. Tento údaj je ovšem značně nespolehlivý, protože autoři citovaného článku vycházeli z kazuistických sdělení, kde byla většina plazmatických koncentrací BA uvedena bez času odběru, nemuselo se tedy jednat o peakové koncentrace. Litovitz a kol. (1988) [8] uvádějí, že v 784 případech požití BA byly naměřeny její koncentrace 70 000 µg/l nebo vyšší pouze u sedmi pacientů, z nichž čtyři byli asymptomatičtí, zatímco tři zbývající trpěli jen nauzeou či zvracením. U žádného pacienta se nevyvinuly závažné projevy toxicity a 88,3 % intoxikací bylo zcela asymptomatických.
Linden a kol. (1986) [26] popsali případ intoxikace 35leté ženy, která v sebevražedném úmyslu požila 80 g BA, po půlhodině od intoxikace došlo ke spontánnímu zvracení a objevil se flush v obličeji. Plazmatická koncentrace BA po jedné hodině od intoxikace dosahovala 2 320 000 µg/l, jiné symptomy intoxikace se u pacientky neobjevily.
Mezi další problémy s interpretací plazmatických koncentrací se řadí poměrně nízký počet případů předávkování v jednotlivých skupinách (děti vs. dospělí vs. chronická vs. akutní intoxikace). Proto pravděpodobně většina doporučených postupů k intoxikaci sloučeninami boru uvádí, že stanovení plazmatické koncentrace vypovídá pouze o tom, zda k expozici došlo, avšak nekoreluje s mírou intoxikace. Dle našich zkušeností má obecně stanovování plazmatických koncentrací při intoxikacích význam nejen k potvrzení, že k předávkování skutečně došlo, ale také k určení schopnosti eliminace u konkrétního pacienta a k ověření efektivity použité metody léčby intoxikace. První koncentrace BA by měla být v ideálním případě u akutní intoxikace změřena přibližně 2–4 hodiny po perorálním požití (pravděpodobný čas dosažení maximální plazmatické koncentrace).
U našeho pacienta by při 100% biologické dostupnosti bylo možné teoreticky dosáhnout maximální plazmatické koncentrace BA 625 000 µg/l (po první aplikaci). Vzhledem k lokálnímu podání, a tedy pomalému vstřebávání BA (postupné rozpouštění krystalů v ráně) a zachované eliminační schopnosti ledvin bylo pravděpodobně dosaženo nižší koncentrace. Abychom situaci dokázali konkretizovat, zvolili jsme distribuční objem 1 l/kg, k této hodnotě nás vedly následující předpoklady: BA je rychle distribuována difuzí do tělesných tekutin a dobře prokrvených tkání, při pozvolné absorpci velkého množství BA z místa podání do krve bude současně docházet k distribuci z plazmy do periferních kompartmentů. Renální insuficience znamenala také delší poločas eliminace a pomalejší pokles plazmatické koncentrace BA (nemuselo docházet k tak rychlému přesunu BA zpět z periferních tkání do centrálního kompartmentu). Ale vzhledem k akutní intoxikaci a omezené délce expozice BA mohl být reálný distribuční objem menší. Při akutní intoxikaci po perorálním podání bude dosaženo rychleji peakové koncentrace a u pacienta s dobrými renálními parametry a/nebo při použití dialýzy bude díky rychlému vylučování BA výsledný Vd nižší, což je v souladu se závěry studie, jejímiž autory byli Teshima a kol. (1992) [4], kde distribuční objem činil 0,25 l/kg při použití dialýzy 16 hodin po akutní ingesci 21 g BA. Ke kumulaci a rozvoji projevů intoxikace BA u našeho pacienta mohl přispět jak nižší distribuční objem (pacient po hemikorporektomii, tělesná hmotnost 40 kg), tak současná renální insuficience − odhadovaná glomerulární filtrace 20–30 ml/min. U pacienta s normálními renálními funkcemi bude docházet k poměrně rychlé a efektivní eliminaci již při probíhající absorpci. Nedostatečný průtok moči (zhoršené renální parametry) a dehydratace zvyšují riziko toxicity BA [27].
V případě našeho pacienta se jednalo o akutní systémovou toxicitu, kde je dominantním nežádoucím účinkem toxicita gastrointestinální. Po přerušení aplikace BA došlo k postupnému odeznění gastrointestinálních projevů do čtyř dnů po ukončení terapie, což je v souladu s odhadovaným poločasem eliminace (tj. 15 hod., za 5 plazmatických poločasů je BA z těla vyloučena).
Rozpoznání otravy sloučeninami boru může být obtížné především při absenci kvalitní anamnézy [12]. Vzhledem k podrobně odebrané anamnéze v našem kazuistickém sdělení (časová souslednost aplikace BA a GIT obtíží, žádná jiná nově přidaná medikace, infekční či alimentární etiologie obtíží byla nepravděpodobná) se i bez stanovení plazmatické koncentrace boru jeví intoxikace BA jako vysoce pravděpodobná. Doporučení k lokálnímu použití BA vychází často ze studií in vitro založených pouze na dobré laboratorní mikrobiální citlivosti, a nikoliv na prokázané efektivitě a bezpečnosti v klinickém prostředí [28,29]. Na základě tohoto případu bylo na daném pracovišti od podávání samotné BA definitivně upuštěno.
Literatura
[1] Lank PM, Wahl M. Boric acid. Encyclopedia of Toxicology (Third Edition) 2014; 533–535.
[2] Murray FJ. A comparative review of the pharmacokinetics of boric acid in rodents and humans. Biol Trace Elem Res 1998; 66: 331–341.
[3] George AJ. Toxicity of boric acid through skin and mucous membranes. Food Cosmet Toxicol 1965; 3: 99–101.
[4] Teshima D, Morishita K, Ueda Y, et al. Clinical management of boric acid ingestion: pharmacokinetics assessment of efficacy of hemodialysis for treatment of acute boric acid poisoning. J Pharmacobiodyn 1992; 15: 287–294.
[5] Wester RC, Hui X, Hartway T, et al. In vivo percutaneous absorption of boric acid, borax and disodium octaborate tetrahydrate in humans compared to in vitro absorption in human skin from infinite and finite doses. Toxicol Sci 1998; 45: 42–51.
[6] Jansen JA, Andersen J, Schou JS. Boric acid single dose pharmacokinetics after intravenous administration to man. Arch Toxicol 1984; 55: 64–67.
[7] Dart RC, Caravati EM, Whyte IM, et al. Medical Toxicology (Third Edition): Chapter 204 Boron Compounds. Lippincott Williams & Wilkins 2004; 1320–1324.
[8] Litovitz TL, Klein‑Schwartz W, Oderda GM, et al. Clinical manifestations of toxicity in a series of 784 boric acid ingestions. Am J Emerg Med 1988; 6: 209–213.
[9] Pahl MV, Culver BD, Vaziri ND. Boron and the kidney. J Ren Nutr 2005; 15: 362–370.
[10] Usuda K, Kono K, Orita Y, et al. Serum and urinary boron levels in rats after single administration of sodium tetraborate. Arch Toxicol 1998; 72: 468–474.
[11] Vertolli U, Alessi M, Naso E, et al. A very unique case of boric acid intoxication with very high‑magnitude rhabdomyolysis. Iran J Kidney Dis 2017; 11: 256–257.
[12] Webb DV, Stowman AM, Patterson JW. Boric acid ingestion clinically mimicking toxic epidermal necrolysis. J Cutan Pathol 2013; 40: 962–965.
[13] Goldbloom RB, Goldbloom A. Boric acid poisoning: report of four cases and a review of 109 cases from the world literature. J Pediatr 1953; 43: 631–643.
[14] Gordon AS, Prichard JS, Freedman MH. Seizure disorders and anemia associated with chronic borax intoxication. Can Med Assoc J 1973; 108: 719–721.
[15] Lung D, Clancy C. “Boiled lobster” rash of acute boric acid toxicity. Clin Toxicol 2009; 47: 432.
[16] O’Sullivan K, Taylor M. Chronic boric acid poisoning in infants. Arch Dis Child 1983; 58: 737–739.
[17] Schillinger BM, Berstein M, Goldbern LA, et al. Boric acid poisoning. J Am Acad Dermatol 1982; 7: 667–673.
[18] Oderda GM, Klein‑Schwartz W, Insley BM. In vitro study of boric acid and activated charcoal. J Toxicol Clin Toxicol 1987; 25: 13–19.
[19] Pedicelli S, Picca S, Di Nardo M, et al. Treatment of boric acid overdose in two infants with Continuous Venovenous Hemodialysis. Clin Toxicol 2015; 53: 920–922.
[20] Baker MD, Bogema SC. Ingestion of boric acid by infants. Am J Emerg Med 1986; 4: 358–361.
[21] Corradi F, Brusasco C, Palermo S, et al. A case report of massive acute boric acid poisoning. Eur J Emerg Med 2010; 17: 48–51.
[22] Naderi ASA, Palmer BF. Successful treatment of a rare case of boric acid overdose with hemodialysis. Am J Kidney Dis 2006; 48: e95–e97.
[23] Pizzorno L. Nothing boring about boron. Integr Med (Encinitas) 2015; 14: 35–48.
[24] Fisher RS, Freimuth HC. Blood boron levels in human infants. J Invest Dermatol 1958; 30: 85–86.
[25] Teshima D, Taniyama T, Oishi R. Usefulness of forced diuresis for acute boric acid poisoning in an adult. J Clin Pharm Ther 2001; 26: 387–390.
[26] Linden CH, Hall AH, Kulig KW, et al. Acute ingestions of boric acid. J Toxicol Clin Toxicol 1986: 24: 269–279.
[27] Restuccio A, Mortensen ME, Kelley MT. Fatal ingestion of boric acid in an adult. Baker MD, Bogema SC. Ingestion of boric acid by infants. Am J Emerg Med 1992; 10: 545–547.
[28] Nagoba B, Davane M. Boric acid‑could it be a potential topical antiseptic agent? Wound Care Manage 2018; 5: 1–2.
[29] Pirhan Y, Cihangiroglu M. Investigation of In Vitro efficacy of boric acid on Pseudomonas aeruginosa strains isolated from diabetic foot infections. Mediterr J Infect Microb Antimicrob 2021; 10: 5.