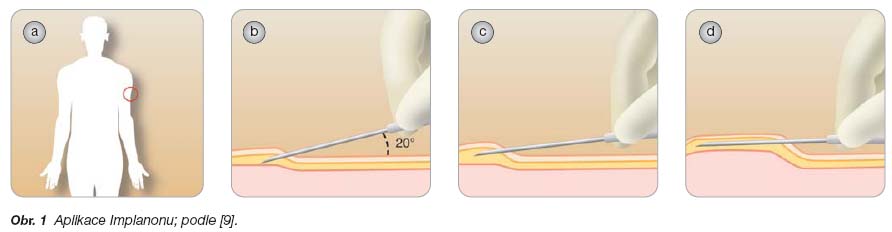
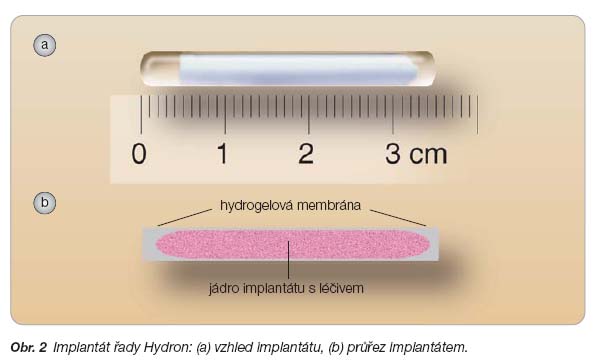
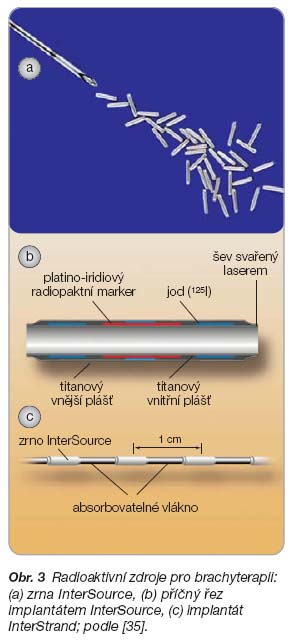
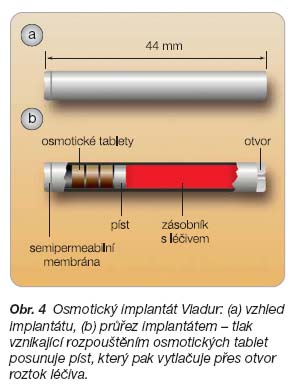
Implantáty jako lékové transportní systémy – klinické uplatnění implantátů obsahujících léčivo
Implantáty obsahující léčivo se v současné době uplatňují v řadě klinických oborů. Již řadu let se používají jako prostředky hormonální antikoncepce. Významnou úlohu hrají tyto systémy rovněž při léčbě hormonálních poruch a v terapii nádorových onemocnění. V posledních letech roste jejich význam v takových oblastech, jako je oftalmologie či ortopedie, a obzvlášť rychle se ukotvily v kardiochirurgii stenty uvolňující léčivo. Cílem článku je představit většinu přípravků dostupných na trhu a některé nové systémy ve stadiu klinických zkoušek.
Seznam použité literatury
- [1] Masteiková R, Chalupová Z, Dvořáčková K, Bernatonienė J. Implantáty jako lékové transportní systémy – teoretické aspekty implantátů obsahujících léčivo. Remedia 2008; 18: 252–258.
- [2] Harrison PF, Rosenfield A. Contraceptive research, introduction, and use. Lessons from Norplant. Washington, National Academy Press, 1998.
- [3] Croxatto HB. Progestin implants for female contraception. Contraception 2002; 65: 15–19.
- [4] Shastri PV. Toxicology of polymers for implant contraceptives for women. Contraception 2002; 65: 9–13.
- [5] Sitruk-Ware R. Delivery options for contraceptives. DDT 2005; 10: 977–985.
- [6] Sivin I, Nash H, Waldman S. Jadelle levonorgestrel rod implants: A summary of scientific data and lessons learned from programmatic experience. New York: Population Council, 2002.
- [7] Croxatto HB, Makarainen L. The pharmacodynamics and efficacy of Implanon. A overview of the data. Contraception 1998; 58: 91–97.
- [8] Weisberg E, Fraser I. Australian women s experience with Implanon. Aust Fam Physician 2005; 34: 694–696.
- [9] Souhrn údajů o přípravku. Implanon. www.sukl.cz
- [10] Amory JK. Contraceptive developments for men. Drugs Today 2007; 43: 179–192.
- [11] Brady BM, Walton M, Hollow N, et al. Depot testosterone with etonogestrel implants result in induction of azoospermia in all men for long-term contraception. Human Reprod 2004; 19: 2658–2667.
- [12] Wang C, Wang XH, Nelson AL, et al. Levonorgestrel implants enhanced the suppression of spermatogenesis by testosterone implants: Comparison between Chinese and non-Chinese men. J Clin Endocrinol Metab 2006; 91: 460–470.
- [13] Gonzalo IT Gaw, Swerdloff RS, Nelson AL, et al. Levonorgestrel implants (Norplant II) for male contraception clinical trials: Combination with transdermal and injectable testosterone. J Clin Endocrinol Metab 2002; 87: 3562–3572.
- [14] Brady BM, Amory JK, Perheentupa A, et al. A multicentre study investigating subcutaneous etonogestrel implants with injectable testosterone decanoate as a potential long-acting male contraceptive. Human Reprod 2006; 21: 285–294.
- [15] Anderson RA, Kinniburch D, Baird DT. Suppression of spermatogenesis by etonogestrel implants with depot testosterone: Potential for long-acting male contraception. J Clin Endocrinol Metab 2002; 87: 3640–3649.
- [16] Pöllänen P, Nikkanen V, Huhtaniemi I. Combination of subcutaneous levonorgestrel implants and transdermal dihydrotestosterone gel for male hormonal contraception. Int J Androl 2001; 24: 369–380.
- [17] Nelson HD, Humphrev LL, Nygren P, et al. Postmenopausal hormone replacement therapy: scientific review. JAMA 2002; 288: 872–881.
- [18] Delanev MF. Srategies for the prevention and treatment of osteoporosis during early postmenopause. Am J Obstet Gynecol 2006; 194 (Suppl. 2): S12–23.
- [19] Souhrn údajů o přípravku. Riselle. www.sukl.cz
- [20] Eugster EA, Clarke W, Kletter GB, et al. Efficacy and safety of histrelin subdermal implant in children with central precocious puberty: a multicentral trial. J Clin Endocrinol Metab 2007; 92: 1697–1704.
- [21] Hirsh HJ, Gillis D, Strich D, et al. The histrelin implant: a novel treatment for central precocious puberty. Pediatrics 2005; 116: e798–e802.
- [22] Supprelin LA. Full Prescribing Information. www.supprelinla.com
- [23] Octreotide implant. www.indevus.com
- [24] Mcleod DG. Hormonal therapy: historical perspective to future directions. Urology 2003; 61 (Suppl. 1): 3–7.
- [25] www.svod.cz
- [26] Dušek P. Zhoubné nádory prostaty. www.linkos.cz
- [27] Heysek RV. Modern brachytherapy for treatment of prostate cancer. Cancer Control 2007; 14: 238–243.
- [28] Bottomley D, Ash D, Al-Quaisieh B, et al. Side effects of permanent I125 prostate seed implants in 667 patients treated in Leeds. Radiother Oncol 2007; 82: 46–49.
- [29] Zelefsky MJ, Kuban DA, Levy LB, et al. Multi-institutional analysis of long-term outcome for stages T1-T2 prostate cancer treated with permanent seed implantation. Int J Radiat Oncol Biol Phys 2007; 67: 327–333.
- [30] Kollmeier MA, Stock RG, Stone N. Biochemical outcomes after prostate brachytherapy with 5-year minimal follow-up importance of patient selection and implant quality. Int J Radiat Oncol Biol Phys 2003; 57: 645–653.
- [31] Prestidge BR, Bice WS, Jurkovic I, et al. Cesium-131 permanent prostate brachytherapy: An initial report. Int J Radiat Oncol Biol Phys 2005; 63 (Suppl. 1): S336–S337.
- [32] Prestidge BR, Bice WS. Clinical outcomes of a phase II, multiinstitutional Cesium-131 permanent prostate brachytherapy trial. Brachytherapy 2007; 6: 78.
- [33] Bernard S, Vynckieer S. Dosimettric study of a new polymer encapsulated palladium-103 seed. Phys Med Biol 2005; 50: 1493–1504.
- [34] Wang Z, Hertel NE. Determination of dosimetric characteristics of OptiSeed™ a plastic brachytherapy (103)Pd source. Appl Radiat Isot 2005; 63: 311–321.
- [35] www.kcsolid.cz/zdravotnictvi/brachyterapie/brachyterapie-index.htm
- [36] Berges R, Bello U. Effect of a new leuprorelin formulation on testosterone levels in patients with advanced prostate cancer. Curr Med Res Opin 2006; 22: 649–655.
- [37] Zinner NR, Bidair M, Centeno A, Tomera K. Similar frequency of testosterone surge after repeat injections of goserelin (Zoladex) 3,6 mg and 10,8 mg: Results of a randomized open-label trial. Urology 2004; 64: 1177–1181.
- [38] Marks LS. Luteinizing hormone-releasing hormone agonists in the treatment of men with prostate cancer: timing, alternatives, and the 1-year implant. Urology 2003; 62 (Suppl. 1): 36–42.
- [39] Dineen MK, Tierney DS, Kuzma P, Pentikis HS. An evaluation of the pharmakokinetics and pharmacodynamics of the histrelin implant for the palliative treatment of prostate cancer. J Clin Pharmacol 2005; 45: 1245–1249.
- [40] Souhrn údajů o přípravku (Eligard 7,5 mg, Eligard 22,5 mg, Eligard 45 mg). www.sukl.cz
- [41] Zoladex in the treatment of prostate cancer. Monograph. www.astrazeneca.com
- [42] Souhrn údajů o přípravku (Zoladex depot 3,6 mg). www.sukl.cz
- [43] The road to Viadur™ ALZA s DUROS® implant technology. Delivery Times 2001; 1: 1–4.
- [44] Vantas (histrelin implant). Prescription information. Valera Pharmaceuticals, Inc., 2004.
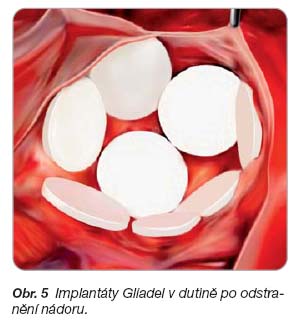
- [45] Perry J, Chambers A, Spithhoff K, Laperriere N. Gliadel wafers in the treatment of malignant glioma: a systematic review. Curr Oncol 2007; 14: 189–194.
- [46] Westphal M, Ram Z, Riddle V, et al. Gliadel wafer in initial surgery for malignant glioma: long-term follow-up of multicenter controlled trial. Acta Neurochir (Wien) 2006; 148: 269–275.
- [47] GLIADEL Wafer. Prescription information. MGI Pharma, 2007.
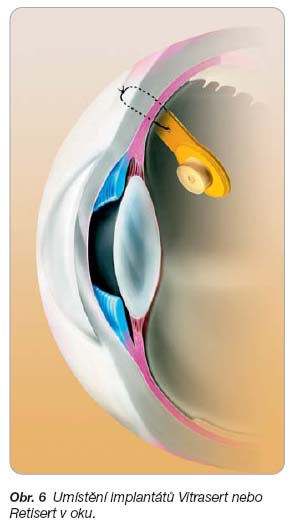
- [48] Chang M, Dunn JP. Ganciclovir implant in the treatment of cytomegalovirus retinitis. Expert Rev Med Devices 2005; 2: 421–427.
- [49] Vitrasert Implant PDR Information. Bausch & Lomb Inc., 2000.
- [50] Kappel PJ, Charonis AC, Holland GN, et al. Outcomes associated with ganciclovir implants in patients with AIDS-related cytomegalovirus retinitis. Ophthalmol 2006; 113: 673–683.
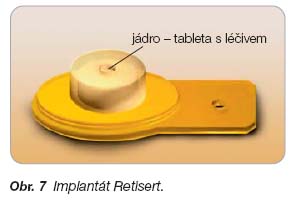
- [51] Jaffe GJ, Martin D, Callanan D, et al. Fluocinolone acetonide implant (Retisert) for noninfectious posterior uveitis: thirty-four-week results of multicenter randomized clinical study. Ophthalmol 2006; 113: 1020–1027.
- [52] RETISERT™ (fluocinolone acetonide intravitreal implant). Prescription information. www.retisert. com
- [53] Brumn MV, Nguyen QD. Fluocinolone acetonide intravitreal sustained release device – a new addition to the armamentarium of uveitic management. Int J Nanomed 2007; 2: 55–64.
- [54] Lee SY, Chee SP, Balakrishnan V, et al. Surodex in paediatric cataract surgery. Br J Ophthalmol 2003; 87: 1424–1426.
- [55] Seah SKL, Husain R, Gazzard G, et al. Use of Surodex in phacotrabeculectomy surgery. Am J Ophthalmol 2005; 139: 927–928.
- [56] Kuppermann BD. Implants can deliver corticosteroids, pharmacologic agents. Retina Today 2007; 3: 27–31.
- [57] www.alimerasciences.com/medidur_overview.asp
- [58] Medidur™ – a novel second generation treatment for vision impartment. www.psivida.com
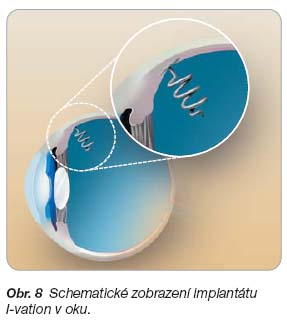
- [59] I-vation™ sustained drug delivery system: intravitreal implant for drug delivery. www.surmodics.com
- [60] MacDonald IM, Sauvé Y, Sieving PA. Preventing blindness in retinal diseasye: ciliary neurotrophic factor intraocular implants. Can J Ophthalmol 2007; 42: 399–402.
- [61] ETC Technology. www.neurotechusa.com
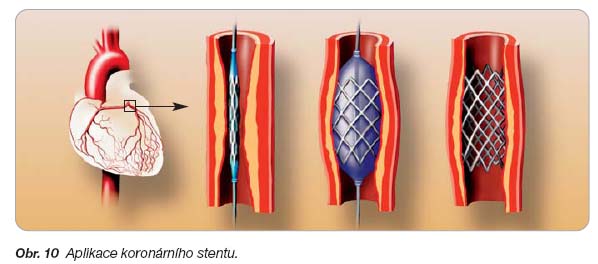
- [62] Šimek S, Aschermann M, Horák J, et al. Koronární stenty uvolňující farmaka (DES – Drug Eluting Stents) – revoluce v léčbě ischemické choroby srdeční. Remedia 2004; 14: 153–157.
- [63] Sousa JE, Serruys PW, Costa MA. New frontiers in cardiology. Drug-eluting stents: Part I. Circulation 2003; 107: 2274–2279.
- [64] Van der Hoeven BL, Pires NMM, Warda HM, et al. Drug-eluting stents: results, promises and problems. Int J Cardiol 2005; 99: 9–17.
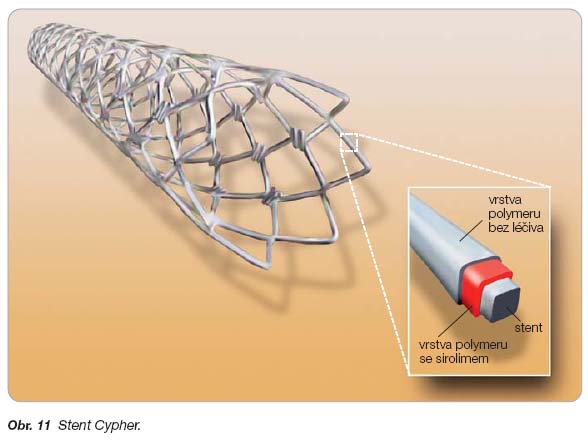
- [65] Acharya G, Park K. Mechanisms of controlled drug release from drug-eluting stents. Adv Drug Deliv Rev 2006; 58: 387–401.
- [66] Kamath KR, Barry JJ, Miller KM. The Taxus™ drug-eluting stent: A new paradigm in controlled drug delivery. Adv Drug Deliv Rev 2006; 58: 412–436.
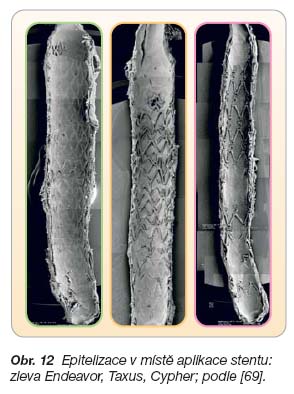
- [67] Stone GW, Midei M, Newman W, et al. Comparison of an Everolimus-Eluting Stent and a Paclitaxel-Eluting Stent in Patients With Coronary Artery Disease. JAMA 2008; 299: 1903–1913.
- [68] Burke SE, Kuntz RE, Schwartz LB. Zotarolimus (ABT-578) eluting stents. Adv Drug Deliv Rev 2006; 58: 437–446.
- [69] wwwp.medtronic.com/Newsroom/?〈=en_US
- [70] Bosiers M, Deloose K, Verbist J, Peeters P. Will absorbable metal stent technology change our practice? J Cardiovasc Surg (Torino) 2006; 47: 393–397.
- [71] Waksman R. Update on bioabsorbable stents: from bench to clinical. J Interv cardiol 2006; 19: 414–421.
- [72] Erbel R, Di Mario C, Bartunek J, et al. Temporary scaffolding of coronary arteries with bioabsorbable magnesium stents: a prospective, non-randomised multicentre trial. Lancet 2007; 369: 1869–1875.
- [73] Kalina K, et al. Drogy a drogové závislosti. Úřad vlády ČR 2003.
- [74] Hulse GK, Tait RJ, Comer SD, et al. Reducing hospital presentations for opioid overdose in patients treated with sustained release naltrexone implants. Drug Alcohol Dependence 2005; 79: 351–357.
- [75] Hulse GK, Arnold-Reed DE, O Neil G, et al. Achieving long-term continuous blood naltrexone and 6-beta-naltrexol coverage following sequential naltrexone implants. Addict Biol 2004; 9: 67–72.
- [76] Naltrexone implant. www.indevus.com
- [77] Lloyd-Jones M. Naltrexone implants: a clinician s view. Of Substance 2006; 4: 22–23.
- [78] Go Medical ONeil naltrexone implant. www.naltrexone.com
- [79] Olsen L, Christophersen AS, Frogopsahl G, et al. Plasma concentrations during naltrexone implant treatment of opiate-dependent patients. Br J Clin Pharmacol 2004; 58: 219–222.
- [80] Campoccia D, Montanaro L, Arciola CA. The significance of infection related to orthopedic devices and issues of antibiotic resistance. Biomaterials 2006; 27: 2331–2339.
- [81] Van de Belt H, Neut D, Schenk W, et al. Infection of orthopedic implants and the use of antibiotic-loaded bone cements. Acta Orthop Scand 2001; 72: 557–571.
- [82] Passuti N, Gouin F. Antibiotic-loaded bone cement in orthopedic surgery. Joint Bone Spine 2003; 70: 169–174.
- [83] Souhrn údajů o přípravku. Garamycin Schwamm. www.sukl.com
- [84] Cui Q, Mihalko WM. Antibiotic-impregnated cement spacers for the treatment of infection associated with total hip or knee arthroplasty. J Bone Joint Surg Am 2007; 89: 871–882.
- [85] White AP, Vaccaro AR, Hall JA, et al. Clinical applications of BMP-7/OP-1 in fractures, nonunions and spinal fusion. Int Orthopaed 2007; 31: 735–741.
- [86] Garrison KR, Donell S, Ryder J, et al. Clinical effectiveness and cost-effectiveness of bone morphogenic proteins in the non-healing of fractures and spinal fusion: a systematic review. Health Technol Assess 2007; 11: 1–168.
- [87] McKay WF, Peckham SM, Badura JM. A comprehensive clinical review of recombinant human bone morphogenic protein-2 (INFUSE® Bone Graft). Int Orthopaed 2007; 31: 727–734.
- [88] Souhrn údajů o přípravku. www.emea.europa.eu/ humandocs/Human/EPAR/inductos/inductos.htm
- [89] Souhrn údajů o přípravku. www.emea.europa.eu/ humandocs/Human/EPAR/osigraft/osigraft.htm