Imunorekonstituční zánětlivý syndrom v souvislosti s léčbou fingolimodem u roztroušené sklerózy
Souhrn
Lapka M. Imunorekonstituční zánětlivý syndrom v souvislosti s léčbou fingolimodem u roztroušené sklerózy. Remedia 2023; 33: 234–239.
Fingolimod je perorální chorobu modifikující lék schválený k léčbě relabující‑remitující roztroušené sklerózy. Látka moduluje sfingosin‑1‑fosfátový receptor a způsobuje sekvestraci lymfocytů, čímž mimo jiné vykazuje imunosupresivní účinek, snižuje počet cirkulujících lymfocytů a predisponuje pacienty ke vzniku bakteriálních a virových infekcí. Imunorekonstituční zánětlivý syndrom (IRIS) je souhrnem zánětlivých poruch spojených s paradoxním zhoršením již existujících infekčních procesů. Na vznik IRIS lze pohlížet jako na komplikaci léčby progresivní multifokální leukoencefalopatie. Objevuje se týdny nebo měsíce po ukončení podávání imunosupresiv, což se projevuje stavy od získané imunodeficience až po imunitní rekonstituci. Tato práce analyzuje možné riziko rozvoje IRIS po léčbě fingolimodem nebo po jejím přerušení na základě dostupného přehledu literatury a elektronického monitorování reakcí na úrovni Evropské lékové agentury s hodnocením jednotlivých nahlášených kazuistik.
Klíčová slova: fingolimod – roztroušená skleróza – imunorekonstituční zánětlivý syndrom.
Summary
Lapka M. Immune reconstitution inflammatory syndrome related to the treatment of multiple sclerosis using fingolimod. Remedia 2023; 33: 234–239.
Fingolimod is an oral disease‑modifying drug approved for the treatment of relapsing‑remitting multiple sclerosis. The substance modulates the sphingosine‑1‑phosphate receptor and causes lymphocyte sequestration, which, among other things, exhibits an immunosuppressive effect, reduces the number of circulating lymphocytes, and predisposes patients to bacterial and viral infections. IRIS (immune reconstitution inflammatory syndrome) is a collection of inflammatory disorders associated with a paradoxical worsening of already existing infectious processes. The development of IRIS can be seen as a complication of the treatment of progressive multifocal leukoencephalopathy. It appears weeks or months after stopping immunosuppressants, which manifests itself in various ways from acquired immunodeficiency to a state of immune reconstitution. This work evaluated the possible risk of IRIS after the use or withdrawal of fingolimod using an available literature review and electronic monitoring of reactions at the level of the European Medicines Agency with the evaluation of individual reported case reports.
Key words: fingolimod – multiple sclerosis – immune reconstitution inflammatory syndrome.
Úvod
Fingolimod je perorální chorobu modifikující lék (disease‑modifying drug, DMD) schválený k léčbě relabující‑remitující roztroušené sklerózy (RR‑RS). Látka moduluje sfingosin‑1‑fosfátový receptor a způsobuje sekvestraci lymfocytů, čímž mimo jiné vykazuje imunosupresivní účinek, snižuje počet dostupných cirkulujících lymfocytů a kromě oportunních infekcí predisponuje pacienty ke vzniku vzácných bakteriálních a virových infekcí [1]. Jedná se o první perorálně podávaný DMD, což představuje určitou výhodu oproti ostatním lékům této skupiny, jež se podávají subkutánně nebo intravenózně. Dvě rozsáhlé dvojitě zaslepené, randomizované studie fáze III prokázaly vyšší účinnost fingolimodu oproti placebu (FREEDOMS a FREEDOMS II) nebo intramuskulárně podávanému interferonu beta‑1a (IFNβ‑1a; jednoletá a rozšířená studie TRANSFORMS). Fingolimod snížil roční míru relapsů a zpomalil progresi neurologického postižení u RR‑RS [2,3].
Imunorekonstituční zánětlivý syndrom
Imunorekonstituční zánětlivý syndrom (immune reconstitution inflammatory syndrome, IRIS) je souhrnem zánětlivých poruch spojených s paradoxním zhoršením již existujících infekcí, přičemž s termínem se pojí synonyma jako nemoc imunitní obnovy, nemoc (syndrom) imunitní rekonstituce atd. Termín IRIS byl poprvé použit u pacientů s RS jakožto komplikace progresivní multifokální leukoencefalopatie (PML), která se objevila při ukončení podávání natalizumabu a spočívala v paradoxní zánětlivé reakci [4]. U pacientů s pozitivitou HIV (virus lidské imunodeficience) se ale pod pojmem IRIS rozumí záněty spojené s paradoxním zhoršením existující infekce po zahájení antiretrovirové terapie (antiretroviral therapy, ART) [5]. U pacientů s HIV a M. avium complex se mohou po ART objevit zánětlivé reakce [6]. Podobně se objevily případy IRIS s projevy leishmaniózy u pacientů s pokročilým syndromem získaného selhání imunity (AIDS), kteří zahájili ART [7]. Fingolimod sice zvyšuje riziko vzniku závažných mykotických a virových infekcí, včetně PML, nicméně jejich výskyt je vzácný [8].
Na vznik IRIS lze pohlížet jako na komplikaci nadměrné imunitní reakce v centrálním nervovém systému infikovaném John Cunningham virem (JCV) po ukončení léčby fingolimodem z důvodu rozvoje PML. Naproti tomu „rebound“ představuje zvýšení aktivity onemocnění po ukončení léčby na míru vyšší, než byla před zahájením terapie, a je charakteristický aktivitou na magnetické rezonanci (MR) nebo progresí neurologického nálezu. Zároveň se zde nabízí racionální otázka, proč se rebound klasifikuje jako IRIS. Existuje zde totiž riziko mísení těchto dvou fenoménů a je potřeba oba v kontextu léčby fingolimodem rozlišit.
Progresivní multifokální leukoencefalopatie
Progresivní multifokální leukoencefalopatie představuje jeden z nejzávažnějších nežádoucích účinků u pacientů s RR‑RS léčených DMDs. Je známo, že zejména natalizumab zvyšuje riziko rozvoje PML v závislosti na přítomnosti JCV v séru a na délce léčby [9]. Progresivní multifokální leukoencefalopatie byla hlášena u natalizumabu a rituximabu [10] stejně jako u fingolimodu a dimetylfumarátu, i když s výrazně nižším rizikem [11]. Fingolimod se stal volbou u pacientů, kteří ukončili léčbu natalizumabem, a případy PML po léčbě fingolimodem mohou představovat „přenesený“ účinek natalizumabu [12]. První případ PML po užívání fingolimodu bez předchozí léčby natalizumabem byl popsán v roce 2013. Jednalo se o 49letého muže, u kterého se PML objevila po přibližně čtyřletém užívání fingolimodu. Dalším případem byl 54letý muž se čtrnáctiletou anamnézou RS, u kterého se PML rozvinula po 2,5letém užívání fingolimodu. Třetí případ představovala 51letá žena s RR‑RS, která byla tři roky léčena fingolimodem [13].
Progresivní multifokální leukoencefalopatie a IRIS
Jak již bylo nastíněno v předchozí části, riziko výskytu IRIS lze očekávat po ukončení léčby fingolimodem z důvodu rozvoje PML (PML‑related IRIS, PML‑IRIS). Klinický obraz je charakterizován rychlým zhoršením neurologického deficitu v důsledku imunitní odpovědi na antigen JCV, která vede k masivní destrukci infikovaných i neinfikovaných tkání [14-16]. PML‑IRIS způsobuje významnou morbiditu a téměř u třetiny pacientů končí úmrtím [17].
Další případy PML‑IRIS během léčby fingolimodem souvisely s předchozí léčbou natalizumabem. Killestein a kol. referovali o 52letém pacientovi s RR‑RS, který byl převeden na fingolimod z natalizumabu [18]. Časem se u pacienta objevily parciální epileptické záchvaty následované únavou a slabostí levé ruky a zpětně byla identifikována chyba nediagnostikovaného PML na MR. Kazuistiky naznačují, že PML‑IRIS se objevuje při nízkém stavu lymfocytů nebo při lymfopenii během léčby fingolimodem po ukončení podávání natalizumabu [19,20].
Pro účely této práce byl vyhotoven literární přehled k vyhodnocení dosavadních informací o riziku výskytu IRIS při léčbě fingolimodem nebo po jejím ukončení. Dalším nástrojem k vyhledávání informací bylo tzv. elektronické monitorování reakcí (electronic Reaction Monitoring Report, eRMR) na úrovni Evropské lékové agentury (EMA). eRMR je nástroj k detekci bezpečnostních signálů v systému EudraVigilance. Nástroj poskytuje souhrnné údaje týkající se hlášení individuálních případů vložených do systému EudraVigilance, které jsou stratifikovány podle různých parametrů a zahrnují poměr šancí, tzv. reporting odds ratio (ROR), jakožto statistické měřítko [21]. Cílem článku je zpracovat tyto dva dostupné zdroje a diskutovat, zda se u zmíněných kazuistik objevil PML‑IRIS, tj. zhoršení stavu po ukončení léčby fingolimodem kvůli PML, případně zda se jednalo o rebound aktivity nemoci po přerušení terapie fingolimodem.
Metodika
Vyhledání literatury
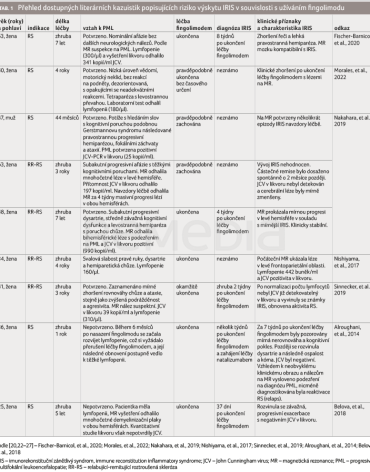 K vyhledávání odborných zdrojů včetně kazuistik a vědecké literatury byly použity databáze PubMed, Scopus a Web of Science s periodou do konce června 2022 za použití termínů „fingolimod“ a „immune reconstitution inflammatory syndrome“ včetně alternativních názvů. Vyhledání identifikovalo celkem 119 publikací. Z těchto bylo po přečtení abstraktů použito 41 k další analýze. Po následném pročtení fulltextů a vyfiltrování duplicit a nerelevantních dat bylo identifikováno sedm způsobilých kazuistik popisujících problematiku IRIS v souvislosti s léčbou fingolimodem nebo s jejím ukončením. Přehled literárních kazuistik je shrnut v tabulce 1.
K vyhledávání odborných zdrojů včetně kazuistik a vědecké literatury byly použity databáze PubMed, Scopus a Web of Science s periodou do konce června 2022 za použití termínů „fingolimod“ a „immune reconstitution inflammatory syndrome“ včetně alternativních názvů. Vyhledání identifikovalo celkem 119 publikací. Z těchto bylo po přečtení abstraktů použito 41 k další analýze. Po následném pročtení fulltextů a vyfiltrování duplicit a nerelevantních dat bylo identifikováno sedm způsobilých kazuistik popisujících problematiku IRIS v souvislosti s léčbou fingolimodem nebo s jejím ukončením. Přehled literárních kazuistik je shrnut v tabulce 1.
Využití eRMR v systému EudraVigilance
Pro účely článku byl v červnu 2022 využit nástroj eRMR v rámci systému EudraVigilance s aktivní látkou fingolimod k retrospektivní analýze hlášených podezření na nežádoucí účinky za zpětné období 12 měsíců. V detailu je nástroj popsán na oficiálním webu EMA [21]. Ve stejném období bylo získáno hodnocení (ROR) a byla zanalyzována všechna příslušná pacientská hlášení z této databáze. ROR popisuje pravděpodobnost výskytu určité události u sledované látky ve srovnání s pravděpodobností výskytu stejné události u ostatních látek v databázi. Pokud je například ROR roven hodnotě 3, pravděpodobnost hlášení této události u sledované látky je třikrát vyšší než pravděpodobnost hlášení stejné reakce u ostatních hlášení. Přehled spontánních hlášení získaných z EudraVigilance je shrnut v tabulce 2.
Výsledky
Literární rešerše
Z celkem sedmi literárních zdrojů bylo popsáno devět pacientů s RS - osm žen a jeden muž. Většina pacientů se nacházela ve skupině dospělých ve věku 18-64 let, konkrétně převážně ve věku nad 40 let. Kazuistiky popsaly rozmezí délky denní léčby fingolimodem od jednoho roku do sedmi let. Většina článků popsala výskyt IRIS od desítek dní po několik týdnů po ukončení léčby fingolimodem. U dvou kazuistik [22,23] se setkáváme s IRIS bez potvrzení PML. Podrobnější přehled literárních kazuistik popisujících souvislost mezi užíváním fingolimodu a diagnostikovaným IRIS přináší tabulka 1.
Hlášení z evropského systému EudraVigilance
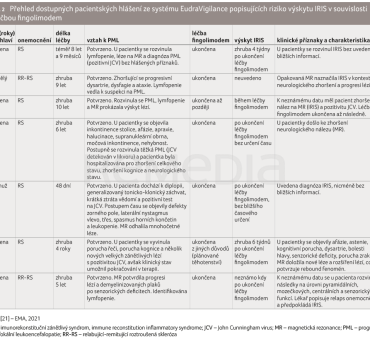 Celkem bylo ve sledovaném období, tedy v jednom roce zpětně do června 2022, zachyceno na úrovni databáze EudraVigilance dvacet pacientských hlášení na podezření na nežádoucí účinek související s léčbou fingolimodem. Po odstranění duplicit a výše uvedených literárních článků (které systém také zachycuje) zbylo ve finálním vzorku devět pacientských hlášení. Tři hlášení byla získána z klinických studií, zbytek byla tzv. spontánní hlášení. Z těchto devíti pacientů bylo sedm žen a dva muži. Jedna kazuistika zachycující případ padesátileté ženy s diagnózou RR‑RS není řádně popsána a chybějí symptomy, klinický stav, medikace a diagnóza. U další kazuistiky známe pouze stáří a pohlaví (53 let, žena). Z těchto důvodů byly oba hlášené případy vyřazeny ze seznamu. Většina pacientů (5) byla ve skupině mezi 18-64 lety, jeden byl starší 65 let a u dalšího víme pouze to, že se jedná o dospělého jedince. Délka užívání fingolimodu byla v rozpětí od několika dní po několik let. U většiny případů se IRIS objevil během léčby fingolimodem a v převážné většině byla léčba ukončena. Ve většině případů byla diagnostikována PML, pouze u jednoho případu se zdá, že podávání fingolimodu bylo ukončeno kvůli plánovanému těhotenství. Podrobnější přehled přináší tabulka 2.
Celkem bylo ve sledovaném období, tedy v jednom roce zpětně do června 2022, zachyceno na úrovni databáze EudraVigilance dvacet pacientských hlášení na podezření na nežádoucí účinek související s léčbou fingolimodem. Po odstranění duplicit a výše uvedených literárních článků (které systém také zachycuje) zbylo ve finálním vzorku devět pacientských hlášení. Tři hlášení byla získána z klinických studií, zbytek byla tzv. spontánní hlášení. Z těchto devíti pacientů bylo sedm žen a dva muži. Jedna kazuistika zachycující případ padesátileté ženy s diagnózou RR‑RS není řádně popsána a chybějí symptomy, klinický stav, medikace a diagnóza. U další kazuistiky známe pouze stáří a pohlaví (53 let, žena). Z těchto důvodů byly oba hlášené případy vyřazeny ze seznamu. Většina pacientů (5) byla ve skupině mezi 18-64 lety, jeden byl starší 65 let a u dalšího víme pouze to, že se jedná o dospělého jedince. Délka užívání fingolimodu byla v rozpětí od několika dní po několik let. U většiny případů se IRIS objevil během léčby fingolimodem a v převážné většině byla léčba ukončena. Ve většině případů byla diagnostikována PML, pouze u jednoho případu se zdá, že podávání fingolimodu bylo ukončeno kvůli plánovanému těhotenství. Podrobnější přehled přináší tabulka 2.
eRMR
Retrospektivně za jeden kalendářní rok (report získán v červnu 2022) bylo zaznamenáno 20 nových hlášení v Eudra-
Vigilance, přičemž všechna tato hlášení byla závažná. Kumulativně bylo v databázi identifikováno 97 hlášení. Pro sledované 12měsíční období vyšla hodnota ROR 8,63, což znamená 8,63× větší pravděpodobnost výskytu IRIS v souvislosti s léčbou fingolimodem oproti ostatním látkám registrovaným na území EU, a tedy zahrnutým v databázi EudraVigilance.
Diskuse
Progresivní multifokální leukoencefalopatie je u pacientů s RS léčených fingolimodem bez předchozí imunosupresivní léčby vcelku vzácná. Patologické rysy PML asociované s fingolimodem u RS zahrnují imunitní reakce, které jsou podobné jako při léčbě natalizumabem. Byly rovněž publikovány případy PML u pacientů užívajících dimetylfumarát [28], okrelizumab nebo alemtuzumab [29] bez předchozí expozice natalizumabu. S normalizací počtu lymfocytů v krvi může dojít k rozvoji příznaků IRIS a obnovení aktivity RS. V tomto případě se zvětšování lézí PML zastavilo po ukončení léčby fingolimodem souběžně s normalizací počtu lymfocytů a rozvojem příznaků IRIS [20].
Imunorekonstituční zánětlivý syndrom se může rozvíjet několik týdnů po ukončení léčby fingolimodem, nicméně projevy jsou většinou mírné a dlouhodobé. Je důležité si uvědomit, že fingolimod nezabraňuje vzniku IRIS u přenesené PML způsobené natalizumabem [30], a dokonce zintenzivňuje potřebu řádného sledování pacientů pomocí MR i po relativně delší době po přerušení léčby natalizumabem [18]. Při přerušení léčby fingolimodem je navíc doporučena opatrnost a zdá se, že zkrácení wash‑out periody na 4-6 týdnů při přechodu z fingolimodu na jiný DMD by mohlo minimalizovat reaktivaci RS a zabránit akutní fázi IRIS [22]. Alroughani a kol. popsali kazuistiku naznačující diagnózu IRIS vzhledem k prudkému nárůstu počtu lymfocytů po ukončení léčby fingolimodem, což bylo spojeno s rychlým klinickým a radiologickým zhoršením. Stupeň zánětu po přerušení léčby svědčil o rychlém přílivu imunitních buněk řídících zánětlivou odpověď. IRIS je pravděpodobně důsledkem redistribuce lymfocytů do cílových tkání po obnovení imunitní funkce. Zde je náročné odlišit IRIS od obvyklé aktivity onemocnění, zejména u pacientů, kteří dostávali natalizumab, a PML nelze vyloučit [22].
V neposlední řadě je vhodné zmínit souvislost mezi projevy IRIS a hodnotami lymfocytů, jelikož u některých pacientů s IRIS může nadále přetrvávat lymfopenie. Úloha lymfopenie v podpoře rozvoje IRIS není dosud dobře vysvětlena ani u pacientů s HIV, u nichž byl fenomén popsán jako první, a pravděpodobně se mechanismus může lišit v závislosti na samotném typu IRIS. Citlivost pacientů k IRIS po ukončení inhibice tumor nekrotizujícího faktoru (TNF) poskytuje jeden pohled na obecný fenomén tzv. rekonstituce. Imunosuprese u HIV pozitivních pacientů zdůrazňuje skutečnost, že samotná infekce pravděpodobně není pro vývoj IRIS vůbec nutná. Existence IRIS u infikovaných pacientů s normální hodnotou T lymfocytů argumentuje proti hypotéze, že IRIS pramení z vývoje dysregulovaných odpovědí CD4+ T lymfocytů v lymfopenickém prostředí. Zde hraje TNF roli mediátoru IRIS, jelikož náchylnost k IRIS v tomto nastavení závisí především na nepřítomnosti TNF signalizace. Jinými slovy, v souvislosti s infekcí vzniká citlivost k patologii vyvolané TNF, když anti‑TNF terapie zpočátku chyběla. Rekonstituční syndromy spojené s protilátkovou blokádou jsou v tomto ohledu podobné: TNF je nutný ke kontrole M. tuberculosis, ale obnovení signalizace TNF postupně vede k rozvoji IRIS. Migrace lymfocytů do místa infekce je nutná ke kontrole JCV, ale obnovení migrace lymfocytů odstraněním natalizumabu je příčinou vzniku IRIS spojeného s PML. V každém případě ztráta formy imunitní reakce vede k neschopnosti tolerovat tuto reakci. Pochopení mechanismu, proč k intoleranci dochází, může vysvětlit, z jakého důvodu jsou imunitní reakce, které jsou pro pacienta za normálních okolností prospěšné, během IRIS patogenní [31].
Závažná zánětlivá povaha plaků na MR a prudké zvýšení počtu lymfocytů poskytly u dalších autorů důvody k názoru, že exacerbace onemocnění byla projevem IRIS. Termín „rebound“ označuje projevy po ukončení podávání léku, přičemž termín „imunitní rekonstituční zánětlivý syndrom“ je patogenetickým základem těchto projevů. Pokud se exacerbace RS týkají přerušení imunomodulační léčby, oba tyto termíny mají v praxi stejný význam, nicméně imunologické mechanismy IRIS s různými formami RS jsou pravděpodobně odlišné. Nabízí se tak význam identifikace rizikových faktorů pro rozvoj IRIS a stanovení jasných pravidel pro přechod z jednoho léku na druhý, což by vyžadovalo prospektivní studie a určení definic a diagnostických kritérií (klinických, imunologických, neurozobrazovacích) pro IRIS a rebound fenomén [23].
Věk se ukazuje jako důležitý faktor. Všichni pacienti ve studiích s PML byli starší 45 let. Stejně jako u dimetylfumarátu jsou pacienti s fingolimodem přibližně o 10 let starší než pacienti s PML indukovanou natalizumabem [32]. Dalším důležitým faktorem je délka léčby, jelikož většina pacientů dostávala fingolimod déle než tři roky.
Práce se pokusila identifikovat dostupné kazuistiky popisující výskyt IRIS bez klinického rozlišení původu reakce související se zahájením léčby fingolimodem. K této metodice sloužilo tzv. eRMR, které naznačilo na základě disproporce více než osmkrát vyšší pravděpodobnost reakce právě v souvislosti s touto léčbou. Na druhou stranu je nutno podotknout, že dané hodnocení je s přihlédnutím ke klinickým souvislostem daleko komplikovanější, navíc se IRIS ukazuje jako velice složitá diagnóza, která bývá bezdůvodně zaměňována s rebound fenoménem.
Závěr
Fingolimod je široce používaným přípravkem pro léčbu pacientů s RR‑RS a jeho perorální podání představuje proti parenterální formě určitou výhodu. Klíčové studie fáze III ukázaly, že fingolimod je účinný ve srovnání s placebem nebo IFNβ‑1a a je obecně dobře snášen. Je však potřeba shromáždit dlouhodobá postmarketingová data k dalšímu posouzení jeho bezpečnostního profilu.
Několik kazuistik popsalo pacienta s RS, u kterého se po přerušení léčby fingolimodem vyvinul IRIS (rebound aktivita) nebo PML‑IRIS navzdory trvalé lymfopenii. Tato skutečnost je důležitá nejen pro účely farmakovigilance, a to u všech léčiv používaných v léčbě RS. Namístě je připomenout farmakovigilanční iniciativu Státního ústavu pro kontrolu léčiv z dřívějších let, kdy byl lékařům předepisujícím natalizumab distribuován balíček obsahující informace o riziku rozvoje PML‑IRIS a kartu pacienta.
Literatura
[1] Comi G, Hartung HP, Bakshi R, et al. Benefit‑risk profile of Sphingosine‑1‑Phosphate receptor modulators in relapsing and secondary progressive multiple sclerosis. Drugs 2017; 77: 1755–1768.
[2] Cohen JA, Barkhof F, Comi G, et al. Oral fingolimod or intramuscular interferon for relapsing multiple sclerosis. N Engl J Med 2010; 362: 402–415.
[3] Radue EW, O’Connor P, Polman CH, et al. Impact of fingolimod therapy on magnetic resonance imaging outcomes in patients with multiple sclerosis. Arch Neurol 2012; 69: 1259–1269.
[4] Shelburne SA, Montes M, Hamill RJ. Immune reconstitution inflammatory syndrome: more answers, more questions. J Antimicrob Chemother 2006; 57: 167−170.
[5] Hirsch HH, Kaufmann G, Sendi P, Battegay M. Immune reconstitution in HIV‑infected patients. Clin Infect Dis 2004; 38: 1159.
[6] Phillips P, Bonner S, Gataric N, et al. Nontuberculous mycobacterial immune reconstitution syndrome in HIV‑infected patients: spectrum of disease and long‑term follow‑up. Clin Infect Dis 2005; 41: 1483.
[7] Posada‑Vergara MP, Lindoso JAL, Tolezano JE, et al. Tegumentary leishmaniasis as a manifestation of immune reconstitution inflammatory syndrome in 2 patients with AIDS. J Infect Dis 2005; 192: 1819.
[8] Ontaneda D, Moore A, Bakshi R, et al. Risk estimates of progressive multifocal leukoencephalopathy related to fingolimod [Abstract P1775]. Mult Scler 2018; 24(2 Suppl): 981–1026.
[9] Plavina T, Subramanyam M, Bloomgren G, et al. Anti‑JC virus antibody levels in serum or plasma further define risk of natalizumab‑associated progressive multifocal leukoencephalopathy. Ann Neurol 2014; 76: 802–812.
[10] Carson KR, Focosi D, Major EO, et al. Monoclonal antibody‑associated progressive multifocal leucoencephalopathy in patients treated with rituximab, natalizumab, and efalizumab: a Review from the Research on Adverse Drug Events and Reports (RADAR) Project. Lancet Oncol 2009; 10: 816–824.
[11] Berger JR. Classifying PML risk with disease modifying therapies. Mult Scler Relat Disord 2017; 12: 59–63.
[12] Dubey D, Cano CA, Stüve O. Update on monitoring and adverse effects of approved second‑generation disease‑modifying therapies in relapsing forms of multiple sclerosis. Curr Opin Neurol 2016; 29: 278–285.
[13] Gyang TV, Hamel J, Goodman AD, et al. Fingolimod‑associated PML in a patient with prior immunosuppression. Neurology 2016; 86: 1843–1845.
[14] Gheuens S, Smith DR, Wang X, et al. Simultaneous PML‑IRIS after discontinuation of natalizumab in a patient with MS. Neurology 2012; 78: 1390–1393.
[15] Kleinschmidt‑DeMasters BK, Miravalle A, Schowinsky J, et al. Update on PML and PML‑IRIS occurring in multiple sclerosis patients treated with natalizumab. J Neuropathol Exp Neurol 2012; 71: 604–617.
[16] Honce JM, Nagae L, Nyberg E. Neuroimaging of natalizumab complications in multiple sclerosis: PML and other associated entities. Mult Scler Int 2015; 2015: 809252.
[17] Tan IL, McArthur JC, Clifford DB, et al. Immune reconstitution inflammatory syndrome in natalizumab‑associated PML. Neurology 2011; 77: 1061–1067.
[18] Killestein J, Vennegoor A, van Golde AEL, et al. PML‑IRIS during fingolimod diagnosed after natalizumab discontinuation. Case Rep Neurol Med 2014; 2014: 307872.
[19] N’gbo Ikazabo R, Mostosi C, Quivron B, et al. Immune‑reconstitution inflammatory syndrome in multiple sclerosis patients treated with natalizumab: a series of 4 cases. Clin Ther 2016; 38: 670–675.
[20] Sinnecker T, Othman J, Kühl M, et al. Progressive multifocal leukoencephalopathy in a multiple sclerosis patient diagnosed after switching from natalizumab to fingolimod. Case Rep Neurol Med 2016; 2016: 5876798.
[21] Uživatelská příručka EudraVigilance verze 2.1, 17 Feb 2021 (EMA/167839/2016). Evropská léková agentura [online] [cit. 25. 10. 2022]. Dostupné na: https://www.ema.europa.eu/en/documents/regulatory‑procedural‑guideline/eudravigilance‑user‑manual‑marketing‑authorisation‑holders_en.pdf
[22] Alroughani R, Almulla A, Lamdhade S, Thussu A. Multiple sclerosis reactivation postfingolimod cessation: Is it IRIS? BMJ Case Rep 2014; 2014: bcr2014206314.
[23] Belova AN, Rasteryaeva MV, Zhulina NI, et al. Immune Reconstitution Inflammatory Syndrome and Rebound Syndrome on Withdrawal of Immunomodulatory Drugs for Multiple Sclerosis: Current Understanding and a Case Report. Neurosci Behavior Physiol 2018; 48: 693–702.
[24] Fischer‑Barnicol B, Oechtering J, Kuhle J, et al. Combination of teriflunomide and interferon as follow‑up therapy after fingolimod‑associated PML. Neurol Neuroimmunol Neuroinflamm 2020; 8: e927.
[25] Morales RP, Garcia MC, Gutierrez‑Rojas L, Barrero Hernández FJ. Progressive Multifocal Leukoencephalopathy and Immune Reconstitution Inflammatory Syndrome after Discontinuation of Fingolimod. Case Rep Neurol 2022; 14: 38−43.
[26] Nakahara J, Tomaske L, Kume K, et al. Three cases of non‑carryover fingolimod‑PML: Is the risk in Japan increased? Neurol Neuroimmunol Neuroinflamm 2019; 6: e559.
[27] Nishiyama S, Misu T, Shishido‑Hara Y, et al. Fingolimod‑associated PML with mild IRIS in MS: A clinicopathologic study. Neurol Neuroimmunol Neuroinflamm 2017; 5: e415.
[28] Jordan AL, Yang J, Fisher CJ, et al. Progressive multifocal leukoencephalopathy in dimethyl fumarate‑treated multiple sclerosis patients. Mult Scler 2022; 28: 7–15.
[29] Sriwastava S, Kataria S, Srivastava S, et al. Disease‑modifying therapies and progressive multifocal leukoencephalopathy in multiple sclerosis: a systematic review and meta‑analysis. J Neuroimmunol 2021; 15: 360577721.
[30] Yoshii F, Moriya Y, Ohnuki T, et al. eurological safety of fingolimod: An updated review. Clin Exp Neuroimmunol 2017; 8: 233−243.
[31] Barber DL, Andrade BB, Sereti I, Sher A. Immune reconstitution inflammatory syndrome: the trouble with immunity when you had none. Nat Rev Microbiol 2012; 10: 150−156.
[32] Berger JR, Cree BA, Greenberg B, et al. Progressive multifocal leukoencephalopathy after fingolimod treatment. Neurology 2018; 90: e1815–e1821.