Inhibitory SGLT (2. část) – farmakokinetika, metabolismus a transport
Souhrn:
Suchopár J. Inhibitory SGLT (2. část) – farmakokinetika, metabolismus a transport. Remedia 2022; 32: 205–208.
Glifloziny jsou antidiabetika se specifickým metabolismem, který je založen zejména na jejich glukuronizaci. Vzniklé glukuronidy jsou eliminovány především močí, zatímco nemetabolizovaná část gliflozinů se eliminuje převážně žlučí. Nejvýznamnější glukuronosyltransferázou při metabolismu gliflozinů je UGT1A9. Transport gliflozinů se děje zejména cestou efluxních transportních systémů P glykoproteinu, BCRP a MRP2. V metabolismu a transportu gliflozinů jsou poměrně značné rozdíly, z nichž se odvíjejí odlišnosti v potřebě redukce dávek gliflozinů při porušené funkci ledvin nebo jater.
Summary:
Suchopar J. SGLT inhibitors (part 2) – pharmacokinetics, metabolism and transport. Remedia 2022; 32: 205–208.
Gliflozins are antidiabetics with a specific metabolism based mainly on their glucuronidation. The resulting glucuronides are eliminated primarily in the urine, while the unmetabolised part of gliflozins is eliminated mainly in bile. The most important glucuronosyltransferase in gliflozin metabolism is UGT1A9. Gliflozins are principally transported via the efflux transport systems P‑glycoprotein, BCRP and MRP‑2. There are relatively significant differences in gliflozin metabolism and transport, resulting in differences in the need for dose reduction for renal or hepatic impairment.
Key words: sodium‑glucose cotransporter, SGLT1, SGLT2, gliflozins, dapagliflozin, canagliflozin, empagliflozin, ertugliflozin, sotagliflozin, pharmacokinetic properties, cytochrome P‑450, UDP‑glucuronosyltransferase, P‑glycoprotein – BCRP.
Glifloziny patří k léčivům,
která mají – ve srovnání s jinými
léčivy – vcelku neobvyklý způsob metabolizace.
Na rozdíl od jiných skupin antidiabetik se totiž
glifloziny na „cukerné“ části molekuly přímo
glukuronizují a jejich oxidativní metabolismus je malý až
zanedbatelný. Hlavními metabolity gliflozinů jsou tak
3-β-O-glukuronidy (sotagliflozin), respektive 2-β-O-
a 3-β-O-glukuronidy (dapagliflozin, kanagliflozin,
empagliflozin, ertugliflozin).
U gliflozinů je řada farmakokinetických vlastností obdobná, jiné se však poměrně zásadně liší. Shoda panuje v délce působení jednotlivých léčiv, v jejich distribučním objemu, způsobu metabolizace, rozdíly lze nalézt v míře biotransformace, způsobu vylučování, rozpustnosti ve vodě a v lipofilitě. Uvedené rozdíly mohou přispívat k odlišnostem gliflozinů z hlediska jejich potenciálu vyvolávat lékové interakce a také v odlišnosti rizik, která z těchto lékových interakcí plynou. Zda mají tyto rozdíly vliv na klinickou účinnost gliflozinů, není dosud známo.
Základní farmakokinetické
vlastnosti gliflozinů
Glifloziny se po perorálním podávání velmi dobře vstřebávají a jejich biologická dostupnost je obecně vysoká (> 65 %).
Podání gliflozinů po jídle
obvykle vede k mírnému snížení plochy pod křivkou
plazmatické koncentrace (AUC), maximálních plazmatických
koncentrací (cmax) a k prodloužení času
nutného k jejich dosažení (t1/2), tabulka 1
[1–20]. Výjimkou je přitom sotagliflozin, u kterého
podání spolu s vysoce tučným jídlem vedlo k poměrně
významnému nárůstu expozice (přípravek Zynquista) [21].
Držitelé rozhodnutí o registraci doporučují užívat
glifloziny před jídlem (kanagliflozin,
sotagliflozin) nebo nezávisle na jídle (dapagliflozin,
empagliflozin, ertugliflozin).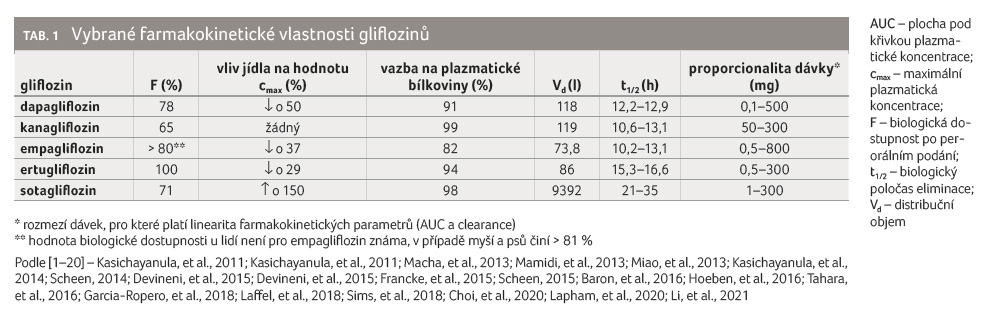
Glifloziny jsou poměrně silně vázány na plazmatické bílkoviny (> 90 %), výjimkou je empagliflozin, jehož vazba je nižší. Všechny glifloziny mají nereálně vysoký distribuční objem (Vd), který významně přesahuje objem tělesné vody, což svědčí o rozsáhlé tkáňové distribuci. Glifloziny mají dlouhý biologický poločas eliminace (t1/2), který umožňuje jejich podávání v jedné denní dávce. Ustáleného stavu je při perorálním podávání gliflozinů dosaženo za 3–5 dnů. Glifloziny mají v širokém dávkovém rozmezí lineární vztah mezi dávkou a farmakokinetickými parametry, jako jsou AUC a celková clearance (tab. 1).
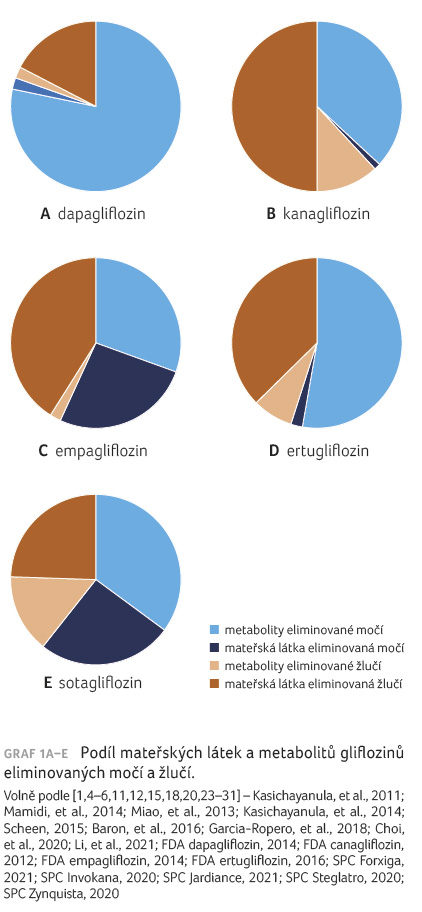
Glifloziny se eliminují jak močí,
tak i žlučí: dapagliflozin převážně močí (74 %),
kanagliflozin převážně žlučí (54 %) a empagliflozin
spolu s ertugliflozinem se přibližně stejnou měrou vylučují
močí a žlučí (tab. 2) [5,10,21–26].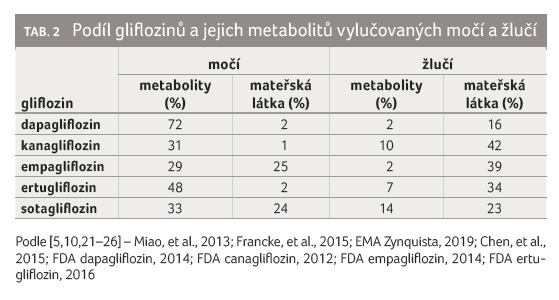
Cesta eliminace a podíl nezměněného léčiva pak mají význam při případné redukci dávky gliflozinu při poruše funkce ledvin a jater. U pacientů s diabetem by obecně při clearance kreatininu (Clcr) < 60 ml/min neměla být terapie glifloziny zahajována, ale může v ní být pokračováno, pokud byla zahájena při Clcr > 60 ml/min. V případě, že dojde k dalšímu poklesu Clcr (< 45 ml/min), měla by být terapie glifloziny ukončena. Podávání gliflozinů u pacientů s těžkou poruchou funkce ledvin není obecně doporučeno, neboť u těchto nemocných dochází k poklesu účinnosti gliflozinů z důvodu snížené glomerulární filtrace (tab. 3) [21,27–36].
Tato omezení však neplatí při
podávání gliflozinů v indikaci srdeční selhání. U těchto
pacientů lze podávat empagliflozin až do Clcr ≥ 20 ml/min,
dapagliflozin až do Clcr ≥ 25 ml/min.
Ostatní glifloziny nemají indikaci srdeční selhání schválenu
a uvedenu v souhrnu údajů o přípravku [27–31].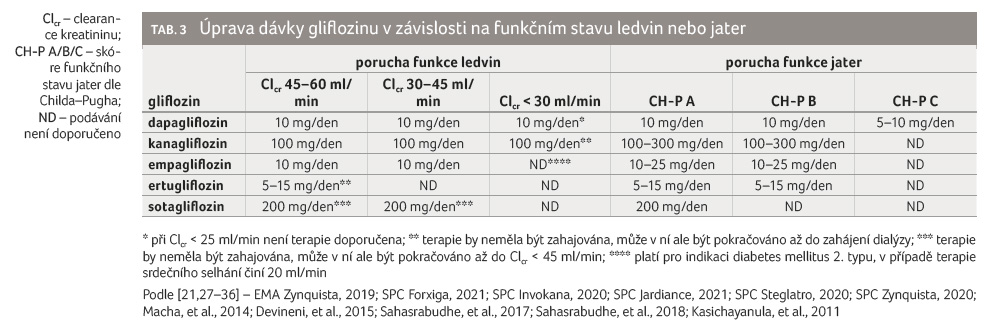
Metabolismus gliflozinů
Oxidační metabolismus gliflozinů je
téměř zanedbatelný. Je zprostředkován cestou cytochromu P450
3A4 (CYP3A4) a z velmi malé části se jej účastní také
další izoenzymy CYP. Konjugace gliflozinů s kyselinou
glukuronovou probíhá cestou UDP-glukuronosyltransferázy 1A9
(UGT1A9) a účastní se jí z menší nebo větší části
i další izoenzymy glukuronosyltransferázy (tab. 4)
[10,19,21,27–31,37,38].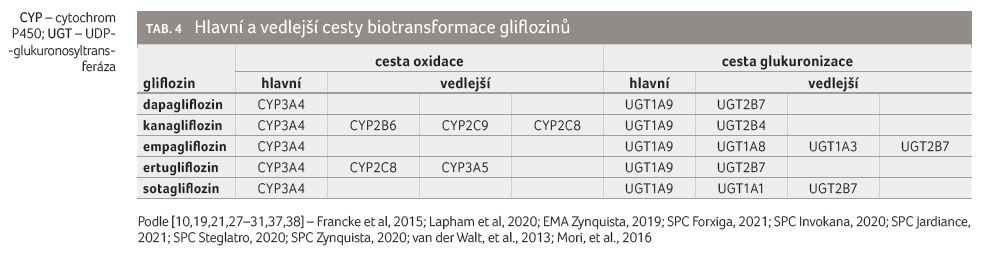
Existence více metabolických cest by měla být výhodnou vlastností v případě lékových interakcí založených na mechanismu inhibice enzymu; této problematice se budeme podrobně věnovat v jednom z dalších článků (Lékové interakce gliflozinů).
Transport gliflozinů
Glifloziny jsou obecně lipofilní látky (rozdělovací koeficient [log P] > 2, jsou tedy nejméně o dva řády rozpustnější v tucích než ve vodě), a proto relativně snadno vstupují do buněk bez nutnosti aktivního transportu. Jistou výjimkou je v tomto ohledu nejméně lipofilní empagliflozin (log P = 1,79), který je substrátem jaterního influxního systému OATP1B1 a OATP1B3 (transportér organických aniontů, organic anion transporting polypeptide), což je významné, neboť 39 % podané dávky empagliflozinu se vylučuje žlučí v nezměněné formě. Všechny glifloziny jsou substráty efluxních transportních systémů P glykoproteinu (P-gp) a BCRP (protein rezistence karcinomu prsu, breast cancer resistance protein).
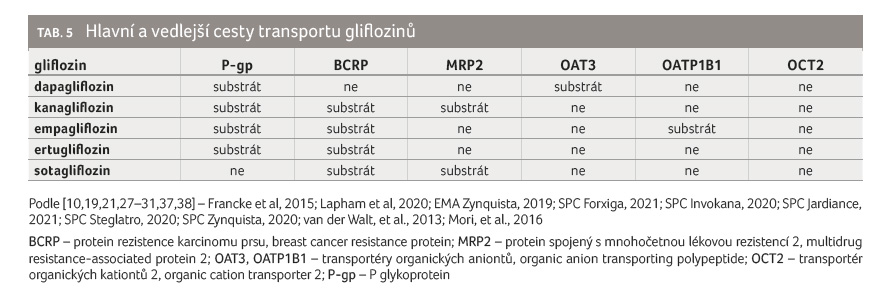
Dapagliflozin a empagliflozin patří dle klasifikace BDDCS (Biopharmaceutics Drug Disposition Classification System) do třídy 1, kanagliflozin patří do třídy 2 [39,40]. Podle fyzikálně-chemických vlastností by ertugliflozin měl být řazen do třídy 1 a sotagliflozin do třídy 2. Z toho vyplývá, že dapagliflozin, empagliflozin a ertugliflozin patří mezi léky, na jejichž osud v organismu mají transportní systémy minimální vliv. N
a druhou stranu zejména nízká rozpustnost ve vodě v případě kanagliflozinu (0,0045 mg/ml) a sotagliflozinu (0,042 mg/ml) ve spojení s jejich vysokou lipofilitou (log P > 3) představuje potenciální riziko lékových interakcí na podkladě mechanismu ovlivnění transportu (tab. 5) [10,19,21,27–
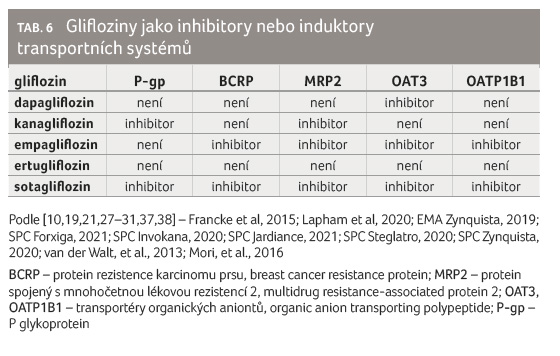
Glifloziny mohou, obvykle slabě, inhibovat některé transportní systém31,37,38]. Také na tomto místě odkazujeme na jeden z dalších článků (Lékové interakce gliflozinů).
y (tab. 6) [10,19,21,27–31,37,38]. Klinicky významná přitom může být inhibice P-gp kanagliflozinem nebo sotagliflozinem, která je prokázána jak in vitro, tak
i in vivo [41,42].
Nejvýznamnější rozdíly farmakokinetických vlastností gliflozinů jsou v eliminaci jednotlivých léčiv, a proto jsou uvedeny v grafu 1A–E k porovnání.
Seznam použité literatury
- [1] Kasichayanula S, Chang M, Hasegawa M, et al. Pharmacokinetics and pharmacodynamics of dapagliflozin, a novel selective inhibitor of sodium-glucose co-transporter type 2, in Japanese subjects without and with type 2 diabetes mellitus. Diabetes Obes Metab 2011; 13: 357–365.
- [2] Kasichayanula S, Liu X, Zhang W, et al. Effect of a high-fat meal on the pharmacokinetics of dapagliflozin, a selective SGLT2 inhibitor, in healthy subjects. Diabetes Obes Metab 2011; 13: 770–773.
- [3] Macha S, Jungnik A, Hohl K, et al. Effect of food on the pharmacokinetics of empagliflozin, a sodium glucose cotransporter 2 (SGLT2) inhibitor, and assessment of dose proportionality in healthy volunteers. Int J Clin Pharmacol Ther 2013; 51: 873–879.
- [4] Mamidi RNVS, Cuyckens F, Chen J, et al. Metabolism and excretion of canagliflozin in mice, rats, dogs, and humans. Drug Metab Dispos 2014; 42: 903–916.
- [5] Miao Z, Nucci G, Amin N, et al. Pharmacokinetics, metabolism, and excretion of the antidiabetic agent ertugliflozin (PF-04971729) in healthy male subjects. Drug Metab Dispos 2013; 41: 445456.
- [6] Kasichayanula S, Liu X, Lacreta F, et al. Clinical pharmacokinetics and pharmacodynamics of dapagliflozin, a selective inhibitor of sodium-glucose co-transporter type 2. Clin Pharmacokinet 2014; 53: 1727.
- [7] Scheen AJ. Evaluating SGLT2 inhibitors for type 2 diabetes: pharmacokinetic and toxicological considerations. Expert Opin Drug Metab Toxicol 2014; 10: 647–663.
- [8] Devineni D, Murphy J, Wang SS, et al. Absolute oral bioavailability and pharmacokinetics of canagliflozin: A microdose study in healthy participants. Clin Pharmacol Drug Dev 2015; 4: 295–304.
- [9] Devineni D, Manitpisitkul P, Murphy J, et al. Effect of food on the pharmacokinetics of canagliflozin, a sodium glucose co-transporter 2 inhibitor, and assessment of dose proportionality in healthy participants. Clin Pharmacol Drug Dev 2015; 4: 279–286.
- [10] Francke S, Mamidi RNVS, Solanki B, et al. In vitro metabolism of canagliflozin in human liver, kidney, intestine microsomes, and recombinant uridine diphosphate glucuronosyltransferases (UGT) and the effect of genetic variability of UGT enzymes on the pharmacokinetics of canagliflozin in humans. J Clin Pharmacol 2015; 55: 1061–1072.
- [11] Scheen AJ. Pharmacokinetics, Pharmacodynamics and Clinical Use of SGLT2 Inhibitors in Patients with Type 2 Diabetes Mellitus and Chronic Kidney Disease. Clin Pharmacokinet 2015; 54: 691–708.
- [12] Baron KT, Sreeraj M, Broedl UC, et al. Population Pharmacokinetics and Exposure-Response (Efficacy and Safety/Tolerability) of Empagliflozin in Patients with Type 2 Diabetes. Diabetes Ther 2016; 7: 455–471.
- [13] Hoeben E, De Winter W, Neyens M, et al. Population Pharmacokinetic Modeling of Canagliflozin in Healthy Volunteers and Patients with Type 2 Diabetes Mellitus. Clin Pharmacokinet 2016; 55: 209–223.
- [14] Tahara A, Takasu T, Yokono M, et al. Characterization and comparison of sodium-glucose cotransporter 2 inhibitors in pharmacokinetics, pharmacodynamics, and pharmacologic effects. J Pharmacol Sci 2016; 130: 159169.
- [15] Garcia-Ropero A, Badimon JJ, Santos-Gallego CG. The pharmacokinetics and pharmacodynamics of SGLT2 inhibitors for type 2 diabetes mellitus: the latest developments. Expert Opin Drug Metab Toxicol 2018; 14: 1287–1302.
- [16] Laffel LMB, Tamborlane WV, Yver A, et al. Pharmacokinetic and pharmacodynamic profile of the sodium-glucose co-transporter-2 inhibitor empagliflozin in young people with Type 2 diabetes: a randomized trial. Diabet Med 2018; 35: 1096–1104.
- [17] Sims H, Smith KH, Bramlage P, Minguet J. Sotagliflozin: a dual sodium-glucose co-transporter-1 and -2 inhibitor for the management of Type 1 and Type 2 diabetes mellitus. Diabet Med 2018; 35: 1037–1048.
- [18] Choi MK, Nam SJ, Ji HY, et al. Comparative Pharmacokinetics and Pharmacodynamics of a Novel Sodium-Glucose Cotransporter 2 Inhibitor, DWP16001, with Dapagliflozin and Ipragliflozin. Pharmaceutics 2020; 12: 268.
- [19] Lapham K, Callegari E, Cianfrogna J, et al. In Vitro Characterization of Ertugliflozin Metabolism by UDP-Glucuronosyltransferase and Cytochrome P450 Enzymes. Drug Metab Dispos 2020; 48: 1350–1363.
- [20] Li Y, Nucci G, Yamamoto Y, et al. Pharmacokinetics and Pharmacodynamics of Ertugliflozin in Healthy Japanese and Western Subjects. Clin Pharmacol Drug Dev 2021; 10: 765776.
- [21] EMA Committee for Medicinal Products for Human Use (CHMP). Assessment Report Zynquista. Procedure No. EMEA/H/C/004889/0000. 2/2019. Dostupné na: https://www.ema.europa.eu/en/documents/assessment-report/zynquista-epar-public-assessment-report_en.pdf
- [22] Chen LZ, Jungnik A, Mao Y, et al. Biotransformation and mass balance of the SGLT2 inhibitor empagliflozin in healthy volunteers. Xenobiotica 2015; 45: 520–529.
- [23] FDA Center for Drug Evaluation and Research. Clinical Pharmacology Biopharmaceutics Review(s). Application Number 202293Orig1s000. Dapagliflozin 11/2013. Dostupné na: https://www.accessdata.fda.gov/drugsatfda_docs/nda/2014/202293Orig1s000ClinPharmR.pdf
- [24] FDA Center for Drug Evaluation and Research. Clinical Pharmacology Biopharmaceutics Review(s). Application Number 204042Orig1s000. Canagliflozin 5/2012. Dostupné na: https://www.accessdata.fda.gov/drugsatfda_docs/nda/2013/204042Orig1s000ClinPharmR.pdf
- [25] FDA Center for Drug Evaluation and Research. Clinical Pharmacology Biopharmaceutics Review(s). Application Number 204629Orig1s000. Empagliflozin 6/2014. Dostupné na: https://www.accessdata.fda.gov/drugsatfda_docs/nda/2014/204629Orig1s000ClinPharmR.pdf
- [26] FDA Center for Drug Evaluation and Research. Clinical Pharmacology Biopharmaceutics Review(s). Application Number 209803Orig1s000. Ertugliflozin 12/2016. Dostupné na: https://www.accessdata.fda.gov/drugsatfda_docs/nda/2017/209803,209805,209806Orig1s000ClinPharmR.pdf
- [27] SPC Forxiga® (dapagliflozin), 3/2021. Dostupné na: https://www.ema.europa.eu/en/documents/product-information/forxiga-epar-product-information_cs.pdf
- [28] SPC Invokana® (kanagliflozin), 1/2020. Dostupné na: https://www.ema.europa.eu/en/documents/product-information/invokana-epar-product-information_cs.pdf
- [29] SPC Jardiance® (empagliflozin), 7/2021. Dostupné na: https://www.ema.europa.eu/en/documents/product-information/jardiance-epar-product-information_cs.pdf
- [30] SPC Steglatro® (ertugliflozin), 8/2020. Dostupné na: https://www.ema.europa.eu/documents/product-information/steglatro-epar-product-information_cs.pdf
- [31] SPC Zynquista® (sotagliflozin), 10/2020. Dostupné na: https://www.ema.europa.eu/en/documents/product-information/zynquista-epar-product-information_cs.pdf
- [32] Macha S, Mattheus M, Halabi A, et al. Pharmacokinetics, pharmacodynamics and safety of empagliflozin, a sodium glucose cotransporter 2 (SGLT2) inhibitor, in subjects with renal impairment. Diabetes Obes Metab 2014; 16: 215–222.
- [33] Devineni D, Curtin CR, Marbury TC, et al. Effect of hepatic or renal impairment on the pharmacokinetics of canagliflozin, a sodium glucose co-transporter 2 inhibitor. Clin Ther 2015; 37: 610–628.
- [34] Sahasrabudhe V, Terra SG, Hickman A, et al. The Effect of Renal Impairment on the Pharmacokinetics and Pharmacodynamics of Ertugliflozin in Subjects With Type 2 Diabetes Mellitus. J Clin Pharmacol 2017; 57: 1432–1443.
- [35] Sahasrabudhe V, Terra SG, Hickman A, et al. Pharmacokinetics of Single-dose Ertugliflozin in Patients With Hepatic Impairment. Clin Ther 2018; 40: 1701–1710.
- [36] Kasichayanula S, Liu X, Zhang W, et al. Influence of hepatic impairment on the pharmacokinetics and safety profile of dapagliflozin: an open-label, parallel-group, single-dose study. Clin Ther 2011; 33: 1798–1808.
- [37] van der Walt JS, Hong Y, Zhang L, et al. A Nonlinear Mixed Effects Pharmacokinetic Model for Dapagliflozin and Dapagliflozin 3-O-glucuronide in Renal or Hepatic Impairment. CPT Pharmacometrics Syst Pharmacol 2013; 2: e42.
- [38] Mori K, Saito R, Nakamaru Y, et al. Physiologically based pharmacokinetic-pharmacodynamic modeling to predict concentrations and actions of sodium-dependent glucose transporter 2 inhibitor canagliflozin in human intestines and renal tubules. Biopharm Drug Dispos 2016; 37: 491–506.
- [39] Shugarts S, Benet L. The Role of Transporters in the Pharmacokinetics of Orally Administered Drugs. Pharm Res 2009; 26: 2039–2054.
- [40] Hosey CM, Chan R, Benet LZ. BDDCS predictions, self-correcting aspects of BDDCS assignments, BDDCS assignment corrections, and classification for more than 175 additional drugs. AAPS 2016; 18: 251–260.
- [41] Devineni D, Manitpisitkul P, Vaccaro N, et al. Effect of canagliflozin, a sodium glucose co-transporter 2 inhibitor, on the pharmacokinetics of oral contraceptives, warfarin, and digoxin in healthy participants. Int J Clin Pharmacol Ther 2015; 53: 41–53.
- [42] DDI Study With Multiple-dose LX4211 and Single Dose Digoxin. Dostupné na: https://clinicaltrials.gov/ct2/show/NCT02300350