Inhibitory SGLT2 (4. část) – lékové interakce gliflozinů
Souhrn:
Suchopár J. Inhibitory SGLT2 (4. část) – lékové interakce gliflozinů. Remedia 2022; 32: 405–408.
Inhibitory SGLT2 (glifloziny) se v organismu metabolizují prakticky jen glukuronidací a jen minimálně oxidativní cestou. Současně jsou některé glifloziny substráty transportních systémů P‑glykoproteinu, BCRP a MRP‑2. Z těchto vlastností gliflozinů se odvozují jejich farmakokinetické lékové interakce. Z mechanismu účinku gliflozinů vyplývá, že zvyšují exkreci glukózy a natria močí, čímž zvyšují také exkreci vody. Kombinace gliflozinů s diuretiky působí synergicky na natriurézu a může vyvolat hypotenzi a dehydrataci. Kombinace gliflozinů s inzulinem nebo inzulinovými sekretagogy pak může zvýšit riziko vzniku hypoglykemických příhod. Glifloziny naproti tomu prakticky neovlivňují osud jiných léků v organismu a mají jen omezené množství klinicky relevantních lékových interakcí. Ke klinicky nejvýznamnějším patří indukce glukuronidace gliflozinů, synergický efekt při souběžném podávání diuretik a vliv gliflozinů na exkreci solí lithia.
Summary:
Suchopar J. SGLT2 inhibitors (part 4) – drug interactions of gliflozins. Remedia 2022; 32: 405–408.
SGLT2 inhibitors (gliflozins) are metabolized in the body practically mainly by glucuronidation and only minimally by the oxidative route. At the same time, some gliflozins are substrates of the P‑glycoprotein, BCRP and MRP‑2 transport systems. These properties of gliflozins indicate their pharmacokinetic drug interactions. The mechanism of action of gliflozins suggests that they increase glucose and sodium excretion in the urine, thereby also increasing water excretion. The combination of gliflozins with diuretics acts synergistically on sodium excretion and may cause hypotension and dehydration. Combining gliflozins with insulin or secretagogues may increase the risk of hypoglycemic episodes. Gliflozins, on the other hand, have virtually no effect on the fate of other drugs. Gliflozins have only a limited number of clinically relevant drug interactions, the most clinically important being the induction of gliflozin glucuronidation, the synergistic effect of co‑administered diuretics and the effect of gliflozins on lithium salt excretion.
Key words: gliflozins, SGLT2, drug interactions, UDP‑glucuronosyltransferase, UGT1A9, fenamates, rifampin, lithium, diuretics, ACE inhibitors.
Úvod
Antidiabetický účinek gliflozinů je nesporný. Vedle toho jsou glifloziny indikovány u pacientů se srdečním selháním se sníženou ejekční frakcí (indikace oficiálně schválena pro dapagliflozin, empagliflozin) nebo u chronického onemocnění ledvin (indikace oficiálně schválena pro dapagliflozin). Nedávno publikované výsledky randomizovaných klinických studií dále prokázaly účinnost gliflozinů (na redukci mortality) u pacientů se srdečním selháním se zachovanou ejekční frakcí, a to pro dapagliflozin [1], empagliflozin [2] a sotagliflozin [3]. K tomu je nezbytné doplnit, že indikace srdeční selhání se zachovanou ejekční frakcí dosud není u žádného z gliflozinů oficiálně schválena. Glifloziny také snižují krevní tlak [4], tělesnou hmotnost [5], mají velmi významný ochranný efekt na funkci ledvin [6] a u pacientů s nealkoholickým ztučněním jater (non alcoholic fatty liver disease, NAFLD) mají také příznivý efekt potvrzený jak v klinických studiích, tak i v jejich metaanalýzách [7]. Vedle toho mají glifloziny potenciální neuroprotektivní efekt [8], a mohly by se proto v budoucnosti uplatnit u pacientů s kognitivní poruchou, případně u nemocných s Alzheimerovou chorobou.
Z uvedeného vyplývá, že klinické využití gliflozinů je, a s největší pravděpodobností v budoucnosti dále bude, stále širší, přičemž podávání gliflozinů by logicky bylo velmi racionální zejména u polymorbidních pacientů. Právě takové pacienty obvykle charakterizuje polyfarmacie. Z uvedených důvodů je proto významné znát potenciálně klinicky významné lékové interakce gliflozinů. Ty by bylo možné rozdělit do dvou skupin dle jejich mechanismu. Jedná se o:
- farmakodynamické lékové interakce gliflozinů,
- farmakokinetické lékové interakce, v jejichž důsledku dochází k ovlivnění osudu, případně účinnosti a bezpečnosti gliflozinu, respektive v jejichž důsledku dochází vlivem gliflozinu k ovlivnění osudu, případně účinnosti a bezpečnosti jiného léku.
Jednotlivé skupiny lékových interakcí budou podrobněji komentovány a na závěr budou formou dvou tabulek porovnány farmakodynamické a farmakokinetické lékové interakce jednotlivých gliflozinů.
Farmakodynamické lékové interakce
Glifloziny snižují glykemii, a proto by jejich kombinace s jinými antidiabetiky mohla zvýšit riziko hypoglykemické příhody, což nesporně platí pro kombinaci gliflozinů s inzulinem a inzulinovými sekretagogy (deriváty sulfonylurey a pravděpodobně i pro repaglinid). To dokládají výsledky hlášení nežádoucích účinků ve Spojených státech amerických dostupné v databázi US FDA Adverse Event Reporting System [9]. Tato databáze k datu 31. 12. 2021 eviduje v souvislosti s podáváním gliflozinů celkem 517 závažných hypoglykemických příhod, přičemž 16 pacientů zemřelo. Z toho k 65 případům klinicky závažné hypoglykemie došlo při souběžném podávání gliflozinů a inzulinových sekretagog (nejvíce – 37 – jich nastalo při léčbě glimepiridem) a k dalším 131 případům klinicky závažné hypoglykemie při souběžném podávání gliflozinů a inzulinu. Hypoglykemické příhody v souvislosti se souběžným podáváním gliflozinů s metforminem, gliptiny a glitazony evidovány nebyly. Přitom glifloziny neovlivňují farmakokinetické vlastnosti metforminu ani inzulinu. Nemají žádný nebo mají jen zanedbatelný vliv na farmakokinetické vlastnosti pioglitazonu, linagliptinu, sitagliptinu, glibenklamidu nebo glimepiridu [10–16].
Také další farmakodynamické lékové interakce gliflozinů vycházejí z jejich farmakodynamických účinků. Glifloziny navozují natriurézu, čímž snižují krevní tlak. Snížení krevního tlaku je sice nevelké, např. v případě dapagliflozinu dochází ke snížení krevního tlaku vsedě o 2,38 mm Hg (95% interval spolehlivosti [confidence interval, CI] 1,40–6,16) v případě souběžného podávání diuretik, o 5,76 mm Hg (95% CI 1,23–10,28) při souběžném podávání betablokátorů nebo o 5,13 mm Hg (95% CI 0,79–9,47) při souběžném podávání kalciových blokátorů [17]. Při léčbě diuretiky, zejména kličkovými, byly pozorovány nejvyšší ztráty natria, proto jsou tyto lékové interakce klinicky závažnější než při podávání jiných skupin antihypertenziv, a to zejména u pacientů s objemovým deficitem. Podrobněji v tabulce 1 [18].
Ovlivnění eliminace natria močí má
ještě jeden důsledek, analogicky dochází k ovlivnění
eliminace lithia močí. Ve výčtu farmakodynamických lékových
interakcí proto nelze opomenout, i když zatím zcela
ojedinělou, přesto významnou kazuistiku 29letého pacienta [19]
léčeného pro bipolární afektivní poruchu mimo jiné lithiem
v lékových formách s modifikovaným uvolňováním
v dávkách 1 350 mg denně. U pacienta došlo
k manickému relapsu pro nedostatečnou adherenci k léčbě
lithiem. Monitorování pacienta během hospitalizace vedlo
ke stanovení diagnózy diabetu 2. typu, a proto bylo
zahájeno podávání empagliflozinu v dávkách 25 mg denně.
Čtvrtý den po zahájení podávání empagliflozinu došlo
k poklesu plazmatické koncentrace lithia na subterapeutické
hodnoty (0,4 mM), po ukončení podávání empagliflozinu
a zahájení aplikace inzulinu během osmi dnů se zvýšily
plazmatické koncentrace lithia na 1,3 mM. Pacient a jeho
rodina souhlasili s provedením tzv. rechallenge s podáním
jediné dávky empagliflozinu ve výši 25 mg; tím bylo
potvrzeno, že empagliflozin opětovně vedl ke snížení
plazmatické koncentrace lithia (snížení na 0,5 mM).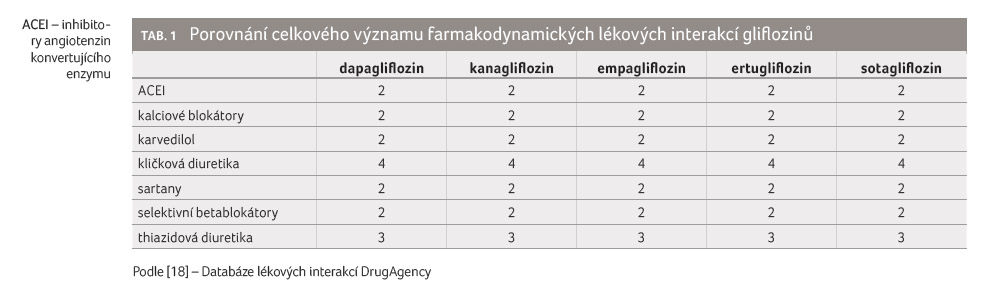
Z hlediska farmakodynamických lékových interakcí by nemělo být podceněno riziko akutního poškození funkce ledvin. Americký úřad pro kontrolu potravin a léčiv (Food and Drug Administration, FDA) [20] uvádí, že od března 2013 do října 2015 bylo v databázi hlášení nežádoucích účinků FAERS identifikováno 101 případů hlášení akutního poškození funkce ledvin (acute kidney injury, AKI) v souvislosti s užíváním gliflozinů, proto FDA doporučuje před započetím podávání gliflozinů u každého pacienta zvážit přítomnost rizikových faktorů pro vznik AKI – hypovolemie, chronického renálního selhání, srdečního selhání a současného podávání kombinace diuretik, inhibitorů angiotenzin konvertujícího enzymu (ACEI) nebo sartanů a nesteroidních protizánětlivých léků (NSA), tzv. triple whammy.
Nepříznivé ovlivnění glomerulární filtrace bylo následně potvrzeno analýzou hlášení nežádoucích účinků v databázi US FDA Adverse Event Reporting System [21]. Podíl hlášení AKI u pacientů léčených gliflozinem byl téměř trojnásobně vyšší ve srovnání s pacienty bez této léčby (reporting odds ratio [ROR] 2,88; 95% CI 2,71–3,05, p < 0,001). Z gliflozinů byl kanagliflozin spojen s vyšším podílem hlášení AKI (7,3 %) ve srovnání s empagliflozinem a dapagliflozinem (4,7 % a 4,8 %, p < 0,001). Tentýž autorský kolektiv pocházející z Hadassah Hebrew University Medical Center v Izraeli [22] poté popsal vlastní zkušenosti s výskytem AKI u pacientů, u nichž bylo zahájeno podávání gliflozinu. AKI bylo zjištěno u sedmi pacientů užívajících empagliflozin (n = 6) nebo dapagliflozin (n = 1). Všichni pacienti současně užívali ACEI či antagonisty angiotenzinu II na AT1 receptorech, čtyři současně užívali diuretika (zpravidla furosemid), tři užívali NSA a jednomu byla nitrožilně aplikována RTG kontrastní látka. Délka užívání gliflozinů před příhodou činila 7–365 dní. Plazmatické koncentrace kreatininu se zvýšily u jednotlivých pacientů o 30–300 %. Glomerulární filtrace byla snížena o 13–69 ml/min/1,73 m2. U dvou pacientů předcházelo příhodě průjmové onemocnění a u tří pacientů infekce močových cest. AKI odeznělo po přerušení podávání gliflozinů a ostatních rizikových léků a po rehydrataci pacientů.
Farmakokinetické lékové interakce gliflozinů
Glifloziny mají omezený počet farmakokinetických lékových interakcí. Nadto tyto lékové interakce nejsou, až na několik málo výjimek, klinicky významné a pacienty tak nikterak neohrožují. Glifloziny neposkytují klinicky významné farmakokinetické lékové interakce vedle výše uvedených antidiabetik ani se statiny, warfarinem nebo cyklosporinem.
Jak již bylo uvedeno ve třetí části této série sdělení, hlavní cestou metabolizace gliflozinů je glukuronidace. Účastní se jí převážně uridindifosfát glukuronosyltransferáza UGT1A9, v menší míře také další izoenzymy uridindifosfát glukuronosyltransferázy, zejména UGT2B4, UGT2B7, a v případě empagliflozinu glukuronidace probíhá ještě za minoritní účasti UGT1A3 a UGT1A8. Silný inhibitor UGT1A9 kyselina mefenamová zvyšuje expozici gliflozinům. Toto zvýšení patrně neovlivňuje míru exkrece glukózy močí, dosud však není známo, zda ovlivňuje bezpečnost terapie glifloziny. Databáze Adverse Event Reporting System [9] eviduje kazuistiku 47leté pacientky léčené dapagliflozinem, u níž došlo po zahájení podávání kyseliny mefenamové k závažnému menstruačnímu krvácení, pro které byla pacientka hospitalizována. Eviduje také kazuistiku 75letého pacienta léčeného empagliflozinem, u kterého vedlo zahájení léčby kyselinou niflumovou ke vzniku těžké hypotenze, která vyústila v hospitalizaci.
Podobný efekt jako fenamáty má i probenecid, který v České republice není registrován. Není známo, zda další inhibitory UGT1A9 (in vitro mají silný inhibiční účinek např. axitinib, dabrafenib, eltrombopag, vandetanib či nintedanib) mají podobný efekt. Stejně tak není známo, zda přírodní látky isoliquiritin, ikaritin nebo ginsenosid, které jsou in vitro silnými inhibitory UGT1A9, mají inhibiční efekt také in vivo. V databázi US FDA Adverse Event Reporting System jsou evidovány jednotlivé kazuistiky lékových interakcí s inhibitory UGT1A9 účinnými in vitro, jako je nintedanib nebo lékořice, v jejichž důsledku byla pozorována hypotenze.
Mezi polyfunkční inhibitory UGT patří kyselina valproová, o níž je navíc známo, že jí vyvolaná inhibice přetrvává přibližně dva týdny po ukončení jejího podávání [23]. V souladu s tím jsou v databázi FAERS popsány lékové interakce dapagliflozinu a kanagliflozinu s valproátem. Jedná se celkem o osm kazuistik, které popisovaly, jak v důsledku lékové interakce došlo k dehydrataci, zvýšení plazmatických hladin gliflozinů, hypoglykemii nebo ke zvýšení hodnot jaterních transamináz. Léková interakce je však „oboustranná“, neboť glifloziny, nejméně kanagliflozin a dapagliflozin, jsou inhibitory UGT [24] a snižují rychlost metabolizace valproátu. To by spolu se snížením tělesné hmotnosti pacientů léčených glifloziny mohlo vést k intoxikaci valproátem. Tento předpoklad potvrzuje kazuistika 67letého pacienta [25], u něhož po zahájení podávání gliflozinu došlo ke zvýšení plazmatických koncentrací valproátu ze 117,3 mg/l na 144,0 mg/l (tj. o 23 %) s projevy třesu rukou nereagujícími na podání anticholinergika biperidenu. Dlužno podotknout, že se na lékové interakci mohlo podílet také snížení tělesné hmotnosti pacienta.
Indukce glukuronidace pak může vést k urychlení eliminace gliflozinů a ke snížení expozice těmto léčivům. To bylo prokázáno v případě dapagliflozinu [26], kanagliflozinu [27], ertugliflozinu [28] a sotagliflozinu [29]. U empagliflozinu byl v klinické studii pozorován zcela opačný efekt, neboť souběžné podávání empagliflozinu s induktorem UGT rifampicinem vedlo ke zvýšení expozice empagliflozinu [30]. Tato „anomálie“ je způsobena skutečností, že je empagliflozin substrátem OATP1B1 a OATP1B3, jejichž silným inhibitorem je právě rifampicin. V důsledku souběžného podávání tak empagliflozin obtížněji vstupuje do hepatocytu, kde následně nemůže být glukuronidován obvyklou rychlostí.
Lékové interakce založené
na mechanismu inhibice nebo indukce oxidativní metabolizace
cestou cytochromu P450 nemají v případě gliflozinů
prakticky žádný klinický význam.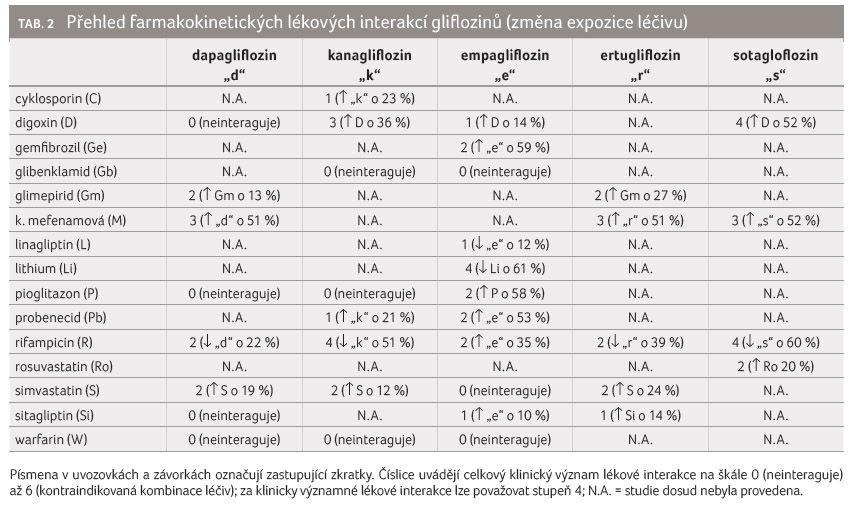
Farmakokinetické lékové interakce a jejich význam přehledně uvádí tabulka 2.
Závěr
Již několikráte zmiňovaná databáze US FDA Adverse Event Reporting System (FAERS, 2022) evidovala k 31. 12. 2021 celkově 288 lékových interakcí gliflozinů se závažným dopadem pro pacienty, dále uvádí 421 případů závažné hypotenze (obvykle v kombinaci s antihypertenzivy vedoucí k nutnosti hospitalizace pacientů) a 409 případů akutního postižení renálních funkcí (obvykle v kombinaci gliflozinu s ACEI a/nebo s NSA).
Souběžné podávání gliflozinů s běžně užívanými léčivy, jako jsou statiny, inhibitory protonové pumpy, levothyroxin, běžná analgetika, antidepresiva či antibiotika, lze považovat za bezpečné.
Shrneme li dosud publikované cílené studie zaměřené na lékové interakce, pak klinicky významné mohou být lékové interakce, jejichž mechanismem je inhibice nebo indukce glukuronidace gliflozinů. Ty můžeme očekávat u pacientů léčených silnými induktory nebo inhibitory UGT1A9. Dále je zcela nezbytné mít na paměti možnost ovlivnění krevního tlaku a exkrece natria, respektive shodným způsobem vylučovaného lithia, a proto je nezbytné monitorovat hodnoty krevního tlaku, natria (lithia) po zahájení terapie glifloziny nebo při změně jejich dávek.
Seznam použité literatury
- [1] Nassif ME, Windsor SL, Borlaug BA, et al. The SGLT2 inhibitor dapagliflozin in heart failure with preserved ejection fraction: a multicenter randomized trial. Nat Med 2021; 27: 1954–1960.
- [2] Anker SD, Butler J, Filippatos G, et al. Empagliflozin in Heart Failure with a Preserved Ejection Fraction. EMPEROR‑Preserved Trial Investigators. N Engl J Med 2021; 385: 1451–1461.
- [3] Bode D, Semmler L, Wakula P, et al. Dual SGLT‑1 and SGLT‑2 inhibition improves left atrial dysfunction in HFpEF. Cardiovasc Diabetol 2021; 20: 7.
- [4] Liakos CI, Papadopoulos DP, Sanidas EA, et al. Blood Pressure‑Lowering Effect of Newer Antihyperglycemic Agents (SGLT‑2 Inhibitors, GLP‑1 Receptor Agonists, and DPP‑4 Inhibitors). Am J Cardiovasc Drugs 2021; 21: 123–137.
- [5] Wong J. Chan KY, Lo K. Sodium‑glucose co‑transporter 2 inhibitors on weight change and cardiometabolic profiles in individuals with overweight or obesity and without diabetes: A meta‑analysis. Obes Rev 2021; 22: e13336.
- [6] Del Vecchio L, Beretta A, Jovane C, et al. A Role for SGLT‑2 Inhibitors in Treating Non‑diabetic Chronic Kidney Disease. Drugs 2021; 81: 1491–1511.
- [7] Lee KW, Devaraj NK, Ching SM, et al. Effect of SGLT‑2 Inhibitors on Non‑alcoholic Fatty Liver Disease among Patients with Type 2 Diabetes Mellitus: Systematic Review with Meta‑analysis and Trial Sequential Analysis of Randomized Clinical Trials. Oman Med J 2021; 36: e273.
- [8] Pawlos A, Broncel M, Wozniak E, Gorzelak‑Pabis P. Neuroprotective Effect of SGLT2 Inhibitors. Molecules 2021; 26: 7213.
- [9] US FDA Adverse Event Reporting System (FAERS) Public Dashboard. Dostupné na: https://www.fda.gov/drugs/fda‑adverse‑event‑reporting‑system‑faers/fda‑adverse‑event‑reporting‑system‑faers‑public‑dashboard [accessed 20.02.2022].
- [10] Brand T, Macha S, Mattheus M, et al. Pharmacokinetics of empagliflozin, a sodium glucose cotransporter‑2 (SGLT‑2) inhibitor, coadministered with sitagliptin in healthy volunteers. Adv Ther 2012; 29: 889–899.
- [11] Dawra VK, Cutler DL, Zhou S, et al. Assessment of the Drug Interaction Potential of Ertugliflozin With Sitagliptin, Metformin, Glimepiride, or Simvastatin in Healthy Subjects. Clin Pharmacol Drug Dev 2019, 8: 314–325.
- [12] Devineni D, Manitpisitkul P, Murphy J, et al. Effect of canagliflozin on the pharmacokinetics of glyburide, metformin, and simvastatin in healthy participants. Clin Pharmacol Drug Dev 2015; 4: 226–236.
- [13] Friedrich C, Metzmann K, Rose P, et al. A randomized, open‑label, crossover study to evaluate the pharmacokinetics of empagliflozin and linagliptin after coadministration in healthy male volunteers. Clin Ther 2013; 35: A33–42.
- [14] Kasichayanula S, Liu X, Shyu WC, et al. Lack of pharmacokinetic interaction between dapagliflozin, a novel sodium‑glucose transporter 2 inhibitor, and metformin, pioglitazone, glimepiride or sitagliptin in healthy subjects. Diabetes Obes Metab 2011; 13: 47–54.
- [15] Macha S, Mattheus M, Pinnetti S, et al. Pharmacokinetics of Empagliflozin and Pioglitazone After Coadministration in Healthy Volunteers. Clin Ther 2015; 37: 1503–1516.
- [16] Vakkalagadda B, Lubin S, Reynolds, et al. Lack of a Pharmacokinetic Interaction Between Saxagliptin and Dapagliflozin in Healthy Subjects: A Randomized Crossover Study. Clin Ther 2016; 38: 1890–1899.
- [17] Weber MA, Mansfield TA, Cain VA, et al. Blood pressure and glycaemic effects of dapagliflozin versus placebo in patients with type 2 diabetes on combination antihypertensive therapy: a randomised, double‑blind, placebo‑controlled, phase 3 study. Lancet Diabetes Endocrinol 2016; 4: 211–220.
- [18] Databáze lékových interakcí DrugAgency, DrugAgency, 2022. Dostupné na: http://lekoveinterakce.cz
- [19] Armstrong GP. Empagliflozin‑Mediated Lithium Excretion: A Case Study and Clinical Applications. Am J Case Rep 2020; 21: e923311.
- [20] FDA Drug Safety Communication: Invokana (kanagliflozin), Farxiga (dapagliflozin), 6/2016. Dostupné na: https://www.fda.gov/drugs/drug‑safety‑and‑availability/fda‑drug‑safety‑communication‑fda‑strengthens‑kidney‑warnings‑diabetes‑medicines‑canagliflozin [accessed 20.02.2022].
- [21] Perlman A, Heyman SN, Matok I, et al. Acute renal failure with sodium‑glucose‑cotransporter‑2 inhibitors: Analysis of the FDA adverse event report system database. Nutr Metab Cardiovasc Dis 2017; 27: 1108–1113.
- [22] Perlman A, Heyman SN, Stokar J, et al. Clinical Spectrum and Mechanism of Acute Kidney Injury in Patients with Diabetes Mellitus on SGLT‑2 Inhibitors. Isr Med Assoc J 2018; 20: 513–516.
- [23] Leary E, Sheth RD, Gidal BE. Time course of reversal of valproate‑mediated inhibition of lamotrigine. Seizure 2018; 57: 76–79.
- [24] Pattanawongsa A, Cahu N, Rowland A, Miners JO. Inhibition of Human UDP‑Glucuronosyltransferase Enzymes by Canagliflozin and Dapagliflozin: Implications for Drug‑Drug Interactions. Drug Metab Dispos 2015; 43: 1468–1476.
- [25] Miyauchi T. Valproate intoxication in a patient with bipolar I disorder due to SGLT2 inhibitor‑induced weight reduction. Daru 2020; 28: 419–421.
- [26] Kasichayanula S, Liu X, Griffen SC, et al. Effects of rifampin and mefenamic acid on the pharmacokinetics and pharmacodynamics of dapagliflozin. Diabetes Obes Metab 2013; 15: 280–283.
- [27] Devineni D, Vaccaro N, Murphy J, et al. Effects of rifampin, cyclosporine A, and probenecid on the pharmacokinetic profile of canagliflozin, a sodium glucose co‑transporter 2 inhibitor, in healthy participants. Int J Clin Pharmacol Ther 2015; 53: 115–128.
- [28] Dawra VK, Sahasrabudhe V, Liang Y, et al. Effect of Rifampin on the Pharmacokinetics of Ertugliflozin in Healthy Subjects. Clin Ther 2018; 40: 1538–1547.
- [29] Study INT14936. Effect of Rifampicin on the Pharmacokinetics and Pharmacodynamics of Sotagliflozin. Dostupné na: https://clinicaltrials.gov/ct2/show/NCT03063580.
- [30] Macha S, Koenen R, Sennewald R, et al. Effect of gemfibrozil, rifampicin, or probenecid on the pharmacokinetics of the SGLT2 inhibitor empagliflozin in healthy volunteers. Clin Ther 2014; 36: 280–290.