Interakční potenciál antipsychotik
Souhrn:
Michalcová J, Tašková I. Interakční potenciál antipsychotik. Remedia 2022; 32: 299–303.
Antipsychotika jsou široce používanou skupinou léčiv nejen v psychiatrii, ale i v jiných lékařských oborech. Jejich hlavní uplatnění spočívá v léčbě psychiatrických poruch, jako jsou schizofrenie a schizoafektivní porucha, bipolární porucha, dále při stavech agrese a napětí, včetně poruch chování při demenci. Lze je také s výhodou použít při léčbě bolesti a nevolnosti. Pacienti je obvykle užívají v delším časovém horizontu a v praxi často dochází k jejich kombinacím, které mohou být zdrojem lékových interakcí. Při posuzování klinického dopadu lékové interakce jsou důležité i další faktory jako genetický polymorfismus, životní styl pacienta a jeho návyky, případně i zdravotní stav. Většina antipsychotik se metabolizuje enzymy cytochromu P450, tudíž jejich plazmatické koncentrace mohou být značně ovlivněny jeho inhibitory nebo induktory. Cílem tohoto článku je poskytnout základní přehled o lékových interakcích antipsychotik. Nejčastějším typem lékové interakce jsou farmakodynamické interakce na úrovni receptorů a farmakokinetické interakce během metabolizace léčiv. Důkladná znalost a správná interpretace lékových interakcí zvyšuje bezpečnost farmakoterapie a zajišťuje efektivní léčbu pacienta. Na závěr tohoto článku je prezentována kazuistika, která přináší pohled na hodnocení a konkrétní řešení interakcí antipsychotik.
Summary:
Michalcova J, Taskova I. The interaction potential of antipsychotics. Remedia 2022; 32: 299–303.
Antipsychotics are widely used drugs in psychiatry and other medical fields. They are indicated in the treatment of psychiatric disorders such as schizophrenia and schizoaffective disorder, bipolar disorder, states of aggression and tension, including behavioral disorders in dementia. Antipsychotics can also be used in the treatment of pain and nausea. Usually, patients take antipsychotics for an extended period and in different combinations, resulting in drug interactions. During the assessment of the clinical impact of the drug interaction, other factors are also important to consider, such as genetic polymorphism, patient lifestyle and habits, and health status. Most antipsychotics are metabolized via enzymes of cytochrome P450, and their plasmatic levels may be affected by inhibitors or inducers of these enzymes. This article aims to provide a basic overview of drug interactions of antipsychotics. The most common drug interactions are pharmacodynamic interactions on drug receptors and pharmacokinetic interactions during drug metabolism. The deep knowledge and appropriate interpretation of drug interactions increase medication safety and enable effective patient treatment. At the end of this article, a case report is presented, which provides a specific view of the evaluation and solution of interactions of antipsychotics.
Key words: antipsychotics, drug interactions, hepatic cytochrome P450, therapeutic drug monitoring, clinical pharmacist.
Lékové interakce antipsychotik
Lékové interakce jsou nežádoucím jevem v klinické praxi, protože mohou být příčinou nežádoucích účinků léčiv, zhoršit zdravotní stav pacienta a prodloužit dobu hospitalizace, tudíž i zvýšit celkové náklady na léčbu [1,2]. Lékové interakce lze rozdělit na farmakodynamické a farmakokinetické. Farmakodynamická interakce je výsledkem působení léčiv na stejném cílovém místě, což může být například receptor, enzym nebo iontový kanál. Dochází buď k zesílení účinku vlivem synergie obou léčiv, nebo naopak k zeslabení účinku vlivem jejich antagonismu. Antipsychotika působí především na dopaminových receptorech, ale v různé míře ovlivňují i jiné receptorové systémy, a to serotoninový, acetylcholinový, histaminový a adrenergní [3,4]. Spektrum účinku antipsychotik, včetně těch nežádoucích, tak úzce souvisí s jejich receptorovým profilem (tab. 1).
Farmakokinetická interakce může způsobit změnu dostupnosti léčiva na cílové struktuře během dějů absorpce, distribuce, metabolismu nebo eliminace. Tímto způsobem dochází ke zvýšení nebo snížení plazmatické koncentrace léčiva, jež může vést až k toxicitě, nebo naopak k neúčinnosti terapie. Antipsychotika jsou léčiva s dobrou absorpcí, která zároveň ve velké míře pronikají přes hematoencefalickou bariéru. Značná část antipsychotik je metabolizována cytochromem P450 na neaktivní metabolity, aby mohla být následně eliminována z organismu. Některá antipsychotika jsou z větší části vylučována ledvinami v nezměněné formě, např. tiaprid, sulpirid, amisulprid a paliperidon. Jiná antipsychotika jsou pak v organismu metabolizována na aktivní metabolity, např. aripiprazol, klozapin, quetiapin a risperidon [3,4]. Vybrané odlišnosti farmakokinetických parametrů antipsychotik jsou shrnuty v tabulce 2.
Lékové interakce a cytochrom P450
Cytochrom P450 je soubor většího počtu izoenzymů, který se podílí na biotransformaci léčiv. Vyskytuje se nejen v játrech, ale také v enterocytech, plicích, ledvinách, mozku a v menší míře i v dalších tkáních. Cytochrom P450 má více izoforem, jež jsou substrátově specifické. Nejčastějším typem farmakokinetické interakce je změna plazmatické koncentrace léčiva během jeho metabolismu, který probíhá zejména v játrech, a to ve dvou základních fázích. Na první úrovni se uplatňují enzymy cytochromu P450 a na druhé konjugační reakce s polárními molekulami, např. acetylace, glukuronidace, sulfatace.
Většina léčiv jsou substráty, některá léčiva i inhibitory nebo induktory různých izoforem cytochromu P450. Antipsychotika jso
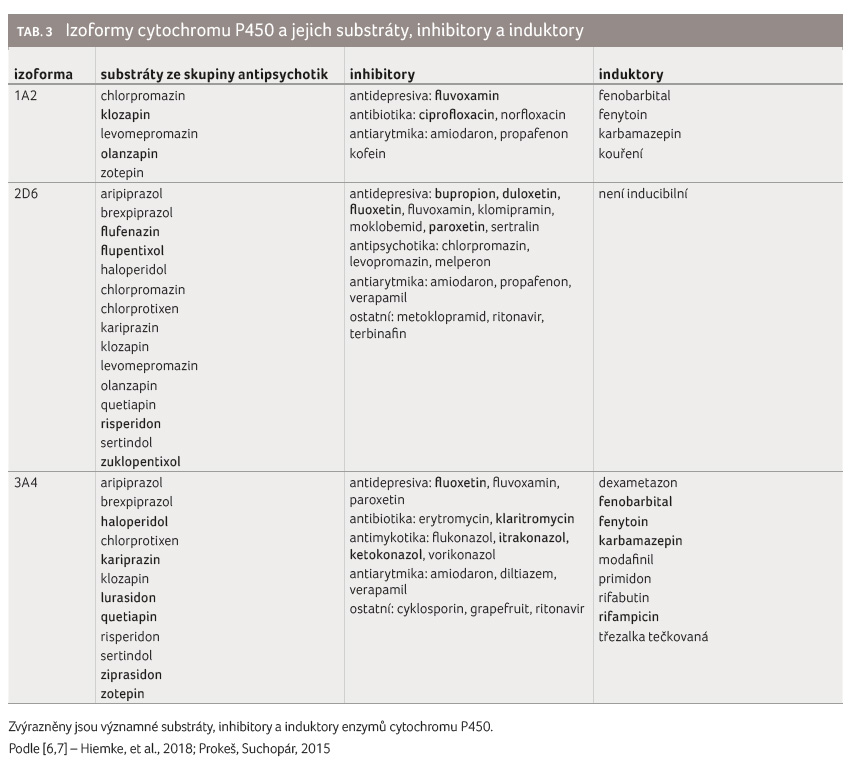
u nejčastěji substráty izoformy CYP1A2, CYP2D6 a CYP3A4 (tab. 3). Při kombinaci substrátu s inhibitorem stejné izoformy cytochromu P450 dochází ke zpomalení metabolismu substrátu a výsledkem je nárůst jeho plazmatické koncentrace. Příliš vysoká plazmatická koncentrace léčiva může vést k výraznějším nežádoucím účinkům, nebo a
ž k projevům toxicity. Nástup inhibice je rychlý. Při kombinaci substrátu s induktorem stejné izoformy cytochromu P450 dochází naopak k urychlení jeho metabolismu a eliminace. Nástup indukce se projeví až v rámci několika dní. K plnému odeznění lékové interakce je obvykle třeba pěti biologických poločasů daného inhibitoru nebo induktoru, v případě indukce musí navíc dojít i k odbourání enzymů, které byly syntetizovány [4,5].
Další faktory ovlivňující účinek léčiv
V rámci metabolismu léčiv může hrát důležitou roli i genetický polymorfismus některých izoenzymů cytochromu P450 (CYP2D6, CYP2C19 a CYP2C9), ale i enzymů druhé fáze metabolizace, např. některých forem uridindifosfát glukuronyltransferázy (UGT). Jedinci v populaci mohou vykazovat značnou variabilitu v aktivitě těchto jaterních izoenzymů, tudíž i rozdílnou rychlost metabolizace léčiv. Na základě této vlastnosti lze rozdělit populaci na pomalé, středně rychlé, rychlé a ultrarychlé metabolizátory. Pomalí metabolizátoři jsou vystaveni vyššímu riziku toxicity, protože u nich může docházet ke kumulaci léčiv. Ultrarychlí metabolizátoři jsou naopak ohroženi neúčinností terapie z důvodu rychlejší metabolizace a následné eliminace léčiva [3,5].
Do vlastního účinku některých
léčiv se promítá i aktivita P glykoproteinu (P gp),
který funguje jako membránový transportér. Tento efluxní protein
je lokalizován zejména v hepatocytech, žlučových kanálcích,
enterocytech, renálním tubulu, hematoencefalické bariéře,
varlatech a placentě. Aktivita P gp je úzce spjata
s aktivitou CYP3A4 tím, že se zčásti substrátově
překrývají. Léčiva, která jsou substrátem P gp, se mohou
omezeně vstřebávat v enterocytech, hůře přecházet přes
hematoencefalickou bariéru nebo se ve vyšší míře
eliminovat z organismu, což může vést k jejich
nedostatečnému účinku [7,8]. Substráty
P gp ze skupiny antipsychotik i jeho inhibitory
a induktory jsou uvedeny v tabulce 4.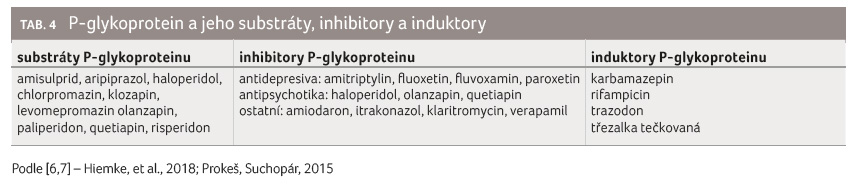
Ke vzniku interakce a ovlivnění účinnosti antipsychotik může dojít i vlivem dalších faktorů. Například polyaromatické uhlovodíky obsažené v cigaretovém kouři jsou induktory izoformy CYP1A2, tudíž mohou významně snižovat plazmatické koncentrace některých antipsychotik (olanzapinu, klozapinu). Ke klinicky významnému urychlení metabolismu může dojít již při kouření několika cigaret denně. Vliv na plazmatické koncentrace těchto antipsychotik může mít i nadměrný příjem kofeinu, který je naopak významným inhibitorem CYP1A2 [6,9]. Plazmatické koncentrace některých antipsychotik (zejména klozapinu, olanzapinu nebo quetiapinu) mohou být značně ovlivněny i probíhajícím zánětem, neboť prozánětlivé cytokiny (IL 6, TNFα a jiné) jsou inhibitory cytochromu P450, zejména jeho izoforem CYP1A2 a CYP3A4. Aktivita těchto izoenzymů je ovlivněna na úrovni exprese, následně dochází k jejich snížené syntéze [10,11].
Jak přistupovat k lékovým interakcím v klinické praxi?
Důkladná znalost lékových interakcí a správné vyhodnocení jejich klinického dopadu jsou základním předpokladem bezpečné farmakoterapie. Ke správné interpretaci lékových interakcí je nezbytná znalost farmakodynamických a farmakokinetických vlastností léčiv. Při hodnocení interakčního potenciálu medikace je vhodné se nejprve zaměřit na to, zda a jakým způsobem se překrývá receptorový profil daných léčiv. Dále je nutné posoudit vliv jednotlivých léčiv především na metabolismus ostatních léčiv v medikaci, případně i na další farmakokinetické děje.
Nejvyšší riziko pro vstup do lékové interakce mají léčiva, jež jsou dominantně metabolizována jednou metabolickou cestou (např. určitá izoforma CYP450) a jsou současně podávána se silným nebo středně silným inhibitorem nebo induktorem této cesty. Při interpretaci lékových interakcí a posouzení jejich klinické významnosti lze spolupracovat s klinickým farmaceutem, jehož úkolem je identifikovat lékové problémy a navrhnout jejich řešení [12,13]. Efektivní metodou k vyhodnocení dopadu lékové interakce je stanovení plazmatické koncentrace léčiva (therapeutic drug monitoring, TDM).
K TDM přistupujeme pravidelně u léčiv s úzkým terapeutickým indexem, u ostatních léčiv například při výskytu závažného nežádoucího účinku, při riziku klinicky významné lékové interakce nebo při podezření na non adherenci k léčbě [14,15]. Velká část nežádoucích účinků antipsychotik je závislá na dávce, např. extrapyramidové a anticholinergní nežádoucí účinky, prodloužení QT intervalu nebo elevace hodnot prolaktinu [16]. Na základě výsledku TDM lze efektivně upravit dávku léčiva, a tímto způsobem eliminovat přítomnost nebo riziko výskytu těchto nežádoucích účinků. V současné době je možné monitorovat plazmatické hladiny mnoha antipsychotik. Podle doporučení bychom měli k TDM přistupovat také u specifických skupin pacientů (těhotné a kojící ženy, děti a adolescenti, starší lidé a pacienti se zhoršenou funkcí jater či ledvin) a ve specifických situacích (morbidní obezita, extrémně nízká hmotnost, přítomnost zánětu a jakékoliv závažné změny zdravotního stavu). Vhodné je stanovit plazmatickou koncentraci léčiva až po dosažení ustáleného stavu, tj. po uplynutí 4−5 biologických poločasů daného léčiva po zahájení léčby nebo po úpravě dávky [6,17].
U každého léčiva bychom si měli položit tyto základní otázky:
- Jaký je mechanismus a cílové místo účinku léčiva?
- Jak se léčivo metabolizuje a eliminuje z organismu?
- Nositelem účinku je pouze mateřská látka, nebo má léčivo aktivní metabolit?
- Jedná se o léčivo s úzkým terapeutickým indexem?
- Je léčivo spojeno s výskytem závažných nežádoucích účinků?
- Je možné využít metody TDM a jaké je doporučené terapeutické rozmezí?
- Jsou v lékovém režimu jiná léčiva, jež mohou vstupovat do lékové interakce?
- Je metabolismus léčiva ovlivněn genetickým polymorfismem či aktivitou P gp?
- Které další faktory (infekce) a návyky (pití kávy, kouření) mohou ovlivnit účinek léčiva?
Kazuistika: Záchyt toxické hladiny klozapinu při zánětu
Základní informace:
Pacient: muž, věk 24 let
Diagnóza: F23.1. Akutní psychotická porucha se symptomy schizofrenie
Farmakoterapie: klozapin 100 mg tbl. (2 0 3), lurasidon 74 mg tbl. (0 0 1), lithium 300 mg tbl. (1 0 2), escitalopram 10 mg tbl. (1 0 0) a prometazin 25 mg tbl. (1 0 1)
Krevní tlak: 90/60 mm Hg, pulz: 86 tepů/min
Průběh hospitalizace:
Mladý pacient byl přijat s dekompenzací psychického stavu po údajně heteroagresivních projevech v domácím prostředí (suspektně po několikadenním vynechání pravidelné psychiatrické medikace). V úvodu hospitalizace pacient vykazoval příznaky katatonní schizofrenie. Postupně byl u něj titrován klozapin do dávky, kterou měl užívat před přijetím. Po třech týdnech hospitalizace se cítil slabý a byla u něj naměřena mírně zvýšená tělesná teplota 37,5 °C. Antigenní test na covid 19 byl pozitivní, posléze byl proveden kontrolní PCR test – opět s pozitivním výsledkem, proto byl pacient přeložen na izolaci. V průběhu pobytu na izolaci byl pacientovi odebrán vzorek ke zjištění plazmatické koncentrace klozapinu, která dosahovala toxických hodnot (1 596 ng/l). Pacient se subjektivně cítil dobře, referoval pouze motání hlavy, které ovšem trvalo déle než dva týdny. Vzhledem k záchytu toxické plazmatické koncentrace klozapinu byla vyžádána konzultace klinického farmaceuta.
Farmakoterapeutické doporučení klinického farmaceuta:
U pacienta došlo k záchytu toxické plazmatické koncentrace klozapinu podávaného v dávce 500 mg/den (klozapin – 1 596 ng/ml, norklozapin – 414 ng/ml). Pacient referuje motání hlavy, jiné příznaky intoxikace nejsou přítomny. Nyní je nutné klozapin vysadit, dále provést statimové kontrolní elektrokardiografické (EKG) vyšetření a pravidelně monitorovat krevní tlak, tepovou frekvenci a tělesnou teplotu pacienta. K nárůstu plazmatické koncentrace klozapinu přispělo zřejmě onemocnění covid 19. Je známo, že prozánětlivé cytokiny inhibují hlavní metabolickou cestu klozapinu (CYP1A2).
Při toxických hodnotách nemusí plazmatická koncentrace léčiva klesat lineárně, proto lze předpokládat, že následujících 4–5 dní nebude potřeba klozapin podávat. Po třech dnech přerušení léčby bude vhodné provést statimový kontrolní odběr hodnot klozapinu a dle výsledku nastavit jeho optimální denní dávku s postupnou titrací od nižších dávek. S odstupem času lze uvažovat i o titraci dávky na původních 500 mg/den. Inhibiční vliv zánětlivých cytokinů ustoupí s odezněním symptomů infekčního onemocnění, nicméně bude nadále vhodné monitorovat plazmatické hladiny klozapinu i v dalším průběhu hospitalizace.
Komentář:
Plazmatické koncentrace klozapinu mohou být značně ovlivněny přítomností zánětu. U pacienta byla při dávce 500 mg/den zjištěna plazmatická koncentrace 1 596 ng/ml, což značně převyšuje jeho optimální terapeutické rozmezí 350−600 ng/ml. Závažná toxicita klozapinu se váže na hodnoty nad 1 000 ng/ml [6]. Rychlý nárůst plazmatické koncentrace klozapinu může zapříčinit závažné nežádoucí účinky (neutropenie, agranulocytóza, myokarditida, trombóza, epileptický záchvat) a může vést ve výjimečných případech až k úmrtí pacienta. Vliv na plazmatickou hladinu klozapinu může mít dávka, pohlaví, věk, hmotnost, kouření, příjem kofeinu, jiné interagující léčivo a zdravotní stav pacienta [17,18]. Hladina C reaktivního proteinu (CRP) je markerem zánětu, jenž může signalizovat riziko zvýšené plazmatické koncentrace klozapinu. Podle nových doporučení je vhodné pravidelně stanovovat CRP jednou týdně po dobu jednoho měsíce po zahájení léčby klozapinem [17]. Byla popsána závislost mezi narůstající hodnotou CRP a hodnotou plazmatické koncentrace klozapinu. Změny v plazmatických koncentracích klozapinu jsou dokumentovány již při hodnotě CRP > 5 mg/l. Dávku klozapinu je doporučeno snížit na polovinu, pokud je hodnota CRP > 100 mg/l. V případě přítomnosti zvýšeného CRP nebo při symptomech zánětu je vždy u pacienta doporučeno ověřit plazmatickou hladinu klozapinu [11,19]. Variabilita plazmatických koncentrací klozapinu je značná, proto je také doporučeno provedení TDM po zahájení léčby nebo při podezření na závažný nežádoucí účinek. K TDM lze přistoupit dále u farmakorezistentních pacientů, u kterých má klozapin pouze částečný efekt, a při podezření na non adherenci. Ustálené plazmatické koncentrace klozapinu je dosahováno přibližně po 5−7 dnech od zahájení terapie nebo po změně dávky. Hladina by měla být stanovena minimálně 12 hodin od podání poslední dávky, většinou se přistupuje k odběru před podáním ranní medikace [17]. Mezi známky toxicity klozapinu patří ospalost, letargie, agitovanost, hyperreflexie, mydriáza, nadměrné slinění, hypotenze, tachykardie, arytmie, kolaps, respirační útlum, dechové selhání až kóma. K úmrtí zpravidla dochází pro srdeční komplikace nebo v důsledku aspirační pneumonie [9,20].
Závěr
Léčba duševně nemocných pacientů obvykle vyžaduje dlouhodobé užívání psychofarmak, včetně antipsychotik. V rámci terapie závažných duševních chorob je monoterapie spíše výjimečná a často se v praxi přistupuje k lékovým kombinacím, zejména u pacientů s těžšími projevy nemoci nebo u těch s pouze částečnou odpovědí na terapii. Lékové kombinace s sebou přinášejí vyšší riziko výskytu lékových interakcí, jež mohou vést k neúčinnosti terapie nebo k častějším projevům nežádoucích účinků. Uvedená kazuistika demonstruje, že interakce antipsychotik nejsou ojedinělé a mohou se vyskytovat i ve specifických situacích, například při infekci. V klinické praxi je důležitá především správná interpretace lékových interakcí a vyhodnocení jejich klinického dopadu, kdy může být spolupráce lékaře a klinického farmaceuta výhodou. Při úspěšné eliminaci lékové interakce dochází ke snížení rizik farmakoterapie a nákladů na léčbu potenciálních komplikací.
Seznam použité literatury
- [1] de Andrade Santos TNG, Mendonça da Cruz Macieira G, Cardoso Sodré Alves BM, el al. Prevalence of clinically manifested drug interactions in hospitalized patients: A systematic review and meta‑analysis. PLoS One 2020; 15: e0235353.
- [2] Dechanont S, Maphanta S, Butthum B, et al. Hospital admissions/visits associated with drug‑drug interactions: a systematic review and meta‑analysis. Pharmacoepidemiol Drug Saf 2014; 23: 489–497.
- [3] Švihovec J, Bultas J, Anzenbacher P, et al. Farmakologie. Praha: Grada, 2018.
- [4] Mohr P, Kopeček M, Brunovský M, et al. Klinická psychofarmakologie. Praha: Maxdorf, 2017.
- [5] Zanger UM, Schwab M. Cytochrome P450 enzymes in drug metabolism: Regulation of gene expression, enzyme activities, and impact of genetic variation. Pharmacol Ther 2013; 138: 103–141.
- [6] Hiemke C, Bergemann N, Clement H, et al. Consensus Guidelines for Therapeutic Drug Monitoring in Neuropsychopharmacology: Update 2017. Pharmacopsychiatry 2018; 51: 9–62.
- [7] Prokeš M, Suchopár J. Lékové interakce v psychiatrii – teorie a praxe. Psychiatr praxi 2015; 16: 51–55.
- [8] Akamine Y, Yasui‑Furukori N, Ieiri I, et al. Psychotropic Drug‑Drug Interactions Involving P‑Glycoprotein. CNS Drugs 2012; 26: 959–973.
- [9] Mayerová M, Horská K, Ustohal L. Klozapin: moderní antipsychotikum s dlouhou tradicí. Praha: Galén, 2021.
- [10] Švancer P, Kopeček M. Přehled farmakokinetických faktorů ovlivňujících sérové koncentrace klozapinu a vlastní pozorování. Psychiatrie 2019; 23: 99–105.
- [11] Hefner G, Shams MEE, Unterecker S, et al. Inflammation and psychotropic drugs: the relationship between C‑reactive protein and antipsychotic drug levels. Psychopharmacology 2016; 233: 1695–1705.
- [12] Mekonen AB, McLachlan AJ, Brien JE. Effectiveness of pharmacist‑led medication reconciliation programmes on clinical outcomes at hospital transitions: a systematic review and meta‑analysis. BMJ Open 2016; 6: e010003.
- [13] Gurwitz JH, Kapoor A, Garber L, et al. Effect of a Multifaceted Clinical Pharmacist Intervention on Medication Safety After Hospitalization in Persons Prescribed High‑risk Medications: A Randomized Clinical Trial. JAMA Intern Med 2021; 181: 610–618.
- [14] Tašková I. Terapeutické monitorování psychofarmak z pohledu klinického farmaceuta: doporučení versus praxe. Remedia 2020; 30: 650–656.
- [15] Šilhán P, Kacířová I, Hýža M, el al. Terapeutické monitorování hladin léčiv v psychiatrii – možnosti a využití v praxi. Psychiatrie pro praxi 2016; 17: 10–14.
- [16] Stroup TS, Gray N. Management of common adverse effects of antipsychotic medications. World Psychiatry 2018; 17: 341–356.
- [17] de Leon J, Schoretsanitis G, Smith RL, et al. An International Adult Guideline for Making Clozapine Titration Safer by Using Six Ancestry‑Based Personalized Dosing Titrations, CRP, and Clozapine Levels. Pharmacopsychiatry 2022; 55: 73–86.
- [18] Mayerová M, Ustohal L, Jarkovský J, el al. Influence of dose, gender, and cigarette smoking on clozapine plasma concentrations. Neuropsychiatr Dis Treat 2018; 14: 1535–1543.
- [19] Clack SR, Warren NS, Kim G, el al. Elevated clozapine levels associated with infection: A systematic review. Schizophr Res 2018; 192: 50–56.
- [20] de Leon J, Ruan C‑J, Verdoux H, et al. Clozapine is strongly associated with the risk of pneumonia and inflammation. Gen Psychiatr 2020; 33: e100183.