Jsou všechna makrolidová antibiotika stejná z hlediska lékových interakcí?
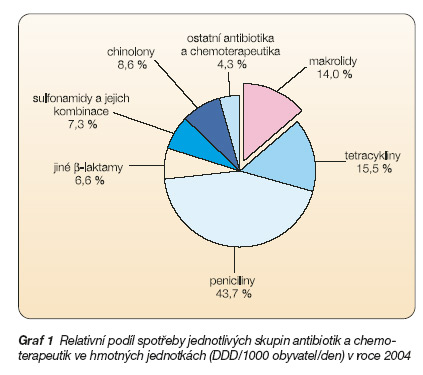
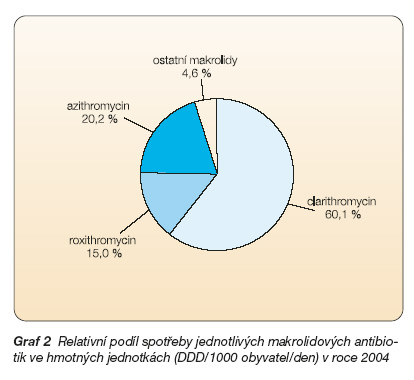
Makrolidová antibiotika patří v podmínkách ČR k velmi často používaným léčivům. V roce 2004 činila spotřeba makrolidových antibiotik v ČR 2,36 DDD/1000 obyvatel/den a ve finančním vyjádření 462 mil. Kč v cenách pro konečného spotřebitele [1]. Makrolidová antibiotika tak měla v roce 2004 podíl na celkové spotřebě antibiotik 14 % ve hmotných jednotkách (graf 1, 2) a 19,4 % ve finančním vyjádření.
V širším slova smyslu se mezi makrolidová antibiotika řadí:
a) ‑makrolidy se 14členným laktonovým cyklem (erythromycin, clarithromycin, dirithromycin, troleandomycin, roxithromycin, flurithromycin);
b) ‑makrolidy s 16členným laktonovým cyklem (rokitamycin, josamycin, miokamycin neboli midekamycin, spiramycin);
c) ‑azalidy, tj. látky s 15členným laktonovým cyklem obsahujícím dusík (azithromycin);
d) ‑ketolidy, tj. látky s 14členným laktonovým cyklem obsahujícím v poloze 3 místo sacharidového zbytku ketoskupinu (telithromycin).
Makrolidová antibiotika mají relativně úzké antibakteriální spektrum zahrnující především grampozitivní mikroorganismy. Užívají se především u bakteriálních infekcí respiračního ústrojí a s jejich širokým podáváním mohou být spojeny problémy vzniku rezistence.
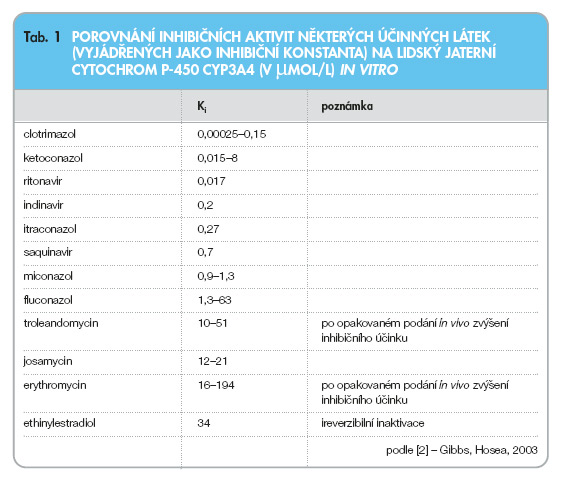
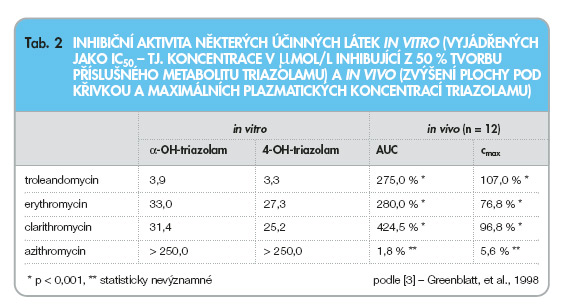
Z hlediska lékových interakcí se jedná o velmi heterogenní skupinu léčiv. Makrolidová antibiotika inhibují izoenzym 3A4 (CYP3A4) cytochromu P-450. Z výsledků studií in vitro [2–4] i in vivo [5] vyplývá, že míra inhibice CYP3A4 je u jednotlivých makrolidových antibiotik různě intenzivní. Nejvyšší inhibiční potenciál na CYP3A4 má troleandomycin, josamycin a telithromycin, slabší inhibiční potenciál má (především in vitro) erythromycin a clarithromycin, výrazně slabší inhibiční potenciál má roxithromycin a azithromycin, dirithromycin a spiramycin mají inhibiční potenciál na CYP3A4 zanedbatelný (tab. 1).
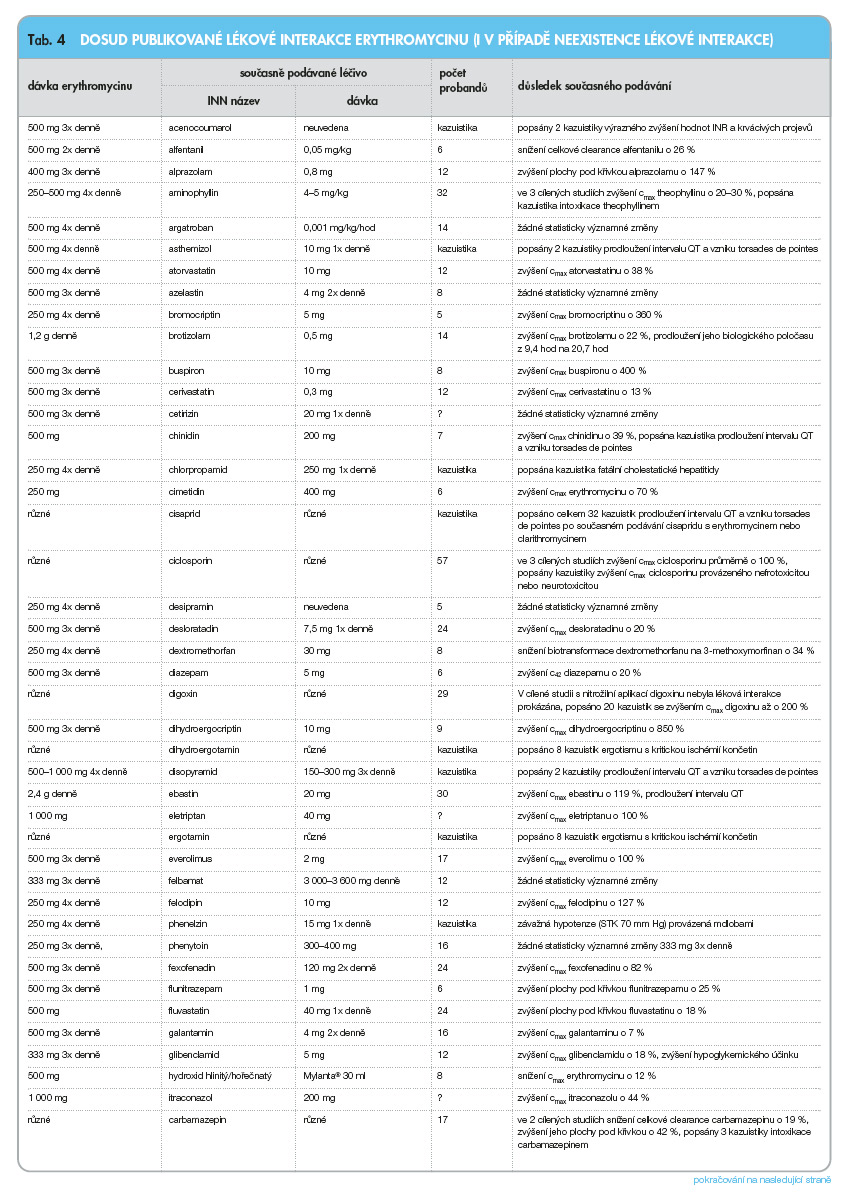
Podle studií in vitro má erythromycin silnější vazebnou afinitu k CYP3A4 než clarithromycin [4], velké množství studií in vivo však prokázalo, že v rozsahu změn farmakokinetických nebo farmakodynamických parametrů interagujících léčiv není zásadní rozdíl mezi erythromycinem a clarithromycinem, naopak clarithromycin obvykle vede k vyššímu ovlivnění farmakokinetických nebo farmakodynamických parametrů ve srovnání s erythromycinem.
In vivo lze míru inhibice CYP3A4 mezi jednotlivými účinnými látkami srovnávat např. pomocí stupně ovlivnění farmakokinetických vlastností (plochy pod křivkou nebo maximálních plazmatických koncentrací) některého ze substrátů CYP3A4 s vysokou citlivostí vůči působení inhibitorů CYP3A4, jedním z takových široce používaných substrátů CYP3A4 je midazolam [6, 7].
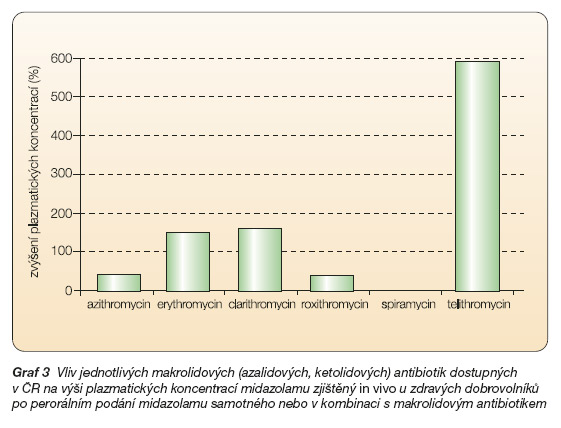
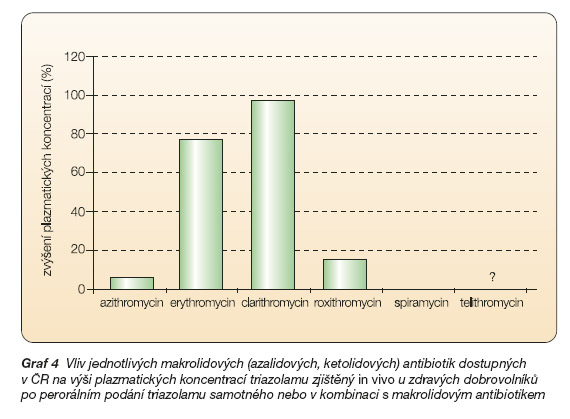
Z hlediska ovlivnění biotransformace midazolamu je nejsilnějším inhibitorem CYP3A4 ve skupině makrolidových antibiotik telithromycin, plazmatické koncentrace perorálně podaného midazolamu zvyšují erythromycin a clarithromycin přibližně stejnou měrou, výrazně menší zvýšení bylo zjištěno v případě azithromycinu a roxithromycinu a spiramycin plazmatické koncentrace perorálně podaného midazolamu neovlivňoval (graf 3).
Podobné výsledky byly shromážděny též při použití triazolamu (dalšího citlivého substrátu CYP3A4) in vitro. V tomto případě však dosud nebyla provedena studie lékové interakce telithromycinu s triazolamem (tab. 2, graf 4).
Erythromycin a pravděpodobně též clarithromycin vedle inhibice na cytochromu P-450 působí zároveň inhibičně na transportním systému P-glykoproteinu [8].
Makrolidová, azalidová a ketolidová antibiotika jsou obecně považována za silné inhibitory CYP3A4. To však platí pouze pro erythromycin, josamycin, clarithromycin, telithromycin a troleandomycin. U spiramycinu dosud nebyla popsána žádná léková interakce, jejíž mechanismus by spočíval v ovlivnění systému cytochromu P-450. Minimální působení azithromycinu na CYP3A4 již bylo uvedeno výše na příkladu midazolamu a triazolamu.
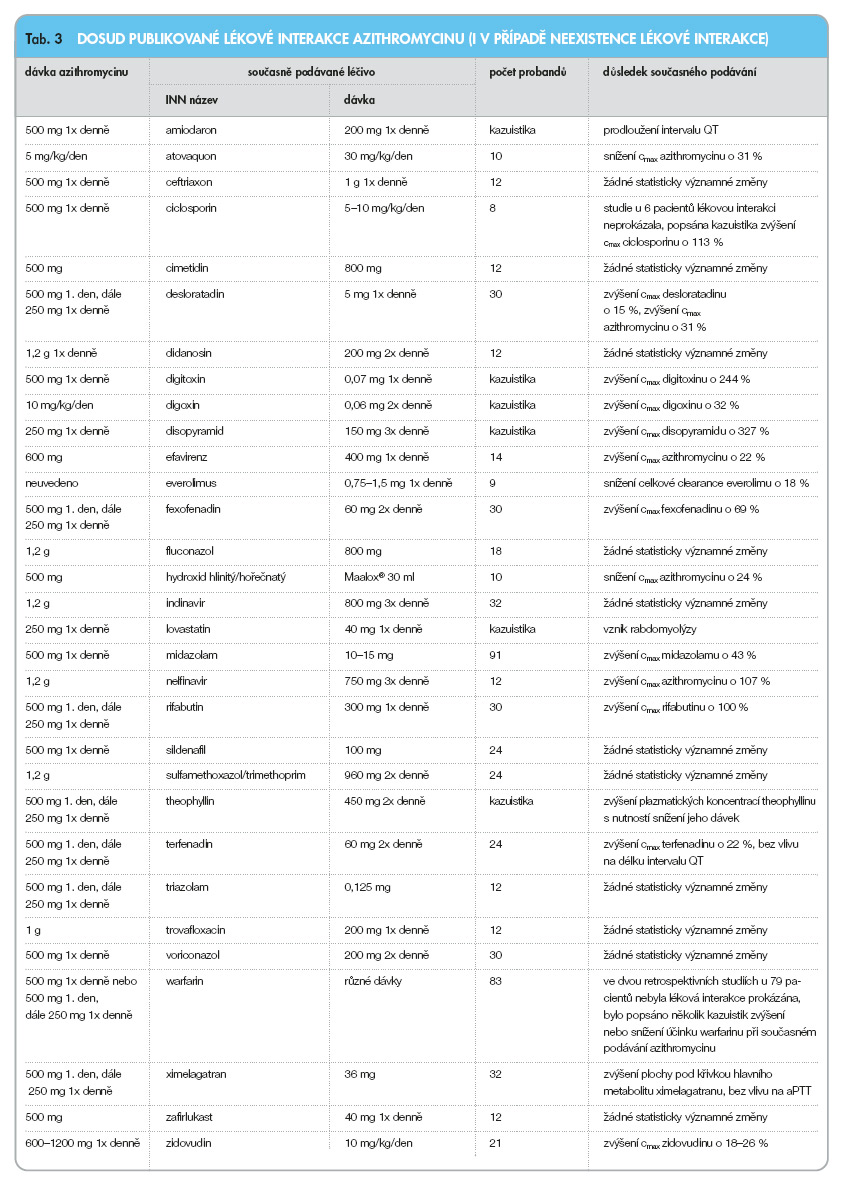
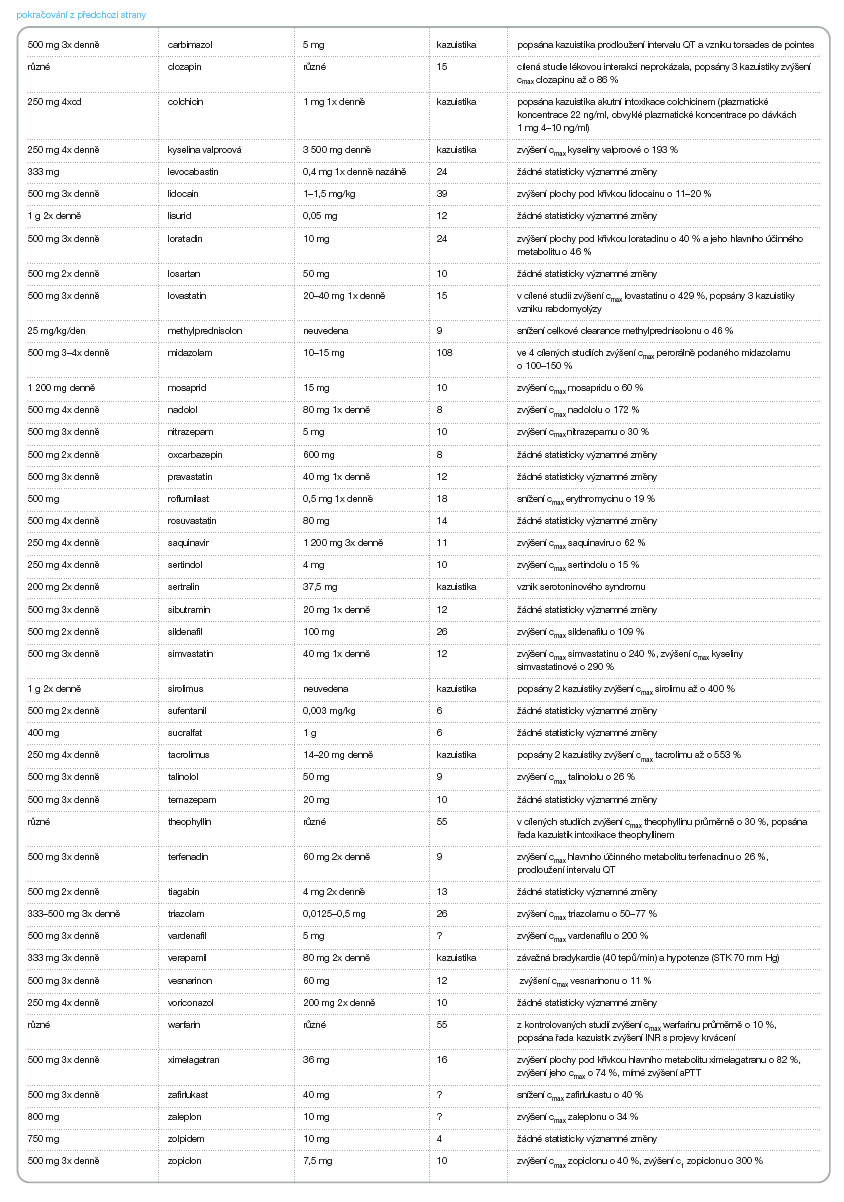
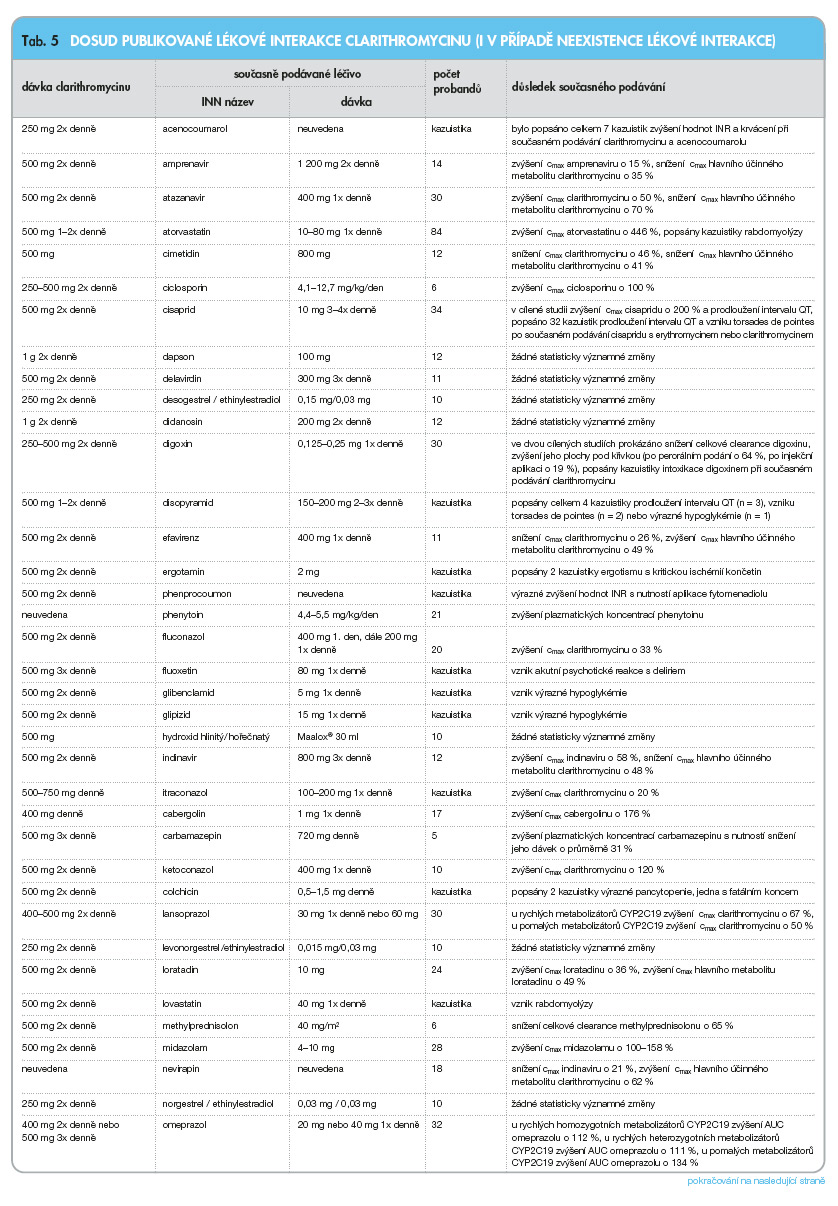
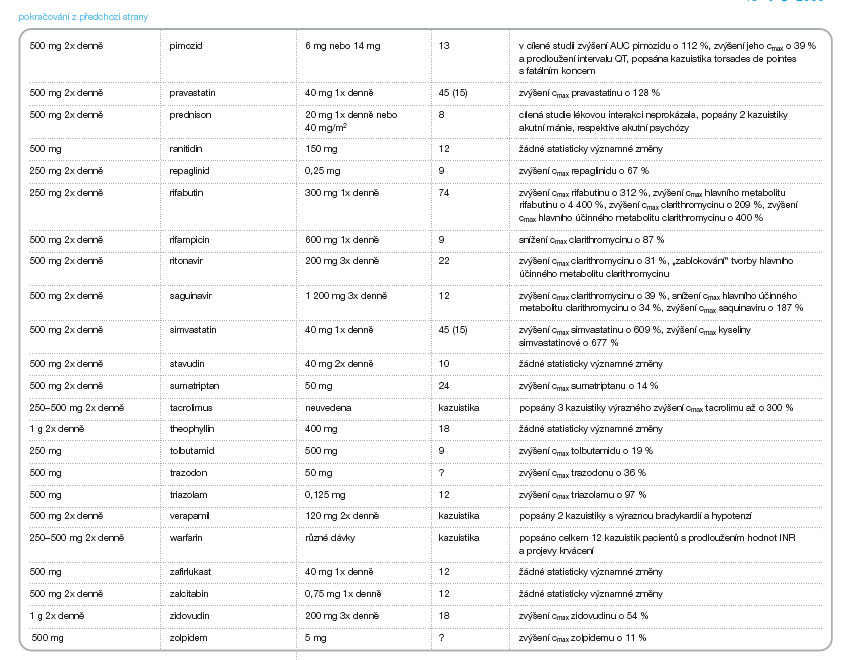
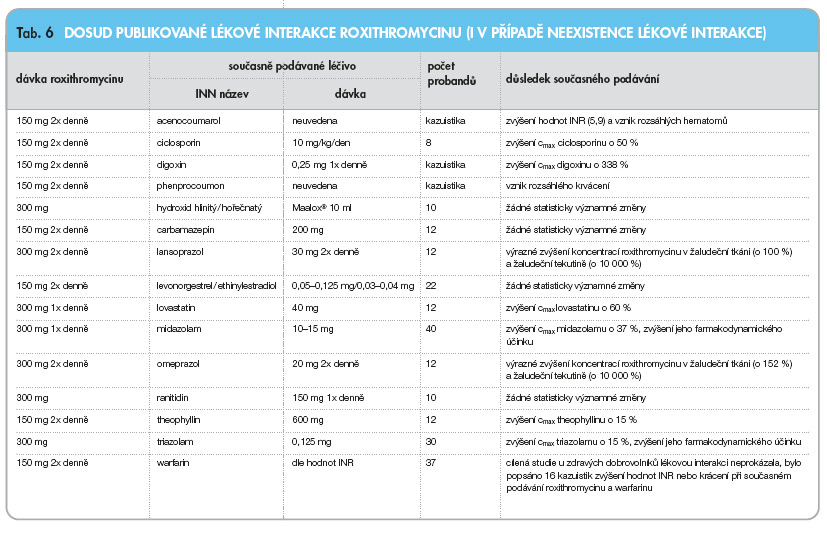
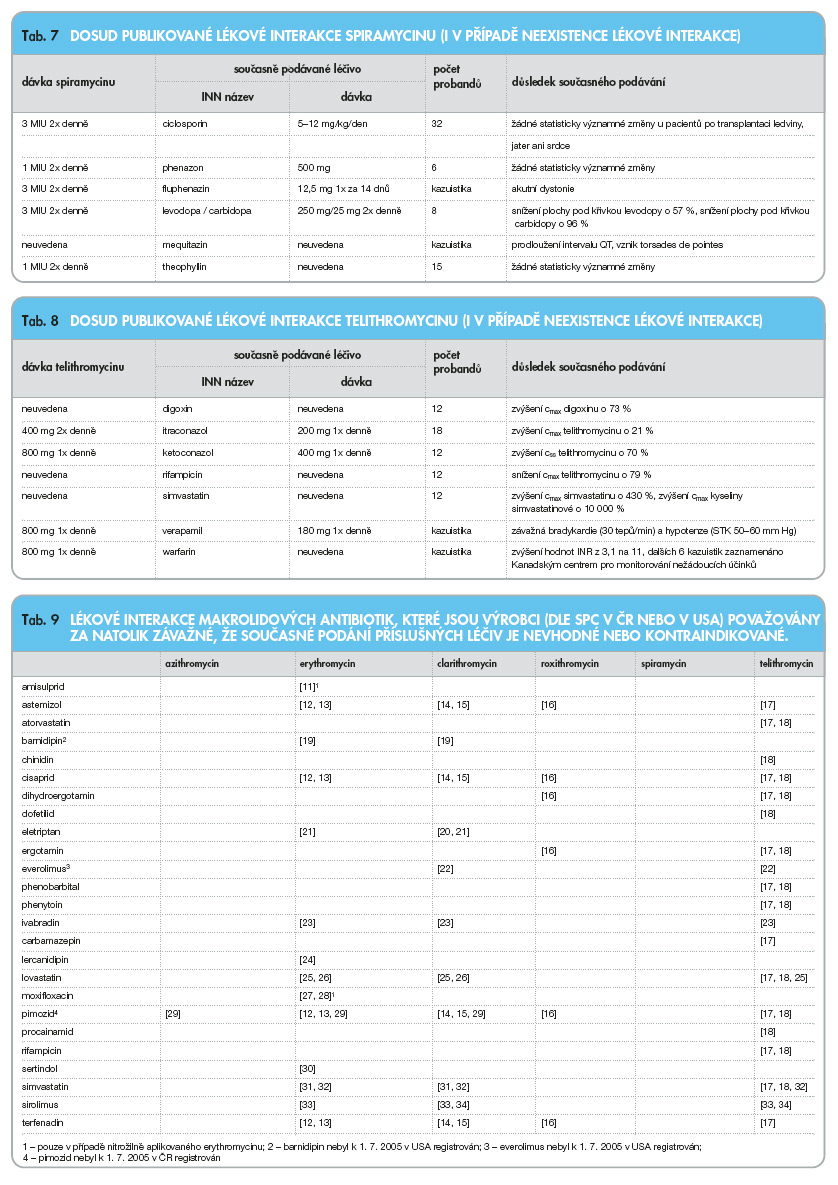
V následujícím přehledu (tab. 3–8) jsou uvedeny lékové interakce v ČR dostupných makrolidových antibiotik: azithromycinu, erythromycinu, clarithromycinu, roxithromycinu, spiramycinu a telithromycinu, [5] (cmax jsou maximální plazmatické koncentrace, css jsou plazmatické koncentrace v ustáleném stavu, c42 jsou plazmatické koncentrace 42 hodin po podání, AUC je plocha pod křivkou).
Vedle výše uvedených lékových interakcí popsaných v cílených studiích nebo v kazuistikách uvádějí výrobci makrolidových antibiotik nebo jiných léčiv v ČR [9] nebo v USA [10] řadu dalších lékových interakcí, které považují za natolik závažné, že jsou kontraindikací současného podávání příslušných léčiv nebo je současné podávání příslušných makrolidových antibiotik a dalších léčiv považováno za nevhodné. Pozoruhodné jsou právě rozdíly mezi údaji uváděnými v Souhrnech údajů o přípravku v ČR nebo v tzv. Prescribing Information v USA.
Následující přehled uvádí výše uvedené lékové interakce makrolidových antibiotik dostupných v ČR.
Lze předpokládat, že výčet závažných lékových interakcí uvedený v tab. 9 bude v budoucnosti dále rozšířen, a to především u telithromycinu (telithromycin prodlužuje interval QT a jeho současné podávání s léčivy prodlužujícími interval QT v tab. 9 neuvedenými může být v budoucnosti klasifikováno jako kontraindikované). Na druhou stranu tomu tak však nemusí být ve všech případech. V nedávno publikované studii o lékových interakcích telithromycinu a sotalolu bylo prokázáno, že v případě současného podávání telithromycinu a sotalolu dochází k nižšímu prodloužení intervalu QT než při samotném podávání sotalolu, což může být způsobeno mimo jiné i tím, že telithromycin snižuje plazmatické koncentrace sotalolu o 33 % [35]. Podobně mohou být rozšířeny kontraindikace v případě lercanidipinu (zatím jsou z makrolidových antibiotik jako kontraindikované uváděny pouze erythromycin a troleandomycin).
Vzhledem k rozsahu změn farmakokinetických, případně farmakodynamických vlastností příslušného léčiva lze za kandidáty kontraindikované lékové interakce dále považovat např. následující lékové interakce:
• ‑erythromycin-dihydroergocriptin [36]: „předléčení" erythromycinem v dávkách 500 mg 3x denně po dobu 4 dnů zvýšilo plochu pod křivkou dihydroergocriptinu podaného v jednorázové dávce ve výši 10 mg o 1 550 % (tj. 16,5x) a jeho maximální plazmatické koncentrace o 850 % (tj. 9,5x);
• ‑erythromycin-bromocriptin [37]: předléčení erythromycinem v dávkách 250 mg 4x denně po dobu 4 dnů zvýšilo plochu pod křivkou bromocriptinu podaného v jednorázové dávce ve výši 5 mg o 186 % a jeho maximální plazmatické koncentrace o 360 % a u všech zdravých dobrovolníků se objevily závažné nežádoucí účinky;
• ‑erythromycin-buspiron [38]: předléčení erythromycinem v dávkách 500 mg 3x denně po dobu 4 dnů zvýšilo plochu pod křivkou buspironu podaného v jednorázové dávce ve výši 10 mg o 491 % (tj. téměř 6x) a jeho maximální plazmatické koncentrace o 400 % (tj. 5x) a zároveň došlo k výraznému zvýšení farmakodynamických vlastností buspironu; tato léková interakce, ačkoli byla publikována v roce 1997, není uváděna ani u jednoho ze dvou v ČR registrovaných léčivých přípravků obsahujících buspiron v Souhrnech údajů o přípravku [39, 40].
Závěr
Makrolidová antibiotika nejsou z hlediska potenciálu lékových interakcí stejná. Z hlediska lékových interakcí proto v žádném případě nelze na tuto skupinu léčiv nahlížet skupinově (class effect). Z výsledků dosud provedených kontrolovaných studií in vitro a in vivo vyplývá, že:
a) ‑makrolidová antibiotika nejsou induktory žádného z izoenzymů cytochromu P-450 [41];
b) ‑makrolidová antibiotika nejsou inhibitory CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 ani CYP2E1 [41];
c) ‑jejich schopnost inhibovat CYP3A4 in vivo klesá v pořadí [2–4, 42, 43] – troleandomycin ≥ telithromycin >> josamycin > clarithromycin = erythromycin > miokamycin = rokitamycin >> roxithromycin > azithromycin = dirithromycin >> spiramycin – s tím, že azithromycin, dirithromycin ani spiramycin prakticky CYP3A4 neovlivňují nebo je míra změn farmakokinetických parametrů a farmakodynamických vlastností příslušného léčiva klinicky zanedbatelná;
d) ‑schopnost inhibovat transportní systém P-glykoproteinu byla prokázána pouze u erythromycinu (např. lékovou interakcí in vivo s fexofenadinem [44]), u clarithromycinu (např. lékovou interakcí in vivo s digoxinem [45]) a pravděpodobně též u azithromycinu (lékovou interakcí in vivo s fexofenadinem [46]), nelze ji však vyloučit i u jiných makrolidových antibiotik.
Z hlediska nevhodnosti nebo dokonce kontraindikace současného podávání jiných léků je v Souhrnech údajů o přípravcích v ČR a/nebo v USA uváděno nejvíce takových omezení u telithromycinu (celkem 19), dále u erythromycinu (celkem 14), clarithromycinu (celkem 10) a roxithromycinu (celkem 6). Azithromycin má pouze jedno takové omezení (současné podávání s pimozidem) a spiramycin nemá takové omezení žádné.
U pacientů dlouhodobě léčených statiny biotransformovanými na CYP3A4 (atorvastatin, lovastatin nebo simvastatin) lze v případě indikace podávání makrolidových antibiotik doporučit podávání azithromycinu (i když v roce 1997 byla publikována kazuistika rabdomyolýzy při současném podávání azithromycinu s lovastatinem) nebo spiramycinu.
U pacientů dlouhodobě léčených ciclosporinem lze v případě indikace podávání makrolidových antibiotik doporučit spiramycin. V celkem 4 studiích provedených u více než 30 pacientů po transplantaci ledviny nebyly zjištěny žádné statisticky významné změny farmakokinetických vlastností ciclosporinu.
U pacientů dlouhodobě léčených dalšími léčivy biotransformovanými na CYP3A4 (např. midazolamem, triazolamem, terfenadinem nebo dalšími léky především s úzkou terapeutickou šířkou) lze v případě indikace podávání makrolidových antibiotik doporučit azithromycin nebo spiramycin.
U pacientů dlouhodobě léčených digoxinem (nebo digitoxinem) je vhodnější vyhnout se podávání makrolidových antibiotik, protože inhibicí mikroorganismu Eubacterium lentum vyvolanou makrolidovým antibiotikem, v jejímž důsledku nevzniká v trávicím ústrojí farmakologicky neaktivní redukovaný metabolit digoxinu, dochází ke zvýšení plazmatických koncentrací digoxinu. Zároveň se při mechanismu lékové interakce pravděpodobně uplatňuje i inhibice transcelulárního transportu digoxinu zprostředkovaná inhibicí P-glykoproteinu makrolidovým antibiotikem (erythromycin a clarithromycin, pravděpodobně též ostatní makrolidová antibiotika). Zatím nebyla popsána léková interakce mezi spiramycinem a digoxinem.
U pacientů dlouhodobě léčených warfarinem lze v případě indikace podávání makrolidových antibiotik doporučit azithromycin nebo spiramycin. Léková interakce mezi warfarinem a spiramycinem nebyla dosud popsána. Dvě retrospektivní studie u celkem 69 pacientů dlouhodobě léčených azithromycinem neprokázaly lékovou interakci mezi warfarinem a azithromycinem, avšak byly popsány kazuistiky mírného až středně vyjádřeného zvýšení hodnot INR nebo obdobných parametrů při současném podávání warfarinu a azithromycinu.
Seznam použité literatury
- [1] Státní ústav pro kontrolu léčiv v Praze, 2005 (www.sukl.cz)
- [2] Gibbs MA, Hosea NA. Factors Affecting the Clinical Development of Cytochrome P450 3A Substrates. Clin Pharmacokinet 2003; 42: 969–984.
- [3] Greenblatt DJ, et al. Inhibition of triazolam clearance by macrolide antimicrobial agents: in vitro correlates and dynamic consequences. Clin Pharmacol Ther 1998; 64: 278–285.
- [4] Westphal JF. Macrolide – induced clinically relevant drug interaction with cytochrome P-450A (CYP) 3A4: an update focused on clarithromycin, azithromycin and dirithromycin. Br J Clin Pharmacol 2000; 50: 285–295.
- [5] Suchopár J (editor). Vademecum Infopharm® 2005, Kompendium lékových interakcí, Praha, 2005.
- [6] Bjornsson TD, et al. The Conduct of In Vitro and In Vivo Drug-Drug Interaction Studies: A PhaRMA Perspective. J Clin Pharmacol 2003; 43: 443–469.
- [7] Zhou H, et al. „Cocktail“ Approches and Strategies in Drug Development: Valuable Tool or Flawed Science? J Clin Pharmacol 2004; 44: 120–134.
- [8] Lin JH, Yamazaki M. Role of P-Glycoprotein in Pharmacokinetics. Clinical Implication. Clin Pharmacokinet 2003; 42: 59–98.
- [9] Škop B (editor). AISLP, Automatizovaný informační systém léčivých přípravků, verze 2005.3 (1. 7. 2005), Praha.
- [10] PDR, Thomson MICROMEDEX® 2005, Englewood, USA.
- [11] Souhrn údajů o přípravku: Solian® (amisulprid), Sanofi-Synthelabo, 20. 4. 2005 (AISLP, verze 2005.3, 1. 7. 2005).
- [12] Prescribing Information: Erythromycin® base (erythromycin), Abbott, July 2003 (PDR, 2005).
- [13] Souhrn údajů o přípravku: Erythrocin® i.v. (erythromycin laktobionát), Abbott, 12. 1. 2005 (AISLP, verze 2005.3, 1. 7. 2005).
- [14] Prescribing Information: Biaxin® XL (clarithromycin), Abbott, December 2003 (PDR, 2005).
- [15] Souhrn údajů o přípravku: Klacid® (clarithromycin), Abbott, 3. 11. 2004 (AISLP, verze 2005.3, 1. 7. 2005).
- [16] Souhrn údajů o přípravku: Rulid® (roxithromycin), Zentiva, 3. 11. 2004 (AISLP, verze 2005.3, 1. 7. 2005).
- [17] Souhrn údajů o přípravku: Ketek® (telithromycin), Aventis, 20. 4. 2005 (AISLP, verze 2005.3, 1. 7. 2005).
- [18] Prescribing Information: Ketek® (telithromycin), Aventis, March 2004 (PDR, 2005).
- [19] Souhrn údajů o přípravku: Vasexten® (barnidipin hydrochlorid), Yamanouchi, 16. 6. 2004 (AISLP, verze 2005.3, 1. 7. 2005).
- [20] Prescribing Information: Relpax® (eletriptan hydrobromide), Pfizer, September 2003 (PDR, 2005).
- [21] Souhrn údajů o přípravku: Relpax® (eletriptan hydrobromid), Pfizer, 16. 6. 2004 (AISLP, verze 2005.3, 1. 7. 2005).
- [22] Souhrn údajů o přípravku: Certican® (everolimus), Novartis, 26. 1. 2005 (AISLP, verze 2005.3, 1. 7. 2005).
- [23] Osobní komunikace Servier.
- [24] Souhrn údajů o přípravku: Lerpin® (lerkanidipin hydrochlorid), Berlin-Chemie, 4. 5. 2005 (AISLP, verze 2005.3, 1. 7. 2005).
- [25] Souhrn údajů o přípravku: Mecacor® (lovastatin), MSD, 18. 5. 2005 (AISLP, verze 2005.3, 1. 7. 2005).
- [26] Prescribing Information: Mevacor® (lovastatin), Merck, June 2002 (PDR, 2005).
- [27] Prescribing Information: Avelox® (moxifloxacin hydrochloride), Bayer, June 2004 (PDR, 2005).
- [28] Souhrn údajů o přípravku: Avelox® (moxifloxacin hydrochlorid), Bayer, 3. 11. 2004 (AISLP, verze 2005.3, 1. 7. 2005).
- [29] Prescribing Information: Orap® (pimozide), Gate, August 1999 (PDR, 2005).
- [30] Souhrn údajů o přípravku: Serdolect® (sertindol), Lundbeck, 8. 1. 2003 (AISLP, verze 2005.3, 1. 7. 2005).
- [31] Prescribing Information: Zocor® (simvastatin), Merck, February 2004 (PDR, 2005).
- [32] Souhrn údajů o přípravku: Zocor® (simvastatin), MSD, 23. 2. 2005 (AISLP, verze 2005.3, 1. 7. 2005).
- [33] Prescribing Information: Rapamune® (sirolimus), Wyeth, August 2004 (PDR, 2005).
- [34] Souhrn údajů o přípravku: Rapamune® (sirolimus), Wyeth, 20. 04. 2005 (AISLP, verze 2005.3, 1. 7. 2005).
- [35] Démolis JL, et al. Assesment of the effect of a single oral dose of telithromycin on sotalol-induced QT interval prolongation in healthy women. Br J Clin Pharmacol 2005; 60: 120–127.
- [36] de Mey C, et al. Erythromycin increases plasma concentrations of -dihydroergocryptine in humans. Clin Pharmacol Ther 2001; 70: 142–148.
- [37] Nelson MV, et al. Pharmacokinetics evaluation of erythromycin and caffeine administered with bromocriptine. Clin Pharmacol Ther 1990; 47: 694–697.
- [38] Kivistö KT, et al. Buspirone concentration are greatly increased by erythromycin and itraconazole. Clin Pharmacol Ther 1997; 62: 348–354.
- [39] Souhrn údajů o přípravku: Anxiron® (buspiron hydrochlorid), ICN, 18. 10. 2000 (AISLP, verze 2005.3, 1. 7. 2005).
- [40] Souhrn údajů o přípravku: Buspiron-Egis® (buspiron hydrochlorid), Egis, 22. 1. 2003 (AISLP, verze 2005.3, 1. 7. 2005).
- [41] http://medicine.iupui.edu/flockhart/table.htm
- [42] Pichard L, et al. Cyclosporin a drug interaction. Screening for Inducers and Inhibitors of Cytochrome P-450 (Cyclosporin A Oxidase) in Primary Cultures of Human Hepatocytes and in Liver Microsomes. Drug Metab Dispos 1990; 18: 595–606.
- [43] Kenworthy KE, et al. CYP3A4 drug interaction: correlation of 10 in vitro probe substrates. Br J Clin Pharmacol 1999; 48: 716–727.
- [44] Milne RW, et al. Hepatic disposition of fexofenadine: influence of the transport inhibitors erythromycin and dibromosulphothalein. Pharm Res 2000; 17: 1511–1515.
- [45] Wakasugi H, et al. Effect of clarithromycin on renal excretion of digoxin: Interaction with P-glycoprotein. Clin Pharmacol Ther 1998; 64: 123–128.
- [46] Gupta S, et al. Pharmacokinetic and safety profile of desloratadine and fexofenadine when coadministered with azithromycin: a randomized, placebo-controlled, parallel-group study. Clin Ther 2001; 23: 451–466.