Kanabidiol, kanabinoidy a jejich vliv na celkovou anestezii
Souhrn
Hess L. Kanabidiol, kanabinoidy a jejich vliv na celkovou anestezii. Remedia 2024; 34: 480–484.
Konopí je široce rozšířenou omamnou drogou používanou již po dobu nejméně 8 000 let. Kolem roku 1800 přinesli konopí z Egypta Napoleonovi vojáci do Evropy. Konopí obsahuje biologicky aktivní látky – fytokanabinoidy, terpeny a flavonoidy. Nejvíce studovány jsou tetrahydrokanabinol (THC) a kanabidiol (CBD), které se v organismu vážou na kanabinoidní receptory. Endogenní ligandy anandamid a 2‑arachidonoylglycerol tvoří spolu s receptory tzv. endokanabinoidní systém, který zasahuje do nejrozmanitějších funkcí organismu, především do vnímání bolesti, protekce neuronů i imunitní činnosti, kontroly metabolismu, zánětlivých reakcí, udržování kostní hmoty, kardiovaskulární činnosti a hormonů. Kanabidiol se váže na alosterické vazebné místo receptoru CB1. Alosterická modulace receptorů CB1 mění jejich konformaci a tím ovlivňuje způsob, jakým receptor CB1 reaguje na THC a endokanabinoidy. Z našeho hlediska jsou nejdůležitějšími anxiolytický účinek, sedace a analgezie. CBD výrazně zmírňuje některé negativní účinky THC a snižuje jeho agonistickou aktivitu na receptorech CB1. Endogenní kanabinoidy z mnoha hledisek ovlivňují účinek anestetik.
Klíčová slova: kanabinoidy – kanabinoidní receptory – endokanabinoidní systém – tetrahydrokanabinol (THC) – kanabidiol (CBD) – mechanismus účinku – vliv kanabinoidů na celkovou anestezii.
Summary
Hess L. Cannabidiol, cannabinoids and their effect on general anesthesia. Remedia 2024; 34: 480–484.
Cannabis is a narcotic drug, which has been widely used for at least 8,000 years. Around 1800, Napoleonʼs soldiers brought cannabis from Egypt to Europe. Cannabis contains biologically active substances – phytocannabinoids, terpenes and flavonoids. Of those, the most widely studied are tetrahydrocannabinol (THC) and cannabidiol (CBD), binding to cannabinoid receptors in the organism. Endogenous ligands anandamide and 2‑arachidonoylglycerol along with the receptors form a so called endocannabinoid system, modulating various functions of the organism, including pain perception, neuron protection and immune processes, metabolism control, inflammatory reactions, bone mass preservation, cardiovascular functions, and hormones. Cannabidiol binds to an allosteric binding site of the CB1 receptor. Allosteric modulation of the CB1 receptors changes their conformation and thus the way CB1 receptor reacts to THC and endocannabinoids. From our point of view, the anxiolysis, sedation and analgesia are the most important effects. CBD hugely reduces some negative effects of THC and decreases its antagonistic activity on CB1 receptors. Endogenous cannabinoids modulate the effects of anesthetics in many ways.
Key words: cannabinoids – cannabinoid receptors – endocannabinoid system – tetrahydrocannabinol (THC) – cannabidiol (CBD) – mechanism of action – effect of cannabinoids on general anesthesia.
Historie
Kromě alkoholu neexistuje žádná omamná droga, která je tak široce rozšířena a provází lidstvo tak dlouho jako konopí.
 Konopí (lat. cannabis) se podle archeologických nálezů používalo v různých formách ve Střední a Východní Asii nejméně po dobu 8 000 let (obr. 1). V první polovině třetího tisíciletí před naším letopočtem (př. n. l.) se konopí objevuje v čínské medicíně. Císař Šen‑nung doporučuje tuto drogu již roku 2737 př. n. l. proti zácpě, revmatismu, malárii a jiným obtížím. Konopí nehrálo v Číně tak důležitou roli jako opium. Okolo 800 let př. n. l. se vynořuje droga v indické ájurvédské medicíně. Také v náboženské oblasti hrála tato droga důležitou úlohu. Na rozdíl od alkoholu nebyl bráhmanům odepřen zážitek z konopí. Při velkých svátcích, jako je svátek boha Višny, dostali mladí kněží konopí a v omámení viděli tvář boha. Při slavnostech na počest krvavé bohyně Kálí dostaly oběti nápoj obsahující konopí a pak se vrhaly pod obrovská kola ozdobných vozů, na kterých trůnil obraz bohyně. Na její počest se vrhaly v omámení pod chodidla svatých slonů a nechaly se jimi rozdrtit. Podle odhadů z roku 1806 byl počet obětí při takových slavnostech okolo 20 tisíc ročně. Při indickém kultu plodnosti bylo podáno konopí vyvoleným ženám, které nebyly v poslední době těhotné. V extatickém stavu pak byla položena oběť na oltář, kde jí byl proříznut krk a krev vytékala na zem. Následně se přiřítili náboženští fanatici nad ještě cukající mrtvolu a zuby nebo nožem vyjímali kusy masa, které zakopali na svém poli, aby zajistili dobrou úrodu. Konopí hrálo důležitou úlohu rovněž ve Starém zákoně nebo v Homérově Odysseji a bylo součástí nápoje zapomnění (nepenthe).
Konopí (lat. cannabis) se podle archeologických nálezů používalo v různých formách ve Střední a Východní Asii nejméně po dobu 8 000 let (obr. 1). V první polovině třetího tisíciletí před naším letopočtem (př. n. l.) se konopí objevuje v čínské medicíně. Císař Šen‑nung doporučuje tuto drogu již roku 2737 př. n. l. proti zácpě, revmatismu, malárii a jiným obtížím. Konopí nehrálo v Číně tak důležitou roli jako opium. Okolo 800 let př. n. l. se vynořuje droga v indické ájurvédské medicíně. Také v náboženské oblasti hrála tato droga důležitou úlohu. Na rozdíl od alkoholu nebyl bráhmanům odepřen zážitek z konopí. Při velkých svátcích, jako je svátek boha Višny, dostali mladí kněží konopí a v omámení viděli tvář boha. Při slavnostech na počest krvavé bohyně Kálí dostaly oběti nápoj obsahující konopí a pak se vrhaly pod obrovská kola ozdobných vozů, na kterých trůnil obraz bohyně. Na její počest se vrhaly v omámení pod chodidla svatých slonů a nechaly se jimi rozdrtit. Podle odhadů z roku 1806 byl počet obětí při takových slavnostech okolo 20 tisíc ročně. Při indickém kultu plodnosti bylo podáno konopí vyvoleným ženám, které nebyly v poslední době těhotné. V extatickém stavu pak byla položena oběť na oltář, kde jí byl proříznut krk a krev vytékala na zem. Následně se přiřítili náboženští fanatici nad ještě cukající mrtvolu a zuby nebo nožem vyjímali kusy masa, které zakopali na svém poli, aby zajistili dobrou úrodu. Konopí hrálo důležitou úlohu rovněž ve Starém zákoně nebo v Homérově Odysseji a bylo součástí nápoje zapomnění (nepenthe).
Staří Asyřané okolo roku 900 př. n. l. používali konopí jako kadidlo. V archivu hliněných tabulek staré Mezopotámie je uváděno, že drogy byly systematicky zkoušeny na otrocích a tím byl objeven mezi jiným také omamující účinek této látky. Osm set let př. n. l. se droga dostala dále na západ. Hérodotos pojednává o asijském jezdeckém kočovném národu Skytů. Semena konopí kladli na žhavé kameny a vzniklými výpary se omamovali. Bylo to spojeno s náboženským rituálem. Ve 12. století doporučuje Hildegarda z Bingenu konopí k lokálnímu použití u otevřených ran a vředů. Společně s mandragorou, rulíkem a dalšími lilkovitými rostlinami a opiem bylo součástí čarodějných mastí pozdního středověku.
Kolem roku 1800 Napoleonovi vojáci přivezli drogu z Egypta a učinili ji všeobecně známou. Neurolog a psychiatr s přezdívkou Moreau de Tours napsal v roce 1845 základní dílo o účincích konopí. Francouzští spisovatelé v této době rovněž založili klub poživačů hašiše (Club des Hashischins) a prováděli v pařížském paláci Pimodan na ostrově sv. Ludvíka pokusy na sobě, které někteří z nich literárně zpracovali (např. Charles Baudelaire, Théophile Gautier nebo Arthur Rimbaud) [1].
Kanabinoidy
Konopí obsahuje biologicky aktivní látky – fytokanabinoidy (chemicky jsou to fenolické sloučeniny s více kruhy), terpeny a flavonoidy. Tvoří součást obrany proti býložravcům, hrají také roli při obraně proti hmyzu, houbám a proti abiotickým stresovým faktorům, např. suchu. Všechny tyto látky ovlivňují chemii našeho organismu. Dosud bylo identifikováno na 120 fytokanabinoidů, z nichž jen málo je podrobněji prozkoumáno. Dva z nich převládají a jsou nejvíce studovány. Delta‑9‑tetrahydrokanabinol (THC) a kanabidiol (CBD) jsou syntetizovány a koncentrovány ve viskózní pryskyřici v malých lepkavých vláscích zvaných trichomy [2].
THC izoloval z konopí Raphael Mechoulam (1930–2023) v roce 1964 na Hebrejské univerzitě v Jeruzalémě a zjistil jeho psychotropní účinky. CBD je druhým nejvýznamnějším kanabinoidem, protože výrazně ovlivňuje psychiku člověka, a proto je také hlavním předmětem tohoto sdělení.
Kanabinoidní receptory
Po mnoho let byl mechanismus účinku THC nejasný. Protože má velmi lipofilní molekulu, převládal názor, že působí podobně jako inhalační anestetika ovlivněním lipoidních membrán. Začátkem 80. let minulého století byla v mozku při studiích in vitro prokázána existence kanabinoidních receptorů, které byly identifikovány jako receptory spojené s G proteinem. Sekvence DNA, která kóduje kanabinoidní receptor CB1 v lidském mozku, byla identifikována a klonována v roce 1990. V letech 1992–1993 byl určen druhý kanabinoidní receptor CB2. Mezi receptory spřaženými s G proteinem jsou kanabinoidní receptory v lidském mozku zastoupeny nejčastěji. Receptory CB1 se vyskytují především v mozku. Pokusy na myších s tzv. knockoutovanými receptory CB1 ukázaly, že tyto receptory zprostředkovávají změny v chování po kanabinoidech. Zvlášť vysoká hustota se nachází ve striatu, kde je dokonce dvojnásobná ve srovnání s hustotou dopaminových receptorů. Vysoká koncentrace se vyskytuje v mozkové kůře, některých částech mozkového kmene, v hipokampu a amygdale. Chybějí v prodloužené míše, částech mozku, kde se nacházejí oblasti řízení respirace a kardiorespiračních funkcí. Objevují se i v mozečku a v reprodukčním systému a vyskytují se v periferních tkáních, například v srdci. Je zajímavé, že okolo 50 % sekvence aminokyselin receptoru CB1 je shodných s receptorem u pijavek, což svědčí o tom, že tento signální systém je fylogeneticky velmi starý. Receptory CB2 se vyskytují především v imunitním systému, na makrofázích a B lymfocytech, hematopoetických orgánech, ale i v srdci. Mají rovněž funkci v keratinocytech, v mozku především v mikrogliových buňkách, nacházejí se také v thymu a žírných buňkách. Receptory CB2 hrají důležitou úlohu v analgezii, zejména při zánětech [3].
Shoda v sekvenci aminokyselin mezi receptory CB1 a CB2 je pouze okolo 44 %. Geny pro oba receptory jsou u člověka umístěny na chromozomu 6, u myši na chromozomu 4. V současné době byly tyto receptory již klonovány [4].
Naproti tomu oblasti, které nejsou zahrnuty do fyziologických účinků kanabinoidů (např. respirační jádra mozkového kmene), mají velmi nízkou hustotu těchto receptorů. Existence kanabinoidních receptorů předpokládá existenci endogenních ligandů.
Endokanabinoidy
Po objevu kanabinoidních receptorů se naskytla otázka, k čemu v organismu slouží a jaké mají endogenní ligandy, podobně jako je tomu u opioidů. Takto byly prokázány tzv. endokanabinoidy, z nichž první byl N‑arachidonoyletanolamin (AEA). Identifikován byl v mozku prasete a byl nazván anandamid (ze sanskrtu ananda = blaženost). Následně byly objeveny další endokanabinoidy – v roce 1995 byl izolován 2‑arachidonoylglycerol (2AG). Jedná se o deriváty mastných kyselin. Endogenní kanabinoidy spolu s kanabinoidními receptory tvoří tzv. endokanabinoidní systém, který zasahuje do nejrozmanitějších funkcí organismu, především do vnímání bolesti, protekce neuronů i imunitní činnosti, kontroly metabolismu, zánětlivých reakcí, udržování kostní hmoty, kardiovaskulární činnosti a činnosti hormonů [5].
Vazba kanabidiolu na kanabinoidní receptory
THC se váže přímo na receptory CB1 na tzv. ortosterickém místě. Vazbu lze přirovnat k odemykání zámku. THC jako molekulární klíč odemkne receptor CB1 a tím spustí řadu nitrobuněčných procesů a rovněž inhibici celé řady neurotransmiterů a navození sedace. Vazebné místo na receptorech CB1 slouží také jako „klíčová dírka“ pro endogenní příbuzné THC anandamid a 2AG, jež jsou nejhojněji se vyskytujícími endokanabinoidy v organismu. Všechny tyto látky se váží na ortosterické místo jako THC, a proto se o nich někdy hovoří jako o „konopí, které si mozek pěstuje sám pro sebe“ [6].
CBD se váže na jiné místo na receptoru CB1 – na tzv. alosterické vazebné místo. Když se CBD naváže jako negativní alosterický modulátor receptoru CB1, není spuštěn signální řetězec nitrobuněčných dějů, avšak je ovlivněn způsob, jakým receptor CB1 reaguje na THC a endokanabinoidy. Alosterická modulace receptoru CB1 změní konformaci (tvar receptoru). Ortosterické vazebné místo funguje jako vypínač, který mohou tyto látky aktivovat, zatímco alosterický modulátor buď zvyšuje, nebo snižuje schopnost receptoru přenášet signál obsahující informace do buňky dle toho, jak alosterický modulátor mění konformaci receptoru [7,8].
Před nedávnem bylo přesně určeno místo, kde se CBD váže na receptor CB1. Tento bílkovinný receptor se skládá ze 472 aminokyselin spojených do řetězce, který je třikrát obtočen kolem buněčné membrány. Díky analýze bylo zjištěno, že hlavním vazebným místem CBD jsou pozice mezi 98. a 107. aminokyselinou na receptoru CB1 [9].
Farmakologické účinky CBD jsou četné – antinocicepční, antiepileptický, antidepresivní, anxiolytický, neuroprotektivní, protizánětlivý. Kromě toho prekurzor CBD – kyselina kanabidiolová – má účinek antibiotický [10].
THC a CBD spolu úzce spolupracují a tvoří nerozlučnou dvojici. Dosud se setkáváme s názorem, že THC má psychotropní účinky, zatímco CBD je nemá. Jak bylo zmíněno, CBD působí anxiolyticky, antidepresivně a neuroprotektivně. Redukuje aktivitu amygdaly při reakci na podněty vyvolávající strach. Inhibuje zpětné vychytávání a hydrolýzu anandamidu a napodobuje tak agonistickou aktivitu na vaniloidním receptoru, který zprostředkovává vnímání mechanických a tepelných podnětů. Kromě toho inhibuje zpětné vychytávání adenosinu.
CBD zmírňuje některé negativní účinky THC, snižuje jeho agonistickou aktivitu na receptorech CB1, zmírňuje tachykardizující a anxiogenní účinky THC a redukuje jím vyvolané psychické příznaky. Snižuje účinek a úroveň neuronální aktivity v klíčových oblastech, které reagují na úzkost vyvolanou podnětem z amygdaly a z přední a zadní cingulární kůry. To znamená, že CBD také ovlivňuje psychiku člověka. Tvrzení, že CBD není psychoaktivní, je tedy zavádějící, ale je možno lépe formulovat, že CBD není psychoaktivní stejným způsobem jako THC.
Dále se CBD váže na glycinové receptory a zvyšuje tak koncentraci glycinu v organismu. Potlačuje zánětlivé reakce a tlumí neuropatickou bolest. Váže se také na GABA receptory a zvyšuje tak koncentraci kyseliny gama‑aminomáselné (GABA), čímž pomáhá proti úzkosti a působí jako antikonvulzivum. Vazbou na serotoninové receptory moduluje náladu, ovlivňuje bolest, kognitivní schopnosti, paměť, nauzeu i kardiovaskulární činnost. Vazbou na adenosinové receptory zprostředkovává protizánětlivé a neuroprotektivní účinky. Jeho význam při vazbě na opioidní receptory není dosud znám. Kromě toho se rovněž váže na receptory adenosinmonofosfátu (AMP) podobně jako ketamin, což vede k jeho antidepresivnímu účinku.
 CBD se testuje v celé řadě indikací. Z našeho hlediska jsou nejdůležitější sedace (obr. 2A, B), analgezie a také anxiolytický účinek. Inhibuje úzkost vyvolanou vysokými dávkami THC, redukuje tedy subjektivní změny v kognici, jako jsou poruchy vnímání, depersonalizace a poruchy v komunikaci. CBD částečně chrání uživatele před nežádoucími účinky THC [11].
CBD se testuje v celé řadě indikací. Z našeho hlediska jsou nejdůležitější sedace (obr. 2A, B), analgezie a také anxiolytický účinek. Inhibuje úzkost vyvolanou vysokými dávkami THC, redukuje tedy subjektivní změny v kognici, jako jsou poruchy vnímání, depersonalizace a poruchy v komunikaci. CBD částečně chrání uživatele před nežádoucími účinky THC [11].
Zajímavá je kombinace kofeinu s CBD. Kofein je celosvětově nejoblíbenějším stimulantem, denně se vypije přes 2,2 miliardy šálků kávy. Kofein je antagonistou adenosinových receptorů. Adenosin se hromadí v průběhu dne v neuronálních synapsích a vyvolává ospalost. Kofein se váže na adenosinový receptor a blokuje ho a výsledkem je zmírnění ospalosti. Kofein také zvyšuje hladinu cyklického AMP prostřednictvím neselektivní inhibice fosfodiesterázy [12]. Naproti tomu CBD zvyšuje aktivitu GABA, hlavního inhibičního neurotransmiteru, kromě toho se váže na serotoninergní receptory. Serotonin reguluje naši náladu a stupeň úzkosti. CBD také reguluje reuptake – zpětný příjem adenosinu do neuronů. Kanabinoidní receptory hrají důležitou úlohu při uvolnění neurotransmiterů dopaminu, serotoninu nebo oxytocinu. Vhodným poměrem kofeinu a CBD vzniká kombinace, která redukuje některé nežádoucí účinky kofeinu, např. úzkost.
Kanabidiol
CBD a bezděčný smích
Smích vyvolává zvýšení hodnot endorfinů a dopaminu, a naopak snižuje koncentrace stresových hormonů kortizolu, adrenalinu a noradrenalinu. Kanabinoidy ovlivňují endokanabinoidní systém, který je mimo jiné již v interakci s endogenním opioidním systémem, a činí ho citlivějším vůči zevním podnětům. CBD též zvyšuje koncentraci oxytocinu, který má také vliv na sociální chování. Oxytocin podporuje prosociální chování a jeho projevy, jako jsou úsměv a smích. To vše vede k tomu, že po požití kanabinoidů může dojít k bezděčnému smíchu. CBD funguje různými vzájemně se doplňujícími způsoby a vytváří tak kontext pro vznik bezděčného smíchu. Tolerance a výše dávky CBD pak ovlivňují výskyt tohoto smíchu.
CBD ve formě nanočástic
CBD se připravuje ve formě oleje, protože je ve vodě nerozpustný. Pomocí ultrazvuku lze olej rozbít na drobné nanočástice, které se pak stabilizují smícháním s povrchově aktivními látkami. Dalším řešením jsou lipozomy – umělé sférické útvary, do jejichž dvojvrstvy fosfolipidů se umístí nanočástice CBD. Nano CBD má 10× větší biologickou dostupnost, jeho účinek nastupuje rychleji, ale také rychleji odeznívá.
Způsoby aplikace a délka účinku CBD při různém podání
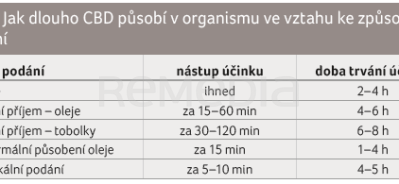 Nejčastěji je CBD podáván perorálně nebo transbukálně (sublinguálně). Možný je též inhalační způsob podání, pro lokální aplikaci se využívá transdermální podání [13]. Nástup účinku a dobu působení CBD v závislosti na způsobu podání shrnuje tabulka 1.
Nejčastěji je CBD podáván perorálně nebo transbukálně (sublinguálně). Možný je též inhalační způsob podání, pro lokální aplikaci se využívá transdermální podání [13]. Nástup účinku a dobu působení CBD v závislosti na způsobu podání shrnuje tabulka 1.
Současné použití CBD v medicíně
Ve Spojených státech amerických a v Evropské unii je CBD používán k léčbě některých vzácných typů epilepsie (syndrom Dravetové, Lennoxův–Gastautův syndrom) a tuberózní sklerózy.
Dosud chybějí dostatečná vědecká data o použití CBD při Parkinsonově chorobě, diabetes mellitus nebo neurologických chorobách. Přesto existuje početná literatura o použití CBD v těchto indikacích [14,15]. Slouží také k sedaci jako anxiolytikum a při chronické bolesti je používán jako analgetikum. Manucci a kol. shrnují pokusná a klinická data o vlivu CBD na epilepsii, Parkinsonovu, Alzheimerovu, Huntingtonovu chorobu, roztroušenou sklerózu, amyotrofickou laterální sklerózu a mozkovou ischemii. Konstatují, že CBD lze použít pro široké spektrum terapeutických účinků včetně neuroprotektivních [16].
Zkouší se rovněž kombinace CBD s ketaminem – vazbou na receptor AMP tlumí jeho psychostimulační a lokomotorické účinky.
Ve veterinární medicíně se CBD používá u psů a koní pro mírnění chronické bolesti způsobené osteoartrózou, v léčbě epilepsie a úzkosti [17].
Schopnost řízení vozidla pod vlivem CBD
V roztoku CBD je obsaženo méně než 0,3 % THC, což je zanedbatelné množství. Obecně je tedy jízda autem povolena. Protože má CBD anxiolytické a psychicky relaxační účinky, může ovlivnit naše reakční schopnosti a ostražitost. Z tohoto důvodu je vhodné posoudit individuální vliv CBD na psychiku jedince a zvážit rovněž aktuální zdravotní stav, eventuálně farmakologickou medikaci. V některých zemích (např. Belgie, Malta, Srbsko) je CBD zakázán, je tedy nutné toto vzít v úvahu při cestování autem do daných států [18].
CBD a legislativa
Olej s CBD a další produkty jsou v České republice legální, pokud jsou vyráběny ze schváleného průmyslového (technického) konopí. CBD samotný není zařazen mezi návykové látky a Soudní dvůr Evropské unie také na konci roku 2020 prohlásil, že se nejedná o narkotikum. Právní regulace CBD prošla turbulentním vývojem. Tvrzení o léčivém efektu jsou u potravin a doplňků stravy zakázána a u nás na dodržování tohoto zákazu dohlíží Státní zemědělská a potravinářská inspekce. Je zajímavé, že v Albánii, Andoře, Bosně a Hercegovině, Gruzii, Litvě, Moldávii, Monaku a Černé Hoře je absolutní zákaz CBD. Pro léčebné účely je povolen např. v Norsku nebo v Portugalsku [19].
Vliv kanabinoidů na účinek anestetik
Působení kanabinoidů na farmaka používaná k celkové anestezii závisí na tom, zda jsou kanabinoidy užívány chronicky, nebo jednorázově. Při jednorázovém podání CBD vzhledem k jeho anxiolytickým a psychicky relaxačním vlastnostem dochází k výrazné redukci dávkování farmak používaných k indukci anestezie i v jejím průběhu. Naopak u chronických uživatelů dochází enzymatickou indukcí k výraznému zvýšení spotřeby anestetik.
Antiemetické a rovněž kardioprotektivní účinky propofolu jsou zprostředkovány centrální interakcí s endogenním kanabinoidním systémem [20]. Naproti tomu inhalační anestetikum sevofluran výrazně snižuje koncentraci anandamidu v krvi, což vede ke zvýšenému výskytu nauzey a zvracení v pooperační fázi [21]. U etomidátu nebyly zjištěny klinicky relevantní interakce s kanabinoidním systémem. Také na účincích paracetamolu (acetaminofen) se podílejí endokanabinoidy. Paracetamol je deacetylován na 4‑aminofenol a je konjugován hydrolázou mastných kyselin (FAAH) na N‑arachidonoylfenol (AM404), který se váže na vaniloidní receptory a receptory CB1 a CB2. AM404 pak inhibuje zpětný příjem anandamidu do neuronu. Výsledkem je, že hodnota anandamidu stoupá. Na analgetických účincích se podílejí i interakce se serotoninergním systémem. Pravidelná konzumace kanabinoidů perorálně nebo inhalačně vede k výraznému zvýšení dávek propofolu, midazolamu i fentanylu k indukci anestezie i v jejím průběhu [22].
Kanabinoidy jsou farmaka vysoce rozpustná v tucích, proto se snadno akumulují v tukové tkáni. Odtud jsou mnoho dní uvolňovány do krve. V játrech jsou odbourávány na aktivní a inaktivní metabolity. Při pravidelném příjmu kanabinoidů nebo příjmu terapeutických dávek THC vyšších než 5 g denně jsou tyto navzdory časové pauze před operací prokazatelné v krvi pacienta. Proto dochází k interakci se sedativy, analgetiky a anestetiky.
Pravidelný příjem konopí perorálně nebo inhalačně ovlivňuje výrazně hypnotický účinek propofolu [23]. K indukci anestezie bylo ve studii zapotřebí vyšších dávek propofolu, ale i fentanylu a midazolamu. Limitace zmíněné studie spočívá v chybějících údajích po týdenní konzumaci konopí a současném užívání tabáku. V jiné studii potřebovali konzumenti výrazně vyšší dávku propofolu na zavedení laryngeální masky. Také je stále nejasný vliv chronického užívání konopí na udržování celkové anestezie – premedikace nabiximolsem (konopný extrakt z THC a CBD ve formě oromukózního spreje) vede k výraznému zvýšení bispektrálního indexu (BIS – elektroencefalografický [EEG] monitoring hloubky sedace a anestezie) ve srovnání s kontrolní skupinou [23]. Dochází ke změlčení anestezie a k zesílení EEG aktivity. Monitorování hloubky anestezie prostřednictvím BIS je u pacientů s chronickým užíváním konopí narušeno. Zvýšená spotřeba propofolu, fentanylu a midazolamu spočívá v indukci cytochromového systému a interakcích s glukuronidovým systémem v játrech. THC působí enzymatickou indukci a zvýšení odbourávání propofolu. Konopí ovlivňuje také plazmatickou koncentraci antiepileptik, jako je klonazepam [23].
V centrálním nervovém systému jsou receptory CB1 spojeny v 60 % s GABAergními neurony. Tato down regulace vede k redukci GABAergní synaptické inhibice, a tím k neuronální hyperexcitaci. Protože inhalační anestetika a propofol se vážou na receptory GABAA, mohly by změny v GABAergní transmisi hrát roli ve zvýšené spotřebě anestetik.
Konzumenti konopí mají daleko vyšší spotřebu sedativ, analgetik a anestetik i v pooperační fázi. Je třeba se cíleně ptát na požívání CBD, THC a dalších kanabinoidů a případně monitorovat abstinenční příznaky v pooperační fázi.
Doc. MUDr. Ladislav Hess, DrSc.
Institut postgraduálního vzdělávání ve zdravotnictví
Ruská 2412/85, 100 00 Praha 10
e-mail: ladislav.hess48@gmail.com
Literatura
[1] Schmidbauer W, vom Scheidt J. Handbuch der Rauschdrogen. Berlín: Fischer, 1990.
[2] Goldstein B. Konopí je lék. Praha: Práh, 2022.
[3] Mackie K. Cannabinoid receptors: Where there are and what they do. J Neuroendocrinol 2008; 20(Suppl 1): 4–10.
[4] Landa L, Juřica J. Léčebné konopí v současné medicínské praxi. Praha: Grada, 2020.
[5] Fišar Z. Endokanabinoidy. Chem Listy 2006; 100: 314–322.
[6] Marcu J, Matthews AS, Lee MA. Is CBD Really Non‑Psychoactive? Project CBD 2016. Dostupné na: https://projectcbd.org/science/is‑cbd‑really‑non‑psychoactive/
[7] Laprairie RB, Bagher AM, Kelly MEM, Denovan‑Wright EM. Cannabidiol is a negative allosteric modulator of the type 1 cannabinoid receptor. Br J Pharmacol 2015; 172: 4790–4805.
[8] Abood ME. Allosteric Modulators: A Side Door. J Med Chem 2016; 59: 42–43.
[9] Kulkarni PM, Kulkarni AR, Korde A, et al.Novel Electrophilic and Photoaffinity Covalent Probes for Mapping the Cannabinoid 1 Receptor Allosteric Site(s). J Med Chem 2015; 59: 44–60.
[10] Pellati F, Borgonetti V, Brighenti V, et al. Cannabis sativa L. and Nonpsychoactive Cannabinoids: Their Chemistry and Role against Oxidative Stress, Inflammation, and Cancer. Biomed Res Int 2018; 23: 1–15.
[11] Mackie K, Rice ASC. Analgesics: Cannabinoids. In Evers AS, Maze M (ed.). Anesthetic Pharmacology: Physiologic principles and clinical practice. Londýn: Churchill Livingstone, 2005: 491–506.
[12] Ferré S. An update on the mechanisms of the psychostimulant effects of caffeine. J Neuro Chem 2008; 105: 1067–1079.
[13] Harrison J, VanDolah BA, Brent A, et al. Clinicians‘ Guide to Cannabidiol and Hemp Oils. Mayo ClinicProc 2019; 94: 1840–1851.
[14] Bonaccorso S, Ricciardi A, Zangani C, et al. Cannabidiol (CBD) use in psychiatric disorders; A systematic review. Neurotoxicology 2019; 74: 282–298.
[15] Karlíčková J. Potenciální léčebné využití kanabidiolu (CBD) z konopí setého. Prakt lékáren 2019; 15: 227–230.
[16] Mannucci C, Navarra M, Calapai F, et al. Neurological Aspects of Medical Use of Cannabidiol. CNS Neurol Disord Drug Targets 2017; 16: 541–553.
[17] Landa L, Trojan V, Demlova R, et al. Cannabidiol and the possibilities of its use in veterinary medicine of dogs and horses: A brief review. Vet Med – Czech 2022; 67: 455–462.
[18] Arkell T, Vickenbosch H, Kevin TC. Effect of cannabidiol and delta tetrahydrocannabinol on driving performance. JAMA 2020; 324: 2177–2186.
[19] How&Where to Buy CBD Products in Europe (Updated 2021). Daily CBD – English. Dostupné na: https://dailycbd.com/en/europe/
[20] Patel S, Wohlfeil ER, Rademacher DJ, et al. The general anesthetic propofol increases brain N‑arachidonylethanolamine (anandamide) content and inhibits fatty acid amide hydrolase. Brit J Farmacol 2003; 139: 885–886.
[21] Schelling G, Hauer D, Azad SC, et al. Effects of General Anesthesia on Anandamide Blood Levels in Humans. Anesthesiology 2006; 104: 273–277.
[22] Lee BH, Sideris A, Ladha KS, et al. Cannabis and Cannabinoids in the Perioperative Period. Anesth Analg 2024; 138: 16–30.
[23] Laudanski K, Wain J, Forget P. Considerations fo rCannabinoids in Perioperative Care by Anesthesiologists. J Clin Med 2022; 11: 558–594.