Kardiovaskulární nežádoucí účinky anti‑VEGF terapie v onkologii
Souhrn:
Lapka M. Kardiovaskulární nežádoucí účinky anti‑VEGF terapie v onkologii. Remedia 2021; 31: 260–263.
Porozumění fyziologické roli vaskulárního endoteliálního růstového faktoru (VEGF) poskytuje vhled do mechanismu nežádoucích účinků (NÚ) připisovaných použití inhibitorů VEGF v klinické onkologii. Nežádoucí účinky představují důsledky potlačení buněčných signálních drah důležitých při regulaci a zachování vaskulárního systému a mohou vést k vaskulárním poruchám. Tento článek uvádí aktuální data o nejčastěji popsaných NÚ spojených s inhibitory VEGF při léčbě onkologických onemocnění. Mnoho léčiv s tímto mechanismem účinku je aktuálně ve vývoji, jsou hodnocena v klinických studiích nebo jsou již schválena k použití v onkologii. Rozšířené užívání zvyšuje pochopení jejich působení, zpřesňuje popis nepříznivých účinků spojených s jejich aplikací a zvyšuje povědomí o těchto NÚ.
Summary:
Lapka M. Cardiovascular side effects of anti‑VEGF therapy in oncology. Remedia 2021; 31: 260–263.
Understanding the physiological role of vascular endothelial growth factor (VEGF) provides insight into the mechanism of side effects (SEs) attributed to the use of VEGF inhibitors in clinical oncology. Side effects represent the consequences of repression of cell signal pathways important in the regulation and maintenance of vascular system that can lead to vascular disorders. This review provides current data on the most commonly described SEs associated with VEGF inhibitors in the therapy of oncological diseases. Many drugs with this mechanism of action are currently being developed, evaluated in clinical studies or already approved for use in oncology. Widespread use increases the understanding of their action, makes the description of SEs associated with their administration more precise and increases awareness of these SEs.
Key words: cardiovascular side effects, anti‑VEGF therapy, oncological diseases.
Úvod
Pokrok v porozumění fyziologické roli vaskulárního endoteliálního růstového faktoru (vascular endothelial growth factor, VEGF) přináší pochopení kontextu nežádoucích účinků (NÚ) připisovaných léčivům inhibujícím VEGF. Nežádoucí účinky se projevují jako dopady inhibice signálních drah důležitých pro regulaci vaskulárního systému, čímž mohou směřovat k rozvoji vaskulárních poruch [1,2].
Vaskulární endoteliální růstový
faktor je glykoprotein, který hraje klíčovou roli v angiogenezi
a lymfangiogenezi. Podílí se na přežití nádoru
spuštěním angiogeneze, kdy nové cévy zajišťují přísun živin
a kyslíku, a zvýšením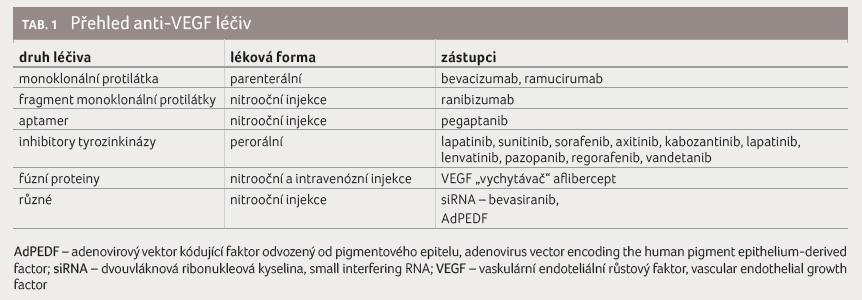 chemorezistence prostřednictvím
autokrinní signalizace. Nejčastější indikací anti-VEGF léčiv
jsou nádorová onemocnění typu metastazujícího kolorektálního
karcinomu, karcinomu prsu, ledvin, nemalobuněčného karcinomu plic
a dalších v rámci cílené biologické léčby a jsou
často podávána v kombinaci s jinými přípravky [3].
chemorezistence prostřednictvím
autokrinní signalizace. Nejčastější indikací anti-VEGF léčiv
jsou nádorová onemocnění typu metastazujícího kolorektálního
karcinomu, karcinomu prsu, ledvin, nemalobuněčného karcinomu plic
a dalších v rámci cílené biologické léčby a jsou
často podávána v kombinaci s jinými přípravky [3].
Zástupce anti VEGF léčiv se zařazením do skupin a podle lékové formy shrnuje tabulka 1.
Mechanismus nežádoucích účinků
Kvůli rozsáhlému řečišti cévního systému lze u inhibitorů angiogeneze očekávat široké rozpětí NÚ. Obecně se NÚ považují za méně závažné než reakce, které se vyskytují při chemoterapii, přestože mohou mít život ohrožující charakter.
Mechanismus účinku anti VEGF léčiv je založen na blokaci VEGF, který byl identifikován v buňkách endotelu. Příkladem role VEGF je ovlivnění funkce a přežití krevních cév, regulace krevního tlaku, renálních, neurologických a jaterních funkcí [4]. Data ze studií strukturálních nebo funkčních změn v orgánech po inhibici signalizace VEGF poskytují další informace k mechanismům. In vivo studie naznačují, že VEGF se podílí na přežití a plasticitě krevních cév. Vyšetření vaskulární sítě průdušnice myší ukazují, že systémová léčba inhibitorem VEGF byla spojena s rychlou regresí slizničních kapilár [5].
Sunitinib v monoterapii byl spojen s kardiovaskulární toxicitou, která může v krátkodobém horizontu ovlivnit léčbu a v dlouhodobém horizontu může vést ke zvýšení morbidity a mortality. Mezi mechanismy rozvoje dysfunkce levé komory a srdečního selhání patří přímé účinky na myokard, stejně jako sekundární toxicita způsobená koronárním nebo periferním poškozením cév. Srdeční toxicita může být výsledkem tzv. on target účinků (v cíli) inhibice VEGF nebo tzv. off target účinků (mimo cíl) vyplývajících z inhibice dalších tyrozinkináz. Podobný mechanismus může být zapojen do rozvoje dysfunkce pravé komory [6].
Další studie přinesly důkazy, že anti VEGF terapie může indukovat kardiotoxicitu prostřednictvím inhibice dráhy MAPK (mitogenem aktivované proteinové kinázy) [7]. Mezi nespecifické účinky inhibice VEGF patří inhibice receptoru růstového faktoru odvozeného z krevních destiček (platelet derived growth factor receptor, PDGF R). Pazopanib je in vivo účinným inhibitorem PDGF R v nádorových buňkách a sunitinib inhibuje fosforylaci PDGF R v modelech myších nádorů. Receptor PDGF je exprimován na povrchu kardiomyocytů a endoteliálních buněk a hraje roli v angiogenezi. Přímé toxické účinky na myokard by mohly být bezvýznamné, ale bývají potencovány a demaskovány současnou systémovou hypertenzí [8,9].
Raf (z angl. rapidly accelerated fibrosarcoma) představuje serin/threonin kinázu fungující prostřednictvím aktivace dráhy MEK ERK1. Aktivace Raf je spojena s buněčnou proliferací a inhibicí apoptózy in vitro. Sorafenib je kromě anti VEGF účinků i silným inhibitorem Raf. Sorafenib inhiboval Raf v nádorových buňkách (u lidských xenograftů karcinomu prsu, kolorekta a plic) a u komorových kardiomyocytů byla inhibice Raf spojena s apoptózou myokardu a poruchou srdeční funkce [10].
Kardiovaskulární nežádoucí účinky
Nežádoucí účinky v onkologické léčbě zahrnují nepříznivé jevy nebo události, příznaky, laboratorní nálezy nebo onemocnění, které mohou nebo nemusejí souviset s léčbou [11,12]. Progrese nádoru nebo příznaky přímo související s nádorem se nepovažují za NÚ.
Mezi časté NÚ patří hypertenze, arteriální tromboembolické příhody, žilní tromboembolismus, plicní embolizace, možnost vzniku aneuryzmat a arteriální disekce, snížení ejekční frakce levé komory (left ventricle ejection fraction, LVEF), srdeční selhání, kardiotoxicita a problémy s krvácením, gastrointestinální perforací a hojením ran [13].
Hypertenze
K dobře zdokumentovaným NÚ se řadí hypertenze. Vaskulární endoteliální růstový faktor snižuje krevní tlak a americké kardiologické guidelines z roku 2017 doporučují zahájení antihypertenzní terapie při podávání inhibitorů angiogeneze [14]. Pokles krevního tlaku je způsoben tvorbou krevních kapilár, které zvyšují celkovou plochu průřezu dostupnou pro průtok krve. Vaskulární endoteliální růstový faktor způsobuje vazodilataci prostřednictvím indukce syntézy oxidu dusnatého a prostacyklinu (PGI2) jako součást signální transdukční dráhy [15]. Inhibitory VEGF zapříčiňují hypertenzi tím, že inhibují produkci oxidu dusnatého a PGI2, což vede k vazokonstrikci a zvýšení krevního tlaku [16].
Při zahajování anti VEGF terapie je nutné dostatečně kompenzovat již diagnostikovanou hypertenzi, stejně jako pravidelně monitorovat krevní tlak během celé terapie s vyžadovanou korekcí a případnou kombinací antihypertenziv kvůli zvýšenému riziku rozvoje hypertenze 3.‒4. stupně. Hypertenzi jako důsledek anti VEGF terapie lze zvládnout pomocí standardní farmakoterapie, jakou představují inhibitory angiotenzin konvertujícího enzymu (ACE), betablokátory, blokátory kalciových kanálů, diuretika a blokátory receptorů pro angiotenzin II [17,18].
Arteriální a žilní
tromboembolické příhody
Léčba inhibitory VEGF je mimo jiné spojena se zvýšeným rizikem rozvoje arteriálních tromboembolických příhod (arterial thromboembolic event, ATE). Zvýšené riziko je zapříčiněno snížením regenerační kapacity endoteliálních buněk a může rovněž dojít k poklesu počtu antiapoptotických faktorů a zároveň k podpoře prokoagulačních změn v cévách. Zdá se, že rychlost rozvoje venózních tromboembolických příhod není ovlivněna inhibicí VEGF, přinejmenším při srovnání bevacizumabu s chemoterapií oproti chemoterapii samotné [19].
Recentní metaanalýza hodnotící ATE a žilní tromboembolické příhody (venous thromboembolic events, VTE) u pacientů s pokročilým karcinomem štítné žlázy léčených inhibitory tyrozinkináz (TKI) vychází z údajů 12 studií včetně čtyř randomizovaných kontrolovaných klinických sledování a osmi klinických sledováních fáze II. Analýza ukazuje, že celkový výskyt ATE a VTE spojených s léčbou TKI činí 1,4 % a 3,3 % [20]. Data jsou v souladu s výsledky z roku 2013, kdy léčba TKI u pokročilého nebo metastatického karcinomu štítné žlázy významně zvýšila riziko vzniku ATE (poměr šancí [odds ratio, OR] 4,72; p = 0,029), nikoliv riziko vzniku VTE ve srovnání s placebem [21].
Ukázalo se, že užívání kyseliny acetylsalicylové během léčby zvyšuje pravděpodobnost krvácivých příhod stupně 3 a 4, ačkoliv nebyl zjištěn žádný významný rozdíl mezi uživateli jednotlivých léčiv. U pacientů s anamnézou ATE a u starších pacientů je vyšší riziko vzniku tromboembolické příhody při užívání inhibitorů VEGF [2].
Krvácení
Riziko krvácení spojeného s anti VEGF terapií představuje jednu z hlavních skupin NÚ hlášených v klinických studiích, převážně u bevacizumabu a ramucirumabu. Obě látky mohou způsobit závažné, až život ohrožující důsledky. Mechanismus zřejmě spočívá v narušení vaskulatury tumoru nebo obecně endoteliální dysfunkce. Nedávná metaanalýza ukázala u bevacizumabu a ramucirumabu významné zvýšení rizika krvácení všech stupňů a zvýšení rizika krvácení závažnějších stupňů a srovnala je s riziky jiných anti VEGF léčiv [22].
Kardiotoxicita
Bevacizumab podaný v rámci chemoterapie vedl ke zvýšení incidence arteriálních NÚ a kardiovaskulární toxicity [18]. Klinické studie se sunitinibem stanovily hypertenzi jako rizikový faktor pro srdeční selhání. Pacienti s chronickým srdečním selháním nebo se srdeční dysfunkcí stupně 3 (LVEF 20–39 %) měli zároveň hypertenzi (žádný pacient neměl hypertenzi 3. stupně a všichni měli normální LVEF před léčbou sunitinibem). Rozvoj srdečního selhání a nejvýraznější změny krevního tlaku byly pozorovány během prvních tří cyklů léčby [23]. Studie u sunitinibu zaznamenala kontinuální postupný pokles srdečních funkcí navzdory léčbě až u 18,9 % pacientů [24].
Kardiotoxicita spojená s anti VEGF terapií se pohybuje od asymptomatického snížení LVEF po srdeční selhání, kardiogenní šok a smrt [25]. Sunitinib byl spojen s kardiovaskulární toxicitou, která může v dlouhodobém měřítku zvýšit morbiditu a mortalitu [6].
Metaanalýza 3 784 pacientů léčených bevacizumabem v randomizovaných kontrolovaných studiích uváděla výskyt městnavého srdečního selhání vyššího stupně u 1,6 % osob léčených bevacizumabem oproti 0,4 % osob s placebem. Přestože je výskyt nízký, ve srovnání s placebem se relativní riziko (relative risk, RR) rozvoje symptomatického srdečního selhání vyšplhalo na 4,74 [11]. Metaanalýza studií zahrnujících celkem 10 647 pacientů léčených TKI odhalila výskyt asymptomatického snížení LVEF u 2,4 % pacientů a u 1,2 % pacientů se objeví symptomatické srdeční selhání. Za zmínku stojí fakt, že nebyl zjištěn rozdíl v riziku kardiotoxicity mezi konkrétními zástupci TKI a ostatními anti VEGF léčivy, která mají jiný mechanismus účinku [25].
Větší metaanalýza zahrnující 28 538 pacientů ukázala, že léčba TKI byla spojena s vyšším RR (5,62) kardiotoxicity vyššího stupně ve srovnání s pacienty s placebem nebo léčenými alternativní protinádorovou terapií. Nejvyšší RR vykázaly ramucirumab a aflibercept [26]. V randomizované kontrolované studii s 1 110 pacienty porovnávající pazopanib se sunitinibem činil výskyt srdečního selhání 1 % a u 9 % pacientů v každé skupině došlo k poklesu LVEF o ≥ 15 % [27].
Zdá se však, že snížená LVEF spojená s anti VEGF terapií se může vyskytovat v rozmezí 10–20 %, přičemž výskyt srdečního selhání je přibližně 1–5 %. Retrospektivní analýza 159 pacientů zjistila, že u 14 % pacientů došlo během léčby k poklesu LVEF o ≥ 10 %, přičemž většina změn byla asymptomatická, a u 3 % osob došlo k srdečnímu selhání [28].
Kardiotoxicita spojená s anti VEGF terapií je částečně reverzibilní. Při snížení dávky sunitinibu a/nebo při léčbě inhibitory ACE, betablokátory anebo blokátory kalciových kanálů bylo snížení LVEF částečně reverzibilní až do 33 týdnů sledování [24]. Ze všech výše uvedených skutečností vyplývá doporučení obezřetnosti při anti VEGF terapii u pacientů s preexistujícím srdečním onemocněním.
Vzhledem k potenciálně reverzibilní povaze snížené LVEF spojené s léčbou inhibitory VEGF to podporuje roli rutinního prospektivního sledování pacientů. Včasná detekce snížení LVEF může zvýšit pravděpodobnost reverzibility a může umožnit opětovné zahájení léčby v nižší dávce a v přítomnosti konvenčních terapií používaných k léčbě srdečního selhání. Jak již bylo uvedeno, srdeční toxicita může být zapříčiněna on target působením inhibice VEGF nebo off target účinky inhibice dalších tyrozinkináz [6]. Vaskulární endoteliální růstový faktor hraje roli v kontraktilitě myokardu in vivo. Vazba VEGF a aktivace fosfolipázy C gama (PLCy) řídí kontraktilitu myokardu regulací cyklů vápníku. Preklinické údaje poskytují přesvědčivé důkazy o tom, že inhibitory VEGF mají přímé toxické účinky na kardiomyocyty [29].
Další přímé toxické účinky na myokard lze připsat off target působení. Odhaduje se, že anti VEGF terapie dysreguluje přibližně 80 kináz in vivo. Je pravděpodobné, že existují další kinázy, které hrají roli ve vývoji kardiotoxicity, a dosud nebyly objeveny [30]. Jiné mechanismy indukce kardiotoxicity mohou souviset s inhibicí dráhy MAPK [7] nebo s inhibicí receptoru PDGF R [8].
Závěr
Ze seznamu kardiovaskulárních NÚ jsou nejlépe zdokumentovány vlivy jednotlivých anti VEGF léčiv na krevní tlak, arteriální tromboembolické příhody a rozvoj kardiotoxicity [2]. V současné době čelí antiangiogenní terapie řadě limitů, které významně ovlivňují její účinnost. Nádory mohou získat rezistenci a prokázat zvýšení agresivity. Kromě zmíněných kardiovaskulárních NÚ může antiangiogenní terapie snížit perfuzi chemoterapie a její účinnost [31]. Budoucí výzkum by se měl zaměřit na zvýšení efektivity chemoterapie využitím antiangiogenní terapie a najít způsoby, jak zmírnit rezistenci na tuto terapii a co nejvíce minimalizovat rizika uvedené léčby.
Seznam použité literatury
- [1] Totzeck M, Mincu RI, Rassaf T. Cardiovascular Adverse Events in Patients With Cancer Treated With Bevacizumab: A Meta‑Analysis of More Than 20 000 Patients. J Am Heart Assoc 2017; 6: e006278.
- [2] Girardi F, Franceschi E, Brandes AA. Cardiovascular safety of VEGF‑targeting therapies: current evidence and handling strategies. Oncologist 2010; 15: 683‒694.
- [3] Lacal PM, Graziani G. Therapeutic implication of vascular endothelial growth factor receptor‑1 (VEGFR‑1) targeting in cancer cells and tumor microenvironment by competitive and non‑competitive inhibitors. Pharmacol Res 2018; 136: 97‒107.
- [4] Conti E, Romiti A, Musumeci MB, et al. Arterial thrombotic events and acute coronary syndromes with cancer drugs: are growth factors the missed link?: what both cardiologist and oncologist should know about novel angiogenesis inhibitors. Int J Cardiol 2013; 167: 2421–2429.
- [5] Korn C, Augustin HG. Mechanisms of Vessel Pruning and Regression. Review 2015; 34: 5‒17.
- [6] Dobbin SJH, Petrie MC, Myles RC, et al. Cardiotoxic effects of angiogenesis inhibitors. Clin Sci (Lond) 2021; 135: 71‒100.
- [7] German AE, Mammoto T, Jiang E, et al. Paxillin controls endothelial cell migration and tumor angiogenesis by altering neuropilin 2 expression. J Cell Sci 2014; 127: 1672‒1683.
- [8] Yue Z, Chen J, Lian H, et al. PDGFR‑β signaling regulates cardiomyocyte proliferation and myocardial regeneration. Cell Rep 2019; 28: 966–978.
- [9] Gould KL. Does coronary flow trump coronary anatomy? JACC Cardiovasc Imaging 2009; 2: 1009–1023.
- [10] Kubin T, Cetinkaya A, Kubin N, et al. The MEK/ERK Module Is Reprogrammed in Remodeling Adult Cardiomyocytes. Int J Mol Sci 2020; 21: 6348.
- [11] Common Terminology Criteria for Adverse Events (CTCAE), National Cancer Institute, US National Institutes of Health. Dostupné na: https://ctep.cancer.gov/protocoldevelopment/electronic_applications/ctc.htm [last updated 9/2020, navštíveno 15. 2. 2021]
- [12] Meadows KL, Hurwitz HI. Anti‑VEGF therapies in the clinic. Cold Spring Harb Perspect Med 2012; 2: a006577.
- [13] Gardner V, Madu CO, Lu Y. Anti‑VEGF Therapy in Cancer: A Double‑Edged Sword. Physiologic and Pathologic Angiogenesis ‒ Signaling Mechanisms and Targeted Therapy 2017; https://doi.org/10.5772/66763.
- [14] Whelton PK, Carey RM, Aronow WS, et al. ACC/AHA/AAPA/ABC/ACPM/
- [15] León‑Mateos L, Mosquera E, Antón Aparicio L. Treatment of sunitinib‑induced hypertension in solid tumor by nitric oxide donors. Redox Biology 2015; 6: 421‒425.
- [16] Rajabi M, Mousa SA. The Role of Angiogenesis in Cancer Treatment. Biomedicines 2017; 5: 34.
- [17] Al‑Jundi M, Thakur S, Gubbi S, et al. Novel Targeted Therapies for Metastatic Thyroid Cancer‑A Comprehensive Review. Cancers (Basel) 2020; 12: 2104.
- [18] Abdel‐Qadir H, Ethier JL, Lee DS, et al. Cardiovascular toxicity of angiogenesis inhibitors in treatment of malignancy: a systematic review and meta‐analysis. Cancer Treat Rev 2017; 53: 120–127.
- [19] Ngo DTM, Williams T, Horder S, et al. Factors Associated with Adverse Cardiovascular Events in Cancer Patients Treated with Bevacizumab. J Clin Med 2020; 9: 2664.
- [20] Bai Y, Li JY, Li J, et al. Risk of venous and arterial thromboembolic events associated with tyrosine kinase inhibitors in advanced thyroid cancer: a meta‑analysis and systematic review. Oncotarget 2018; 10: 4205‒4212.
- [21] Qi WX, Min DL, Shen Z, et al. Risk of venous thromboembolic events associated with VEGFR‑TKIs: a systematic review and meta‑analysis. Int J Cancer 2013; 132: 2967–2974.
- [22] Xiao B, Wang W, Zhang D. Risk of bleeding associated with antiangiogenic monoclonal antibodies bevacizumab and ramucirumab: a meta‑analysis of 85 randomized controlled trials. Onco Targets Ther 2018; 11: 5059‒5074.
- [23] Di Lorenzo G, Autorino R, Bruni G, et al. Cardiovascular toxicity following sunitinib therapy in metastatic renal cell carcinoma: a multicenter analysis. Ann Oncol 2009; 20: 1535–1542.
- [24] Narayan V, Keefe S, Haas N, et al. Prospective Evaluation of Sunitinib‑Induced Cardiotoxicity in Patients with Metastatic Renal Cell Carcinoma. Clin Cancer Res 2017; 23: 3601‒3609.
- [25] Ghatalia P, Morgan CJ, Je Y, et al. Congestive heart failure with vascular endothelial growth factor receptor tyrosine kinase inhibitors. Crit Rev Oncol Hematol 2015; 94: 228–237.
- [26] Santoni M, Guerra F, Conti A, et al. Incidence and risk of cardiotoxicity in cancer patients treated with targeted therapies. Cancer Treat Rev 2017; 59: 123–131.
- [27] Motzer RJ, Hutson TE, et al. Pazopanib versus Sunitinib in Metastatic Renal‑Cell Carcinoma. N Engl J Med 2013; 369: 722–731.
- [28] Hall PS, Harshman LC, Srinivas S, Witteles RM. The frequency and severity of cardiovascular toxicity from targeted therapy in advanced renal cell carcinoma patients. JACC Heart Fail 2013; 1: 72–78.
- [29] Braile M, Marcella S, Cristinziano L, et al. VEGF‑A in Cardiomyocytes and Heart Diseases. Int J Mol Sci 2020; 21: 5294.
- [30] Stuhlmiller TJ, Zawistowski JS, Chen X, et al. Kinome and Transcriptome Profiling Reveal Broad and Distinct Activities of Erlotinib, Sunitinib, and Sorafenib in the Mouse Heart and Suggest Cardiotoxicity From Combined Signal Transducer and Activator of Transcription and Epidermal Growth Factor Receptor Inhibition. J Am Heart Assoc 2017; 6: e006635.
- [31] Morserle L, Jimenez‑Valerio G, Casanovas O. Antiangiogenic therapies: going beyond their limits. Cancer Discov 2014; 4: 31–41.