Klinické aspekty aspirinové rezistence
Souhrn:
Kyselina acetylsalicylová (aspirin, ASA) v sekundární prevenci kardiovaskulárních příhod u pacientů s aterosklerotickým postižením koronárních i periferních tepen snižuje výskyt úmrtí a závažných ischemických cévních příhod o 22 %. Pokud je však laboratorně měřena účinnost antiagregační terapie aspirinem, neodpovídá kolem jedné třetiny pacientů adekvátním způsobem. Pro tento fenomén se vžil název aspirinová rezistence. Většina studií a metaanalýzy, které se zabývaly aspirinovou rezistencí, potvrdily korelaci různými metodami zjištěné aspirinové rezistence s horšími klinickými výsledky. V metaanalýze dvaceti studií s témě? 3?000 pacienty ?inil pom?r ?anc? (pooled odds ratio) pro kardiovaskul?rn? p??hodu u?pacient? rezistentn?ch na terapii ASA 3,8. Frekvence v?skytu aspirinov? rezistence se v?jednotliv?ch studi?ch ?asto dramaticky li?? od?t?m?? nulov?ch hodnot po?hodnoty p?es 70?%. K?t?mto markantn?m rozd?l?m doch?z? p?edev??m v?z?vislosti na?pou?it? laboratorn? metod?, klinick? situaci (stabiln?, nebo akutn? onemocn?n?, p??padn? zdrav? dobrovoln?ci) a?dal??ch aspektech, jako jsou l?kov? interakce atd. V?n?sleduj?c?m textu se pokus?me nazna?it, jak? klinick? a?laboratorn? aspekty ovliv?uj? v?skyt aspirinov? rezistence a?jak?m zp?sobem naopak aspirinov? rezistence ovliv?uje progn?zu pacienta. V?sou?asn? dob? nen? dostupn? p?esv?d?iv? d?kaz o?efektivit? ?pravy medikace na?z?klad? laboratorn? zji?t?n? aspirinov? rezistence, uv?d?me v?ak postupy, kter? byly pou?ity v?klinick?ch studi?ch za???elem zv??en? laboratorn? odpov?di na?antiagrega?n? terapii. ř 3 000 pacienty činil poměr šancí (pooled odds ratio) pro kardiovaskulární příhodu u pacientů rezistentních na terapii ASA 3,8. Frekvence výskytu aspirinové rezistence se v jednotlivých studiích často dramaticky liší od téměř nulových hodnot po hodnoty přes 70 %. K těmto markantním rozdílům dochází především v závislosti na použité laboratorní metodě, klinické situaci (stabilní, nebo akutní onemocnění, případně zdraví dobrovolníci) a dalších aspektech, jako jsou lékové interakce atd. V následujícím textu se pokusíme naznačit, jaké klinické a laboratorní aspekty ovlivňují výskyt aspirinové rezistence a jakým způsobem naopak aspirinová rezistence ovlivňuje prognózu pacienta. V současné době není dostupný přesvědčivý důkaz o efektivitě úpravy medikace na základě laboratorně zjištěné aspirinové rezistence, uvádíme však postupy, které byly použity v klinických studiích za účelem zvýšení laboratorní odpovědi na antiagregační terapii.
Key words: aspirin resistance – acetylsalicylic acid – aggregometry – antiplatelet therapy.
Summary:
Acetylsalicylic acid (aspirin, ASA) reduces mortality and major adverse cardiovascular events by 22% when used in coronary and peripheral artery disease secondary prevention. Laboratory assessed aspirin antiplatelet therapy effectiveness showed an inadequate response to the ASA treatment in about one third of patients. This phenomenon is often called “aspirin resistance”. Most of the studies and metaanalyses regarding the aspirin resistance proved a certain correlation between the ASA resistance assessed by various laboratory methods and the worst clinical outcomes. In the metaanalysis with nearly 3,000 patients the pooled odds ratio of cardiovascular events in ASA resistant patients was 3.8. The ASA resistance frequency shown in various clinical studies varies from almost zero values to as much as 70% of resistant patients. The distinct differences in the ASA resistance frequency are caused by variability in used laboratory methods, different clinical situations in particular studies (stable or acute cardiovascular disease or healthy volunteers) and other aspects as drug interactions etc. In the text as follows, we describe the clinical and laboratory aspects influencing the ASA resistance incidence and the influence of the ASA resistance on patient prognosis. Nowadays, there is no solid proof available which would confirm the fact that the ASA resistance guided treatment modification is associated with better clinical outcomes. Nevertheless, herein we describe various methods of therapy modification used in clinical studies for improving the laboratory ASA treatment response.
Metody detekce aspirinové rezistence
Jedním z nejsilnějších induktorů agregace destiček je tromboxan A2 (TXA2), který vzniká z kyseliny arachidonové (ARA) za spolupůsobení cyklooxygenázy (COX). Antiagregační účinek kyseliny acetylsalicylové (aspirin, ASA) a dalších nesteroidních antiflogistik (NSAID) je zprostředkován právě inhibicí COX, a zjištění míry produkce TXA2 je tedy ideální metodou pro odhad vlivu ASA na agregaci destiček. Vzhledem ke krátkému biologickému poločasu TXA2 se stanovuje v plazmě jeho stabilnější metabolit tromboxan B2 (TXB2). Měření plazmatické koncentrace TXB2 je často považováno za nejspolehlivější metodu pro zjištění odpovědi na terapii aspirinem [1,2]. Je možné rovněž kvantifikovat metabolit TXB2 11 dehydrotromboxan B2 v moči, ale korelace s aktivací destiček je v tomto případě nižší [3].
Dále je v současné době dostupných několik funkčních testů, které jsou založeny na měření agregace destiček ve vzorku in vitro. Specificita pro COX dependentní (a tedy aspirinem inhibovatelnou) cestu aktivace je v případě těchto metod nižší, a proto je v těchto testech detekována větší míra aspirinové rezistence než pomocí sérového TXB2. Pro tento fenomén někteří autoři razí označení „reziduální destičková reaktivita“, který označuje agregaci zprostředkovanou na COX nezávislými cestami aktivace při terapii aspirinem [4]. Na druhé straně bylo rovněž zjištěno, že navýšení dávek ASA vede často ke zlepšení laboratorní odpovědi na terapii ASA i v případě méně specifických testů [5]. Přestože byla nezávisle na sobě potvrzena prediktivní hodnota jednotlivých metod pro klinický vývoj [3,6−9], při použití různých metod u stejných vzorků mezi sebou výsledky často nekorelují [3,4,10]. To může být způsobeno právě tím, že různé metody detekují rovněž agregaci destiček nezávislou na inhibici COX.
Výsledkem funkčních testů je procentuální hodnota inhibice agregace destiček, případně absolutní počet agregujících trombocytů. Riziko vzniku kardiovaskulární příhody stoupá plynule s počtem destiček, které si zachovávají schopnost agregace, a opačně je tomu s rizikem krvácení [11]. Pokud laboratoř poskytuje výsledek ve formě označení jako citlivý, nebo rezistentní, používá předem určenou cut off hodnotu (danou výrobcem či změřenou na velkém počtu pacientů) pro využití v klinické praxi. V současné době nejsou cut off hodnoty jednotlivých metod jasně stanoveny a v klinických studiích jsou často používány hodnoty různé, což komplikuje srovnání výsledků různých studií mezi sebou.
Dostupné laboratorní metody měření účinnosti terapie aspirinem se liší v několika aspektech [8,12]:
- rozdílné zpracování vzorku: plazma bohatá na destičky nebo plná krev;
- rozdílné technické provedení: turbidimetrie při projasňování plazmy bohaté na destičky (optická agregometrie – light transmittance aggregometry, LTA), měření impedance na elektrodách v plné krvi (impedanční agregometrie), zaznamenávání času do uzavření kapiláry potažené kolagenem a epinefrinem (platelet function assay, PFA 100), turbidimetrie při agregaci destiček a mikročástic potažených lidským fibrinogenem (VerifyNow);
- rozdílný použitý induktor: v rámci některých metod (LTA, impedanční agregometrie) je možno použít různé induktory agregace (ARA, epinefrin, kolagen a další).
Metody vysoce specifické pro detekci
inhibice COX zaznamenávají pravidelně nízký výskyt aspirinové
rezistence. V případě měření sérového TXB2
je to pouze u 1–1,7 % subjektů [1] a v případě
měření acetylace COX pomocí monoklonálních protilátek dokonce
0 % (po ověření compliance pacientů) [13]. Rovněž
v případě LTA je zaznamenáván nízký výskyt rezistence,
pokud je jako induktor agregace použita ARA [11]. Při použití
metod méně specifických pro COX dependentní agregaci stoupá
senzitivita metody, zjištěná rezistence na  antiagregační
terapii však nemusí být způsobena pouze nedostatečnou odpovědí
na terapii ASA. I v tomto případě je však zachován
vztah mezi laboratorním výsledkem a klinickým obrazem.
Například ve studii Muellera a kol. u pacientů
s ischemickou chorobou dolních končetin byli všichni pacienti
citliví na terapii ASA, pokud byla jako induktor použita ARA.
Autoři se tedy rozhodli použít kombinaci induktorů méně
specifických pro COX dependentní agregaci (epinefrin a kolagen),
aby rozdělili pacienty na citlivé a rezistentní. Uzávěry
tepen dolních končetin po balonkové angioplastice
se vyskytovaly pouze u pacientů, kteří byli na základě
této metody označeni jako rezistentní [7]. I při použití
stejného induktoru nemusí být zaznamenána stejná odpověď,
pokud jsou použity různé metody. Například agregace destiček
měřená pomocí přístroje VerifyNow nekorelovala s výsledky
LTA, i když byla v obou případech použita ARA jako
induktor [4]. Porovnání četnosti výskytu aspirinové rezistence
podle jednotlivých metod u pacientů se stabilní ischemickou
chorobou srdeční shrnuje tabulka 1.
antiagregační
terapii však nemusí být způsobena pouze nedostatečnou odpovědí
na terapii ASA. I v tomto případě je však zachován
vztah mezi laboratorním výsledkem a klinickým obrazem.
Například ve studii Muellera a kol. u pacientů
s ischemickou chorobou dolních končetin byli všichni pacienti
citliví na terapii ASA, pokud byla jako induktor použita ARA.
Autoři se tedy rozhodli použít kombinaci induktorů méně
specifických pro COX dependentní agregaci (epinefrin a kolagen),
aby rozdělili pacienty na citlivé a rezistentní. Uzávěry
tepen dolních končetin po balonkové angioplastice
se vyskytovaly pouze u pacientů, kteří byli na základě
této metody označeni jako rezistentní [7]. I při použití
stejného induktoru nemusí být zaznamenána stejná odpověď,
pokud jsou použity různé metody. Například agregace destiček
měřená pomocí přístroje VerifyNow nekorelovala s výsledky
LTA, i když byla v obou případech použita ARA jako
induktor [4]. Porovnání četnosti výskytu aspirinové rezistence
podle jednotlivých metod u pacientů se stabilní ischemickou
chorobou srdeční shrnuje tabulka 1.
Příčiny aspirinové rezistence
Kromě použité laboratorní metody je
výskyt aspirinové rezistence rovněž významně ovlivněn
klinickou situací a dalšími aspekty (tab. 2). V případě zdravých dobrovolníků je výskyt
rezistence mizivý a rovněž korelace mezi různými metodami
je vyšší než v případě pacientů s kardiovaskulárním
onemocněním [14]. U pacientů se stabilním kardiovaskulárním
onemocněním je výskyt rezistence na ASA ve většině
studií rovněž velmi nízký [4,13], ale významně stoupá
v případě akutního stavu [15,16].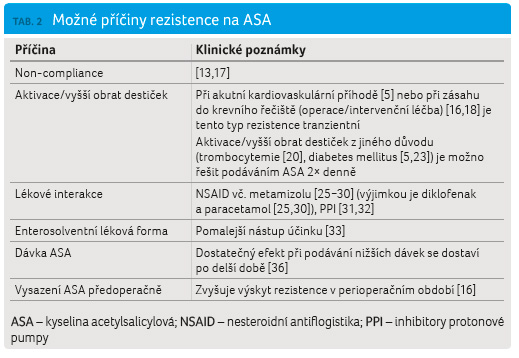
Pokud je rezistence na ASA zjištěna u stabilních pacientů v ambulantním sledování, je třeba pomýšlet v první řadě na non compliance [13,17], kterou někteří autoři považují za nejčastější příčinu aspirinové rezistence vůbec. Ve studii Homorodiho a kol. se podařilo u pacientů se stabilní ischemickou chorobou srdeční zcela odstranit aspirinovou rezistenci, pokud bylo důsledně (telefonicky) kontrolováno užívání medikace. V této studii byly použity metody detekce aspirinové rezistence vysoce selektivní pro inhibici COX (včetně přímého měření míry acetylace COX pomocí monoklonálních protilátek) [13]. Nebyla tedy zjišťována reziduální destičková aktivita, která může rovněž ovlivňovat klinický vývoj [7]. Non compliance jako možnou příčinu výskytu dvacetiprocentní rezistence u 101 pacientů se stabilní ischemickou chorobou srdeční uvádí rovněž Ulehlová se spolupracovníky [17].
Non compliance však nevysvětluje opakovaně zaznamenaný vysoký výskyt přechodné aspirinové rezistence u pacientů v akutním stavu za hospitalizace po chirurgickém výkonu/cévní intervenci [15,16,18,19]. Kempfert se spolupracovníky zaznamenali postupný nárůst rezistence k terapii ASA u velké části pacientů po elektivním koronárním bypassu (CABG). Většina pacientů sice byla citlivá bezprostředně po operaci, ale došlo u nich ke ztrátě citlivosti pátý pooperační den, kdy výskyt rezistence dosáhl 78 %. Zajímavým zjištěním bylo, že ani po přidání ASA in vitro nedošlo k výraznému oslabení agregace po přidání ARA, jedná se tedy o farmakodynamickou rezistenci, resp. reziduální destičkovou aktivitu [16]. Zimmermann a kol. rovněž popisují vysokou míru pooperační aspirinové rezistence s postupnou obnovou antiagregační účinnosti desátý den po výkonu, pokud byla ASA přidána k destičkám in vitro. Účinek ASA podávané per os v dávce 100 mg denně po deseti dnech však stále nebyl dostatečný [19]. Pravděpodobně tedy „farmakodynamická rezistence“ trvá kratší dobu než rezistence způsobená farmakokinetickými vlivy (změny absorpce, lékové interakce atd.). Poulsen se spolupracovníky popsali pokles výskytu aspirinové rezistence na 2 % při měření za 30 dnů od výkonu [18]. Obnovení účinku aspirinu v delším odstupu od výkonu potvrzují i výsledky studií u pacientů se stabilní ischemickou chorobou srdeční, které popisují velice nízký (až nulový) výskyt rezistence na ASA v případě dobré adherence k léčbě [13]. Kempfert a kol. rovněž popisují vyšší výskyt rezistence na ASA u pacientů, kteří předoperačně vysadili ASA, oproti pacientům, kterým byl aspirin podáván po celé perioperační období [16].
Příčinou rozvoje rezistence na ASA může být vyšší obrat trombocytů, který způsobuje, že ke konci 24hodinového dávkovacího intervalu vznikne dostatek nových destiček bez acetylované COX pro překročení cut off hodnoty pro aspirinovou rezistenci. Při esenciální trombocytemii koreluje aktivita destiček při terapii ASA s počtem nezralých trombocytů a byla prokázána lepší efektivita terapie ASA při podávání 100 mg po dvanácti hodinách ve srovnání s podáváním 200 mg jednou denně [20]. Ve studii případů a kontrol byl zaznamenán trend k vyšší reaktivitě destiček a k vyššímu destičkovému obratu u pacientů s trombózou intrakoronárního stentu [21]. Rovněž u pacientů s diabetem byl popsán vyšší obrat trombocytů a nižší účinnost terapie ASA na konci 24hodinového dávkovacího intervalu, především u mladších a obézních diabetiků [22]. Henry se spolupracovníky zaznamenali nedostatečný efekt terapie ASA po dvou hodinách od podání u 4,7 % pacientů s ischemickou chorobou srdeční. Pokud byla agregace měřena 24 hodin po podání ASA, dosahoval výskyt „rezistence“ hodnoty 24,7 %. Kratší doba efektivního působení aspirinu se vyskytovala častěji u kuřáků, diabetiků a pacientů s elevovanými hodnotami zánětlivých markerů [23].
V případě diabetu hraje rovněž významnou roli zvýšená reaktivita destiček. Destičky jsou aktivovány hyperosmolárním prostředím při hyperglykemii a interakcí s částicemi VLDL bohatými na triglyceridy. Při oxidativním stresu a vlivem produktů pokročilé glykace se zvyšuje rovněž trombogenita endotelu, což je faktor, který může významně přispět k rozvoji trombózy, ale není zjistitelný in vitro funkčními testy agregace [24]. Neubauer a kol. popisují diabetes mellitus jako rizikový faktor pro rozvoj rezistence na ASA, měřené pomocí impedanční agregometrie [5]. Vyšší reaktivita destiček může být rovněž důvodem, proč Rocca a kol. zaznamenali ve své studii u diabetiků lepší odpověď na supresi produkce sérového TXB2 při podávání ASA 2× denně, přestože nebyl zaznamenán signifikantní rozdíl v destičkové reaktivitě při použití méně specifických testů (VerifyNow) [22]. Je otázkou, jaký je klinický význam lepšího účinku aspirinu na produkci TXB2 při srovnatelné reziduální destičkové aktivitě měřené VerifyNow.
Významně může efekt ASA ovlivnit rovněž přidružená medikace, především NSAID, což bylo prokázáno jak in vitro [25], tak in vivo na zdravých dobrovolnících [26,27] a v klinických studiích [28,29]. Catella Lawson a kol. podávali zdravým dobrovolníkům aspirin dvě hodiny po podání ibuprofenu a zaznamenali pouze tranzientní inhibici agregace, která nepřetrvávala 24 hodin. Naopak pokud podávali aspirin dvě hodiny před podáním ibuprofenu, přetrvávala inhibice agregace destiček po celých 24 hodin. V prvním případě dojde k obsazení COX ibuprofenem, což se projeví krátkodobou inhibicí agregace a zároveň je tímto způsobem zabráněno acetylaci COX pomocí aspirinu. Pokud aspirin nemůže COX obsadit, deacetyluje se na jiném místě (v játrech, na membránových proteinech atd.) a zbylá kyselina salicylová je rychle eliminována z organismu. Po následné eliminaci ibuprofenu se obnovuje funkce destiček, neboť inhibiční účinek ibuprofenu na COX je reverzibilní [27]. Tento efekt byl patrný in vitro, u zdravých dobrovolníků a u pacientů s ischemickou chorobou srdeční rovněž při současném podávání ASA a metamizolu [25,26,29], který je v České republice hojně využíván jako pooperační analgetikum (Novalgin).
Physicians’ Health Study potvrdila účinnost aspirinu v primární prevenci infarktu myokardu. Zároveň bylo v této studii prokázáno, že pokud je ASA chronicky podávána zároveň s NSAID, dochází k úplné ztrátě jejího protektivního efektu. Vliv této interakce nebyl potvrzen, pokud pacienti užívali NSAID intermitentně (méně než 60 dní v roce) [28]. Klinický význam interakce mezi ASA a ibuprofenem potvrzují také údaje z databáze zdravotnických informací skotského kraje Tayside. Ze 7 107 pacientů léčených ASA mezi lety 1989 a 1997 užívalo 187 pacientů pravidelně ASA spolu s ibuprofenem a 206 spolu s diklofenakem. Studie potvrdila, že pacienti, kteří užívali ASA s ibuprofenem, měli horší prognózu než ostatní pacienti včetně pacientů užívajících diklofenak [30]. To odpovídá výsledkům získaným in vitro, které potvrzují, že paracetamol a diklofenak nezpůsobují oslabení účinku ASA. Paracetamol z důvodu příliš slabé afinity ke COX a diklofenak z důvodu vazby na jiné místo na COX než ostatní NSAID [25].
Dalšími léky, které jsou v literatuře diskutovány jako možná příčina sníženého účinku ASA, jsou inhibitory protonové pumpy (PPI). Observační studie prokázala vyšší reaktivitu destiček, pokud pacienti užívali PPI, pravděpodobně z důvodu nižšího vstřebávání aspirinu ze žaludku při vyšším pH [31]. Retrospektivní dánská studie zkoumající vliv PPI na léčbu aspirinem rok po infarktu myokardu zaznamenala zvýšený výskyt závažné kardiovaskulární příhody u uživatelů PPI. Přestože tento efekt nebyl zjištěn pro antagonisty receptorů H2, nelze zcela vyloučit chybu vzniklou neznámým činitelem, např. kouřením, které predisponuje jak k chorobám žaludku, tak ke koronární ateroskleróze [32].
Aspirin se jako slabá kyselina ochotně vstřebává v žaludku a bylo prokázáno, že po jednorázovém podání 325 mg enterosolventní ASA se u poloviny ze 400 dobrovolníků nedostavil dostatečný antiagregační efekt [33]. Odborné společnosti z tohoto důvodu doporučují při akutním koronárním syndromu používat tablety s okamžitým uvolňováním [34,35]. Pokud je však nízká dávka enterosolventní ASA podávána dlouhodobě, antiagregační efekt se zhruba do týdne dostaví [13,33]. V případě vyššího obratu destiček efektivně suprimovala enterosolventní ASA produkci TXB2, pokud byla podávána 2× denně [20,22].
Velice zajímavou studii publikovali již v roce 1978 Burch a kol. Pomocí in vitro přidaného radioaktivně značeného aspirinu (tritium ve zbytku kyseliny octové) zkoumali, jak velká část molekul COX u destiček zdravých dobrovolníků zůstává neacetylována při podávání různých dávek aspirinu. Zatímco při podání jedné dávky 325 mg ASA došlo k acetylaci 89 % COX, při dávce 160 mg byl aspirin účinný pouze z 82 % a při dávce 80 mg klesla účinnost pod 80 %. Při opakovaném podávání 80 mg denně po dobu 7 dní bylo za 24 hodin od užití poslední dávky acetylováno 86 % COX. Pokud byl aspirin přidáván k destičkám in vitro, byl vztah mezi koncentrací ASA a inhibicí COX lineární. Oproti tomu vztah mezi dávkou podanou dobrovolníkům a inhibicí COX linearitu postrádal, což je nepochybně způsobeno farmakokinetickými aspekty [36]. Metodika této studie je natolik odlišná od funkčních testů agregace, že nelze jednoduše srovnávat s dalšími citovanými studiemi. V zásadě však z této studie vyplývá, že v případě snahy o rychlý nástup účinku ASA nemusí být dávka 100 mg dostatečná, což odpovídá i doporučením odborných společností pro terapii akutního koronárního syndromu, jež uvádějí jako vhodnou dávku p.o. ASA při akutním koronárním syndromu 150−300 mg, resp. 162−325 mg [34,35]. Vyšší účinek měřený inhibicí produkce TXB2 po navýšení dávky ASA potvrdila i klinická studie u diabetiků [22].
I v případě měření vlivu různých dávek a dávkovacích intervalů na účinnost terapie ASA záleží na použité laboratorní metodě. Spectre se spolupracovníky měřili různými metodami efekt podání 75 mg ASA 1× a 2× denně a 320 mg 1× denně. Při měření metodou LTA s ARA jako induktorem nebyl zaznamenán rozdíl v účinnosti aspirinu, metody méně selektivní pro inhibici COX různým způsobem rozdělily vzorky buď podle dávky (TXB2 v moči), nebo podle dávkovacího intervalu (impedanční agregometrie) [37]. Capodanno a kol. u pacientů s diabetes mellitus a stabilní ischemickou chorobou srdeční zjistili, že velikost dávky ASA statisticky významně ovlivňuje sérovou koncentraci TXB2 (p = 0,008). Výsledek LTA s kolagenem jako induktorem byl naopak ovlivněn spíše dávkovacím intervalem (p = 0,06) a výsledky LTA s ARA jako induktorem nebyly ovlivněny ani dávkou, ani dávkovacím intervalem ASA [38]. Zdá se tedy, že navyšování dávek ASA má vliv na COX dependentní produkci sérového TXB2 a zkracování intervalu mezi dávkami ASA ovlivňuje spíše reziduální destičkovou aktivitu.
Mezi popsané rizikové faktory pro rozvoj aspirinové rezistence patří dále nižší koncentrace fibrinogenu, užívání statinu [39] (nesignifikantní trend rovněž ve [18]), vyšší markery zánětu [5,23], vyšší PREDICT skóre (The Residual Platelet Aggregation after Deployment of Intracoronary Stent score) a nedostatečná odpověď na terapii klopidogrelem [5]. Obezita byla popsána jako rizikový faktor u diabetiků i nediabetiků [22]. Naopak vyšší pravděpodobnost účinnosti léčby byla paradoxně u pacientů s hypertenzí, což je patrně způsobeno vyšší preskripcí inhibitorů ACE a betablokátorů, které rovněž predisponovaly pacienty k vyšší účinnosti ASA [39]. Dále byla vyšší efektivita zaznamenána u pacientů, kteří užívali nitráty [5].
Klinický význam perioperační a chronické rezistence na ASA/reziduální destičkové aktivity
Nehledě na rozdílnou podstatu zvýšené srážlivosti destiček při měření různými metodami a bez ohledu na rozdílné použité cut off hodnoty má podle většiny publikovaných studií laboratorně zjištěná aspirinová rezistence prediktivní hodnotu pro další klinický vývoj [3,6–9]. Ať se tedy jedná o „pravou rezistenci na ASA“ způsobenou nedostatečnou inhibicí COX aspirinem, nebo o reziduální destičkovou aktivitu, lze vyšší agregaci změřenou funkčními testy považovat za negativní prediktivní faktor. Krasopoulos a kol. popisují poměry šancí (odds ratios) u pacientů s aspirinovou rezistencí 4,06 pro akutní koronární syndrom, 3,78 pro cerebrovaskulární příhodu a 5,99 pro mortalitu [40], poměr šancí pro souhrnný cílový ukazatel jakékoliv kardiovaskulární příhody je 3,8 [9,40].
Prediktivní význam má pravděpodobně i aspirinová rezistence zjištěná časně po akutním koronárním syndromu, přestože se jedná o tranzientní stav. Pacienti, kteří byli časně (do 30 hodin) po perkutánní koronární intervenci (PCI) rezistentní na aspirin, mají větší riziko selhání léčby v následujícím roce [41,42]. Perioperační výskyt rezistence koreloval rovněž s výskytem pozdního uzávěru žilního koronárního bypassu [3].
Nepřímým důkazem pro klinický význam rezistence na ASA jsou rovněž výsledky studií, které popisují nižší účinnost aspirinu v prevenci cévních příhod u pacientů užívajících NSAID [28,30]. Vzhledem k tomu, že tyto léky u zdravých dobrovolníků vyvolávají rezistenci na ASA [26,27], lze předpokládat, že za horšími výsledky léčby stojí právě tato příčina. Je sice možné namítnout, že pacienti užívající NSAID mohou být v horším zdravotním stavu ve srovnání s pacienty bez této medikace, MacDonald a kol. nicméně popsali zhoršenou prognózu pouze u pacientů užívajících ibuprofen, a nikoliv u pacientů užívajících diklofenak [30], který se od ostatních NSAID liší mimo jiné právě tím, že neblokuje účinek ASA [25].
Jakým způsobem lze aspirinovou rezistenci ovlivnit?
Základním postupem zůstává u pacientů ve stabilním stavu s časovým odstupem od cévní příhody nebo intervence na cévním řečišti jejich edukace se snahou zvýšit compliance při chronické léčbě [13], případně zamezit lékovým interakcím. Zatímco význam aspirinové rezistence jako rizikového faktoru pro kardiovaskulární příhody je potvrzen řadou studií a metaanalýzami [9,40], pouze několik málo studií popisuje efekt úpravy antiagregační terapie u rezistentních pacientů. V zásadě je možno buď navýšit dávku aspirinu, nebo nahradit ASA inhibitorem P2Y12 (klopidogrel, prasugrel, tikagrelor), případně zahájit duální antiagregační terapii (DAPT). Žádný z těchto způsobů nebyl validován klinickými studiemi a není doporučován odbornými společnostmi.
Podávání aspirinu 2× denně úspěšně zabránilo rozvoji laboratorně měřené aspirinové rezistence u stavů s vyšším destičkovým obratem, jako jsou esenciální trombocytemie [20] a diabetes mellitus [22,37,38]. Rovněž při navýšení dávky ze 100 mg 1× denně na 200 mg 1× denně došlo ke snížení rychlosti obnovy produkce TXB2, nicméně efekt byl nižší než při rozdělení do dvou denních dávek [22]. Ve studii BOCLA Plan byly pacientům po PCI zvyšovány dávky ASA při laboratorně detekované aspirinové rezistenci až na 500 mg 1× denně a bylo dosaženo 100% odpovědi. Problémem studie BOCLA Plan je skutečnost, že první měření bylo provedeno již 48 hodin po PCI [5]. Vzhledem k výše popsanému tranzientnímu charakteru aspirinové rezistence, jejíž výskyt je nejvyšší bezprostředně po výkonu [16,18,43], lze předpokládat, že i bez navýšení dávky by část pacientů odpověděla na terapii ASA po odeznění akutního stavu. Navíc v rámci protokolu studie byla dávka ASA zvyšována až na 500 mg, což je dávka spojovaná s horší účinností antiagregační terapie oproti dávkám běžně doporučovaným (75−325 mg) [44].
Účinnost a bezpečnost klopidogrelu je srovnatelná s aspirinem [45]. Teoreticky je tedy možné pacienty s aspirinovou rezistencí převést na léčbu klopidogrelem (případně jiným inhibitorem P2Y12), nicméně byl popsán zvýšený výskyt rezistence na klopidogrel u pacientů rezistentních na ASA [46], a je tedy vhodné při tomto rozhodnutí zkontrolovat účinnost léčby inhibitorem P2Y12.
Gasparovic se spolupracovníky randomizovali 224 pacientů po CABG, kteří byli čtvrtý pooperační den ASA rezistentní k terapii buď samotnou ASA v dávce 300 mg, nebo kombinací 300 mg ASA + 75 mg klopidogrelu. Byly zjištěny signifikantně lepší výsledky terapie DAPT v podskupinách pacientů mladších 65 let a u obézních pacientů. Pro celkovou populaci nedosáhl trend k lepším výsledkům při DAPT statistické významnosti, stejně jako trend k vyššímu výskytu krvácení [15].
Závěrem – doporučení pro klinickou praxi
Pro zamezení příliš pomalého nástupu účinku ASA by měla být v akutních případech použita vždy perorální léková forma s okamžitým uvolňováním [33,34] a v rámci běžného rozmezí dávek doporučovaných pro antiagregační terapii by měly být použity vyšší dávky [34−36]. Konkomitantní podávání ASA a NSAID, včetně metamizolu, může snížit účinnost terapie ASA. Výjimku tvoří diklofenak a paracetamol [25−27,30,34]. Tato interakce se pravděpodobně neprojeví, pokud je analgetikum použito při chronické terapii aspirinem pouze jednorázově, ale nabývá na významu, pokud jsou NSAID používána chronicky, nebo při zahajování terapie ASA. V případě detekce rezistence na ASA při stabilním kardiovaskulárním onemocnění je třeba pátrat především po non compliance [13,17]. V případě vyššího obratu destiček (trombocytemie, obezita, diabetes mellitus) je vhodné podávat ASA ve dvou denních dávkách [20,22,37,38]. Pro změnu antiagregační terapie na základě funkčních testů agregace destiček není v současné době dostatek validovaných dat.
Seznam použité literatury
- [1] Cattaneo M. Laboratory detection of ‘aspirin resistance’: what test should we use (if any)? Eur Heart J 2007; 1673−1675.
- [2] EMEA. POSITION PAPER ON THE REGULATORY REQUIREMENTS FOR THE AUTHORISATION OF LOW‑DOSE MODIFIED RELEASE ASA FORMULATIONS IN THE SECONDARY PREVENTION OF CARDIOVASCULAR EVENTS. In, Reference number: CPMP/EWP/282/02. http://www.ema.europa.eu: EMA; 2002
- [3] Pusch G, Feher G, Kotai K, et al. Aspirin resistance: focus on clinical endpoints. J Cardiovasc Pharmacol 2008; 52: 475−484.
- [4] Lordkipanidze M, Pharand C, Schampaert E, et al. A comparison of six major platelet function tests to determine the prevalence of aspirin resistance in patients with stable coronary artery disease. Eur Heart J 2007; 28: 1702−1708.
- [5] Neubauer H, Kaiser AF, Endres HG, et al. Tailored antiplatelet therapy can overcome clopidogrel and aspirin resistance‑‑the BOchum CLopidogrel and Aspirin Plan (BOCLA‑Plan) to improve antiplatelet therapy. BMC Med 2011; 9: 3.
- [6] Paniccia R, Priora R, Liotta AA, et al. Platelet function tests: a comparative review. Vasc Health Risk Manag 2015; 11: 133−148.
- [7] Mueller MR, Salat A, Stangl P, et al. Variable platelet response to low‑dose ASA and the risk of limb deterioration in patients submitted to peripheral arterial angioplasty. Thromb Haemost 1997; 78: 1003−1007.
- [8] Feher G, Feher A, Pusch G, et al. Clinical importance of aspirin and clopidogrel resistance. World J Cardiol 2010; 2: 171−186.
- [9] Snoep JD, Hovens MM, Eikenboom JC, et al. Association of laboratory‑defined aspirin resistance with a higher risk of recurrent cardiovascular events: a systematic review and meta‑analysis. Arch Intern Med 2007; 167: 1593−1599.
- [10] Blois SL, Lang ST, Wood RD, et al. Biologic variability and correlation of platelet function testing in healthy dogs. Vet Clin Pathol 2015; 44: 503−510.
- [11] Alberts MJ. Platelet function testing for aspirin resistance is reasonable to do: yes! Stroke 2010; 41: 2400−2401.
- [12] Xu ZH, Jiao JR, Yang R, et al. Aspirin resistance: clinical significance and genetic polymorphism. J Int Med Res 2012; 40: 282−292.
- [13] Homorodi N, Kovacs EG, Lee S, et al. The lack of aspirin resistance in patients with coronary artery disease. J Transl Med 2016; 14: 74.
- [14] Karon BS, Wockenfus A, Scott R, et al. Aspirin responsiveness in healthy volunteers measured with multiple assay platforms. Clin Chem 2008; 54: 1060−1065.
- [15] Gasparovic H, Petricevic M, Kopjar T, et al. Impact of dual antiplatelet therapy on outcomes among aspirin‑resistant patients following coronary artery bypass grafting. Am J Cardiol 2014; 113: 1660−1667.
- [16] Kempfert J, Anger K, Rastan A, et al. Postoperative development of aspirin resistance following coronary artery bypass. Eur J Clin Invest 2009; 39: 769−774.
- [17] Ulehlova J, Slavik L, Krcova V, et al. The assessment of aspirin resistance by using light transmission and multiple electrode aggregometry. Int J Lab Hematol 2011; 33: 305−309.
- [18] Poulsen TS, Kristensen SR, Korsholm L, et al. Variation and importance of aspirin resistance in patients with known cardiovascular disease. Thromb Res 2007; 120: 477−484.
- [19] Zimmermann N, Wenk A, Kim U, et al. Functional and biochemical evaluation of platelet aspirin resistance after coronary artery bypass surgery. Circulation 2003; 108: 542−547.
- [20] Pascale S, Petrucci G, Dragani A, et al. Aspirin‑insensitive thromboxane biosynthesis in essential thrombocythemia is explained by accelerated renewal of the drug target. Blood 2012; 119: 3595−3603.
- [21] Wurtz M, Grove EL, Wulff LN, et al. Patients with previous definite stent thrombosis have a reduced antiplatelet effect of aspirin and a larger fraction of immature platelets. JACC Cardiovasc Interv 2010; 3: 828−835.
- [22] Rocca B, Santilli F, Pitocco D, et al. The recovery of platelet cyclooxygenase activity explains interindividual variability in responsiveness to low‑dose aspirin in patients with and without diabetes. J Thromb Haemost 2012; 10: 1220−1230.
- [23] Henry P, Vermillet A, Boval B, et al. 24‑hour time‑dependent aspirin efficacy in patients with stable coronary artery disease. Thromb Haemost 2011; 105: 336−344.
- [24] Kakouros N, Rade JJ, Kourliouros A, et al. Platelet function in patients with diabetes mellitus: from a theoretical to a practical perspective. Int J Endocrinol 2011; 2011: 742719.
- [25] Saxena A, Balaramnavar VM, Hohlfeld T, et al. Drug/drug interaction of common NSAIDs with antiplatelet effect of aspirin in human platelets. Eur J Pharmacol 2013; 721: 215−224.
- [26] Papp J, Sandor B, Vamos Z, et al. Antiplatelet effect of acetylsalicylic acid, metamizole and their combination – in vitro and in vivo comparisons. Clin Hemorheol Microcirc 2014; 56: 1−12.
- [27] Catella‑Lawson F, Reilly MP, Kapoor SC, et al. Cyclooxygenase inhibitors and the antiplatelet effects of aspirin. N Engl J Med 2001; 345: 1809−1817.
- [28] Kurth T, Glynn RJ, Walker AM, et al. Inhibition of clinical benefits of aspirin on first myocardial infarction by nonsteroidal antiinflammatory drugs. Circulation 2003; 108: 1191−1195.
- [29] Polzin A, Zeus T, Schror K, et al. Dipyrone (metamizole) can nullify the antiplatelet effect of aspirin in patients with coronary artery disease. J Am Coll Cardiol 2013; 62: 1725−1726.
- [30] MacDonald TM, Wei L. Effect of ibuprofen on cardioprotective effect of aspirin. Lancet 2003; 361: 573−574.
- [31] Wurtz M, Grove EL, Kristensen SD, et al. The antiplatelet effect of aspirin is reduced by proton pump inhibitors in patients with coronary artery disease. Heart 2010; 96: 368−371.
- [32] Charlot M, Grove EL, Hansen PR, et al. Proton pump inhibitor use and risk of adverse cardiovascular events in aspirin treated patients with first time myocardial infarction: nationwide propensity score matched study. Br Med J 2011; 342: d2690.
- [33] Grosser T, Fries S, Lawson JA, et al. Drug resistance and pseudoresistance: an unintended consequence of enteric coating aspirin. Circulation 2013; 127: 377−385.
- [34] Amsterdam EA, Wenger NK, Brindis RG, et al. 2014 AHA/ACC Guideline for the Management of Patients with Non‑ST‑Elevation Acute Coronary Syndromes: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 2014; 64: e139−228.
- [35] Roffi M, Patrono C, Collet JP, et al. 2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST‑segment elevation. Task Force for the Management of Acute Coronary Syndromes in Patients Presenting without Persistent ST‑Segment Elevation of the European Society of Cardiology (ESC). G Ital Cardiol (Rome) 2016; 17: 831−872.
- [36] Burch JW, Stanford N, Majerus PW. Inhibition of platelet prostaglandin synthetase by oral aspirin. J Clin Invest 1978; 61: 314−319.
- [37] Spectre G, Arnetz L, Ostenson CG, et al. Twice daily dosing of aspirin improves platelet inhibition in whole blood in patients with type 2 diabetes mellitus and micro‑ or macrovascular complications. Thromb Haemost 2011; 106: 491−499.
- [38] Capodanno D, Patel A, Dharmashankar K, et al. Pharmacodynamic effects of different aspirin dosing regimens in type 2 diabetes mellitus patients with coronary artery disease. Circ Cardiovasc Interv 2011; 4: 180−187.
- [39] Feher G, Koltai K, Papp E, et al. Aspirin resistance: possible roles of cardiovascular risk factors, previous disease history, concomitant medications and haemorrheological variables. Drugs Aging 2006; 23: 559−567.
- [40] Krasopoulos G, Brister SJ, Beattie WS, et al. Aspirin “resistance” and risk of cardiovascular morbidity: systematic review and meta‑analysis. Br Med J 2008; 336: 195−198.
- [41] Marcucci R, Paniccia R, Antonucci E, et al. Usefulness of aspirin resistance after percutaneous coronary intervention for acute myocardial infarction in predicting one‑year major adverse coronary events. Am J Cardiol 2006; 98: 1156−1159.
- [42] Gianetti J, Parri MS, Sbrana S, et al. Platelet activation predicts recurrent ischemic events after percutaneous coronary angioplasty: a 6 months prospective study. Thromb Res 2006; 118: 487−493.
- [43] Poston RS, Gu J, Brown JM, et al. Endothelial injury and acquired aspirin resistance as promoters of regional thrombin formation and early vein graft failure after coronary artery bypass grafting. J Thorac Cardiovasc Surg 2006; 131: 122−130.
- [44] Kong DF, Hasselblad V, Kandzari DE et al. Seeking the optimal aspirin dose in acute coronary syndromes. Am J Cardiol 2002; 90: 622−625.
- [45] A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). CAPRIE Steering Committee. Lancet 1996; 348: 1329–1339.
- [46] Castilla‑Guerra L, Fernandez‑Moreno Mdel C, Navas‑Alcantara MS, Jimenez-Gonzalo F, et al. Switching from aspirin to clopidogrel in patients with aspirin resistance after an ischemic stroke. Is it a good solution? Eur J Intern Med 2014; 25: e40−41.