Kognitivní poruchy vyvolané medikací I
Souhrn
Tašková I. Kognitivní poruchy vyvolané medikací I. Remedia 2023; 33: 263–268.
V rámci projektu, který implementuje Národní akční plán pro Alzheimerovu nemoc a obdobná onemocnění 2020–2030 (NAPAN) Ministerstva zdravotnictví České republiky, vzniká dokument, který se mimo jiné zabývá i vztahem farmakoterapie a kognitivních poruch, a to v mnoha ohledech. Vedle souhrnu léčby demence a jejích behaviorálních a psychologických symptomů mapuje také klinicky závažné lékové interakce těchto léčiv, popisuje změny farmakokinetiky a farmakodynamiky léčiv ve stáří, obsahuje doporučení pro změny dávek rizikových léčiv u pacientů s poškozenými eliminačními orgány, zabývá se léčivy, která mohou kognitivní poruchy způsobovat, apod. Obsah těchto kapitol sloužil jako podklad pro text tohoto článku, který má za cíl informovat jednak o problematice kognitivních poruch vyvolaných léky a jednak o projektu Doporučené postupy pro diagnostiku a léčbu Alzheimerovy nemoci a jiných kognitivních poruch, který zahajuje implementaci NAPAN. V článku jsou popsány rozdíly mezi deliriem podmíněným léky a demencí a také změny ve farmakokinetice a farmakodynamice léčiv ve stáří, jež mohou přispívat k vyšší citlivosti pacientů k centrálním nežádoucím účinkům některých léčiv. Dále je zmíněna problematika nedostatku robustních dat v oblasti prokazování kauzality mezi podáním rizikových léčiv a vyvoláním kognitivních poruch. V závěru článku je publikován obecnější tabulkový přehled skupin rizikových léčiv s jejich zástupci a komentářem jejich dopadu na kognici. Na první díl článku bude navazovat druhý, který se opět zaměří na vztah mezi kognicí a léky a přinese již detailní přehled vlivu nejrizikovějších skupin. Současně se bude snažit dle dostupných dat stratifikovat riziko u jednotlivých léčiv v rámci těchto skupin tak, aby mohl klinik v praxi vybrat pro pacienta léčivo s nejmenším negativním vlivem na kognici.
Klíčová slova: polékové delirium – poléková kognitivní porucha – geriatrie – léky ve stáří.
Summary
Taskova I. Drug‑induced cognitive disorders I. Remedia 2023; 33: 263–268.
As part of the project that implements the National Action Plan for Alzheimer's Disease (NAPAN) of the Ministry of Health of the Czech Republic, a document has been created that, among other things, deals with the relationship between pharmacotherapy and cognitive disorders. In addition to a summary of the treatment of dementia and its behavioural and psychological symptoms, it also maps clinically significant drug interactions of these drugs, describes changes in the pharmacokinetics and pharmacodynamics of drugs in elderly, contains recommendations for changes in doses of risky drugs in patients with impaired elimination organs, and summarizes drugs that can cause cognitive disorders. The content of these chapters served as a basis for this article, which aims to inform about problematics of drug‑induced cognitive impairment and about the project “Recommended procedures for the diagnosis and treatment of Alzheimer's disease and other cognitive disorders”, which is starting the implementation of NAPAN. The text describes the differences between drug‑induced delirium and dementia, as well as changes in the pharmacokinetics and pharmacodynamics of drugs in elderly, which may contribute to a higher sensitivity of patients to the central side effects of some drugs. Furthermore, the issue of the lack of robust data in the field of proving causality between the administration of risky drugs and the induction of cognitive disorders is also mentioned. At the end of the article, a general overview of groups of risky drugs is published with their representatives and a comment on their impact on cognition. The first part of the article will be followed by the second on the topic of cognition and medication, which will provide a detailed overview of the risk groups of drugs. At the same time, the stratification of the risk of individual drugs within these groups according to the available data will be summarized, so that the clinicians would be able to choose the drug for the patient with the least negative effect on cognition.
Key words: drug‑induced delirium – drug‑induced cognitive disorder – geriatrics – drugs in elderly.
Úvod
V rámci projektu, který implementuje Národní akční plán pro Alzheimerovu nemoc a obdobná onemocnění 2020–2030 (NAPAN) Ministerstva zdravotnictví České republiky, vzniká dokument, který se mimo jiné zabývá i vztahem farmakoterapie a kognitivních poruch, a to v mnoha ohledech. Vedle souhrnu léčby demence a jejích behaviorálních a psychologických symptomů mapuje také klinicky závažné lékové interakce těchto léčiv, popisuje změny farmakokinetiky a farmakodynamiky léčiv ve stáří, obsahuje doporučení pro změny dávek rizikových léčiv u pacientů s poškozenými eliminačními orgány, zabývá se léčivy, která mohou kognitivní poruchy způsobovat, apod. Obsah těchto kapitol sloužil jako podklad pro text tohoto článku, který má za cíl informovat jednak o této problematice a jednak o projektu Doporučené postupy pro diagnostiku a léčbu Alzheimerovy nemoci a jiných kognitivních poruch, který zahajuje implementaci NAPAN. Více viz odkaz: https://www.cls.cz/doporucene‑postupy‑diagnostika‑a‑lecba‑Alzheimerovy‑nemoci‑a‑jinich‑kognitivnich‑poruch.
Polékové reverzibilní poruchy
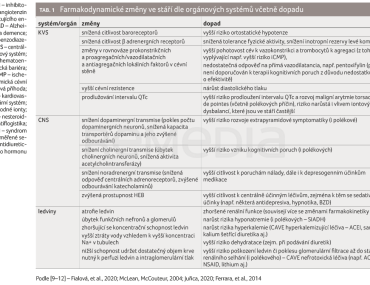
 Polékové reverzibilní kognitivní poruchy stojí v popředí zájmu odborné veřejnosti mnoha medicínských oborů z důvodu jejich možné preventability, četnosti a negativního dopadu, tj. zvýšená mortalita a morbidita pacientů, častější nutnost jejich hospitalizace a prodloužení její délky a ekonomická zátěž zdravotnického systému [1]. Při vzniku polékové kognitivní poruchy u seniorské populace může hrát roli i přítomnost „frailty syndromu“ (geriatrická křehkost), který se týká změn v oblasti mentální, pohybové i nutriční [2]. Dále zde mohou hrát roli farmakokinetické a farmakodynamické změny doprovázející stárnutí organismu (viz tabulky 1 a 2), závažné komorbidity a polyfarmacie [3]. Léky mohou vyvolat deliria a polékové kognitivní poruchy trvalejšího charakteru [4].
Polékové reverzibilní kognitivní poruchy stojí v popředí zájmu odborné veřejnosti mnoha medicínských oborů z důvodu jejich možné preventability, četnosti a negativního dopadu, tj. zvýšená mortalita a morbidita pacientů, častější nutnost jejich hospitalizace a prodloužení její délky a ekonomická zátěž zdravotnického systému [1]. Při vzniku polékové kognitivní poruchy u seniorské populace může hrát roli i přítomnost „frailty syndromu“ (geriatrická křehkost), který se týká změn v oblasti mentální, pohybové i nutriční [2]. Dále zde mohou hrát roli farmakokinetické a farmakodynamické změny doprovázející stárnutí organismu (viz tabulky 1 a 2), závažné komorbidity a polyfarmacie [3]. Léky mohou vyvolat deliria a polékové kognitivní poruchy trvalejšího charakteru [4].
 Delirium je závažný klinický syndrom, který je výsledkem akutní mozkové dysfunkce a projevuje se řadou psychických a behaviorálních příznaků. Často se vyskytuje u hospitalizovaných pacientů, zejména staršího věku, a to až ve 40 %. Vznik deliria má často multifaktoriální podklad. Jeho příčinou mohou být infekce, elektrolytové dysbalance, metabolické odchylky, operace, úrazy aj. Nelze opominout ani vliv medikace (riziková nebo zbytná medikace, předávkování či intoxikace, syndrom z vysazení atd.). Většinou vzniká náhle a jeho intenzita a projevy bývají v čase měnlivé. Projevuje se jako porucha vnímání podnětů z vnějšího prostředí, dezorientace, změna psychomotorického tempa, porucha emocí, pozornosti nebo jako narušený cyklus spánku a bdění (často v podobě spánkové inverze). Myšlení bývá dezorganizované a mohou být přítomny i vegetativní příznaky. Delirium může komplikovat prognózu pacienta a zvyšovat mortalitu. Na delirium bývá plná nebo ostrůvkovitá amnézie. Odhaduje se, že přibližně 30–40 % případů vzniku deliria je preventabilních.
Delirium je závažný klinický syndrom, který je výsledkem akutní mozkové dysfunkce a projevuje se řadou psychických a behaviorálních příznaků. Často se vyskytuje u hospitalizovaných pacientů, zejména staršího věku, a to až ve 40 %. Vznik deliria má často multifaktoriální podklad. Jeho příčinou mohou být infekce, elektrolytové dysbalance, metabolické odchylky, operace, úrazy aj. Nelze opominout ani vliv medikace (riziková nebo zbytná medikace, předávkování či intoxikace, syndrom z vysazení atd.). Většinou vzniká náhle a jeho intenzita a projevy bývají v čase měnlivé. Projevuje se jako porucha vnímání podnětů z vnějšího prostředí, dezorientace, změna psychomotorického tempa, porucha emocí, pozornosti nebo jako narušený cyklus spánku a bdění (často v podobě spánkové inverze). Myšlení bývá dezorganizované a mohou být přítomny i vegetativní příznaky. Delirium může komplikovat prognózu pacienta a zvyšovat mortalitu. Na delirium bývá plná nebo ostrůvkovitá amnézie. Odhaduje se, že přibližně 30–40 % případů vzniku deliria je preventabilních.
Deliria dělíme na:
- hyperaktivní formu (15–20 % delirií vyššího věku), která je doprovázena výrazným psychomotorickým neklidem, bezcílným přecházením, křikem a podobně; Pozn.: Delirium zaměstnanosti je stav, kdy nemocný může např. bezúčelně překládat šaty, ubrus, sbírat věci – na dotaz sdělí, že „pracuje“.
- hypoaktivní formu (20–70 %), pro kterou je charakteristický pokles psychomotorického tempa, apatie, skleslost, pasivita a často bývá nerozpoznaná;
- smíšenou formu, kdy se v čase obě formy střídají.
Delirium, zejména aktivní, může být zaměněno za projevy agitované deprese nebo za projevy mánie.
Terapie deliria spočívá v odstranění vyvolávajících faktorů (terapie infekce, redukce zbytné nebo rizikové medikace apod.), dále ve vhodné symptomatické farmakoterapii a podpůrné léčbě (hydratace, nutriční péče, úprava prostředí apod.). Psychoterapeutická podpora pacienta a jeho rodiny může také hrát významnou roli [1,5–8].
Poléková kognitivní porucha je syndrom, při němž dochází k narušení funkce vyšších korových center (včetně myšlení, paměti, orientace aj.) a který je vyvolán chronickým podáváním medikace. Taková porucha může být reverzibilní a po vysazení problematické medikace se ve vybraných případech může zcela upravit. Pravděpodobnější je ale scénář, kdy porucha kognice perzistuje i po vysazení medikace [4]. Na rozdíl od deliria nemá akutní začátek a spíše se projeví plíživě a při dlouhodobějším užívání rizikové medikace.
Změny farmakodynamiky a farmakokinetiky ve stáří
Ve stáří dochází k mnoha fyziologickým změnám, které sekundárně mohou ovlivňovat farmakodynamiku a farmakokinetiku léčiv.
Farmakodynamické změny jsou nejčastěji popisovány na centrálním nervovém systému (CNS), kardiovaskulárním systému (KVS) a ledvinách. Výsledkem je ve většině případů vyšší citlivost na účinky léčiv. Konkrétní změny a jejich dopad zobrazuje tabulka 1 [9–12].
Stárnutí organismu má vliv i na osud léčiv v organismu a postihuje všechny farmakokinetické děje, tedy absorpci, distribuci, metabolizaci i exkreci.
Absorpce je většinou zpomalená (tj. prodlužuje se čas dosažení maximální plazmatické koncentrace bez většího vlivu na plochu pod křivkou) vlivem atrofie, menšího prokrvení a snížením motility gastrointestinálního traktu (GIT). Dále klesá tvorba slin, což může hrát roli při absorpci léčiv ve formě tablet rozpustných v ústech. Vlivem vyššího pH žaludečních šťáv se snižuje absorpce kyselých léčiv. Na druhou stranu může narůstat absorpce u léčiv bazické povahy.
Distribuci léčiv ovlivňuje zejména změna v jejich presystémové eliminaci. Snížení first‑pass efektu povede k jejich vyšší biodostupnosti, zejména u léčiv s vysokou jaterní extrakcí (např. u betablokátorů, opiátů apod.). Dalším faktorem ovlivňujícím distribuci je pokles hodnoty albuminu; toto snížení je ve stáří častější (např. z důvodu malnutrice, kachexie, proteinurie aj.), což má za následek zvýšení volné frakce léčiv, a tudíž i jejich vyšší účinnost a toxicitu (platí zejména u léčiv s vysokou vazbou na proteiny a úzkým terapeutickým indexem).
Metabolismus léčiv je ve stáří pomalejší vlivem poklesu kapacity některých enzymů z rodiny cytochromu P450 (CYP3A4, CYP2E1) a UDP‑glukuronosyltransferázy v důsledku snížení objemu jater a jejich nižší perfuze.
Exkrece je ve vyšším věku zpomalena zejména poklesem glomerulární filtrace (zhruba o 0,5–1 ml/min za rok po 20. roce života). Tento pokles je dán součtem následujících změn: snížení perfuze ledvin, snížení jejich objemu (asi o 20 %), ztráta funkčních glomerulů (zhruba ze 35 %) a pokles počtu nefronů (asi o 20 %). Nejvíce jsou ovlivněna léčiva, která jsou ve vyšší míře eliminována renálně (např. lithium, amisulprid, tiaprid aj.).
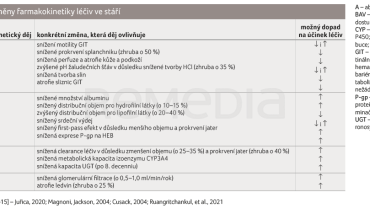 Obecně lze konstatovat, že největší podíl na změnách farmakokinetiky léčiv ve stáří mají právě změny eliminační schopnosti ledvin (nejen glomerulární filtrace, ale rovněž tubulární sekrece), případně změny v distribučním objemu léčiv (úbytek vody, relativní nadbytek tuku), a dále funkční změny GIT, jejichž vlivem dochází zejména ke změnám absorpce léčiv [11,13–15]. Všechny relevantní farmakokinetické změny ve stáří jsou přehledně zobrazeny v tabulce 2.
Obecně lze konstatovat, že největší podíl na změnách farmakokinetiky léčiv ve stáří mají právě změny eliminační schopnosti ledvin (nejen glomerulární filtrace, ale rovněž tubulární sekrece), případně změny v distribučním objemu léčiv (úbytek vody, relativní nadbytek tuku), a dále funkční změny GIT, jejichž vlivem dochází zejména ke změnám absorpce léčiv [11,13–15]. Všechny relevantní farmakokinetické změny ve stáří jsou přehledně zobrazeny v tabulce 2.
Podávání medikace jako rizikový faktor vzniku kognitivní poruchy
Podávání rizikové medikace může být pro vznik kognitivní poruchy jedním z rizikových faktorů, který je, jak již bylo řečeno, do jisté míry preventabilní. Dle dostupných zdrojů stojí léky za vznikem 12–39 % všech delirií [2,16]. Delirogenní efekt medikace je odborné veřejnosti všeobecně znám, problematický bod představuje pouze nedostatek robustních dat, která tuto kauzalitu prokazují [17], proto se např. guidelines pro management a prevenci deliria rizikovými léčivy často ani nezabývají [18]. Pokud mají data silnou evidenci, často pocházejí z populace mladších pacientů bez kognitivní poruchy. Metaanalýza Reisingera a kol. (2022) vycházela z 31 studií, jejichž naprostá většina (25/31) posuzovala data pacientů hospitalizovaných na chirurgických lůžkách či na odděleních intenzivní péče. Ze závěrů této metaanalýzy vyplývá, že podávání haloperidolu (poměr šancí [odds ratio, OR] 0,96; 95% interval spolehlivosti [confidence interval, CI] 0,72–1,28), olanzapinu (OR 0,25; 95% CI 0,15–0,40), ketaminu (OR 0,72; 95% CI 0,35–1,46) a kortikosteroidů (OR 0,69; 95% CI 0,32–1,50) není spojeno s vyšším rizikem vzniku deliria. Jedná se o data s vysokou nebo střední úrovní kvality vědeckých důkazů. Podávání anticholinergik je dle jejich závěrů spojeno s trojnásobným nárůstem rizika vzniku deliria (OR 3,11; 95% CI 1,04–9,26), ale kvalita důkazů pro tento závěr byla pouze nízká a pacienti s demencí byli ze studií vyloučeni. Pro opiáty, antihistaminika, benzodiazepiny a antidepresiva nebylo dosaženo dostatečné kvality důkazů (výrazná heterogenita a nekonzistence zdrojových dat) k tomu, aby mohl být vytvořen závěr o jejich potenciálu vyvolat delirium. U opiátů byl zjištěn nesignifikantní nárůst rizika vzniku deliria (aOR [adjusted OR] 1,50; 95% CI 0,91–2,49) s vyšším rizikem pro morfin, fentanyl a pethidin na rozdíl od oxykodonu a kodeinu. Riziko narůstalo se zvyšující se dávkou. Stejně tak svědčí data pro statisticky nevýznamné zvýšení rizika vzniku deliria při polyfarmacii (aOR 1,60; 95% CI 0,93–2,76) [17].
Léky mohou kognitivní poruchu vyvolat mnoha způsoby. Jednak mohou indukovat či agravovat jiný vyvolávající faktor (např. infekce – imunosupresiva, hyponatremie – karbamazepin a antidepresiva, dehydratace – diuretika, hypoglykemie – antidiabetika aj.), jednak mohou přímo svým účinkem kognitivní poruchu vyvolat (zejména anticholinergní a dopaminergní léčiva). Benzodiazepiny mohou k jejímu vzniku přispět zejména v rámci rozvoje syndromu z vysazení [16].
Mechanismy, jimiž léky kognitivní poruchy vyvolávají, jsou různé a vycházejí z patofyziologického podkladu vzniku deliria. Nejčastěji je uváděn vliv:
- deficitu acetylcholinu,
- nadbytku dopaminu, noradrenalinu a glutamátu,
- modulace aktivity histaminu, serotoninu a kyseliny gama‑aminomáselné,
- změn v cirkadiánních rytmech [1,19].
Léky mohou ovlivňovat kognici v krátkodobém či dlouhodobém horizontu. V praxi jsou nejpravděpodobnější situace, kdy podáním nevhodného léčiva dojde k akutnímu zhoršení kognitivních funkcí. Pacienti s preexistující kognitivní poruchou mohou být na účinky léčiv ještě citlivější. V tomto případě může po vysazení nevhodného léku dojít k úpravě stavu, ale k absolutnímu vymizení kognitivní poruchy většinou nedochází. Léky přispějí nejčastěji ke vzniku deliria v kombinaci s jinými faktory (např. u pacienta po operaci či s infekcí). Některá léčiva jsou spojována i s rozvinutím demence, tedy vyvolají trvalý nebo dlouhodobý pokles kognitivních funkcí a v tomto ohledu jsou často skloňovány anticholinergní látky, antiepileptika (fenytoin, karbamazepin, valproát a topiramát), benzodiazepiny a Z‑hypnotika, celková anestetika (zejm. při opakovaném podání), soli hliníku, léčiva používaná k terapii nádorů (5‑fluorouracil) a kortikosteroidy. Poléková plně reverzibilní demence je velmi vzácná [16,20,21].
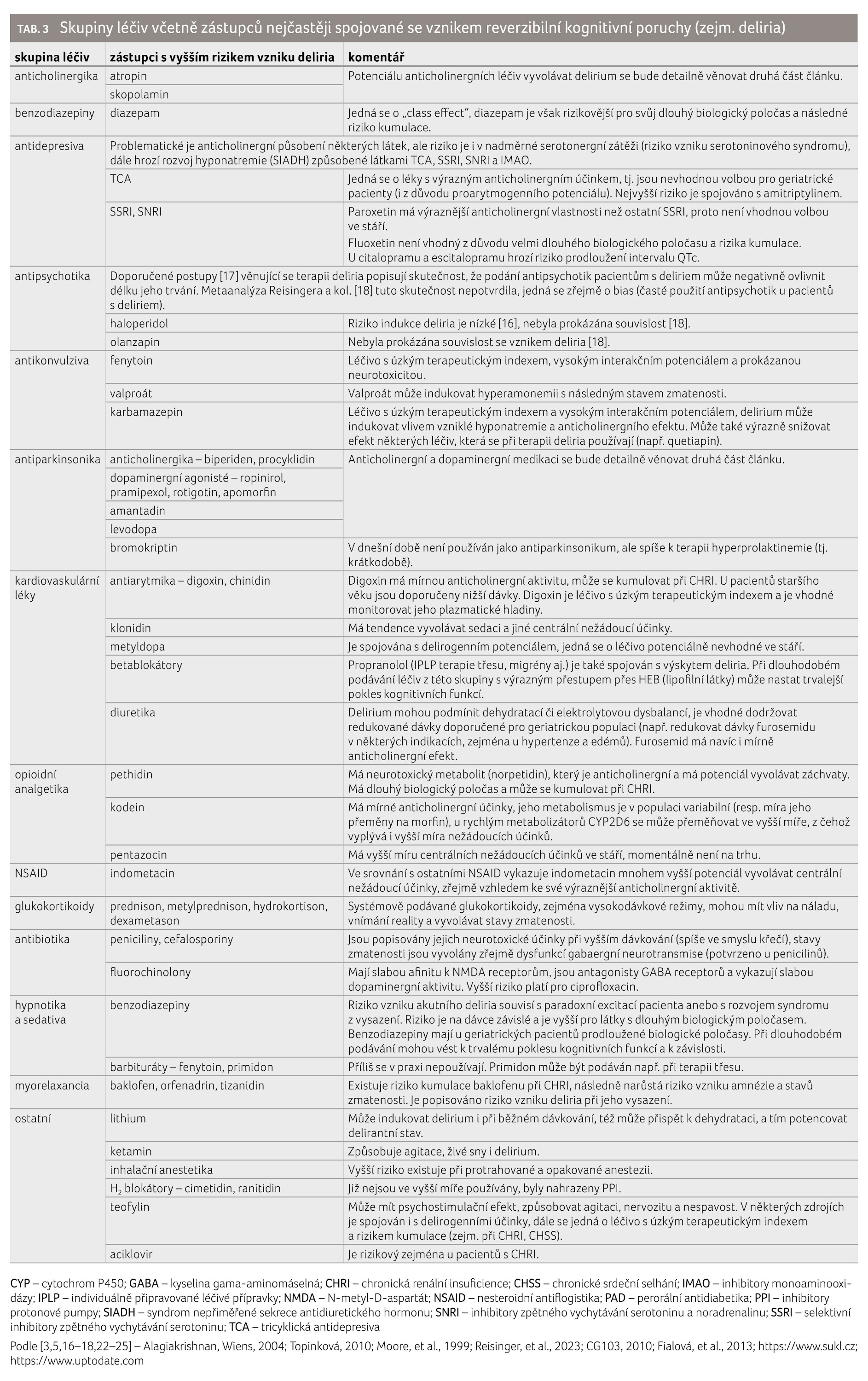 Skupiny léčiv nejčastěji spojované se vznikem reverzibilní kognitivní poruchy přehledně shrnuje tabulka 3 [3,5,16–18,22–25]. Další stavy, které souvisejí s výskytem reverzibilní kognitivní poruchy a jsou nepřímo podmíněny medikací, jsou shrnuty v tabulce 4.
Skupiny léčiv nejčastěji spojované se vznikem reverzibilní kognitivní poruchy přehledně shrnuje tabulka 3 [3,5,16–18,22–25]. Další stavy, které souvisejí s výskytem reverzibilní kognitivní poruchy a jsou nepřímo podmíněny medikací, jsou shrnuty v tabulce 4.
 V neposlední řadě zde existuje lékový faktor, který je také spojován se vznikem kognitivní poruchy, a tím je polyfarmacie. Dle závěrů metaanalýzy thajského kolektivu [26] je pravidelné užívání 5–9 léčiv asociováno se vznikem demence a zvyšuje její riziko o 30 % (aRR [adjusted risk ratio] 1,3; 95% CI 1,16–1,46). Excesivní polyfarmacie (pravidelné užívání > 9 léčiv) vede pak ke zvýšení tohoto rizika o 50 % (aRR 1,51; 95% CI 1,39–1,64).
V neposlední řadě zde existuje lékový faktor, který je také spojován se vznikem kognitivní poruchy, a tím je polyfarmacie. Dle závěrů metaanalýzy thajského kolektivu [26] je pravidelné užívání 5–9 léčiv asociováno se vznikem demence a zvyšuje její riziko o 30 % (aRR [adjusted risk ratio] 1,3; 95% CI 1,16–1,46). Excesivní polyfarmacie (pravidelné užívání > 9 léčiv) vede pak ke zvýšení tohoto rizika o 50 % (aRR 1,51; 95% CI 1,39–1,64).
Závěr
Tento článek má sloužit jako úvod do problematiky negativního vlivu léčiv na kognici. Druhá část článku Kognitivní poruchy vyvolané medikací II se bude detailně zabývat nejrizikovějšími skupinami léčiv (anticholinergní, dopaminergní, hypnotická a sedativní, protizánětlivá léčiva, analgetika aj.), včetně stratifikace rizika jednotlivých látek v rámci těchto skupin, to vše v kontextu medicíny založené na důkazech.
Znalost rizikových skupin léčiv, jejichž podávání může vést ke vzniku kognitivní poruchy, je zásadní pro všechny kliniky, kteří o ohroženou skupinu pacientů pečují. S trochou nadsázky lze konstatovat, že bez ohledu na sílu evidence je potřeba tato riziková léčiva znát, a pokud je to možné, jejich podání se vyvarovat. Dále je vhodné medikaci pacientů s kognitivní poruchou často přehodnocovat a racionalizovat např. i za pomoci klinického farmaceuta.
Literatura
[1] Wu YC, Tseng PT, Tu YK, et al. Association of Delirium Response and Safety of Pharmacological Interventions for the Management and Prevention of Delirium: A Network Meta‑analysis. JAMA Psychiatry 2019; 76: 526–535.
[2] Nováková M. Fragilita geriatrického seniora – možnosti řešení. Intern Med 2012; 14: 101–103.
[3] Alagiakrishnan K, Wiens CA. An approach to drug induced delirium in the elderly. Postgrad Med J 2004; 80: 388–393.
[4] Ressner P, Bártová P. Polékové kognitivní poruchy. Neurol Praxi 2012; 13: 83–86.
[5] Topinková E. Delirantní stavy u hospitalizovaných seniorů – Současné diagnostické a léčebné postupy. Medical Tribune 2010. Dostupné na: https://www.tribune.cz/archiv/delirantni‑stavy‑u‑hospitalizovanych‑senioru‑soucasne‑diagnosticke‑a‑lecebne‑postupy/
[6] Tašková I, et al. Psychofarmaka v kazuistikách. 1. vydání. Praha: Maxdorf Jessenius, 2021.
[7] Jirák R. Gerontopsychiatrie. Praha: Galén, 2013.
[8] Franková V. Delirium ve vyšším věku. Psychiatr Praxi 2007; 2: 56–59.
[9] Fialová D, Halačová M, Brkič J, et al. Klinická farmacie v geriatrii a 20 let klinických a výzkumných zkušeností s hodnocením racionality geriatrické preskripce v České republice a v evropských zemích. Klin Farmakol Farm 2020; 34: 122–129.
[10] McLean AJ, Le Couteur DG. Aging biology and geriatric clinical pharmacology. Pharmacol Rev 2004; 56: 163–184.
[11] Juřica J. Specifika farmakoterapie ve stáří. Remedia 2020; 30: 344–348.
[12] Ferrara N, Komici K, Corbi G, et al. β‑adrenergic receptor responsiveness in aging heart and clinical implications. Front Physiol 2014; 4: 396.
[13] Mangoni AA, Jackson SH. Age‑related changes in pharmacokinetics and pharmacodynamics: basic principles and practical applications. Br J Clin Pharmacol 2004; 57: 6–14.
[14] Cusack BJ. Pharmacokinetics in older persons. Am J Geriatr Pharmacother 2004; 2: 274–302.
[15] Ruangritchankul S, Chantharit P, Srisuma S, et al. Adverse Drug Reactions of Acetylcholinesterase Inhibitors in Older People Living with Dementia: A Comprehensive Literature Review. Ther Clin Risk Manag 2021; 17: 927–949.
[16] Moore AR, O’Keeffe ST. Drug‑Induced Cognitive Impairment in the Elderly. Drugs Aging 1999; 15: 15–28.
[17] Reisinger M, Reininghaus EZ, Biasi JD, et al. Delirium‑associated medication in people at risk: A systematic update review, meta‑analyses, and GRADE‑profiles. Acta Psychiatr Scand 2023; 147: 16–42.
[18] Delirium: prevention, diagnosis and management Clinical guideline [CG103]. Published: July 2010 (Last updated: March 2019). Dostupné na: https://www.nice.org.uk/guidance/cg103/chapter/Recommendations#interventions‑to‑prevent‑delirium‑2
[19] Maldonado JR. Neuropathogenesis of delirium: review of current etiologic theories and common pathways. Am J Geriatr Psychiatry 2013; 21: 1190–222.
[20] Jain KK. Drug‑Induced Disorders of Memory and Dementia. In: Drug‑induced Neurological Disorders. Springer 2021. Dostupné na https://doi.org/10.1007/978‑3‑030‑73503‑6_14
[21] Gray SL, Anderson ML, Dublin S, et al. Cumulative use of strong anticholinergics and incident dementia: a prospective cohort study. JAMA Intern Med 2015; 175: 401–407.
[22] Fialová D, Topinková E, Ballóková A, et al. Expertní konsenzus ČR 2012 v oblasti léčiv a lékových postupů potenciálně nevhodných ve stáří. Klin Farmakol Farm 2013; 27: 18–28.
[23] SPC uvedených přípravků. Dostupné na: https://www.sukl.cz
[24] Monografie uvedených přípravků. Lexicomp. Dostupné na: https://www.uptodate.com
[25] Sterns RH. Pathophysiology and etiology of the syndrome of inappropriate antidiuretic hormone secretion (SIADH). Databáze UpToDate. Dostupné na: https://www.uptodate.com
[26] Leelakanok N, DʼCunha RR. Association between polypharmacy and dementia – A systematic review and metaanalysis. Aging Mental Health 2019; 23: 932–941.