Lékové interakce v revmatologii
Souhrn:
Suchý D, Sabitova E. Lékové interakce v revmatologii. Remedia 2021; 31: 103–108.
Cílem článku je shrnout závažné lékové interakce nesteroidních antirevmatik, imunosupresiv, antimalarik, glukokortikoidů, biologických a cílených syntetických chorobu modifikujících antirevmatických léků s léky používanými ve vnitřním lékařství.
Summary:
Suchy D, Sabitova E. Drug interactions in rheumatology. Remedia 2021; 31: 103–108.
This report summarizes important interactions of non‑steroidal anti‑inflammatory drugs, immunosupressants, antimalarial drugs, glucocorticosteroids, biological and targeted synthetic disease‑modifying antirheumatic drugs with drugs commonly used in internal medicine.
Key words: non‑steroidal antirheumatics, glucocorticosteroids, immunosupressants, warfarin, biological disease‑modifying drugs, targeted synthetic disease‑modifying drugs, cytochrome P450
Úvod
Cílem léčby revmatických chorob je dosažení remise nebo snížení aktivity onemocnění. Antirevmatická terapie zahrnuje konvenční syntetické chorobu modifikující léky (conventional synthetic disease modifying antirheumatic drugs, csDMARDs), biologické chorobu modifikující léky (biologic disease modifying antirheumatic drugs, bDMARDs), cílené syntetické chorobu modifikující léky (targeted synthetic disease modifying antirheumatic drugs, tsDMARDs) a glukokortikoidy (GK), které se používají ke zmírnění zánětlivého procesu. Důležitou částí terapie revmatických chorob jsou nesteroidní antirevmatika (NSA) v kombinaci s inhibitory protonové pumpy (IPP). Nutná dlouhodobá polyfarmakoterapie může být příčinou potenciálně nebezpečných lékových interakcí. Léková interakce je definována jako vzájemné ovlivnění dvou či více léčiv podávaných dohromady. Interakce se projevují jako oslabení nebo zesílení účinnosti, popřípadě nežádoucí účinek předepsaného léčiva. Riziko interakce se zvyšuje s rostoucím počtem používaných léků. Některé interakce mohou být zdrojem závažných nežádoucích účinků ‒ přibližně 1‒3 % hospitalizací je způsobeno komplikacemi vzniklými na podkladě lékových interakcí. Mnohdy je obtížné odlišit interakci od individuální variability účinku léčiva zejména tam, kde není změna účinku léčiva pozorovatelná v těsné časové souvislosti s použitím dalšího léčiva. Farmakodynamické interakce lze většinou alespoň částečně odvodit, jelikož vyplývají z mechanismu účinku nebo z nežádoucích účinků interagujících léků. Existuje však obrovské množství farmakokinetických interakcí, především na úrovni metabolismu léčiv, které je velmi obtížné až nemožné si zapamatovat. Většina lipofilních léčiv podléhá v těle metabolismu mikrozomálními enzymy lokalizovanými zejména v játrech a sliznici tenkého střeva. Exprese a aktivita metabolických enzymů cytochromu P450 (CYP450) vykazují širokou interindividuální variabilitu, která je zčásti podmíněna vlivem venkovního prostředí (kouření, alkohol, indukce nebo inhibice souběžně užívanými léčivy nebo potravou), věkem, pohlavím nebo patologickým stavem. Důležitým faktorem variability metabolismu léčiv je genetický polymorfismus CYP450. Z tohoto hlediska je nejvýznamnější CYP2D6, který metabolizuje přibližně 25 % klinicky užívaných léčiv a je vysoce polymorfní. Cílem tohoto článku je přehledně shrnout nejvýznamnější interakce léčiv používaných u revmatologických pacientů s běžně užívanými léčivy a tím pomoci snížit rizika vyplývající z farmakoterapie u této skupiny nemocných.
Nesteroidní antirevmatika
Tato léčiva mají množství nežádoucích účinků a poměrně velký interakční potenciál. Z nežádoucích účinků jsou nejzávažnější poškození gastrointestinálního traktu (GIT), hepatopatie, nefropatie a zvýšené kardiovaskulární riziko. Lékové interakce většinou potencují tato rizika.
- Možnost vzniku interakcí je relativně vysoká z následujících důvodů:
- jedná se o vysoce lipofilní molekuly,
- podávání je dlouhodobé,
- jako lipofilní látky z hlediska biotransformace podléhají většinou intenzivnímu metabolismu v první fázi biotransformace cestou CYP450 [1].
Největší interakční potenciál
mají léky, které potencují riziko krvácení do GIT při
užívání NSA (např. antiagregancia,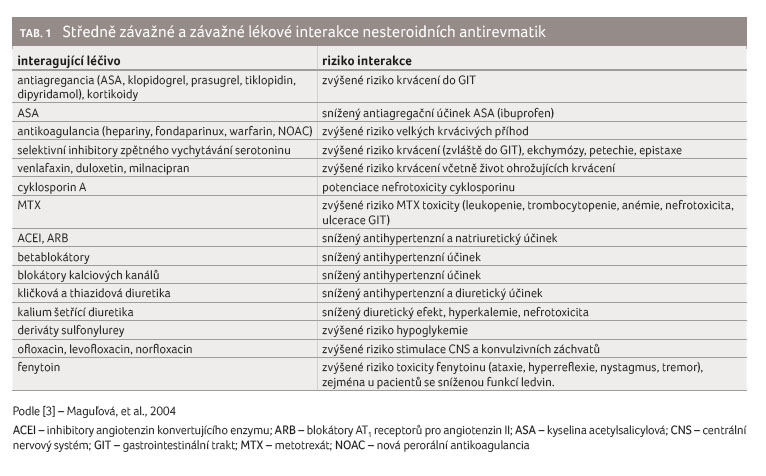 antikoagulancia, některá
antidepresiva), a léky potencující orgánovou toxicitu
(nefrotoxicitu či hepatotoxicitu). Kromě samotných NSA jsou to
také léky, jejichž účinnost je redukována kvůli inhibici
syntézy prostaglandinů v ledvinách při užívání NSA
(antihypertenziva, diuretika), a léky, jejichž účinnost
a tím i toxicita je zvýšena z důvodu jejich
snížené clearance způsobené interakcí s NSA (lithium,
metotrexát). Při souběžném užívání NSA a GK dochází
k rozvoji farmakodynamické interakce, přičemž i krátkodobá
léčba může mít za následek gastroduodenální vředy.
Regenerace sliznice žaludku ad integrum je závislá
na produkci prostaglandinu E, při souběžném podání
kortikoidů a NSA se snižuje produkce cytokinů a protektivního
růstového faktoru. Následkem je inhibice autoregulačních
mechanismů reparace mukózy žaludku [2].
antikoagulancia, některá
antidepresiva), a léky potencující orgánovou toxicitu
(nefrotoxicitu či hepatotoxicitu). Kromě samotných NSA jsou to
také léky, jejichž účinnost je redukována kvůli inhibici
syntézy prostaglandinů v ledvinách při užívání NSA
(antihypertenziva, diuretika), a léky, jejichž účinnost
a tím i toxicita je zvýšena z důvodu jejich
snížené clearance způsobené interakcí s NSA (lithium,
metotrexát). Při souběžném užívání NSA a GK dochází
k rozvoji farmakodynamické interakce, přičemž i krátkodobá
léčba může mít za následek gastroduodenální vředy.
Regenerace sliznice žaludku ad integrum je závislá
na produkci prostaglandinu E, při souběžném podání
kortikoidů a NSA se snižuje produkce cytokinů a protektivního
růstového faktoru. Následkem je inhibice autoregulačních
mechanismů reparace mukózy žaludku [2].
Lékové interakce NSA shrnuje tabulka 1 [1,3].
Glukokortikoidy
Warfarin
Souběžná léčba GK a warfarinem může vést k farmakodynamickým i farmakokinetickým interakcím. Oba typy interakce zvyšují riziko krvácení. Mechanismus farmakokinetické interakce není plně objasněn, předpokládá se kompetice na úrovni hepatálního CYP450, izoenzymu 3A4, což vede k inhibici metabolismu warfarinu, k nárůstu jeho plazmatických koncentrací a následnému zvýšení antikoagulačního účinku. Warfarin je rovněž metabolizován enzymy CYP1A2 a CYP2C9 [4,5]. Zvýšení biologické dostupnosti warfarinu může nastat i jiným mechanismem, a to jako výsledek dočasného zvýšení hodnoty pH séra při podávání GK. Tato interakce byla pozorována u pacientů, kteří byli krátkodobě léčeni vysokými dávkami GK nebo intravenózními pulzy [5‒7]. V literatuře je popisován i opačný efekt, tj. snížení účinku perorálních antikoagulancií při léčbě GK. To se však týká zejména starších generací antagonistů vitaminu K [4].
Při souběžném podávání GK a warfarinu byla v práci Carsona a kol. zaznamenána vyšší incidence krvácení do GIT. Jako prevence této komplikace je doporučována častější kontrola hodnoty mezinárodního normalizovaného poměru (INR), adjustace dávky warfarinu a souběžná léčba IPP [4,5,8]. Nicméně je třeba podotknout, že omeprazol inhibuje metabolismus R-warfarinu, zatímco pantoprazol pravděpodobně interakci nevykazuje [9].
Fluorochinolony
Glukokortikoidy i fluorochinolony mohou způsobovat entezopatie, jejich kombinace zvyšuje riziko ruptury šlach. Mechanismus tohoto synergického vlivu zůstává nejasný, tato kombinace není vhodná u nemocných s bolestí šlach, jejich zánětem nebo rupturou [10,11].
Inhibitory a induktory cytochromu P450
Glukokortikoidy jsou substráty CYP3A4. Induktory a inhibitory CYP3A4 mohou ovlivňovat biologický poločas (t1/2), plochu pod křivkou (AUC) a maximální plazmatickou koncentraci (cmax) GK [4]. Nejvíce interakcí tohoto typu bylo popsáno u methylprednisolonu. Účinnost methylprednisolonu je snížena při souběžném podání induktorů CYP3A4 fenobarbitalu, fenytoinu a karbamazepinu, naopak zvýšena je při podání inhibitorů CYP3A4 itrakonazolu, ketokonazolu, klaritromycinu a grepové šťávy [12‒14]. Glynn a kol. prokázali změny farmakokinetického profilu methylprednisolonu při souběžném podání s ketokonazolem. Méně je indukcí a inhibicí CYP3A4 ovlivněn prednison, pro interakci s ketokonazolem existují rozporuplné údaje [15‒18]. Není zaznamenána interakce s itrakonazolem a grepovou šťávou, pouze flukonazol v kazuistice zvýšil účinnost prednisonu [19]. Dexamethason je substrátem, ale zároveň i induktorem CYP3A4. Vzhledem k významu tohoto izoenzymu pro metabolismus řady léčiv může dexamethason potenciálně snížit účinnost řady léčiv.
Glukokortikoidy mají diabetogenní účinek, zvyšují glukoneogenezi a glykemii. Jejich podávání tedy může vést k dekompenzaci diabetu a k redukci účinnosti antidiabetické léčby. U léčených hypertoniků mohou snížit účinnost antihypertenzní terapie, prohloubit hypokalemizující účinek kličkových i thiazidových diuretik. V kombinaci s NSA násobí jejich ulcerogenní potenciál i vliv na renální funkce (retence sodíku a vody) [1].
Metotrexát
Nesteroidní antirevmatika
Přibližně 80 % MTX je vylučováno ledvinami glomerulární filtrací, MTX je dále vylučován aktivními transportéry, např. transportérem organických aniontů (OAT) 1 a 3 v ledvinách. Nesteroidní antirevmatika snižují syntézu prostaglandinů, zhoršují krevní cirkulaci v ledvinách a tímto způsobem redukují glomerulární filtraci. Filtrace MTX se zpomaluje, ale riziko rozvoje nežádoucích účinků roste při jeho dávce vyšší než 30 mg za týden, při menších dávkách je riziko minimální [2].
Glukokortikoidy
Interakce mezi MTX a GK má charakter farmakokinetický. Je popsáno zvýšení hepatotoxicity při kombinaci MTX s dlouhodobě užívanými kortikoidy. Je možné, že tento efekt je následkem ovlivnění různých transportérů kortikody, které eliminují MTX, zejména multidrug resistance associated protein (MRP) a breast cancer resistance protein (BCRP) [2].
Kotrimoxazol
V revmatologii může být kotrimoxazol (trimetoprim/sulfametoxazol) použit k léčbě infekcí u imunosuprimovaných pacientů. Tyto účinné látky mohou být také souběžně podány v léčbě granulomatózy s polyangiitidou, kde jsou používány při navození a udržení dlouhodobé remise [4,20]. Interakce s MTX byla pozorována při dávce 160 mg/800 mg dvakrát denně, ale ne u nižších profylaktických dávek (160 mg/800 mg třikrát týdně) [20].
Tato farmakodynamická interakce je způsobena synergickým efektem MTX a kotrimoxazolu v inhibici dihydrofolátreduktázy, tj antifolátového účinku [21,22]. Nicméně byly popsány i změny farmakokinetiky samotného MTX, pravděpodobně způsobené jeho sníženou tubulární eliminací nebo jeho vytěsněním z vazby na bílkoviny [21].
V praxi je doporučováno vyhnout se souběžnému podávání těchto látek. Pokud je třeba léčit infekce kotrimoxazolem, měla by být terapie MTX ukončena. Při souběžném podávání je nutné pečlivě monitorovat hematologické abnormality a nefrotoxicitu [4,21,23].
Inhibitory protonové pumpy
Souběžné podání MTX a IPP (omeprazol, lansoprazol, pantoprazol) může zvyšovat toxicitu MTX snížením renální clearance MTX a jeho metabolitu 7 hydroxymetotrexátu. Mechanismem interakce je inhibice specifických proteinů (BCRP, MRP2) z rodiny transmembránových pump – ABC transportérů (ATP binding casette proteins) [24]. Tato interakce je velmi dobře popsána u vysokých dávek MTX se všemi třemi výše uvedenými IPP [24,25]. U nižších dávek MTX, běžně používaných v revmatologii (7,5‒30 mg týdně), byla interakce s pantoprazolem popsána v jediné kazuistice [26]. V jedné studii bylo zjištěno, že souběžné podávání lansoprazolu a naproxenu nemění farmakokinetiku MTX u dospělých pacientů s revmatoidní artritidou [27]. Ačkoliv nebyla interakce mezi IPP a nízkými dávkami MTX potvrzena, je doporučováno monitorovat známky toxicity MTX (myalgie, bolesti kostí) a léčba IPP by při zjištěné toxicitě měla být přerušena nebo nahrazena antagonisty H2 receptorů [4].
Amiodaron
Kombinace MTX a amiodaronu může být použita například k léčbě srdečních arytmií souvisejících s revmatickými chorobami. Oba léky jsou prokazatelně hepatotoxické [23,28]. Kromě hepatotoxicity se může interakce projevovat cytopenií, nefrotoxicitou, slizničními vředy a ulceracemi na ložiscích lupénky. Navíc mohou oba léky vyvolat plicní onemocnění [4,29]. Můžeme předpokládat farmakodynamický charakter interakce, nicméně studie na potkanech ukázala zvýšení plazmatické koncentrace MTX jako důsledek inhibice organického aniontového transportéru 2 (OATP2) v játrech [30]. Při souběžném podávání je nutná zvýšená opatrnost a sledování hodnot jaterních transamináz a známek toxicity [4].
Jiné hepatotoxické léky
Zvýšený hepatotoxický efekt je pravděpodobný při souběžném podávání MTX v kombinaci s jinými hepatotoxickými léky (rifampicin, bosentan, nimesulid, leflunomid, azatioprin, sulfasalazin, ketokonazol, itrakonazol, isoniazid, antracyklin a acitretin). Podávání MTX s acitretinem je kontraindikováno [4,8,31].
Nefrotoxické léky
Farmakodynamické interakce potencující nefrotoxicitu MTX lze předpokládat, pokud je MTX souběžně podáván s potenciálně nefrotoxickými léky (amfotericin B, amikacin, inhibitory cyklooxygenázy, cyklosporin, chemoterapeutika na bázi platiny, gentamicin, meloxikam, naproxen, aurothiomalát sodný, takrolimus, teikoplatina a vankomycin). Při souběžném podávání MTX a potenciálně nefrotoxických léků je nutná zvýšená opatrnost a sledování nefrotoxicity a plazmatických koncentrací urey a kreatininu [4,8].
Metamizol
Farmakodynamická interakce mezi MTX a analgetikem metamizolem může být teoreticky příčinou hematologických nežádoucích účinků. V literatuře byl popsán jenom jeden případ útlumu kostní dřeně při souběžném podání MTX a metamizolu [2].
Leflunomid
Glukokortikoidy
Leflunomid v kombinaci s GK vyvolává hypertenzi a hyperlipidemii. Při kombinaci těchto dvou léčiv je nutná pravidelná monitorace tlaku a hodnot lipidemie [2].
Warfarin
Leflunomid zvyšuje antikoagulační aktivitu warfarinu, čímž se zvyšuje riziko krvácení. Mechanismus interakce může být důsledkem inhibice metabolismu S warfarinu přes CYP2C9 aktivním metabolitem leflunomidu (teriflunomid, A 771726) nebo vytěsněním z vazby na albumin, protože oba léky se vážou na plazmatické proteiny s vysokou afinitou. Nicméně tento mechanismus nebyl prokázán in vitro [32]. V praxi je doporučováno monitorování INR a příznaků předávkování warfarinem. Dávka warfarinu by měla být upravena dle potřeby.
Cholestyramin a aktivní uhlí
Tyto léky urychlují odstranění leflunomidu a zkracují jeho t1/2. Mechanismus interakce je založen na vazbě na aktivní metabolit leflunomidu při jeho enterohepatální cirkulaci, což vede ke snížení jeho koncentrace v plazmě [8]. I přes negativní dopad na plazmatické koncentrace leflunomidu může být kombinace přínosem pro léčbu předávkování leflunomidem nebo pro rychlou eliminaci leflunomidu z těla (tzv. wash out), například před plánovaným těhotenstvím. V jiných případech je třeba se souběžné léčbě vyhnout [4].
Rifampicin
Při kombinaci leflunomidu s rifampicinem dochází k enzymové indukci metabolismu leflunomidu a k následnému zvýšení koncentrace metabolitu leflunomidu (teriflunomidu) o 40 %, proto je třeba zvýšená opatrnost při léčbě touto kombinací a monitorace příznaků leflunomidové toxicity [3].
Azatioprin
Alopurinol
Vzhledem k inhibici xantinoxidázy alopurinolem dojde k inhibici přeměny merkaptopurinu (aktivní metabolit azatioprinu) na neaktivní metabolity, zatímco koncentrace cytostaticky účinných metabolitů azatioprinu (6 thioguanin nukleotidů) se zvyšuje. Tímto mechanismem dojde k signifikantnímu nárůstu toxicity azatioprinu. Doporučuje se vyhnout se společnému podávání azatioprinu s alopurinolem. Není li to možné, je třeba monitorovat krevní obraz před zahájením léčby a při souběžném podávání, a to alespoň jednou týdně po dobu prvních čtyř týdnů. Předpokládaná redukce dávky azatioprinu odpovídá jedné čtvrtině původní dávky [33,34].
Warfarin
Antikoagulační aktivita warfarinu může být snížena při souběžném podání s azatioprinem. Tento mechanismus není jasný, v úvahu připadá redukce absorpce warfarinu, zvýšený metabolismus warfarinu nebo zvýšená aktivita protrombinu [35]. Při souběžném podávání azatioprinu s warfarinem je třeba pečlivě monitorovat INR a upravit dávkováni warfarinu dle potřeby.
Inhibitory angiotenzin konvertujícího enzymu
Souběžné podání inhibitorů angiotenzin konvertujícího enzymu (ACEI) a azatioprinu zvyšuje riziko myelosuprese, především anémie a neutropenie [34,36]. Mechanismus interakce nebyl zcela objasněn. V praxi je nejbezpečnější vyhnout se této kombinaci. Pokud to není možné, je třeba sledovat známky myelosuprese (anémie, leukopenie) [4].
Cyklosporin A
Induktory a inhibitory CYP3A4
Cyklosporin A, substrát CYP3A4, interaguje s řadou induktorů a inhibitorů izoenzymu CYP3A4. Koncentrace cyklosporinu a tím i jeho toxicita mohou být zvýšeny ketokonazolem, makrolidy, aminoglykosidy, verapamilem, diltiazemem, androgeny, perorální antikoncepcí a GK. A naopak, koncentrace cyklosporinu a tím i jeho účinnost klesají při podání s rifampicinem, barbituráty, karbamazepinem nebo s fenytoinem. Při souběžném podávání je nutná opatrnost a je třeba sledovat účinek, toxicitu a případně i koncentrace cyklosporinu v krvi [37].
Statiny
Souběžné užívání statinů s cyklosporinem může zvyšovat koncentrace statinů, a tedy i riziko myopatie a rhabdomyolýzy. Mechanismus této interakce se liší v závislosti na typu statinu a u některých statinů není zcela objasněn. Běžný mechanismus je důsledkem inhibice CYP3A4 (atorvastatin, lovastatin, simvastatin), P glykoproteinu (atorvastatin, lovastatin, pravastatin, simvastatin) nebo OATP2 (rosuvastatin) [38]. Souběžné podávání se nedoporučuje. Nicméně pokud je to nutné, je třeba zvážit nižší počáteční a udržovací dávky statinů, nebo přejít k léčbě fluvastatinem, který se zdá být v kombinaci s cyklosporinem bezpečný [39]. Avšak někteří autoři považují i tuto kombinaci za vysoce rizikovou [8,38].
Cyklofosfamid
Alopurinol
Při podávání s alopurinolem se může zvyšovat riziko útlumu kostní dřeně nebo krvácení a infekce. Mechanismus interakce není znám, ale bylo pozorováno prodloužení t1/2 cyklofosfamidu. Předpokládaným mechanismem je snížení clearance metabolitů cyklofosfamidu nebo inhibice CYP450 [40]. Dávkování by mělo být upraveno.
Sulfasalazin
Digoxin
Souběžné podávání sulfasalazinu a digoxinu může vést ke snížení biologické dostupnosti digoxinu. V jedné kazuistice bylo dokumentováno signifikantní zvýšení sérové koncentrace digoxinu po ukončení podávání sulfasalazinu. Následně autoři provedli studii a potvrdili, že tato interakce je pravděpodobně důsledkem snížené absorpce digoxinu indukované sulfasalazinem. Při souběžném podávání je třeba dbát zvýšené opatrnosti, monitorovat koncentraci digoxinu zejména na začátku podávání a při ukončení souběžného užívání, a případně jeho dávkování upravit [41].
Penicilamin
Železo, soli hliníku a hořčíku
Penicilamin může interagovat s doplňky železa a solemi hliníku a hořčíku přítomnými v antacidech a dalších lécích. Protože revmatologická onemocnění často postihují GIT (např. jícen u systémové sklerodermie), penicilamin bývá s antacidy podáván. Přípravky s obsahem železa jsou často předepisovány např. u malabsorpčních onemocnění nebo sideropenie. Pravděpodobnou příčinou interakce je chelatační vlastnost penicilaminu. Interakci lze předcházet podáváním léků nejméně dvě hodiny po sobě. V takovém případě není potřeba upravovat dávkování [42].
Antimalarika
Digoxin
Interakce mezi digoxinem a hydrochlorochinem byla dokumentována na dvou kazuistikách a mezi digoxinem a chlorochinem na studii se zvířaty. Mechanismus interakce není znám, ale zdá se pravděpodobné, že je důsledkem vytěsnění digoxinu z jeho vazebného místa ve tkáních nebo snížení renální clearance digoxinu. Při souběžném podávání by měla být monitorována toxicita a sérová koncentrace digoxinu [43,44].
Paracetamol
Paracetamol je metabolizován CYP2D6 na svůj toxický metabolit N acetyl p benzochinonimin. Chlorochin a hydrochlorochin mají schopnost inhibovat CYP2D6, dochází ke zpomalení kumulace toxického metabolitu. I přesto toxicita paracetamolu narůstá, protože chlorochin a hydroxychlorochin tlumí lysozomální degradaci poškozených organel, a tím dochází ke smrti buněk a rozvoji jaterní nekrózy [2].
Glukokortikoidy
Interakce mezi antimalariky a GK je farmakodynamická. Obě léčiva zvyšují riziko myopatie a kardiomyopatie, proto je jejich kombinace potenciálně nebezpečná [2].
Lékové interakce csDMARDs shrnuje
tabulka 2.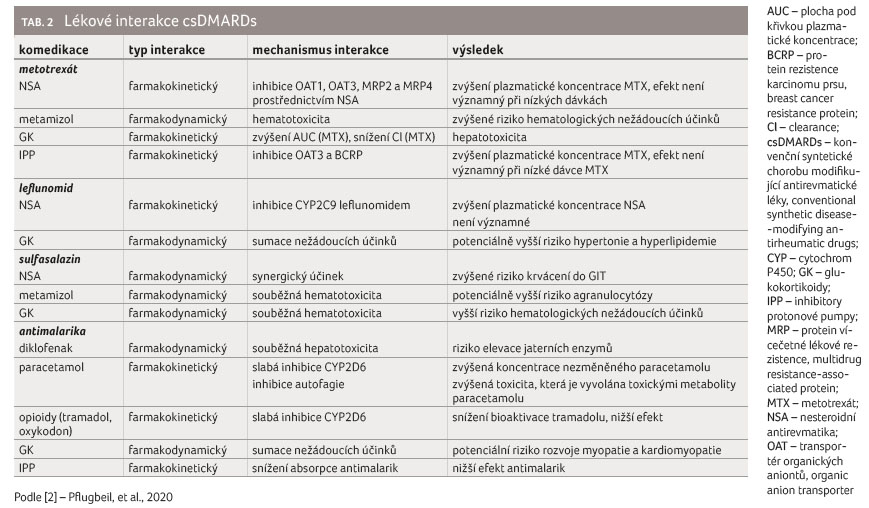
Biologické chorobu modifikující
antirevmatické léky
V revmatologii se používají inhibitory tumor nekrotizujícího faktoru alfa (TNFα) ‒ adalimumab, etanercept, certolizumab, golimumab, infliximab; inhibitory interleukinu 1 (IL 1) – anakinra, kanakinumab; inhibitory IL 6 ‒ tocilizumab, sarilumab, sirukumab; inhibitory IL 17 – sekukinumab; léčiva s jiným mechanismem účinku – abatacept, rituximab, belimumab. Biologické DMARDs nejsou metabolizovány cytochromy, nejsou vylučovány aktivním transportem, proto neočekáváme žádné farmakokinetické interakce s účastí těchto léčiv. Některé z nich ovlivňují expresi cytochromů.
Tocilizumab, inhibitor IL 6, vstupuje do farmakokinetických interakcí s různými substráty cytochromů. Interleukin 6 se vytváří během zánětlivého procesu a snižuje expresi cytochromů, následně je ovlivněn metabolismus substrátů. Při inhibici signální cesty zprostředkované IL 6 se normalizuje aktivita cytochromů a metabolismus substrátů narůstá. Stejný typ interakce byl popsán u antagonisty IL 17A sekukinumabu a antagonisty IL 17 ixekizumabu.
Dále při souběžném podávání MTX a bDMARDs dochází k farmakodynamické interakci. Elevace hodnot jaterních enzymů je častým nežádoucím účinkem léčby MTX a může vzniknout i při terapii bDMARDs. Obdobně zvýšenou hepatotoxicitu můžeme pozorovat i při podávání kombinace bDMARDs a leflunomidu.
Lékové interakce bDMARDs shrnuje tabulka 3.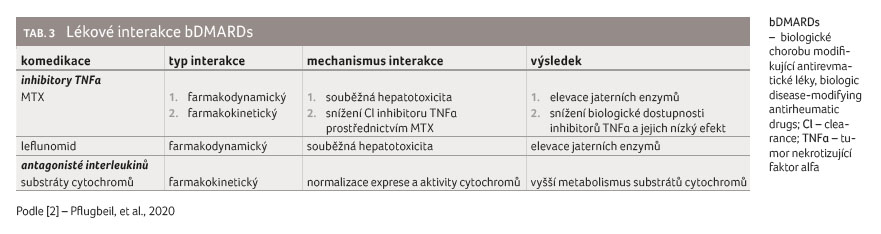
Cílené syntetické chorobu
modifikující antirevmatické léky
Z této skupiny se používají inhibitory Janusovy kinázy (tofacitinib a baricitinib) a inhibitor fosfodiesterázy 4 apremilast.
Všechna tsDMARDs jsou substráty cytochromů, zejména CYP3A4, ale také CYP1A2, 2C9, 2C19 a 2D6. Kombinace tofacitinibu se silnými inhibitory CYP3A4 (ketokonazol, flukonazol) zvyšuje expozici tofacitinibu přibližně o 100 %, proto výrobce doporučuje redukovat dávku tofacitinibu z obvyklých 5 mg dvakrát denně na 5 mg jednou denně. V případě apremilastu a baricitinibu se celková expozice významně nemění.
Silné induktory CYP3A4 snižují expozici tofacitinibu o 84 % a apremilastu o 72 %, z čehož výrobci vyvozují doporučení vyhnout se souběžnému podávání silných induktorů CYP3A4 (takrolimus, cyklosporin) [45].
Závěr
Manifestace lékové interakce v revmatologii může být zaměněna za symptomy samotného revmatologického onemocnění, jako je tomu například v případě nefrotoxicity způsobené souběžným podáváním MTX a kotrimoxazolu nebo myopatie při kombinaci GK a azolových antimykotik. Tyto symptomy mohou být zaměněny za symptomy asociované s lupusovou nefritidou nebo polymyozitidou. Projevy lékové interakce mají často opožděný nástup (např. interakce s warfarinem) a mohou přetrvávat ještě po ukončení podávání léku (interakce s warfarinem, digoxin‒hydrochlorochin).
Interakce se často potvrdí po opětovném objevení se příznaků po znovuzavedení souběžné terapie.
Seznam použité literatury
- [1] Doseděl M. Nežádoucí účinky a lékové interakce nesteroidních antiflogistik a jejich management pohledem farmaceuta. Prakt Lékáren 2014; 10: 90–94.
- [2] Pflugbeil S, Böckl K, Pongratz R, et al. Drug interactions in the treatment of rheumatoid arthritis and psoriatic arthritis. Rheum Int 2020; 40: 511‒521.
- [3] Maguľová L, Božeková L. Interakcie liečiv v klinickej praxi. Slovak Academic Press 2004.
- [4] Hromadkova L, Soukup T, Vlcek J. Important drug interactions in patiens with rheumatic disorders; interactions of glucocorticoids, immunosupressants and antimalarik drugs. Drugs Today 2012; 48: 545‒553.
- [5] Hazlewood KA, Fugate SE, Harrison DL. Effect of oral corticosteroids on chronic warfarin therapy. Ann Pharmacother 2006; 40: 2101‒2106.
- [6] Kaufman M. Treatment of multiple sclerosis with high‑dose corticosteroids may prolong the prothrombin time to dangerous levels in patients taking warfarin. Mult Scler 1997; 3: 248‒249.
- [7] Costedoat‑Chalumeau N, Amoura Z, Aymard G, et al. Potentiation of vitamin K antagonists by high‑dose intravenous methylprednisolone. Ann Int Med 2000; 132: 631‒635.
- [8] Drugdex® System Version 5.1. Thomson reuters, Greenwood Village, Colorado.
- [9] Carson JL, Strom BL, Schinnar R, et al. The low risk of upper gastrointestinal bleeding in patients dispensed corticosteroids. Am J Med 1991; 91: 223‒228.
- [10] van der Linden PD, Sturkenboom MCJM, Herings RMC, et al. Fluoroquinolones and risk of Achilles tendon disorders, case‑control study. Br Med J 2002; 324: 1306‒1307.
- [11] Blanco I, Krähenbühl S, Schlienger RG. Corticosteroid‑associated tendinopathies, an analysis of the published literature and spontaneous pharmacovigilance data. Drug Safety 2005; 28: 633‒643.
- [12] Lebrun‑Vignes B, Archer VC, Diquet B, et al. Effect of itraconazole onthe pharmacokinetics of prednisolone and methylprednisoloneand cortisol secretion in healthy subjects. Br J Clin Pharmacol 2001; 51: 443‒450.
- [13] Varis T, Kivistö KT, Neuvonen PJ. The effect of itraconazole on the pharmacokinetics and pharmacodynamics of oral prednisolone. Eur J Clin Pharmacol 2000; 56: 57‒60.
- [14] Glynn AM, Slaughter RL, Brass C, et al. Effect of ketoconazole on methylprednisolone pharmacokinetics and cortisol secretion. Clin Pharmacol Ther 1986; 36: 654‒659.
- [15] Ulrich B, Frey FJ, Speck RF, Frey BM. Pharmacokinetics/pharmacodynamics of ketoconazole‑prednisolone interaction. J Pharmacol Exp Ther 1992; 260: 487‒490.
- [16] Zurcher RM, Frey BM, Frey FJ. Impact of ketoconazole on the metabolism of prednisolone. Clin Pharmacol Ther 1989; 45: 366‒372.
- [17] Ludwig EA, Slaughter RL, Savliwala M, et al. Steroid‑specific effects of ketoconazole on corticosteroid disposition, unaltered prednisolone elimination. Drug Intel Clin Phar 1989; 23: 858‒861.
- [18] Yamashita SK, Ludwig EA, Middleton E jr., Jusko WJ. Lack of pharmacokinetic and pharmacodynamic interactions between ketoconazole and prednisolone. Clin Pharmacol Ther 1991; 49: 558‒570.
- [19] Tiao GM, Martin J, Weber FL, et al. Addisonian crisis in a liver transplant patient due to fluconazole withdrawal. Clin Transplant 1999; 13: 62‒64.
- [20] White ES, Lynch JP. Pharmacological therapy for Wegener’s granulomatosis. Drugs 2006; 66: 1209‒1228.
- [21] Bannwarth B, Péhourcq F, Schaeverbeke T, et al. Pharmacokinetics of low‑dose pulse methotrexate inrheumatoid arthritis. Clin Pharmacokinet 1996; 30: 194‒210.
- [22] Steuer A, Gumpel JM. Methotrexate and trimethoprim, Afatal interaction. Br J Rheumatol 1998; 37: 105‒106.
- [23] SPC Methotrexate Hospira (methotrexate). Hospira UK Limited, Royal Leamington Spa, Great Britain, August 2007.
- [24] Breedveld P, Zelcer N, Pluim D, et al. Mechanism of the pharmacokinetic interaction between methotrexate and benzimidazoles. Potential role for breast cancer resistance proteinin clinical drug‑drug interactions. Cancer Res 2004; 64: 5804‒5811.
- [25] Suzuki K, Doki K, Homma M, Tamaki H, et al. Co‑administration of proton pump inhibitors delays elimination of plasma methotrexate in highdose methotrexate therapy. Br J Clin Pharmacol 2008; 67: 44‒49.
- [26] Tröger U, Stötzel B, Martens‑Lobenhoffer J, et al. Severe myalgia from an interaction between treatmentswith pantoprazole and methotrexate. Br Med J 2002; 324: 1497.
- [27] Vakily M, Amer F, Kukulka MJ, et al. Coadministration of lansoprazole and naproxen does not affectthe pharmacokinetic profile of methotrexate in adult patientswith rheumatoid arthritis. J Clin Pharmacol 2005; 45: 1179‒1186.
- [28] SPC Cordarone (amiodarone). Sanofi-aventis s.r.o., Praha ČR, červen 2016.
- [29] Reynolds NJ, Jones SK, Crossley J, et al. Methotrexate induced skin necrosis, a drug interaction with amiodarone? Br Med J 1989; 299: 980‒981.
- [30] Fuksa L, Brcakova E, Cermanova J, et al. Amiodarone modulates pharmacokinetics of low‑dose methotrexate in rats. Biopharm Drug Dispos 2008; 29: 289‒299.
- [31] SPC Neotigason (acitretin). Actavis Group PTC ehf. Hafnarfjordur, Island, květen 2015.
- [32] Chonlagan J, Halloran MA, Hammonds A. Leflunomide and warfarin interaction, case report and review of the literature. Pharmacother 2006; 26: 868‒871.
- [33] Gearry RB, Day AS, Barclay ML, et al. Azathioprine and allopurinol, a two‑edged interaction. J Gastroenterol Hepatol 2010; 25: 653‒655.
- [34] SPC Imuran (azathioprin). Aspen Pharma Trading Ltd., Irsko, srpen 2015.
- [35] Havrda DE, Rathun S, Scheid D. A case report of warfarin resistance due to azathioprine and review of the literature. Pharmacother 2001; 21: 355‒357.
- [36] Gossmann J, Kachel HG, Schoeppe W, Scheuermann EH. Anemia in renal transplant recipients caused by concomitant therapy with azathioprine and angiotensin‑converting enzyme inhibitors. Transplantation 1993; 56: 585‒589.
- [37] Linholm A. Factors influencing the pharmacokinetics of cyclosporine in man. Ther Drug Monit 1991; 13: 465‒477.
- [38] Asberg A. Interactions between cyclosporin and lipid‑lowering drugs, implications for organ transplant recipients. Drugs 2003; 63: 367‒378.
- [39] Jardine A, Holdaas H. Fluvastatin in combination with cyclosporin in renal transplant recipients, a review of clinical and safety experience. J Clin Pharm Ther 1999; 24: 397‒408.
- [40] Loandman PM, Bibby MC. Pharmacokinetic drug interactions with anticancer drugs. Clin Pharmacokinet 1994; 26: 486‒500.
- [41] Juhl RP, Summers RW, Guillory JK, et al. Effect of sulfasalazine on digoxin bioavailability. Clin Pharmacol Ther 1976; 20: 387‒394.
- [42] Osman MA, Patel RB, Schuna A, et al. Reduction in oral penicillamine absorption by food, antacid, and ferrous sulfate. Clin Pharmacol Ther 1983; 33: 465‒470.
- [43] Leden I. Digoxin‑hydroxychloroquine interaction? Acta Med Scand 1982; 211: 411‒412.
- [44] McEnay JC, Sidahmed AM, D′Arcy PF, McQuade RD. Chloroquine‑digoxin interaction. Int J Pharm 1985; 26: 267‒274.
- [45] Suchopár J, Prokeš M, Suchopár Š. Lékové interakce léčiv používaných v revmatologii. Remedia 2019; 29: 481‒491.